Hafnium
Hafnium (veraltet: Celtium)[16] ist ein chemisches Element mit dem Symbol Hf und der Ordnungszahl 72. Benannt ist es nach dem lateinischen Namen der Stadt Kopenhagen, Hafnia, in der das Element entdeckt wurde. Es ist ein silbergrau glänzendes, korrosionsbeständiges Übergangsmetall, das im Periodensystem in der 4. Nebengruppe (Titangruppe) steht.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Hafnium, Hf, 72 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 4, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | stahlgrau | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-166-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.333 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 4,2 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 178,486 ± 0,006[3][4] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 155 (208) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 150 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f14 5d2 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.825070(12) eV[5] ≈ 658.52 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 14.61(4) eV[5] ≈ 1410 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 22.55(4) eV[5] ≈ 2176 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 33.370(25) eV[5] ≈ 3220 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 68.37(4) eV[5] ≈ 6600 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | zwei (α-/β-Hf) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 13,28 g/cm3 (25 °C)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch[9] (χm = 7,0 · 10−5)[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 2506 K (2233 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 4876 K[11] (4603 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 13,44 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 648 kJ/mol[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 25,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 0,00013[12] Pa bei 1970 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 3010 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 140 J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 3,12 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 23 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [13] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −1,505 V (HfO2 + 4 H+ + 4 e− → Hf + 2 H2O) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,3 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,5 mg·m−3 (gemessen als einatembarer Staub)[15] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hafnium besitzt sehr ähnliche Eigenschaften wie das im Periodensystem direkt darüber gelegene Zirconium. Biologische Funktionen sind nicht bekannt, es kommt normalerweise nicht im menschlichen Organismus vor und ist nicht toxisch.[17]
Geschichte
Hafnium war eines der letzten stabilen Elemente des Periodensystems, die entdeckt wurden. Der erste Hinweis auf die Existenz eines weiteren Elements zwischen Lutetium und Tantal ergab sich aus dem 1912 gefundenen Moseleyschen Gesetz. Henry Moseley versuchte 1914 erfolglos, das unbekannte, aber nach diesem Gesetz zu erwartende Element mit der Ordnungszahl 72 in Proben von Mineralen der seltenen Erden (heute Lanthanoiden) zu finden.[18]
Niels Bohr sagte in seiner 1922 veröffentlichten Arbeit zur Atomtheorie voraus, dass die Lanthanoiden-Reihe mit Lutetium zu Ende sei und dass damit das Element 72 Ähnlichkeit mit Zirconium haben müsse. Allerdings hatte er darin in Charles Bury, wie er selbst angab, einen Vorläufer, der außerdem, wie Eric Scerri fand, im Gegensatz zu Bohr ausschließlich aus der Atomtheorie argumentierte.[19] Schon ein Jahr später konnte Hafnium nachgewiesen werden: 1923 wurde es in Kopenhagen von Dirk Coster und George de Hevesy durch Röntgenspektroskopie in norwegischem Zirkon entdeckt. Weitere Untersuchungen anderer Mineralien zeigten, dass Hafnium immer in zirconiumhaltigen Mineralien enthalten ist. Die Trennung vom Zirconium gelang Jantzen und Hevesy durch wiederholte Kristallisation der Diammonium- und Dikaliumfluoride der beiden Elemente. Elementares Hafnium konnte danach durch Reduktion mit Natrium gewonnen werden.
Vorkommen
Hafnium ist mit einem Gehalt von 4,9 ppm an der kontinentalen Erdkruste[20] ein auf der Erde nicht sehr häufiges Element. In der Häufigkeit ist es damit vergleichbar mit den Elementen Brom und Caesium und häufiger als das schon lange bekannte Gold und Quecksilber. Hafnium kommt nicht gediegen vor und bisher ist nur ein Mineral mit dem Hauptbestandteil Hafnium bekannt, das 1974 entdeckt und nach diesem als Hafnon benannt wurde. In Zirconium-Mineralen wie unter anderem Zirkon und Allendeit ist jedoch oft Hafnium als Fremdbeimengung enthalten,[21] wobei die Menge an Hafnium meist 2 % des Zirconiumgehaltes (1–5 Gewichtsprozent Hafnium) beträgt. Eines der wenigen Minerale, die mehr Hafnium als Zirconium enthalten, ist die Zirkon-Varietät Alvit [(Hf,Th,Zr)SiO4].
Analog zu Zirconium sind die wichtigsten Lagerstätten an Hafnium die Zirkon-Lagerstätten in Australien und Südafrika. Die Reserven werden auf 1,1 Millionen Tonnen (gerechnet als Hafniumoxid) geschätzt.[22]
Gewinnung und Darstellung


Um Hafnium zu gewinnen, muss es von Zirconium abgetrennt werden. Das ist nicht während des Herstellungsprozesses möglich, sondern erfolgt in einem getrennten Verfahren. Für die Trennung werden Extraktionsverfahren angewendet. Dabei wird die unterschiedliche Löslichkeit bestimmter Zirconium- und Hafniumsalze in speziellen Lösungsmitteln genutzt. Beispiele hierfür sind die verschiedenen Löslichkeiten der Nitrate in Tri-n-butylphosphat und die der Thiocyanate in Methylisobutylketon. Andere mögliche Trennungsmöglichkeiten sind Ionenaustauscher und die fraktionierte Destillation von geeigneten Verbindungen.
Das abgetrennte Hafnium kann anschließend nach dem Kroll-Prozess zunächst in Hafnium(IV)-chlorid überführt werden und anschließend mit Natrium oder Magnesium zu elementarem Hafnium reduziert werden.
Wird noch reineres Hafnium benötigt, kann das Van-Arkel-de-Boer-Verfahren angewandt werden. Dabei reagiert während des Erhitzens unter Vakuum zunächst das Hafnium mit Iod zu Hafnium(IV)-iodid. Das wird an einem heißen Draht wieder zu Hafnium und Iod zersetzt.
Hafnium wird nur in geringen Mengen in einer Größenordnung von 100 Tonnen[17] produziert. Es wird nicht eigens hergestellt, sondern fällt als Nebenprodukt bei der Gewinnung von Hafnium-freiem Zirconium für die Hüllen von Kernbrennstäben an. Der USGS gibt als US-Importpreise für Hafnium 453 USD je kg im Jahre 2010 und 578 USD je kg für 2013 an.[23]
Eigenschaften
Physikalische Eigenschaften
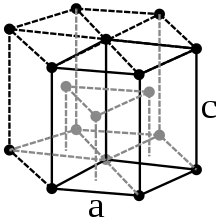
Hafnium ist ein silbrig-glänzendes Schwermetall von hoher Dichte (13,31 g/cm3).[17] Es kristallisiert temperaturabhängig in zwei verschiedenen Modifikationen. Bei Normalbedingungen kristallisiert es in einer hexagonal-dichtesten Kugelpackung (α-Hf) und ist damit isotyp zu α-Zr, oberhalb von 1775 °C[17] geht es in eine kubisch-raumzentrierte Struktur über (β-Hf).
Liegt Hafnium in einer hohen Reinheit vor, ist es relativ weich und biegsam. Es ist leicht durch Walzen, Schmieden und Hämmern zu bearbeiten. Sind dagegen Spuren von Sauerstoff, Stickstoff oder Kohlenstoff im Material vorhanden, wird es spröde und schwer zu verarbeiten. Der Schmelz- und der Siedepunkt des Hafniums sind mit 2233 °C beziehungsweise 4603 °C[11] die höchsten in der Gruppe (Schmelzpunkt: Titan: 1667 °C, Zirconium: 1857 °C).
In fast allen weiteren Eigenschaften ähnelt das Metall seinem leichteren Homologen Zirconium. Dies wird durch die Lanthanoidenkontraktion verursacht, die ähnliche Atom- und Ionenradien bedingt (Atomradien Zr: 159 pm, Hf: 156 pm[17]). Eine Ausnahme ist die Dichte, bei der Zirconium mit 6,5 g/cm3 einen deutlich kleineren Wert besitzt. Ein technisch wichtiger Unterschied besteht darin, dass Hafnium 600-mal besser Neutronen absorbieren kann. Dies ist der Grund dafür, dass für den Einsatz von Zirconium in Kernkraftwerken das Hafnium abgetrennt werden muss.
Hafnium ist unterhalb der Sprungtemperatur von 0,08 K supraleitend.[17]
Chemische Eigenschaften
Hafnium ist ein unedles Metall, das beim Erhitzen mit Sauerstoff zu Hafniumdioxid reagiert. Auch andere Nichtmetalle, wie Stickstoff, Kohlenstoff, Bor und Silicium bilden unter diesen Bedingungen Verbindungen. Bei Raumtemperatur bildet sich schnell eine dichte Oxidschicht, die das Metall passiviert und so vor weiterer Oxidation schützt.
In den meisten Säuren ist Hafnium wegen der Passivierung unter Normalbedingungen beständig. In Flusssäure korrodiert es schnell, in heißer konzentrierter Schwefel- und Phosphorsäure tritt merkliche Korrosion ein. Salzsäure-Salpetersäure-Gemischen, hierzu zählt auch Königswasser, sollte Hafnium auch bei Raumtemperatur nur kurzfristig ausgesetzt werden, bei 35 °C muss mit Abtragsraten von mehr als 3 mm/Jahr gerechnet werden. In wässrigen Basen ist es bis zu einer Temperatur von ca. 100 °C beständig, der Materialabtrag beträgt in der Regel weniger als 0,1 mm/Jahr.
Isotope
Von Hafnium sind insgesamt 35 Isotope und 18 Kernisomere[25] von 153Hf bis 188Hf bekannt. Natürliches Hafnium ist ein Mischelement, das aus insgesamt sechs verschiedenen Isotopen besteht. Das häufigste Isotop ist mit einer Häufigkeit von 35,08 % 180Hf. Es folgen 178Hf mit 27,28 %, 177Hf mit 18,61 %, 179Hf mit 13,62 %, 176Hf mit 5,27 % und 174Hf mit 0,16 %. 174Hf ist schwach radioaktiv, ein Alphastrahler mit einer Halbwertszeit von 2·1015 Jahren. Der Betastrahler 182Hf zerfällt mit einer Halbwertszeit von 9 Mio. Jahren in das stabile Wolfram-Isotop 182W. Diese Erkenntnis wurde genutzt, um die Bildung des Mondes und des Erdkerns auf einen Zeitraum innerhalb der ersten 50 Mio. Jahre einzuschränken.[26]
Die Isotope 177Hf und 179Hf können mit Hilfe der NMR-Spektroskopie nachgewiesen werden.
Das Kernisomer 178m2Hf ist mit einer Halbwertszeit von 31 Jahren[25] langlebig und sendet zugleich beim Zerfall eine starke Gammastrahlung von 2,45 MeV[25] aus. Dies ist die höchste Energie, die ein über längere Zeit stabiles Isotop aussendet. Eine mögliche Anwendung besteht darin, dieses Kernisomer als Quelle in starken Lasern zu verwenden.[27] 1999 entdeckte Carl Collins, dass das Isomer bei Bestrahlung mit Röntgenstrahlung seine Energie auf einen Schlag abgeben kann. Allerdings sind mögliche Anwendungen, etwa als Sprengstoff, unwahrscheinlich.[28]
Verwendung
Auf Grund seiner schwierigen Gewinnung wird Hafnium nur in geringen Mengen verwendet. Das Haupteinsatzgebiet ist die Kerntechnik, in der Hafnium als Steuerstab zur Regulierung der Kettenreaktion in Kernreaktoren eingesetzt wird. Die Verwendung von Hafnium hat gegenüber anderen möglichen neutronenabsorbierenden Substanzen einige Vorteile. So ist das Element sehr korrosionsbeständig und bei der Kernreaktion mit den Neutronen entstehen Hafniumisotope, die ebenfalls hohe Absorptionsquerschnitte besitzen.[29] Auf Grund des hohen Preises kommt es häufig nur für militärische Anwendungen in Frage, beispielsweise für Reaktoren in Atom-U-Booten.
Es existieren noch einige weitere Verwendungsmöglichkeiten. So reagiert Hafnium schnell mit geringen Mengen Sauerstoff und Stickstoff und kann darum als Gettersubstanz eingesetzt werden, um kleinste Mengen dieser Stoffe aus Ultrahochvakuum-Anlagen zu entfernen. Beim Verbrennen sendet das Metall ein sehr helles Licht aus. Deshalb ist es möglich, Hafnium in Blitzlichtlampen mit einer besonders hohen Lichtausbeute einzusetzen. Darüber hinaus kann es zur Herstellung sehr stabiler und hochschmelzender Verbindungen verwendet werden, insbesondere Hafniumnitrid und Hafniumcarbid.
In Legierungen mit Metallen wie Niob, Tantal, Molybdän und Wolfram wirkt ein Zusatz von 2 % Hafnium festigkeitssteigernd. Es entstehen besonders stabile, hochschmelzende und hitzebeständige Werkstoffe.
Aus Hafnium wurde eine einzige Gedenkmünze geprägt: 2002 eine 5 Kronen-Münze der Turks- und Caicosinseln.[30]
Sicherheitshinweise
Wie viele andere Metalle ist Hafnium in feinverteiltem Zustand leichtentzündlich und pyrophor. In kompaktem Zustand ist es dagegen nicht brennbar. Das Metall ist nicht toxisch. Aus diesen Gründen sind für den Umgang mit Hafnium keine besonderen Sicherheitsvorschriften zu beachten.
Verbindungen
Hafnium bildet eine Reihe von Verbindungen. Diese sind meist Salze oder Mischkristalle und besitzen häufig hohe Schmelzpunkte. Die wichtigste Oxidationsstufe des Hafnium ist +IV, es sind aber auch Verbindungen in geringeren Oxidationsstufen, von 0 bis +III, in Komplexen auch negative Oxidationsstufen bekannt.
Hafnium(IV)-oxid
_oxide.jpg.webp)
Hafnium(IV)-oxid ist ein sehr stabiler und hochschmelzender Feststoff. Es besitzt eine hohe relative Permittivität von 25 (zum Vergleich: Siliciumdioxid: 3,9).[31] Darum ist ein Einsatz als High-k-Dielektrikum als Isolation des Steueranschlusses (Gate) für Feldeffekttransistoren möglich.[32] Durch weitere Verkleinerung der Strukturbreiten in integrierten Schaltkreisen werden die Leckströme zu einem immer größeren Problem, denn die Miniaturisierung der Strukturen erfordert auch dünnere Gate-Isolationen. Unter 2 nm Dicke steigt der unerwünschte Leckstrom durch den Tunneleffekt stark an. Durch den Einsatz eines High-k-Dielektrikums kann zur Leckstromverringerung die Dicke des Dielektrikums wieder vergrößert werden, ohne dass es zu Leistungseinbußen (Verringerung der Schaltgeschwindigkeit) kommt. Dickere Dielektrika ermöglichen also eine weitere Miniaturisierung von vor allem Mikroprozessoren.
Weitere Hafniumverbindungen
Hafniumcarbid zählt zu den Substanzen mit den höchsten Schmelzpunkten überhaupt. Zusammen mit Hafniumnitrid und Hafniumdiborid (HfB2) gehört es zu den Hartstoffen. Hafniumdiborid wird aufgrund seiner guten Temperaturwechselbeständigkeit oft als Heizwiderstandsmaterial in thermoelektrischen Druckköpfen von Tintendruckern verwendet.
Es sind einige Halogenverbindungen des Hafniums bekannt. In der Oxidationsstufe +IV existieren sowohl das Hafnium(IV)-fluorid (HfF4) als auch Hafnium(IV)-chlorid (HfCl4), Hafnium(IV)-bromid (HfBr4) und Hafnium(IV)-iodid (HfI4). Hafnium(IV)-chlorid und Hafnium(IV)-iodid spielen bei der Gewinnung des Hafniums eine Rolle. In den niederen Oxidationsstufen sind nur Chlor- und Bromverbindungen, sowie Hafnium(III)-iodid bekannt.
Das Kaliumhexafluoridohafnat(IV) K2[HfF6] wie auch das Ammoniumhexafluoridohafnat(IV) (NH4)2[HfF6] können zur Abtrennung des Hafniums von Zirconium eingesetzt werden, da beide Salze leichter löslicher sind als die entsprechenden Zirconiumkomplexe.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, 1988, ISBN 3-527-26169-9.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3.
- Eric Scerri: A tale of seven elements, Oxford University Press, Oxford, 2013
Weblinks
- Abbildung von kristallinem Hafnium nach Van-Arkel-de-Boer-Verfahren sowie elektronenstrahlgeschmolzenes und verarbeitetes in der Elementansammlung von Heinrich Pniok
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag 1999, ISBN 3-7776-0736-3.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Hafnium) entnommen.
- Standard Atomic Weights, auf ciaaw.org
- Standard Atomic Weight of Hafnium Revised, auf iupac.org
- Eintrag zu hafnium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu hafnium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Hafnium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. 1988, ISBN 3-527-26169-9, S. 1231.
- C. J. Kriessman, T. R. McGuire: Magnetic Susceptibility of Hafnium and Manganese. In: Physical Review. 98, 4, 1955, S. 936–937, doi:10.1103/PhysRev.98.936.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Eintrag zu Hafnium, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Hafnium) entnommen.
- Datenblatt Hafnium, powder, −325 mesh, 99.5% trace metals basis (purity excludes ~2% zirconium), contains 1:10 pentanol to water solution as stabilizer bei Sigma-Aldrich, abgerufen am 3. Mai 2017 (PDF).
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7440-58-6 bzw. Hafnium), abgerufen am 4. März 2020.
- K. Rauschert, J. Voigt, I. Wilke, K-Th. Wilke: Chemische Tabellen und Rechentafeln für die analytische Praxis. 11. Auflage. Europa-Lehrmittel, 2000, ISBN 978-3-8085-5450-0, S. 43.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5.
- Scerri, A Tale of Seven Scientists, and a New Philosophy of Science, Oxford University Press, New York, 2016, S. 99
- K. H. Wedepohl: The composition of the continental crust. In: Geochimica et Cosmochimica Acta. 59, 7, 1995, S. 1217–1232, doi:10.1016/0016-7037(95)00038-2.
- Webmineral – Mineral Species sorted by the element Hf (Hafnium).
- Zirconium und Hafnium bei usgs mineral resources (PDF; 62 kB).
- MINERAL COMMODITY SUMMARIES 2015. (PDF 2,3 MB, S. 191 (188)) USGS, abgerufen am 6. September 2015 (englisch).
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. B30, 1974, S. 193–204, doi:10.1107/S0567740874002469.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- G. Caro, T. Kleine: Extinct Radionuclides and the Earliest Differentiation of the Earth and Moon. In: Anthony Dosseto u. a. (Hrsg.): Timescales of Magmatic Processes: From Core to Atmosphere. Blackwell, 2011, ISBN 978-1-4443-3260-5, S. 9–51 (eingeschränkte Vorschau in der Google-Buchsuche).
- C. B. Collins: Nuclear resonance spectroscopy of the 31-yr isomer of Hf-178 In: Laser Physics Letters. 2, 3, 2005, S. 162–165, doi:10.1002/lapl.200410154.
- Bertram Schwarzschild: Conflicting Results on a Long-Lived Nuclear Isomer of Hafnium Have Wider Implications. In: Physics today. Mai 2004, S. 21; doi:10.1063/1.1768663.
- Hafnium. In: Lexikon der Chemie. Spektrum Akademischer Verlag, Heidelberg/ Berlin 2001.
- 5 Crowns (Death of The Queen Mother 1900-2002) abgerufen 16. März 2020.
- G. D. Wilk, R. M. Wallace, J. M. Anthony: High-κ gate dielectrics: Current status and materials properties considerations. In: Journal of Applied Physics. 89, 10, 2001, S. 5243–5273, doi:10.1063/1.1361065.
- Hafniumoxid bringt den Durchbruch: AG der RUB entwickelt neuartige Verbindung: Preis im Erfinderwettbewerb Presseinfo 101, pm.rub.de, Ruhruniversität Bochum, AG unter Anjana Devi, 20. März 2007, abgerufen 16. März 2020. - Artikel: Reji Thomas, Eduard Rije, Peter Ehrhart, Andrian Milanov, Raghunandan Bhakta, Arne Bauneman, Anjana Devi, Roland Fischer and Rainer Waser: Thin Films of HfO2 for High-k Gate Oxide Applications from Engineered Alkoxide- and Amide-Based MOCVD Precursors. In: „Journal of The Electrochemical Society“ 2007, Vol. 154, Nr. 3, S. G77–G84, 31. Januar 2007.
