Lösungsmittel
Ein Lösungsmittel (auch Lösemittel oder Solvens, auch Menstruum) ist ein Stoff, der Gase, Flüssigkeiten oder Feststoffe lösen und dabei verdünnen kann, ohne dass es beim Lösevorgang zu chemischen Reaktionen zwischen dem Lösungsmittel, dem zu lösenden und dem gelöstem Stoff kommt. (siehe auch: Lösung (Chemie)). In der Regel werden als Lösungsmittel Flüssigkeiten wie Wasser oder flüssige organische Stoffe zum Lösen der Stoffe eingesetzt. Aber auch Feststoffe können andere Stoffe lösen, indem sie diese Stoffe aufnehmen und einlagern. Beispielsweise wird in den Wasserstofftanks von Autos, die mit Brennstoffzellen betrieben werden, gasförmiger Wasserstoff in festem Material, (genannt:Metall-organische Gerüstverbindungen, kurz MOFs) gelöst.
„Lösungsmittel“ oder „Lösemittel“
Beide Bezeichnungen finden sich seit über 200 Jahren in der Literatur. Im Forschungs- und Laborbereich hat sich Lösungsmittel etabliert, in der industriellen und technischen Großchemie dagegen Lösemittel. Beispielsweise spricht das Römpp Lexikon Chemie von Lösungsmittel, während die TRGS (Technische Regeln für Gefahrstoffe) Lösemittel bevorzugen.
Definition im Alltag
Das wohl bekannteste Lösungsmittel ist Wasser. Im Hinblick auf Farben, Lacke, Klebstoffe usw. denkt man jedoch bei dem Begriff „Lösungsmittel“ eher an Stoffe, die unangenehme Gerüche, Gesundheits- und Umweltschäden verursachen, oder sogar explosive Dämpfe freisetzen können. Gemeint sind hierbei Lösemittel im Sinne der TRGS (Technische Regeln für Gefahrstoffe) 610,[1] nach der nur flüchtige organische Lösemittel mit einem Siedepunkt bis 200 °C als Lösemittel bezeichnet werden.
Als lösemittelfrei gelten Produkte, wenn der Lösemittelgehalt des verarbeitungsfertigen Produktes kleiner ist als 0,5 %.
Die als „Hochsieder“, bezeichneten, nur wenig flüchtigen Substanzen mit Siedepunkten über 200 °C, gelten daher rechtlich nicht als Lösemittel. Während klassische Lösemittel aufgrund ihrer Flüchtigkeit schon wenige Stunden bis Tage nach der Verarbeitung vollständig verdunstet sind, können die in manchen als „lösemittelfrei bezeichneten“ Produkten ersatzweise enthaltenen Hochsieder unter Umständen noch über Monate oder Jahre an die Raumluft abgegeben werden. Sie werden daher teils sogar deutlich kritischer beurteilt als Produkte, die klassische, leicht flüchtige Lösemittel enthalten.[2] Gerade die Vermeidung von giftigen, langfristig haltbaren, umweltschädlichen Substanzen ist Bestandteil der Grünen Chemie.
Chemie
Obwohl das Lösungsmittel nicht selbst an der chemischen Reaktion teilnimmt, kann es für den gewünschten Ablauf einer chemischen Reaktion sehr wichtig sein. Dabei können die Auswirkungen des Lösungsmittels sehr unterschiedlich sein. Sie hängen ab von der Art und der Löslichkeit der beteiligten Reaktionspartner und von der Art der gewünschten Reaktion. Dabei ist wichtig und nützlich, das durch die Auflösung der Reaktionspartner in dem Lösungsmittel die ablaufenden Reaktionen thermisch beeinflussbar und damit kontrollierbar werden. Dabei muss bedacht werden, dass die Konzentrationsangaben von gelösten Substanzen wegen der Temperaturabhängigkeit nur für eine bestimmte Temperatur gelten.
Die wichtigsten Aufgaben des Lösemittels bei chemischen Reaktionen sind
- konvektiver Wärme- und Stofftransport
- Stabilisierung von Übergangszuständen der Reaktion
- Verdünnung zur Vermeidung von Nebenreaktionen
Für die Reinigung und Prozessierung von Reaktionsgemischen (Downstream-Prozess) spielen Lösungsmittel eine weitere wichtige Rolle. Hier seien exemplarisch einige wichtige Verfahrensweisen benannt:
Marktwirtschaftliche Aspekte
Die wichtigste Lösungsmittel-Gruppe sind Alkohole, wie Ethanol, n-Butanol, Isopropanol und Methanol. Im Jahr 2011 wurden hiervon weltweit ca. 6,4 Mio. Tonnen nachgefragt. Ein überdurchschnittlicher Verbrauchsanstieg von jährlich mehr als 3 % wird in der Periode 2011 bis 2019 bei Ethanol sowie bei den Ethern erwartet. Neben den halogenierten Lösungsmitteln, die in Westeuropa und Nordamerika ihren Abwärtstrend fortsetzen, werden auch Aromaten und reine Kohlenwasserstoffe langfristig weiter an Bedeutung verlieren.[3]
Löseeigenschaften
Die quantitative Vorhersage von Löseeigenschaften und ihrer Temperaturabhängigkei ist nicht möglich und muss experimentell ermittelt werden. Es gibt jedoch die plausible, generelle Regel:„Similia similibus solvuntur“ (lat.: „Ähnliches löst sich in Ähnlichem“), die aber nur als Richtschnur gelten kann. Gemäß dieser Regel lösen sich polare Stoffe mehr oder weniger gut in polaren Lösemitteln, (z. B. Salze in Wasser). Dagegen lösen sich unpolare Stoffe mehr oder weniger gut in unpolaren Lösemitteln, (z. B. Fette und Öle in unpolaren organischen Lösemitteln wie Benzol oder Ether).
Einteilungen
Lösungsmittel werden meist nach ihren physikalischen Eigenschaften in Klassen eingeteilt. Solche Einteilungskriterien sind z. B.:
- Siedepunkt
- Permittivität (Polarisationsfähigkeit)
- Flammpunkt
- Flüchtigkeit
- Viskosität
- Polarität
- CH-Acidität
Aprotische Lösungsmittel
Wenn das Molekül eines Lösungsmittels nicht über eine funktionelle Gruppe verfügt, aus der Wasserstoffatome als Protonen abgespalten werden können (Dissoziation), spricht man von einem aprotischen Lösungsmittel. Sie stehen den protischen Lösungsmitteln gegenüber.
Aprotisch-unpolar
Alkane sind wegen des geringen Unterschieds in der Elektronegativität zwischen Kohlenstoff und Wasserstoff unpolar. Dies macht alle Stoffe dieser Gruppen ineinander leicht löslich; sie sind sehr lipophil (eigentlich noch lipophiler als die sehr schwach polaren, namensgebenden Fette) und sehr hydrophob (wasserabweisend). Aber nicht nur Wasser kann sich nicht lösen, sondern alle anderen stark polaren Stoffe auch nicht, wie z. B. kurzkettige Alkohole, Chlorwasserstoff oder Salze. In der Flüssigkeit werden die Teilchen lediglich von Van-der-Waals-Kräften zusammengehalten. Deshalb fallen bei dieser Stoffgruppe die Siedetemperaturen im Vergleich zu Molekülgröße und -masse wesentlich niedriger aus als bei permanenten Dipolen. Da eine Abspaltung von Protonen unter Bildung von Carbanionen nur mit extrem starken Basen möglich ist, sind sie aprotisch. Ebenfalls zur Gruppe der aprotisch-unpolaren Lösungsmittel gezählt werden außerdem Verbindungen wie etwa Carbonsäureester oder Ether, die zwar polare Bindungen enthalten, aufgrund ihrer niedrigen Permittivität jedoch nicht in der Lage sind, ionische Verbindungen aufzulösen.
Vertreter dieser Gruppe sind:
- Alkane (Paraffine)
- Alkene (Olefine), Alkine
- Benzol und andere Aromaten mit aliphatischen und aromatischen Substituenten
- Carbonsäureester
- Ether, z. B. Diethylether
- völlig symmetrisch gebaute Moleküle wie etwa Tetramethylsilan oder Tetrachlorkohlenstoff
- Kohlenstoffdisulfid, bei hohem Druck auch Kohlenstoffdioxid
- halogenierte Kohlenwasserstoffe, die entweder (wie Tetrachlorkohlenstoff) völlig unpolar oder aber trotz der hohen Elektronegativität des betreffenden Halogens, z. B. Chlors, nur wenig polar (Methylenchlorid) sind
- Eine spezielle Untergruppe halogenierter Kohlenwasserstoffe bilden dabei die perfluorierten Kohlenwasserstoffe (z. B. Hexafluorbenzol), die nicht nur selber unpolar, sondern auch sehr schlecht von außen polarisierbar sind und sich daher auch mit den übrigen unpolaren Lösungsmitteln eher schlecht vertragen.
Aprotisch-polar
Ist das Molekül jedoch mit stark polaren funktionellen Gruppen wie der Carbonylgruppe, der Nitrogruppe oder der Nitrilgruppe substituiert, so weist das Molekül ein Dipolmoment auf, zwischenmolekular tritt nun also elektrostatische Anziehung dauerhafter Dipole zu den immer noch vorhandenen (aber viel schwächeren) Van-der-Waals-Kräften hinzu. Dies hat eine wesentliche Erhöhung des Siedepunktes zur Folge und in vielen Fällen eine Verschlechterung der Mischbarkeit mit unpolaren Lösungsmitteln sowie eine Verbesserung der Löslichkeit von und in polaren Stoffen. Typische aprotisch-polare Lösungsmittel weisen eine Permittivität über 15 auf[4] und sind in der Lage, Kationen zu solvatisieren. Da die Anionen kaum solvatisiert werden (nackte Anionen), zeigen sie eine hohe SN2-Reaktivität. Derartige Lösungsmittel sind hervorragend geeignet, um nukleophile Substitutionen unter milden Bedingungen durchzuführen. Dazu gehören:
- Ketone, z. B. Aceton
- Lactone wie γ-Butyrolacton
- Lactame wie N-Methyl-2-pyrrolidon
- Nitrile wie Acetonitril
- Nitroverbindungen wie Nitromethan
- tertiäre Carbonsäureamide wie Dimethylformamid
- Harnstoffderivate wie Tetramethylharnstoff oder Dimethylpropylenharnstoff (DMPU)
- Sulfoxide wie Dimethylsulfoxid (DMSO)
- Sulfone wie Sulfolan
- Kohlensäureester wie Dimethylcarbonat oder Ethylencarbonat
Protische Lösungsmittel
Sobald ein Molekül über eine funktionelle Gruppe verfügt, aus der Wasserstoffatome im Molekül als Protonen abgespalten werden können (Dissoziation), spricht man von einem protischen Lösungsmittel. Diese stehen den aprotischen Lösungsmitteln gegenüber.
Das wichtigste protische Lösungsmittel ist Wasser, das (vereinfacht) in ein Proton und ein Hydroxid-Ion dissoziiert.
Weitere protische Lösungsmittel stellen z. B. Alkohole und Carbonsäuren dar. Hier erfolgt die Abspaltung des Protons immer an der OH-Gruppe, da der elektronegative Sauerstoff die entstehende negative Ladung gut aufnehmen kann.
Das Maß, in dem das jeweilige Lösungsmittel dissoziiert, wird durch die Acidität (nach dem Säure-Base-Konzept von Brønsted und Lowry) bestimmt. Es ist zu beachten, dass auch an Kohlenstoff gebundene Wasserstoff-Atome als Protonen abgespalten werden können (CH-Acidität), die Acidität dieser Verbindungen aber meist zu gering ist, um eine nennenswerte Dissoziation in neutralem Medium zu erlauben. Die Freisetzung dieser Protonen ist nur durch sehr starke Basen möglich.
Polar protische Lösungsmittel lösen Salze und polare Verbindungen, dagegen ist die Löslichkeit unpolarer Verbindungen gering.
Protische Lösungsmittel sind:
- Wasser, das wichtigste Lösungsmittel überhaupt, insbesondere in der belebten Natur
- Methanol, Ethanol und andere kurzkettige Alkohole (je größer das C-Gerüst, desto weniger stark ausgeprägt ist der polare Charakter, so ist Cholesterin z. B. ein Alkohol, aber dennoch stark lipophil)
- primäre und sekundäre Amine
- Carbonsäuren (Ameisensäure, Essigsäure)
- primäre und sekundäre Amide wie Formamid
- Mineralsäuren (Schwefelsäure, Halogenwasserstoffe bzw. Halogenwasserstoffsäuren)
Polaritätsskalen
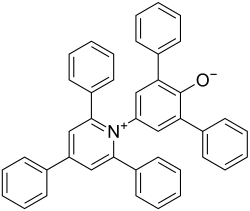
Eine bekannte Skala für die Polarität eines Lösungsmittels ist die ET(30)- oder ETN-Skala. Sie leitet sich von empirischen spektroskopischen Messungen ab. Der ET(30)-Wert ist als Übergangsenergie der längstwelligen Vis/NIR-Absorptionsbande in einer Lösung mit dem negativ solvatochromen Reichardt-Farbstoff (Betain 30) bei Normalbedingungen in kcal·mol−1 definiert. Der ETN-Wert ist der auf die Polaritätsextrema Tetramethylsilan (=0) und Wasser (=1) normalisierte ET(30)-Wert.[5][6]
Tabelle mit Lösungsmitteln und ihren Daten
| Lösungsmittel | Schmelzp. [°C] |
Siedep. [°C] |
Flammp. [°C] |
Dichte [g/cm3] bei 20 °C |
Permittivität bei 25 °C |
Dipolmoment [· 10−30 Cm] |
Brechungsindex |
[kJ/mol][7] |
Kompressibilität [10−6 /bar][8] |
|---|---|---|---|---|---|---|---|---|---|
| Aceton | −95,35 | 56,2 | −19 | 0,7889 | 20,70 | 9,54 | 1,3588 | 176,4 | 126 |
| Acetonitril | −45,7 | 81,6 | 13 | 0,7857 | 37,5 (20 °C) | 11,48 | 1,3442 | 192,3 | 115 |
| Anilin | −6,3 | 184 | 76 | 1,0217 | 6,89 (20 °C) | 5,04 | 1,5863 | 185,2 | - |
| Anisol | −37,5 | 155,4 | 41 | 0,9961 | 4,33 | 4,17 | 1,5179 | 155,5 | - |
| Benzol | 5,5 | 80,1 | −8 | 0,87565 | 2,28 | 0,0 | 1,5011 | 142,2 | 95 |
| Benzonitril | −13 | 190,7 | 70 | 1,0102 (15 °C) | 25,20 | 13,51 | 1,5289 | 175,6 | - |
| Brombenzol | −30,8 | 156 | 51 | 1,4950 | 5,40 | 5,17 | 1,5597 | 156,8 | - |
| 1-Butanol | −89,8 | 117,3 | 34 | 0,8098 | 17,51 | 5,84 | 1,3993 | 209,8 | - |
| tert-Butylmethylether (MTBE) | −108,6 | 55,3 | −28 | 0,74 | ? | ? | 1,3690 | 145,2 | - |
| γ-Butyrolacton | −44 | 204–206 | 101 | 1,13 | 39,1 | 4,12 | 1,436 | – | - |
| Chinolin | −15,6 | 238 | 101 | 1,0929 | 9,00 | 7,27 | 1,6268 | 164,7 | - |
| Chlorbenzol | −45,6 | 132 | 28 | 1,1058 | 5,62 | 5,14 | 1,5241 | 156,8 | - |
| Chloroform | −63,5 | 61,7 | – | 1,4832 | 4,81 (20 °C) | 3,84 | 1,4459 | 163,4 | 100 |
| Cyclohexan | 6,5 | 80,7 | 4,5 | 0,7785 | 2,02 (20 °C) | 0,0 | 1,4266 | 130,4 | 118 |
| Dibutylether | −98 | 142,5 | 25 | 0,764 | 4,34 (20 °C) | 3,9 | 1,399 | 187,6 | - |
| Diethylenglycol | −6,5 | 244,3 | 124 | 1,1197 (15 °C) | 7,71 | 7,71 | 1,4475 | 224,9 | - |
| Diethylether | −116,2 | 34,5 | −40 | 0,7138 | 4,34 (20 °C) | 4,34 | 1,3526 | 144,6 | - |
| Dimethylacetamid | −20 | 165 | 66 | 0,9366 (25 °C) | 37,78 | 12,41 | 1,4380 | 182,7 | - |
| Dimethylformamid | −60,5 | 153 | 67 | 0,9487 | 37,0 | 12,88 | 1,4305 | 183,1 | - |
| Dimethylsulfoxid | 18,4 | 189 | 88 | 1,1014 | 46,68 | 13,00 | 1,4770 | 188,1 | - |
| 1,4-Dioxan | 11,8 | 101 | 12 | 1,0337 | 2,21 | 1,5 | 1,4224 | 150,0 | - |
| Eisessig | 16,6 | 117,9 | 42 | 1,0492 | 6,15 (20 °C) | 5,60 | 1,3716 | 214,0 | - |
| Essigsäureanhydrid | −73,1 | 139,5 | 49 | 1,0820 | 20,7 (19 °C) | 9,41 | 1,3900 | 183,5 | - |
| Essigsäureethylester | −83,6 | 77,06 | −2 | 0,9003 | 6,02 | 6,27 | 1,3723 | 159,3 | 104 |
| Ethanol | −114,5 | 78,3 | 18 | 0,7893 | 24,55 | 5,77 | 1,3614 | 216,9 | 114 |
| 1,2-Dichlorethan (Ethylendichlorid) | −35,3 | 83,5 | 13 | 1,2351 | 10,36 | 6,2 | 1,4448 | 175,1 | - |
| Ethylenglycol | −13 | 197 | 117 | 1,1088 | 37,7 | 7,61 | 1,4313 | 235,3 | - |
| Ethylenglycoldimethylether | −58 | 84 | −6 | 0,8628 | 7,20 | 5,70 | 1,3796 | 159,7 | - |
| Formamid | 2,5 | 210,5 | 175 | 1,1334 | 111,0 (20 °C) | 11,24 | 1,4472 | 236,6 | - |
| n-Hexan | −95 | 68 | −20 | 0,6603 | 1,88 | 0,0 | 1,3748 | 129,2 | 150 |
| n-Heptan | −91 | 98 | −4 | 0,684 | 1,97 | 0,0 | 1,387 | 130,1 | 120 |
| 2-Propanol (Isopropylalkohol) | −89,5 | 82,3 | 16 | 0,7855 | 19,92 | 5,54 | 1,3776 | 203,1 | 100 |
| Methanol | −97,8 | 64,7 | 6,5 | 0,7914 | 32,70 | 5,67 | 1,3287 | 232,0 | 120 |
| 3-Methyl-1-butanol (Isoamylalkohol) | −117,2 | 130,5 | 42 | 0,8092 | 14,7 | 6,07 | 1,4053 | 196,5 | - |
| 2-Methyl-2-propanol (tert-Butanol) | 25,5 | 82,5 | 9 | 0,7887 | 12,47 | 5,54 | 1,3878 | 183,1 | - |
| Methylenchlorid (Dichlormethan, DCM) | −95,1 | 40 | – | 1,3266 | 8,93 | 5,17 | 1,4242 | 171,8 | - |
| Methylethylketon (Butanon) | −86,3 | 79,6 | −4 | 0,8054 | 18,51 (20 °C) | 9,21 | 1,3788 | 172,6 | - |
| N-Methyl-2-pyrrolidon (NMP) | −24 | 202 | 245 | 1,03 | 32,2 | 4,09 | 1,47 | – | - |
| N-Methylformamid | −3,8 | 183 | 111 | 1,011 (19 °C) | 182,4 | 12,88 | 1,4319 | 226,1 | - |
| Nitrobenzol | 5,76 | 210,8 | 81 | 1,2037 | 34,82 | 13,44 | 1,5562 | 175,6 | - |
| Nitromethan | −28,5 | 100,8 | 35 | 1,1371 | 35,87 (30 °C) | 11,88 | 1,3817 | 193,5 | - |
| n-Pentan | −130 | 36 | −49 | 0,6262 | – | – | 1,358 | 129,7 | - |
| Petrolether/Leichtbenzin | – | 25–80 | -26 | 0,63–0,83 | – | – | – | – | – |
| Piperidin | −9 | 106 | 4 | 0,8606 | 5,8 (20 °C) | 3,97 | 1,4530 | 148,4 | - |
| Propanol | −126,1 | 97,2 | 24 | 0,8035 | 20,33 | 5,54 | 1,3850 | 211,9 | 100 |
| Propylencarbonat (4-Methyl-1,3-dioxol-2-on) | −48,8 | 241,7 | 130 | 1,2069 | 65,1 | 16,7 | 1,4209 | 195,6 | - |
| Pyridin | −42 | 115,5 | 23 | 0,9819 | 12,4 (21 °C) | 7,91 | 1,5095 | 168,0 | - |
| Schwefelkohlenstoff | −110,8 | 46,3 | −30 | 1,2632 | 2,64 (20 °C) | 0,0 | 1,6319 | 136,3 | - |
| Sulfolan | 27 | 285 | 177 | 1,261 (25 °C) | 43,3 (30 °C) | 16,05 | 1,4840 | 183,9 | - |
| Tetrachlorethen | −19 | 121 | – | 1,6227 | 2,30 | 0,0 | 1,5053 | 133,3 | - |
| Tetrachlorkohlenstoff | −23 | 76,5 | – | 1,5940 | 2,24 (20 °C) | 0,0 | 1,4601 | 135,9 | 110 |
| Tetrahydrofuran | −108,5 | 66 | −22,5 | 0,8892 | 7,58 | 5,84 | 1,4070 | 156,3 | - |
| Toluol | −95 | 110,6 | 7 | 0,8669 | 2,38 | 1,43 | 1,4961 | 141,7 | 87 |
| 1,1,1-Trichlorethan | −30,4 | 74,1 | – | 1,3390 | 7,53 (20 °C) | 5,24 | 1,4379 | 151,3 | - |
| Trichlorethen | −73 | 87 | – | 1,4642 | 3,42 (16 °C) | 2,7 | 1,4773 | 150,1 | - |
| Triethylamin | −114,7 | 89,3 | −7 | 0,7275 | 2,42 | 2,90 | 1,4010 | 139,2 | - |
| Triethylenglycol | −5 | 278,3 | 166 | 1,1274 (15 °C) | 23,69 (20 °C) | 9,97 | 1,4531 | 223,6 | - |
| Triethylenglycoldimethylether (Triglyme) | – | 222 | 113 | 0,98 | 7,5 | – | 1,4233 | 161,3 | - |
| Wasser | 0,0 | 100 | – | 0,9982 | 78,39 | 6,07 | 1,3330 | 263,8 | 46 |
Tabelle mit alkoholischen Lösungsmitteln und ihren Verdunstungsraten
relativ zu Essigsäure-n-butylester (= 1)[9]
| Lösungsmittel | Siedep. [°C] |
Verdunstungsrate |
|---|---|---|
| Methanol | 65 | 2,1 |
| Ethanol | 78 | 1,6 |
| 2-Propanol | 82 | 1,4 |
| tert-Butanol | 83 | 0,95 |
| tert-Amylalkohol | 102 | 0,93 |
| 1-Propanol | 97 | 0,86 |
| 2-Butanol | 100 | 0,81 |
| 2-Methyl-1-propanol | 108 | 0,62 |
| 1-Butanol | 118 | 0,44 |
| 4-Methyl-2-pentanol (MIBC) | 132 | 0,3 |
| 1-Pentanol (Amylalkohol) | 137 | 0,2 |
| Diacetonalkohol | 166 | 0,14 |
| 2-Ethyl-1-butanol | 146 | 0,11 |
| Hexanol | 148 | 0,096 |
| Cyclohexanol | 161 | 0,05 |
| Tetrahydrofurfurylalkohol | 178 | 0,03 |
| 2-Ethylhexanol | 185 | 0,02 |
| 2-Octanol | 177 | 0,018 |
| 1-Octanol | 196 | 0,007 |
| Benzylalkohol | 205 | 0,007 |
| 1-Decanol | 231 | 0,001 |
Indifferente Lösungsmittel
Unter einem indifferenten bzw. neutralen Lösungsmittel wird in der Polymerchemie ein Medium verstanden, das
- Abbruch- und Übertragungsreaktionen von Polymerisationen und dadurch auch Polymerisationsgeschwindigkeit und -grad wenig bis nicht beeinflusst.[10]
- für alle Domänen eines Blockcopolymers gleiche Lösungseigenschaften aufweist (das Gegenteil ist ein selektives Lösungsmittel).[11]
„Schwere“ und „leichte“ Lösemittel
Speziell bei Extraktionen mit oder aus Wasser unterscheidet man zwischen schweren und leichten Lösemitteln, weil je nach Dichte des Lösemittels ggf. andere Methoden oder andere Apparaturen anzuwenden sind. Die Bezeichnung schwer oder leicht bezieht sich auf die Dichte von Wasser. Lösemittel werden als schwer bezeichnet, wenn die Dichte größer als die von Wasser, und als leicht, wenn sie niedriger ist.
Siehe auch
Literatur
- C. Reichardt: Solvents and Solvent Effects in Organic Chemistry. Wiley-VCH Verlag, Weinheim 1979 (1. Auflage), 1988 (2. Auflage), 2003 (3. Auflage), 2010 (4. Auflage; mit T. Welton).
Weblinks
- Eigenschaften von Lösungsmitteln (engl.)
Einzelnachweise
- TRGS (baua.de).
- lga.de: Produktgruppe Klebstoffe (Memento vom 16. September 2010 im Internet Archive)
- Marktstudie Lösungsmittel von Ceresana.
- Eintrag zu aprotische Lösemittel. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Juni 2014.
- Alan R. Katritzky, Dan C. Fara, Hongfang Yang, Kaido Tämm et al.: Quantitative Measures of Solvent Polarity, S. 183 Spectroscopic Measurements.
- Karl Dimroth, Christian Reichardt, Theodor Siepmann, Ferdinand Bohlmann: Über Pyridinium-N-phenol-betaine und ihre Verwendung zur Charakterisierung der Polarität von Lösungsmitteln. In: Justus Liebigs Annalen der Chemie. Band 661, Nr. 1, 18. Februar 1963, S. 1–37, doi:10.1002/jlac.19636610102.
- AG Reichardt: ET(30)-Werte der Aliphatische, cycloaliphatische, aromatische Ether, Thioether und Acetale und Alkane
- Agilent Technologies: Tabelle 9: Kompressibilität von Lösungsmitteln. (PDF; 5,1 MB) Februar 2009, archiviert vom Original am 31. Juli 2013; abgerufen am 31. Juli 2013.
- Nicholas P. Cheremisinoff: Industrial Solvents Handbook. 2. Auflage. Marcel Dekker, 2003, ISBN 0-8247-4033-5, S. 6.
- M.D. Lechner, K. Gehrke, E.H. Nordmeier, Makromolekulare Chemie, 4. Auflage, Basel 2010, S. 160.
- H.-G. Elias, Makromoleküle Band 1, 5. Auflage, Basel 1990, S. 797.