Thioester
Unter Thioester (auch Thiolester) versteht man in der organischen Chemie zwei Gruppen isomerer Verbindungen, bei denen ein Sauerstoffatom der Ester-Gruppe durch Schwefel ersetzt ist. Da die Ester-Gruppe zwei Sauerstoffatome enthält, ergeben sich auch zwei Möglichkeiten der Substitution.
| Thioester |
|---|
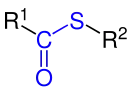 Thiolsäureester, ein Monothioester |
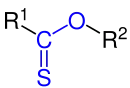 Thionsäureester, ein Monothioester |
| R1, R2 = Organylgruppe wie z. B. Alkylgruppe oder Arylgruppe.
Die funktionellen Gruppen sind blau markiert. |
Sind beide Sauerstoffatome eines Carbonsäureesters durch Schwefelatome ersetzt, liegen Dithioester (Dithiocarbonsäureester) vor.
Thiolester
Von allergrößter Bedeutung sind die sich durch den Ersatz des die Acylgruppe mit dem Rest R2 verbindenden Sauerstoffs ergebenden Thiolester im Stoffwechsel. Diese Thiolesterbindung ist energetisch recht ungünstig, d. h. ihre Auflösung z. B. durch eine Hydrolyse liefert relativ viel Energie. Daher spielen sie im Stoffwechsel aller lebenden Organismen eine zentrale Rolle als Energie- und Acylgruppenüberträger. Wichtige Thiolester des Stoffwechsels sind z. B. Acetyl-CoA[1] oder Malonyl-CoA. Die Photochemie der Thiolester ist in der Literatur[2] beschrieben, dabei bilden sich u. a. Disulfide. Bei der Photolyse der S-Arylthiolester der ortho-Chlorbenzoesäure wird die Bildung von Thioxanthon-Derivaten beobachtet.[3] Analoge Photosynthesen von Azathioxanthonen wurden ebenfalls beschrieben.[4]
Thionester
Die Thionester ergeben sich andererseits durch den Ersatz des Carbonylsauerstoffs einer Ester-Gruppe durch Schwefel. Dies ist möglich z. B. durch Reaktion eines Esters mit Lawessons Reagenz. Die Verbindungsklasse der Thionester besitzt keine größere Bedeutung.
Einzelnachweise
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta AG, 2006, S. 415. ISBN 978-3-906390-29-1.
- Jürgen Martens und Klaus Praefcke: Organische Schwefelverbindungen VII: Photochemische α-Spaltung von Thiobenzoesäure-S-p-tolylestern in Lösung, Chemische Berichte 107 (1974) 2319–2325, doi:10.1002/cber.19741070716.
- Gerd Buchholz, Jürgen Martens, Klaus Praefcke: Photochemische Thioxanthon-Synthese aus Halogenthiobenzoesäure-S-arylestern, Synthesis 1974, 666–667, doi:10.1055/s-1974-23399.
- Gerd Buchholz, Jürgen Martens, Klaus Praefcke: 2- und 4-Azathioxanthone durch Photoumlagerung von Thionicotinsäure-S-arylestern, Angew. Chem. 1974, 86, 562–563; Angew. Chem. Int. Ed. Engl. 1974, 13, 550–551, doi:10.1002/anie.197405501.