Ozonschicht
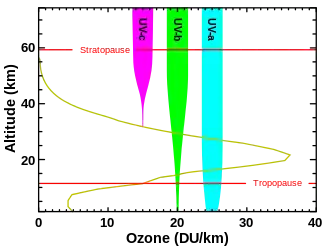
Die Ozonschicht ist ein Bereich erhöhter Konzentration des Spurengases Ozon (O3) in der Erdatmosphäre, hauptsächlich in der unteren Stratosphäre. Etwa 90 % des atmosphärischen Ozons befinden sich in 15 bis 30 km Höhe.[1] In etwa 40 km Höhe hat es seine höchste Volumenkonzentration von etwa 8 ppm.[2] Es entsteht aus dem Luftsauerstoff, indem dessen Moleküle O2 durch den energiereichsten Anteil des Sonnenlichts (UV-C) zu Sauerstoffatomen gespalten werden. Die Atome verbinden sich dann sofort mit je einem weiteren O2 zu O3.
Ozon selbst ist viel lichtempfindlicher als O2. Es absorbiert UV-C und UV-B und schützt damit Pflanzen, Organismen, Tiere und Menschen vor Strahlenschäden. Wenn ein Ozon-Molekül ein UV-Photon absorbiert, wird es zwar gespalten, aber in den allermeisten Fällen bildet das freigesetzte O-Atom sofort wieder Ozon. Nur die Ausnahmen, hauptsächlich O + O3 → 2 O2, bedeuten einen Verlust von Ozon.
Ozon hat großen Einfluss auf die Temperatur der Stratosphäre, einerseits über die UV-Absorption, andererseits absorbiert und emittiert es als gewinkeltes Molekül entsprechend seiner Resonanz um 9…10 µm im Mittleren Infrarot und trägt so zum Treibhauseffekt bei.
Die Temperatur steigt wegen des Ozons von etwa −60 °C in 15 bis 20 km Höhe auf etwa 0 °C in 50 km Höhe an.[2]
Als Entdecker der Ozonschicht gelten die französischen Physiker Charles Fabry und Henri Buisson. Sie wiesen 1913 durch UV-spektroskopische Messungen Ozon in höheren Atmosphärenschichten nach.
Globale Verteilung
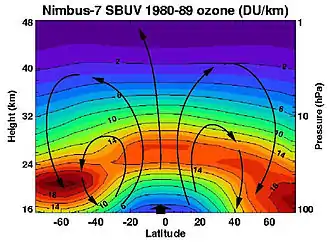
Die effektive Lebensdauer des Ozons ist groß genug, dass es von den langsamen Strömungen der Stratosphäre global transportiert wird: Obwohl das meiste Ozon im Bereich des Äquators entsteht, befindet sich der überwiegende Teil des Ozons in gemäßigten und hohen Breiten, im Höhenbereich zwischen 15 und 25 Kilometern. Die Säulenhöhe, gemessen in Dobson-Einheiten (DU), beträgt in gemäßigten Breiten zwischen 300 und 400 DU, in höheren Breiten im Frühsommer teils über 500 DU, wobei 100 DU einer Stärke von 1 mm entsprechen. In den Tropen wird die Ozonschicht vom Aufstrom aus der Troposphäre auf 20 bis 30 km Höhe angehoben und auf 200 bis 300 DU ausgedünnt. Die global geringste Säulenhöhe beträgt im sogenannten Ozonloch, das sich regelmäßig im Frühjahr der Antarktis auftut, manchmal weit unter 200 DU.[3]
Messung
Die Ozonverteilung und dessen Konzentration können mit Stratosphärenballons bis 30 km und durch Messung der Infrarotstrahlung der Erde von künstlichen Erdsatelliten (Raumsonden) aus gemessen werden. Letzteres ist möglich, weil die entsprechend der Planckschen Strahlungskurve von der Erdoberfläche abgegebene Wärmestrahlung nach Durchtritt durch die Atmosphäre die durch die typischen Absorptionsmaxima der Treibhausgase verursachten Minima enthält. Bei Ozon ist das ein Bereich unterhalb 10 µm Wellenlänge.
Ballonsonden messen den Ozongehalt elektrochemisch mittels Kaliumjodidlösung und funken die Werte während ihres Aufstieges bis über 30 km laufend zur Erde. Ozon emittiert wie andere Treibhausgase seinerseits bei der charakteristischen Wellenlänge um 10 µm entsprechend seiner Temperatur. Daher kann die Gesamtkonzentration bei Kenntnis der Druck- und Temperaturverteilung auch vom Boden und von Flugzeugen aus gemessen werden.[4]
Prozesse

Die Photolyse eines Sauerstoffmoleküls (O2) bei Wellenlängen unter 240 nm liefert zwei Sauerstoffatome, die sich jeweils an ein weiteres Sauerstoffmolekül binden, sodass zwei Ozonmoleküle entstehen:
- 3 O2 → 2 O3 (Wellenlänge < 240 nm)
Ozon absorbiert langwelligeres UV-Licht, bis etwa 300 nm, wobei die Ozonmoleküle je ein Sauerstoffatom abspalten. Dieses Atom findet in den allermeisten Fällen gleich wieder Anschluss an ein Sauerstoffmolekül, sodass die Ozonmenge kaum abnimmt:
- O3 + O2 → O2 + O3 (Wellenlänge < 300 nm)
In einer sauberen Stratosphäre ist der häufigste Verlustprozess die Reaktion eines Sauerstoffatoms mit einem Ozonmolekül. Dabei entstehen zwei gewöhnliche Sauerstoffmoleküle:
- O + O3 → 2 O2
Dies ist der sogenannte Ozon-Sauerstoff-Zyklus, bei dem die Menge von Ozon annähernd konstant bleibt.
Beobachtbarkeit
Trotz der geringen Anzahl der Ozonmoleküle in 15 bis 30 km Höhe macht sich die Ozonschicht bei zwei atmosphärischen Phänomenen während der Dämmerung bemerkbar, die beide auf die Chappuis-Absorption zurückzuführen sind:[5]
- Direkt nach Sonnenuntergang bzw. vor Sonnenaufgang ist die Blaufärbung des Himmels vorwiegend auf die Absorptionswirkung des Ozons zurückzuführen und nicht – wie sonst am Taghimmel – auf die Rayleigh-Streuung. Dass die Chappuis-Absorption Ursache dieser Färbung ist, wurde erst 1952 von dem US-amerikanischen Geophysiker Edward Hulburt (1890–1982) erkannt. Bekannt war diese besondere, als Blaue Stunde bekannte Färbung des Himmels bereits zuvor.
- Kurz vor Sonnenauf- beziehungsweise nach Sonnenuntergang ist der sogenannte Erdschattenbogen sichtbar. Dabei handelt es sich um einen horizontnahen blaugrauen Streifen in Gegenposition zur Sonne. Nach einer der umstrittenen Theorien der Entstehung des Erdschattenbogens sei seine Farbe ebenfalls auf die Absorptionswirkung des Ozons zurückzuführen.
Erdgeschichte
Vor etwa 3,5 Milliarden Jahren enthielt die Erdatmosphäre noch keinen freien Sauerstoff (O2). Mit dem Auftreten der ersten oxygen-phototrophen (bei der Photosynthese O2 freisetzenden) Mikroorganismen, wahrscheinlich Cyanobakterien, begann die Freisetzung von Sauerstoff (O2) aus Wasser. Der freigesetzte Sauerstoff (O2) gelangte aber vorerst nicht in die Atmosphäre, sondern wurde bei der Oxidation der im Wasser gelösten unedlen Metall-Ionen, vor allem Fe2+, und des ebenfalls im Wasser gelösten Sulfids verbraucht. Erst als nach sehr langer Zeit diese Oxidationen abgeschlossen waren, konnte sich freier Sauerstoff in der Erdatmosphäre ansammeln. Diese Phase der Entwicklung der Erdatmosphäre wird als große Sauerstoffkatastrophe bezeichnet. Durch Konvektion und Diffusion gelangte Sauerstoff bis in die Stratosphäre, wo dann durch den Ozon-Sauerstoff-Zyklus die Ozonschicht entstand.
Ozonloch
Als Bestandteil bestimmter Gase, insbesondere Fluorchlorkohlenwasserstoffen (FCKW), gelangen Chlor und Brom in die Stratosphäre, die dann durch katalytische Kreisprozesse zum Abbau des stratosphärischen Ozons beitragen. Dadurch erhöht sich die UV-B-Strahlung auf der Erdoberfläche, was nachteilige Auswirkungen auf Mensch und Natur hat, weil organische Stoffe photochemisch zerlegt werden. In der Polarnacht über der Antarktis enstetehen Polare Stratosphärenwolken, für die es sonst in der trockenen Stratosphäre zu warm ist. In ihnen sind die Ozon abbauenden Stoffe gebunden und werden beim Sonnenaufgang im Frühjahr durch Photolyse massiv frei. Im unteren Teil der Stratosphäre wird dadurch das Ozon innerhalb weniger Wochen fast vollständig abgebaut. Erst wenn der Polarwirbel instabil wird, dringen ozonreichere Luftmassen in das Ozonloch ein und schließen es, während ozonarme Luft manchmal bis Südamerika und Australien vordringt und dort zu erhöhten UV-B-Werten führt. Auswirkungen sind zu erwarten, aber schwer zu erfassen. Im Jahr 1981 beschrieb Veerabhadran Ramanathan, dass allein der sehr starke Treibhauseffekt der Fluorchlorkohlenwasserstoffe die Erdatmosphäre bis zum Jahr 2000 um ein ganzes Grad erwärmen würde, wenn die Emissionen dieser Gase nicht dramatisch reduziert werden.[6]
Die stratosphärische Ozonschicht steht nicht in Verbindung mit dem bodennah vermehrt auftretenden Ozon bei Sommersmog.
Bedeutende Wissenschaftler bei der Erforschung der Ozonschicht
- Alfred Cornu (1841–1902) entdeckte, dass das Sonnenspektrum unterhalb 300 nm abbricht.
- Carl Dorno (1865–1942), Begründer der Strahlungsklimatologie.
- Paul Götz (1891–1954), Entdecker des auch Götz-Effekt genannten Umkehreffekts zur Bestimmung der vertikalen Verteilung von Ozon in der Atmosphäre.
- Gordon Dobson (1889–1976) erkannte als Erster die jahreszeitlichen Schwankungen der Dicke der Ozonschicht.
- Hans-Karl Paetzold (1916–2002) wies 1971 auf die Gefährdung der Ozonschicht durch hochfliegende zivile Überschallflugzeuge hin.
- Erich Regener (1881–1955) erforschte das Sauerstoff-Ozon-Gleichgewicht in der Atmosphäre.
- Sydney Chapman (1888–1970) von ihm wurden 1930 die chemischen Zusammenhänge des Ozon-Sauerstoff-Zyklus aufgeklärt.
- Paul Crutzen (1933–2021) wurde im Jahr 1995 – zusammen mit Mario J. Molina und Frank Sherwood Rowland – „für seine Arbeiten zur Chemie der Erdatmosphäre, insbesondere über Bildung und Abbau von Ozon“ mit dem Nobelpreis für Chemie ausgezeichnet.
Weblinks
- Forscher: Ozonschicht hat sich stabilisiert. Auf: wissenschaft.de vom 31. August 2005.
- Warum die Ozonschicht geduldig sein muss. Auf: wissenschaft.de vom 15. Februar 2006.
- Luzian Schmassmann: Welt-Ozon-Tag — Ein Feiertag für die Rettung der Ozonschicht. In: srf.ch, 16. September 2021.
Einzelnachweise
- https://elib.dlr.de/65533/1/Dameris_2010_deutsch_web.pdf Martin Dameris: Klimawandel und die Chemie der Atmosphäre – wie wird sich die stratosphärische Ozonschicht entwickeln?
- Die Ozonschicht, Mitteilung des Büro für Umweltforschung und -beratung GmbH
- Antje Dethof: Assimilation of ozone data in the ECMWF model. (Memento vom 20. Mai 2005 im Internet Archive) (PDF; 5,9 MB), ECMWF, 2005.
- Rolf Müller, Karl Dzuba: Messung der Ozonkonzentration, abgerufen am 13. Dez. 2021
- Götz Hoeppe: Himmelslicht, Spiegelbild des Erdklimas, Freie Universität Berlin
- Spencer Weart: The Discovery of Global Warming: Other Greenhouse Gases. Center of History am American Institute of Physics, aip.org