Schwefeltetrachlorid
Schwefeltetrachlorid ist eine chemische Verbindung aus der Gruppe der anorganischen Schwefelverbindungen und Chloride.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
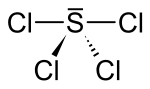 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Schwefeltetrachlorid | ||||||||||||
| Andere Namen |
Schwefel(IV)-chlorid | ||||||||||||
| Summenformel | SCl4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 173,88 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest unter −30 °C[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
Zersetzung ab −20 °C, nur unter −30 °C haltbar[1] | ||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Herstellung
Schwefeltetrachlorid wird durch Chlorierung von Schwefeldichlorid mit Chlor hergestellt.[1]
Eigenschaften
Schwefeltetrachlorid besteht aus den Ionen SCl3+ und Cl− [4][5] und ist nur im festen Zustand und unterhalb −30 °C beständig, darüber zersetzt es sich zu elementarem Chlor und Schwefeldichlorid. Im festen Zustand liegt es als weiße, feinpulvrige Substanz vor. Im Intervall bis −20 °C sintert und schmilzt es unter gleichzeitiger Zersetzung.[1] Mit Wasser hydrolysiert es in einer heftigen Reaktion zu Chlorwasserstoff und Schwefeldioxid.[6]
Weblinks
- Patent US4172115A: Preparation and use of sulfur tetrachloride derivatives of the formula [SA3+.MXn+1- ]. Angemeldet am 31. Juli 1978, veröffentlicht am 23. Oktober 1979, Anmelder: Exxon Research & Engineering Co, Erfinder: Roger Hulme.
Einzelnachweise
- F. Fehér. In: Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3. umgearbeitete Auflage. Band 1. F. Enke Verlag, Stuttgart 1975, ISBN 3-432-02328-6, S. 386.
- Eintrag zu sulphur tetrachloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Schwefeltetrachlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Dezember 2019. (JavaScript erforderlich)
- Ralf Steudel, David Scheschkewitz: Chemistry of the Non-Metals: Syntheses – Structures – Bonding – Applications, 2nd ed., de Gruyter, Berlin/Boston 2020, ISBN 978-3-11-057805-8, S. 555–564.
- Ralf Steudel, Detlef Jensen, Bettina Plinke: Low Temperature Raman Spectra of Dichlorosulfane (SCl2), Tetrachlorosulfurane (SCl4), Dichlorodisulfane (S2Cl2) and Dichlorodiselane (Se2Cl2). In: Zeitschrift für Naturforschung B. Band 42b, 1987, S. 163–168 (englisch, Artikel Download [PDF; 5,1 MB; abgerufen am 20. Oktober 2020]).
- L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Schwefeltetrachlorid, CD-ROM Ausgabe 8/2021, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4 .

