Calcium
Calcium (eingedeutscht Kalzium geschrieben) ist ein chemisches Element mit dem Elementsymbol Ca und der Ordnungszahl 20. Im Periodensystem steht es in der zweiten Hauptgruppe, bzw. der 2. IUPAC-Gruppe und zählt daher zu den Erdalkalimetallen. Die Schreibweise Calcium entspricht der IUPAC-Norm und gilt als fachsprachlich.[17]
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Calcium, Ca, 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Erdalkalimetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 2, 4, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-179-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.344 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code |
A12AA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 3,39 %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 40,078(4)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 180 (194) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 176 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 231[4] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.1131554(3) eV[5] ≈ 589.83 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 11.871719(4) eV[5] ≈ 1145.45 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 50.91316(25) eV[5] ≈ 4912.37 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 67.2732(21) eV[5] ≈ 6490.9 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 84.34(8) eV[5] ≈ 8140 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 1,55 g/cm3 (20 °C)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 1,75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 1,9 · 10−5)[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1115 K (842 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 1760 K[10] (1487 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 26,20 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 153 kJ/mol[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 8,54 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 3810 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 647,3[1] J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 2,87 eV[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 29,4 · 106[12] A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 200 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [13] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | (+1[14]) +2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,84 V (Ca2+ + 2 e− → Ca) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,00 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Elementares Calcium ist ein glänzendes, silberweißes Metall. In der Erdhülle ist es, auf den Massenanteil (ppmw) bezogen, nach Sauerstoff, Silicium, Aluminium und Eisen das fünfthäufigste Element. Aufgrund seiner starken Reaktivität kommt es nur chemisch gebunden als Bestandteil von Mineralien vor. Zu diesen gehören z. B. Calcit, Aragonit und Dolomit in Kalkstein, Marmor und Kreide sowie Gips (Calciumsulfat). Hydroxylapatit (Calciumphosphat) ist ein wesentlicher Bestandteil von Knochen und Zähnen.
Geschichte

Der Name „Calcium“ ist vom lateinischen Wort calx abgeleitet. So bezeichneten die Römer Kalk, Kalkstein, Kreide und aus Kalk hergestellten Mörtel (Baukalk).[18]
Elementares Calcium gewann erstmals Humphry Davy 1808 durch Abdampfen des Quecksilbers aus elektrolytisch gewonnenem Calciumamalgam.
Vorkommen
In der Umwelt kommt Calcium nur in gebundener Form vor, zum Beispiel in Kalkstein, Marmor, Kreide, Gips und den Mineralien Calcit, Aragonit, Dolomit, Anhydrit, Fluorit und Apatit. Eine Ausnahme stellt vermutlich eine Fluorit-Varietät („Stinkspat“) dar, in dessen Kristallgitter wahrscheinlich kolloidales Calcium durch natürliche ionisierende Strahlung entstand.[19] Calciumhaltige Minerale wie Calcit und Gips sind in großen Mengen vorhanden (z. B. bestehen in den Alpen gebirgsbegleitende Züge aus Kalkstein – Nördliche Kalkalpen bzw. Südliche Kalkalpen).
Calciumverbindungen sind wasserlöslich, wobei die Löslichkeit von Calcium im Grundwasser wesentlich vom Kohlensäure-Überschuss bestimmt wird (Kalksättigung). Daher ist die Frage, welche Calciumverbindung im Grundwasser stabil ist, im Wesentlichen abhängig vom pH-Wert des Grundwassers. Als Calciumverbindung überwiegen bei mittleren bis alkalischen pH-Werten Calcit (Ca[CO3]) und Gips (Ca[SO4] · 2H2O). Bei niedrigem pH-Wert tritt Calcium als Ca2+ auf.[20]
Haupteintragsprozess von Calcium in das Grundwasser ist die Verwitterung calciumhaltiger Gesteine wie Kalkstein.
Als essentieller Bestandteil der belebten Materie ist Calcium am Aufbau von Blättern, Knochen, Zähnen und Muscheln beteiligt. Neben K+ und Na+ spielt Ca2+ eine wichtige Rolle bei der Reizübertragung in Nerven- und Muskelzellen. Aber auch in anderen Zellen spielen Calcium-Ionen eine wichtige Rolle bei der Signaltransduktion.
Eigenschaften


Calcium ist ein leichtes, sehr duktiles, silbriges Metall, dessen Eigenschaften den schwereren Erdalkalimetallen Magnesium, Strontium, Barium und Radium sehr ähnlich sind. Es kristallisiert in der kubischen flächenzentrierten Anordnung wie Strontium. Oberhalb von 450 °C verwandelt es sich in eine hexagonale Kristallstruktur wie Magnesium.[8]
Es ist ein guter elektrischer Leiter und Wärmeleiter. Beim Erhitzen geht es zuerst in einen flüssigen, dann in einen gasförmigen Zustand über und verliert seine metallischen Eigenschaften. Wenn es unter Druck gesetzt wird, beginnt es, seine metallischen Eigenschaften und seine elektrische Leitfähigkeit zu verlieren. Wenn der Druck jedoch weiter erhöht wird, werden die metallischen Eigenschaften wiederhergestellt und es zeigt die Eigenschaften eines Supraleiters, der andere Elemente in diesen Parametern um ein Vielfaches übertrifft.
Calcium ist weicher als Blei, lässt sich aber mit einem Messer nicht schneiden. In der Luft läuft es schnell an. Mit Wasser reagiert es heftig unter Bildung von Calciumhydroxid und Wasserstoff.
- Reaktion von Calcium mit Wasser
An der Luft verbrennt es zu Calciumoxid und – geringfügig – Calciumnitrid. Fein verteiltes Calcium ist selbstentzündlich (pyrophor).
Beim Erhitzen reagiert es mit Stickstoff, Wasserstoff, Kohlenstoff, Silicium, Bor, Phosphor, Schwefel und anderen Substanzen. Im Freien reagiert es sofort mit Sauerstoff und Kohlenstoffdioxid, sodass es mit einer grauen Beschichtung überzogen wird.
Es reagiert heftig mit Säuren und geht manchmal in Flammen auf. Aufgrund seiner hohen Reaktivität wird elementares Calcium im Labor in einem dunklen Glas mit fest geschlossenem Deckel und unter einer Schicht Paraffin oder Kerosin gelagert.[21]
Calcium gehört zu den Erdalkalimetallen. Es liegt in chemischen Verbindungen fast nur in der Oxidationszahl +2 vor.[14]
Herstellung
Das Metall wird unter Vakuum durch Reduktion von gebranntem Kalk (Calciumoxid) mit Aluminiumpulver bei 1200 °C hergestellt. Aluminium hat zwar eine geringere Reaktivität und Enthalpie als Calcium, sodass das Gleichgewicht der Reaktion
eigentlich fast völlig auf der linken Seite dieser Gleichung liegt, trotzdem funktioniert dieser Herstellungsprozess, weil das entstehende Calcium bei dieser Temperatur ständig verdampft und so aus dem Gleichgewicht verschwindet. Eine Reinigung erfolgt durch Destillation des Calciums.
Verwendung
Metallisches Calcium dient als Reduktionsmittel in der Metallurgie zur Herstellung von Metallen wie Thorium, Vanadium, Zirconium, Yttrium und anderen Metallen der Seltenen Erden, als Reduktionsmittel in der Stahl- und Aluminiumherstellung, als Legierungszusatz in Aluminium-, Beryllium-, Kupfer-, Blei- und Magnesiumlegierungen und als Ausgangsstoff für die Herstellung von Calciumhydrid.
Die technische Nutzung des Calciums erfolgt überwiegend in gebundener Form.
Kalkstein (überwiegend Calciumcarbonat, CaCO3) und Dolomit (CaMg(CO3)2) sind zwei der wichtigsten Rohstoffe der heutigen Industrie:
- Verschlackungsmittel in der Stahlherstellung. Der Verbrauch liegt bei 0,5 Tonnen Kalkstein pro Tonne Stahl
- Ausgangsstoff zur Herstellung von gebranntem Kalk
- Kreide als Füllstoff für Kunststoffe, zum Beispiel PVC. Ziel ist die Verbesserung der Steifigkeit und Schlagzähigkeit, sowie eine Verringerung der Schrumpfung. Die ebenfalls stark erhöhte thermische Leitfähigkeit erlaubt höhere Arbeitstakte beim Extrudieren.
- Feinkörniges Calciumcarbonat dient als Füllstoff von hochwertigem, holzfreiem Papier
- Fein vermahlener Kalk oder Dolomit wird als Düngekalk in der Land- und Forstwirtschaft oder als Futterkalk in der Tierhaltung eingesetzt.
Aufgrund seiner Funktionen in Organismen wird Calcium auch als Medikament eingesetzt.
Nachweis

Neben der bei Calcium orange-roten Flammenfärbung weist man Calcium-, Strontium- und Barium-Kationen mit Schwefelsäure oder Ammoniumsulfatlösung nach. Bei dieser Nachweisreaktion entstehen weiße, säure-unlösliche Niederschläge. Auch mit Carbonat-, Oxalat- und Dichromat-Anionen können Niederschläge unterschiedlich geringer Löslichkeit erzeugt werden. Deren genauere Untersuchung lässt dann eine Unterscheidung der Erdalkalimetall-Kationen zu (vgl. unter Kationentrenngang und Ammoniumcarbonatgruppe).
In der Routineanalytik (Klinische Chemie, Umweltchemie, Wasserchemie) wird Calcium bis in den Spurenbereich mit der Flammenphotometrie quantitativ bestimmt. Die Bestimmungsgrenze liegt bei 100 µg/l.[22] In höheren Konzentrationen ist auch die Titration mit EDTA gegen Eriochromschwarz T möglich. Zur gravimetrischen Bestimmung von Calcium fällt man dieses mit Oxalat und glüht es bei 600 °C aus, um die Wägeform Calciumcarbonat zu erhalten.
Präanalytik
Die Calcium-Konzentration wird in der Routine-Labordiagnostik in Blut und Urin bestimmt. Calcium ist ein wichtiger Parameter in der Diagnostik des Knochen- und Calciumstoffwechsels. Als Blutprobe kann sowohl Serum als auch heparinisiertes Plasma verwendet werden; entsprechend wird die Calcium-Konzentration im Blut kurz als Serumcalcium oder Plasmacalcium bezeichnet. Zu beachten ist bei Plasma, dass kein Calcium-bindendes Antikoagulans (wie Citrat oder EDTA) verwendet wird.[23][24] Ein zu langes Stauen der Vene vor der Blutentnahme kann zu falsch erhöhten Werten führen.
Analytik
Calcium liegt im Blut zu 50 % als Ca2+-Ionen, zu 35 % an Proteine (Albumin, Globuline) gebunden und zu 15 % komplexgebunden (Bicarbonat, Lactat, Citrat, Phosphat) vor. Der Serumwert des Calcium bewegt sich in engen Grenzen bei einem normalen Gesamtcalcium von 2,2 bis 2,6 mmol/L (9 bis 10,5 mg/dL) und einem normalen ionisierten Calcium von 1,1 bis 1,4 mmol/L (4,5 bis 5,6 mg/dL). Die biologischen Effekte von Calcium werden durch die Verfügbarkeit freier Calciumionen bestimmt, ausschlaggebend ist daher das ionisierte Calcium.[25]
Die totale Calcium-Konzentration (Gesamtcalcium) im Blut ist von der Albumin-Konzentration abhängig und muss entsprechend korrigiert werden. Alternativ wird direkt die Konzentration des ionisierten Calciums gemessen.[23] Das Gesamtcalcium im Serum wird mittels Absorptionsspektrometrie oder Flammenatomemissionspektrometrie bestimmt.[26] Dabei werden die physikalischen Eigenschaften von Calcium ausgenutzt.
Ionisiertes Calcium wird mit ionenselektiven Elektroden bestimmt.[26]
Interpretation
Die Calciumkonzentration ist im Körper äußerst eng kontrolliert. Eine erhöhte Calciumkonzentration wird als Hyperkalzämie, eine erniedrigte Calciumkonzentration wird als Hypokalzämie bezeichnet. Spezifische Ursachen und Symptome finden sich dort.
| Messwert | Referenzbereich[24] | ||
|---|---|---|---|
| Gesamtcalcium | 8,4–10,5 mg/dl | 2,2–2,6 mmol/l | |
| Ionisiertes Calcium | 4,6–5,4 mg/dl | 1,15–1,35 mmol/l | |
Die genauen Werte sind abhängig vom Messverfahren, weshalb der vom Labor angegebene Referenzwert ausschlaggebend ist. Bei Kindern liegen die Werte etwas höher als bei Erwachsenen.
Funktionen im Organismus
Calcium ist ein Mengenelement (Definition: Element mit mehr als 50 mg pro kg Körpergewicht) und gehört damit nicht zu den Spurenelementen. Mit einem Körperbestand von 1 bis 1,1 kg ist Calcium der mengenmäßig am stärksten vertretene Mineralstoff im menschlichen Organismus. 99 % des im Körper vorkommenden Calciums befinden sich gebunden in Knochen (über 90 %) und Zähnen – die calciumreiche Verbindung Hydroxylapatit (Ca5(PO4)3(OH)) verleiht ihnen Stabilität und Festigkeit. Gleichzeitig dienen die Knochen als Speicher für Calcium – bei Calciummangel kann ein Teil davon aus den Knochen gelöst und für andere Aufgaben zur Verfügung gestellt werden. Die Knochenentkalkung, Osteoporose, kommt vor allem bei älteren Menschen vor. Zur Prävention der Osteoporose trägt eine vermehrte Calcium-Aufnahme von etwa 1 g/Tag bei (Basistherapie DVO).
Innerhalb der Zellen ist Calcium entscheidend an der Erregung von Muskeln und Nerven, dem Glykogen-Stoffwechsel, der Zellteilung sowie an der Aktivierung einiger Enzyme und Hormone beteiligt. Wie erstmals Setsuro Ebashi nachwies, führt erst der Einstrom von Calcium-Ionen in die Muskelzellen zu einer Kontraktion der Muskulatur. Außerhalb der Zellen ist Calcium an der Blutgerinnung und der Aufrechterhaltung der Zellmembranen beteiligt. Im Blutserum muss ständig eine Konzentration von 2,1 bis 2,6 mmol/l Calcium gegeben sein, wobei etwa 1 bis 1,5 mmol/l in ionisierter Form vorliegen. Sie wird durch die Hormone Calcitriol, Calcitonin und Parathormon reguliert. Nur 0,1 % des im Körper vorhandenen Calciums findet sich im Extrazellularraum, davon sind 30 bis 55 % an Proteine gebunden, 5 bis 15 % liegen in Form von Komplexen vor (z. B. Calciumhydrogencarbonat, Calciumcitrat, Calciumsulfat, Calciumphosphat oder Calciumlactat). Nur ca. 50 % des extrazellulären Calciums liegt in frei ionisierter und damit in biologisch aktiver Form vor.[27] Symptome der Hypokalzämie treten erst bei einem Mangel dieses ionisierten Calciumanteils auf.[28]
DGE, ÖGE, SGE Referenzwerte
Die D-A-CH Referenzwerte der Deutschen Gesellschaft für Ernährung, der Österreichischen Gesellschaft für Ernährung und der Schweizerischen Gesellschaft für Ernährung (2012); die tolerierbaren Höchstaufnahmemengen wurden von der Europäischen Behörde für Lebensmittelsicherheit (European Food Safety Authority, EFSA) 2006 herausgegeben:[29][30]
| Alter | Empfohlene Zufuhr (mg/Tag) | Nährstoffdichte männlich (mg/MJ)1 | Nährstoffdichte weiblich (mg/MJ)1 | tolerierbare Höchstaufnahmemenge (UL) (mg/Tag) |
|---|---|---|---|---|
| Säugling 0–4 Monate2 | 220 mg | 110 mg | 116 mg | n/v |
| Säugling 4–12 Monate | 330 mg | 133 mg | 138 mg | n/v |
| 1–4 Jahre | 600 mg | 128 mg | 136 mg | n/v |
| 4–7 Jahre | 750 mg | 109 mg | 121 mg | n/v |
| 7–10 Jahre | 900 mg | 114 mg | 127 mg | n/v |
| 10–13 Jahre | 1100 mg | 117 mg | 129 mg | n/v |
| 13–15 Jahre | 1200 mg | 107 mg | 128 mg | n/v |
| 15–19 Jahre | 1200 mg | 113 mg | 141 mg | n/v |
| 19–25 Jahre | 1000 mg | 94 mg | 123 mg | 2500 mg |
| 25–51 Jahre | 1000 mg | 98 mg | 128 mg | 2500 mg |
| 51–65 Jahre | 1000 mg | 109 mg | 135 mg | 2500 mg |
| über 65 Jahre | 1000 mg | 120 mg | 145 mg | 2500 mg |
| Schwangere unter 19 Jahre |
1200 mg | — | ~ 109 mg | 2500 mg |
| Schwangere über 19 Jahre |
1000 mg | — | 109 mg | 2500 mg |
| Stillende unter 19 Jahre |
1200 mg | — | ~ 93 mg | 2500 mg |
| Stillende über 19 Jahre |
1000 mg | — | 93 mg | 2500 mg |
Food and Nutrition Board (US) Referenzwerte
Die Empfehlungen des US-amerikanischen Food and Nutrition Board (FNB) at the Institute of Medicine of the National Academies (November 2010):[31]
| Alter | Geschätzter Bedarf (mg/Tag) | Empfohlene Zufuhr (mg/Tag) | tolerierbare Höchstaufnahmemenge (UL) (mg/Tag) |
|---|---|---|---|
| Säugling 0–6 Monate | n/v | 200 mg | 1000 mg |
| Säugling 6–12 Monate | n/v | 260 mg | 1500 mg |
| 1–3 Jahre | 500 mg | 700 mg | 2500 mg |
| 4–8 Jahre | 800 mg | 1000 mg | 2500 mg |
| 9–13 Jahre | 1110 mg | 1300 mg | 3000 mg |
| 14–18 Jahre | 1110 mg | 1300 mg | 3000 mg |
| 19–30 Jahre | 800 mg | 1000 mg | 2500 mg |
| 30–50 Jahre | 800 mg | 1000 mg | 2500 mg |
| 50–70 Jahre Männer | 800 mg | 1000 mg | 2000 mg |
| 50–70 Jahre Frauen | 1000 mg | 1200 mg | 2000 mg |
| älter als 70 Jahre | 1000 mg | 1200 mg | 2000 mg |
| 14–18 Jahre schwanger/stillend |
1100 mg | 1300 mg | 3000 mg |
| 19–50 Jahre schwanger/stillend |
800 mg | 1000 mg | 2500 mg |
Großbritannien
In Großbritannien liegt die Empfehlung für die tägliche Kalziumaufnahme von Erwachsenen bei 700 mg.[32]
Aufnahme
Nicht alles Calcium, was durch die Nahrung aufgenommen wird, wird im Magen resorbiert. Der Mensch resorbiert zirka 30 % des Calciums aus der Nahrung, dieser Prozentsatz variiert aber je nach Nahrungszusammensetzung. Auch andere Faktoren nehmen Einfluss auf die Calciumresorption. Die Effizienz der Resorption nimmt bei steigender Calciumaufnahme ab. Bei Säuglingen und Kindern im Wachstum liegt die Resorptionsrate bei bis zu 60 %, da diese für den Knochenaufbau viel Calcium benötigen. Die Resorptionsrate fällt auf bis zu 15 bis 20 % bei Erwachsenen, wobei der Bedarf bei Frauen in der Schwangerschaft wieder ansteigt.[33][34][35][36]
Risikogruppen für eine unzureichende Calciumzufuhr sind junge Frauen, Schwangere, Stillende und Senioren.[36]
Voraussetzung dafür, dass Calcium in größeren Mengen vom Körper aufgenommen werden kann, ist eine ausreichende Versorgung mit Vitamin D3. Durch die gleichzeitige Zufuhr von Oxalsäure und Phytinsäure sowie deren Salze (Oxalate, Phytate) wird die Calciumresorption verringert. Ausgeschieden wird Calcium über den Urin, wobei unter anderem eine hohe Zufuhr von Proteinen, Speisesalz, Kaffee oder Alkohol die Calciumausscheidung erhöht.[36][37][38][39]
Das spezifische Aminosäuren-Profil – besonders von schwefelhaltigen Aminosäuren – bestimmt den calciuretischen (die Calciumausscheidung über die Niere fördernden) Effekt der Nahrungsproteine. Sulfate, die im Stoffwechsel aus solchen Aminosäuren gebildet werden, erhöhen die Acidität des Urins, was zur Folge hat, dass größere Calciummengen in den Urin abgeschieden werden. Schwefelhaltige Aminosäuren finden sich sowohl in Nahrung tierischer Herkunft wie auch in Nahrungspflanzen, zum Beispiel Getreide.[37][38][40]
Calciumquellen
Ungefähre Calciumgehalte in mg pro 100 g Lebensmittel (verzehrbarer Anteil):
- Samen
- Mohn: 2500 mg
- Hanfsamen: 144 bis 954 mg[41]
- Sesam: 800 mg
- Mandeln, Haselnüsse und Amarant: 200 bis 250 mg
- Paranüsse: 170 mg
- Gekochte Sojabohnen: 70 mg
- Hafermehl und Sonnenblumenkerne: 50 mg
- Milchprodukte
- Angereicherte Pflanzenmilch: 120 mg
- Gemüse
- Brennnesseln: 360 mg
- Grünkohl, Petersilie: 200 mg bis 250 mg
- Brunnenkresse, Löwenzahn und Rucola: 150 mg bis 200 mg
- Chinakohl, Fenchel, Broccoli, Meerrettich: 100 mg bis 150 mg
- Bleichsellerie: 80 mg
- Rote Rüben: 20 mg
- Früchte
- Vollkornbrot: 50 mg
- Mineralwasser: 2 mg bis > 50 mg[42]
Gesundheitliche Risiken
Im Gegensatz zum Nierengesunden kann ein Dialyse-Patient überflüssiges Calcium nicht über den Urin ausscheiden, und auch der Knochen nimmt in der Regel das angebotene Calcium nicht auf. So besteht die Gefahr, dass sich Calcium in Gefäßen und Weichteilen absetzt. Calciumcarbonat, angewendet als Phosphatbinder, kann zur kardiovaskulären Verkalkung beitragen. Eine über zwei Jahre durchgeführte Studie aus dem Jahr 2004 zeigte eine stetige Korrelation zwischen der Einnahme von Calciumcarbonat und voranschreitender Arterienverkalkung bei Hämodialyse-Patienten.[43]
Im Jahre 2010 publizierten Bolland u. a. im British Medical Journal eine Metaanalyse, die behauptet, dass Calciumpräparate ohne Cholecalciferol (Vitamin D3) das Herzinfarktrisiko um bis zu 30 % steigern. Dieser Effekt soll dosisabhängig ab einer täglichen Supplementierung von 500 mg Calcium ohne Vitamin D3 auftreten. Auch Schlaganfälle und Todesfälle traten in der Calciumsupplementgruppe vermehrt auf.[44][45] Diese Arbeit wurde bezüglich ihrer Methodik kritisiert.[46][47] Die Arzneimittelkommission der deutschen Ärzteschaft erkannte in den von Bolland u. a. vorgelegten Daten keinen ausreichenden Beleg für ein erhöhtes Herzinfarktrisiko durch die Anwendung von Calciumsupplementen. In einer Stellungnahme verwies die Kommission zudem darauf, dass die in der Metaanalyse untersuchte alleinige Gabe von Calcium zur Korrektur einer osteoporotischen Stoffwechselstörung ohne zusätzliche Gabe von Vitamin D3 in den gültigen deutschen Leitlinien nicht empfohlen wird. Andererseits sei auch der Nutzen der kombinierten Substitution von Calcium und Vitamin D3 zur Prävention von Frakturen begrenzt und abhängig von Faktoren wie der Calciumzufuhr über die Nahrung, der Vitamin-D-Serumkonzentration, dem Lebensalter, einer Unterbringung in einem Pflegeheim und dem Ausgangsrisiko für Frakturen. Es gebe keine aussagekräftigen Daten, die belegen, dass eine Calciumsupplementierung bei Menschen mit normaler Calcium- und Vitamin-D3-Versorgung von Nutzen ist. Andererseits ließen sich negative Auswirkungen wie ein erhöhtes Risiko für Nierensteine nachweisen. Calciumsupplemente könnten deshalb nicht generell empfohlen werden. Es müssten vielmehr Risikogruppen identifiziert werden, die voraussichtlich von einer zusätzlichen Calciumgabe profitieren. Die Gesamtcalciumaufnahme (Nahrung plus Supplement) sollte nach Meinung der Kommission 1000 bis 1500 mg betragen.[48]
Auch Studien aus dem Jahr 2013 weisen auf eine erhöhte Mortalität durch eine Über-Substitution von Calcium hin. Eine schwedische Studie zeigt, dass Frauen, die unnötigerweise mit Calcium substituiert wurden, obwohl genügend Calcium über die Nahrung aufgenommen wurde, eine erhöhte Mortalität aufwiesen.[49] Für Männer wurde in einer anderen Studie ein erhöhtes Herz-Kreislauf-Risiko durch Calciumsubstitution festgestellt.[50]
Zwei prospektive Kohortenstudien zeigten, dass der Konsum von Calciumdosen > 2000 mg pro Tag mit einem erhöhten Risiko für Prostatakrebs einhergeht. Zwei andere prospektive Kohortenstudien brachten keinen Zusammenhang für Calciumdosen von 1330 und 1840 mg pro Tag. Als Hintergrund für die Risikoerhöhung wird eine mangelhafte Produktion von Vitamin D3 verdächtigt. Eine hohe Calciumzufuhr vermindert die körpereigene Cholecalciferol-Produktion, und präklinische Studien zeigten mehrere potenziell nützliche Effekte des Vitamins bezüglich Prostatakrebs. In welchem Ausmaß der Calciumkonsum im Verhältnis zum Fettkonsum (aus Milch und Milchprodukten) zum Risiko beiträgt, ist unklar.[51]
Verbindungen
In Verbindungen kommt Calcium fast ausschließlich als zweiwertiges Kation mit dem Oxidationszustand 2 vor.
Oxide und Hydroxide
Calciumoxid ist eine weiße kristalline Substanz, die mit Wasser unter starker Wärmeentwicklung reagiert. Es bildet Kristalle in der Natriumchlorid-Struktur. Gebrannter und anschließend mit Wasser gelöschter Kalk wird in der Bauindustrie als Beimischung zu Mörtel und Putzen verwendet, sowie zur industriellen Fertigung von Kalksandsteinen.[52] Außerdem ist er ein untergeordneter Bestandteil von Zementklinker. In der Chemie nutzt man die Substanz außerdem als Trocknungsmittel und zur Absorption von Kohlenstoffdioxid.
Calciumperoxid ist ein starkes Oxidationsmittel und von mittlerer brandfördernder Wirkung, da es bei Erhitzung Sauerstoff abspaltet. Es liegt häufig als Octahydrat vor, das bei etwa 130 °C das Kristallwasser verliert. Das Octahydrat hat eine tetragonale Kristallstruktur in der Raumgruppe P4/mcc (Raumgruppen-Nr. 124).[53] Es wird als Trocknungsbeschleuniger für Polysulfidelastomere, Antiseptikum in Zahnpasten und Kaugummi, als Stabilisator in der Gummiindustrie, in der Zahnheilkunde, als Teigverbesserer in der Backindustrie und als Saatgutdesinfektionsmittel verwendet.[54]
Calciumhydroxid ist ein farbloses Pulver, welches sich nur wenig in Wasser löst, wobei die Lösung stark basisch reagiert. Es besteht aus trigonalen Kristallen mit dem Polytyp 2H der Kristallstruktur vom Cadmiumiodid-Typ in der Raumgruppe P3m1 (Raumgruppen-Nr. 164). Es wird zur Herstellung von Mörtel im Bauwesen, als Desinfektionsmittel, Säureregulator in Lebensmitteln und Pflanzenschutzmittel im Obstbau verwendet.
Halogenide

Calciumchlorid bildet in Reinform farblose Kristalle und ist in wasserfreiem Zustand stark hygroskopisch. Es nimmt leicht Wasser aus der Umgebung auf und bildet dabei einen Hydrat-Komplex. Es sind mehrere kristalline Hydrate bekannt.[55] Wasserfreies Calciumchlorid ist aufgrund seiner Hygroskopie ein wichtiges Trocknungsmittel im Labor, beispielsweise im Exsikkator, und in der technischen Chemie für Gase und Flüssigkeiten. Außerdem findet es als Auftausalz, im Beton als Abbindebeschleuniger, als Streusalz, als Frostschutzmittel, als Komplexbildner, Geschmacksverstärker und Stabilisator in der Lebensmittelindustrie und als Elektrolyt in Sportgetränken Verwendung.
Calciumfluorid bildet farblose, in Wasser, Alkohol und verdünnten Säuren schwerlösliche Kristalle. Es kristallisiert im kubischen Kristallsystem in der höchstsymmetrischen Kristallklasse 4/m 3 2/m (kubisch-hexakisoktaedrisch) beziehungsweise der Raumgruppe Fm3m (Raumgruppen-Nr. 225). Natürlich vorkommendes Calciumfluorid heißt Fluorit oder Flussspat und ist meist durch Verunreinigungen gelb, grün, blau oder violett gefärbt.
Calciumbromid ist ein farbloser, an der Luft sich langsam gelb färbender Feststoff. Es kristallisiert wie Calciumchlorid und Strontiumchlorid in der Calciumchloridstruktur, die der Rutilstruktur ähnlich ist.
Calciumiodid ist ein hochschmelzender kristalliner Feststoff, der in einer typischen Schichtstruktur, der hexagonalen Cadmiumiodid-Struktur in der Raumgruppe P63mc (Raumgruppen-Nr. 186) kristallisiert.[56] Ist Calciumiodid-Hydrat im Kontakt mit Luft oder Licht, kann es Kohlenstoffdioxid aufnehmen bzw. Iod abgeben und verfärbt sich infolgedessen gelblich.[57]
Weitere anorganische Verbindungen

Calciumcarbonat ist ein farbloser, kristalliner Feststoff. Es ist eine der am weitesten verbreiteten Verbindungen auf der Erde, vor allem in Form von Kalkstein, Kreide, Marmor und Sedimentgesteinen. Es tritt vor allem in der Form des Minerals Calcit auf, das zu den häufigsten Mineralen der Erdkruste gehört. Kalkstein wird in großen Mengen als Rohstoff für die Baustoff-Industrie, als Zuschlagstoff in der Stahlindustrie, als mineralischer Dünger, als Futterkalk und als mineralischer Füllstoff in diversen industriellen Anwendungen verwendet, zum Beispiel in Papieren, Farben, Lacken, Putzen, Kunststoffen und Rückseitenbeschichtungen von Teppichen.
Calciumsulfat ist ein weißer Feststoff, der schwer löslich in Wasser ist und sich ab einer Temperatur über 1200 °C zersetzt, wobei Calciumoxid und Schwefeltrioxid entstehen. Es kommt natürlich in Form der Minerale Anhydrit, Gips (Ca[SO4] · 2H2O) und Bassanit (Ca[SO4] · ½H2O) in Evaporiten vor. Es wird als Baustoff verwendet.
Calciumnitrat ist ein weißer, hygroskopischer, oxidierender Feststoff, der sehr leicht löslich in Wasser ist. Es bildet eine Reihe von Hydraten. Es wird als Düngemittel und als Bestandteil von Kühlsolen und von Koagulierungsbädern von Latex eingesetzt.[58]
Calciumcarbid (Calciumacetylid) ist in reinem Zustand ist eine farblose, kristalline Masse. Es existieren zwei Modifikationen, die tetragonale und eine kubisch flächenzentrierte Modifikation vom Pyrit-Typ, welche sich durch Erhitzen über 440 °C bildet.[59] Es wird als Ausgangsstoff für chemische Synthesen und zur Herstellung von Kalkstickstoff-Dünger, für die Herstellung von Acetylen, bei der Entschwefelung von Eisen, als Brennstoff bei der Stahlherstellung und in Karbidlampen verwendet.[60]
Organische Verbindungen
Calciumgluconat wird als Säureregulator in der chemischen Industrie aber auch in der Lebensmittelindustrie verwendet. Es wird Lebensmitteln als Komplexbildner, Säureregulator oder Stabilisator zugesetzt. Außerdem hat es verschiedene medizinische Anwendungen.
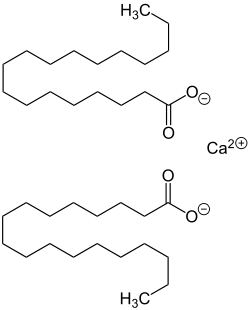
Calciumstearat ist das Calciumsalz der Stearinsäure und gehört zu den Kalkseifen. Es besteht aus einem Calcium-Ion und zwei langkettigen Stearat-Ionen. Es wird zur Herstellung sogenannter non-tox Stabilisatoren von Kunststoffen, bevorzugt in Verbindung mit Zinkstearat, aber auch Bariumstearat oder Magnesiumstearat verwendet. Weiterhin dient es als Gleitmittel in pharmazeutischen Produkten und als Schmierstoff (Staufferfett) in der Papier- und Metall-verarbeitenden Industrie, als Hydrophobierungsmittel für Baustoffe sowie in der Sandaufbereitung.
Weblinks
- Heilmittel Calcium bei Phytodoc
- Calcium Calculator – Ein Tool zur Berechnung der eingenommenen Menge Calcium (englisch)
- Laborlexikon: Calcium
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Calcium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: J. Phys. Chem. A. 113, 2009, S. 5806–5812, doi:10.1021/jp8111556.
- Eintrag zu calcium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu calcium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Calcium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 136.
- Robert C. Weast u. a. (Hrsg.): CRC Handbook of Chemistry and Physics. Chemical Rubber Publishing Company, Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, Berlin/New York 2005, ISBN 3-11-017485-5, S. 361.
- T. C. Chi: Electrical Resistivity of Alkaline Earth Elements. S. 470 (nist.gov [PDF]).
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Calcium) entnommen.
- Sven Krieck, Helmar Görls, Lian Yu, Markus Reiher, Matthias Westerhausen: Stable "Inverse" Sandwich Complex with Unprecedented Organocalcium(I): Crystal Structures of [(thf)2Mg(Br)-C6H2-2,4,6-Ph3] and [(thf)3Ca{μ-C6H3-1,3,5-Ph3}Ca(thf)3]. In: Journal of the American Chemical Society. Band 131, Nr. 8, 4. Februar 2009, S. 2977–2985, doi:10.1021/ja808524y. An der Friedrich-Schiller-Universität Jena wurde 2009 ein stabiler, wenn auch extrem wasser- und luftempfindlicher Calcium(I)-Komplex (inverse sandwich) synthetisiert, bei dem das Calcium in der bei stabilen Verbindungen bislang unbekannten Oxidationsstufe +1 vorliegt.
- Eintrag zu Calcium im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Calcium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016. (JavaScript erforderlich)
- Eintrag auf duden.de, abgerufen am 14. November 2017
- Vgl. auch Friedrich Kluge, Alfred Götze: Etymologisches Wörterbuch der deutschen Sprache. 20. Aufl., hrsg. von Walther Mitzka, De Gruyter, Berlin/ New York 1967; Neudruck („21. unveränderte Auflage“) ebenda 1975, ISBN 3-11-005709-3, S. 342 (Kalk).
- berthold-weber.com: Fluorit im Wölsendorfer Flußspat-Revier (Memento vom 16. Juli 2006 im Internet Archive), abgerufen am 10. März 2011.
- Burkhard Heuel-Fabianek: Partition Coefficients (Kd) for the Modelling of Transport Processes of Radionuclides in Groundwater (PDF; 9,4 MB) JÜL-Berichte, Forschungszentrum Jülich, Nr. 4375, 2014.
- MEL Science: Chemical and physical characteristics of calcium, its interaction with water
- K. Cammann (Hrsg.): Instrumentelle Analytische Chemie. Spektrum Akademischer Verlag, Heidelberg/Berlin 2001, S. 4–60.
- W. G. Robertson, R. W. Marshall: Calcium measurements in serum and plasma--total and ionized. In: CRC Critical Reviews in Clinical Laboratory Sciences. Band 11, Nr. 3, November 1979, S. 271–304, PMID 116800.
- H. Renz (Hrsg.): Integrative Klinische Chemie und Laboratoriumsmedizin. Pathophysiologie, Pathobiochemie, Hämatologie. Walter de Gruyter, 2003, ISBN 3-11-017367-0.
- Olav Hagemann: Calcium. In: laborlexikon.de. Abgerufen am 21. Mai 2011.
- Walter G. Guder, Jürgen Nolte (Hrsg.): Das Laborbuch für Klinik und Praxis. Elsevier, Urban & Fischer, München/Jena 2005, ISBN 3-437-23340-8.
- Laura M. Calvi, David A. Bushinsky: When Is It Appropriate to Order an Ionized Calcium? In: Journal of the American Society of Nephrology. Band 19, Nr. 7, 1. Juni 2008, S. 1257–1260, doi:10.1681/ASN.2007121327.
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/Heidelberg/New York u. a. 1999, ISBN 3-540-65024-5, S. 56 (Kalzium).
- Deutsche Gesellschaft für Ernährung: Calcium Referenzwerte für die Nährstoffzufuhr.
- Scientific Committee on Food / Scientific Panel on Dietetic Products, Nutrition and Allergies / European Food Safety Authority (Hrsg.): Tolerable upper Intake Levels for Vitamins and Minerals. 2006, ISBN 92-9199-014-0, S. 243–252 (efsa.europa.eu [PDF; 5,7 MB]).
- Food and Nutrition Board (FNB) at the Institute of Medicine of the National Academies: Dietary Reference Intakes for Calcium and Vitamin D (Memento vom 24. Dezember 2010 im Internet Archive).
- Vitamins and minerals - Calcium. 23. Oktober 2017, abgerufen am 1. Dezember 2021 (englisch).
- Committee to Review Dietary Reference Intakes for Vitamin D and Calcium, Food and Nutrition Board, Institute of Medicine. Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: National Academy Press, 2010.
- Optimal calcium intake. In: NIH consensus statement. Band 12, Nummer 4, 6–8 Jun 1994, S. 1–31, PMID 7599655 (Review).
- R. P. Heaney, R. R. Recker, M. R. Stegman, A. J. Moy: Calcium absorption in women: relationships to calcium intake, estrogen status, and age. In: Journal of Bone and Mineral Research. Band 4, Nummer 4, August 1989, S. 469–475, doi:10.1002/jbmr.5650040404. PMID 2816496.
- Office of Dietary Supplements, National Institutes of Health: Dietary Supplement Fact Sheet Calcium. In: ods.od.nih.gov. August 2012, upgedatet am 2. März 2017, abgerufen am 6. Mai 2018.
- C. M. Weaver, W. R. Proulx, R. Heaney: Choices for achieving adequate dietary calcium with a vegetarian diet. In: Am J Clin Nutr. 70(3 Suppl), Sep 1999, S. 543S–548S. PMID 10479229 Volltext (PDF; 89 kB).
- R. P. Heaney: Bone mass, nutrition, and other lifestyle factors. In: Nutrition reviews. Band 54, Nummer 4 Pt 2, April 1996, S. S3–S10. PMID 8700450 (Review).
- E. Barrett-Connor, J. C. Chang, S. L. Edelstein: Coffee-associated osteoporosis offset by daily milk consumption. The Rancho Bernardo Study. In: JAMA : the journal of the American Medical Association. Band 271, Nummer 4, Januar 1994, S. 280–283. PMID 8295286.
- T. R. Fenton, M. Eliasziw, A. W. Lyon, S. C. Tough, D. A. Hanley: Meta-analysis of the quantity of calcium excretion associated with the net acid excretion of the modern diet under the acid-ash diet hypothesis. In: The American journal of clinical nutrition. Band 88, Nummer 4, Oktober 2008, S. 1159–1166. PMID 18842807.
- M. Mihoc, G. Pop, E. Alexa, I. Radulov: Nutritive quality of romanian hemp varieties (Cannabis sativa L.) with special focus on oil and metal contents of seeds. In: Chemistry Central journal. Band 6, Nummer 1, 2012, S. 122, doi:10.1186/1752-153X-6-122. PMID 23088580. PMC 3543203 (freier Volltext).
- Claus Leitzmann, Markus Keller: Vegetarische Ernährung. Verlag Eugen Ullmer, Stuttgart 2010, ISBN 978-3-8001-2893-8.
- J. Braun, H. G. Asmus, H. Holzer, R. Brunkhorst, R. Krause, W. Schulz, H. H. Neumayer, P. Raggi, J. Bommer: Long-term comparison of a calcium-free phosphate binder and calcium carbonate--phosphorus metabolism and cardiovascular calcification. In: Clin Nephrol. 62(2), Aug 2004, S. 104–115. PMID 15356967.
- M. J. Bolland, A. Avenell, J. A. Baron, A. Grey, G. S. MacLennan, G. D. Gamble, I. R. Reid: Effect of calcium supplements on risk of myocardial infarction and cardiovascular events: meta-analysis. In: BMJ. Band 341, 29. Juli 2010, S. c3691, doi:10.1136/bmj.c3691, PMID 20671013.
- Anna Julia Voormann: DGIM: Zwischen Knochenschwund und Herzinfarkt. Kalzium schützt das Skelett, gefährdet aber die Blutgefäße. Deutsche Gesellschaft für Innere Medizin, Pressemitteilung vom 8. September 2010 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 15. September 2015.
- z. B. B. E. Nordin, R. M. Daly, J. Horowitz, A. V. Metcalfe: Calcium and heart attacks. Making too much of a weak case. In: BMJ. 341, 15. September 2010, S. c4997, doi:10.1136/bmj.c4997, PMID 20843919 (Volltext).
- C. Korownyk, N. Ivers, G. M. Allan: Does calcium supplementation increase risk of myocardial infarction? In: Can Fam Physician. 57(7), Jul 2011, S. 798, PMID 21753105 (PDF-Volltext).
- Arzneimittelkommission der deutschen Ärzteschaft (Fachausschuss der Bundesärztekammer): Kalziumsupplementierung und kardiovaskuläres Risiko (PDF; 129 kB), Berlin, 24. September 2010.
- K. Michaëlsson, H. Melhus, E. W. Lemming, A. Wolk, L. Byberg: Long term calcium intake and rates of all cause and cardiovascular mortality: community based prospective longitudinal cohort study. In: BMJ. 346, 2013, S. f228 doi:10.1136/bmj.f228.
- Q. Xiao, R. A. Murphy, D. K. Houston, T. B. Harris, W. Chow, Y. Park: Dietary and Supplemental Calcium Intake and Cardiovascular Disease Mortality: The National Institutes of Health–AARP Diet and Health Study. In: JAMA Intern Med. 2013, S. 1–8. doi:10.1001/jamainternmed.2013.3283
- G. A. Sonn, W. Aronson, M. S. Litwin: Impact of diet on prostate cancer: a review. In: Prostate Cancer and Prostatic Diseases. 8, 2005, S. 304–310. doi:10.1038/sj.pcan.4500825 PMID 16130015.
- Universität Regensburg: Chemie des (Haus-)Baus (Memento vom 27. April 2015 im Internet Archive)
- G. V. Shilov, A. I. Karelin, D. G. Lemesheva, L. S. Leonova, L. O. Atovmyan: Crystal Structure and Properties of CaO2 · 8H2O, Russian Journal of Inorganic Chemistry, Vol. 50, No. 6, June 2005, S. 842–847.
- Malyk Yuriy: In-Vitro Untersuchungen zum Einsatz von Calciumperoxid haltigen Sealermaterialien in der endodontischen Therapie. urn:nbn:de:bvb:19-43959.
- Eintrag zu Calciumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. Februar 2017. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1241.
- Eintrag zu Calciumiodid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Eintrag zu Calciumnitrat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 931–932.
- Calcium Carbide, Bernhard Langhammer, Ullmann's Encyclopedia of Industrial Chemistry, Wiley Interscience (Subscription required).