Lithium
Lithium (abgeleitet von altgriechisch λίθος líthos, deutsch ‚Stein‘; Aussprache [ˈliːti̯ʊm][16][17][18] oder auch [ˈliːʦi̯ʊm][19]) ist ein chemisches Element mit dem Symbol Li und der Ordnungszahl 3. Es ist ein Element der 1. IUPAC-Gruppe, der Gruppe der Alkalimetalle, und gehört zur zweiten Periode des Periodensystems der Elemente. Lithium ist ein Leichtmetall und besitzt die geringste Dichte der unter Standardbedingungen festen Elemente.
| Eigenschaften | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||
| Name, Symbol, Ordnungszahl | Lithium, Li, 3 | ||||||||||||||||||
| Elementkategorie | Alkalimetalle | ||||||||||||||||||
| Gruppe, Periode, Block | 1, 2, s | ||||||||||||||||||
| Aussehen | silbrig weiß/grau | ||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||
| EG-Nummer | 231-102-5 | ||||||||||||||||||
| ECHA-InfoCard | 100.028.274 | ||||||||||||||||||
| Massenanteil an der Erdhülle | 60 ppm[1] 27. Häufigkeit | ||||||||||||||||||
| Atomar [2] | |||||||||||||||||||
| Atommasse | 6,94 (6,938–6,997)[3][4] u | ||||||||||||||||||
| Atomradius (berechnet) | 145 (167) pm | ||||||||||||||||||
| Kovalenter Radius | 128 pm | ||||||||||||||||||
| Van-der-Waals-Radius | 182 pm | ||||||||||||||||||
| Elektronenkonfiguration | [He] 2s1 | ||||||||||||||||||
| 1. Ionisierungsenergie | 5.39171495(4) eV[5] ≈ 520.22 kJ/mol[6] | ||||||||||||||||||
| 2. Ionisierungsenergie | 75.6400964(13) eV[5] ≈ 7298.16 kJ/mol[6] | ||||||||||||||||||
| 3. Ionisierungsenergie | 122.4543581(8) eV[5] ≈ 11815.05 kJ/mol[6] | ||||||||||||||||||
| Physikalisch [7] | |||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Modifikationen | 1 | ||||||||||||||||||
| Kristallstruktur | kubisch raumzentriert | ||||||||||||||||||
| Dichte | 0,534 g/cm3 (20 °C)[8] | ||||||||||||||||||
| Mohshärte | 0,6 | ||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 1,4 · 10−5)[9] | ||||||||||||||||||
| Schmelzpunkt | 453,69 K (180,54 °C) | ||||||||||||||||||
| Siedepunkt | 1603 K[10] (1330 °C) | ||||||||||||||||||
| Molares Volumen | 13,02 · 10−6 m3·mol−1 | ||||||||||||||||||
| Verdampfungsenthalpie | 136 kJ/mol[10] | ||||||||||||||||||
| Schmelzenthalpie | 3 kJ·mol−1 | ||||||||||||||||||
| Schallgeschwindigkeit | 6000 m·s−1 bei 293,15 K | ||||||||||||||||||
| Spezifische Wärmekapazität | 3482[1] J·kg−1·K−1 | ||||||||||||||||||
| Austrittsarbeit | 2,9 eV[11] | ||||||||||||||||||
| Elektrische Leitfähigkeit | 10,6 · 106 A·V−1·m−1 | ||||||||||||||||||
| Wärmeleitfähigkeit | 85 W·m−1·K−1 | ||||||||||||||||||
| Chemisch [12] | |||||||||||||||||||
| Oxidationszustände | +1 | ||||||||||||||||||
| Normalpotential | −3,04 V | ||||||||||||||||||
| Elektronegativität | 0,98 (Pauling-Skala) | ||||||||||||||||||
| Isotope | |||||||||||||||||||
| |||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Lithium kommt in der Natur aufgrund seiner hohen Reaktivität nicht elementar vor. Bei Raumtemperatur ist es nur in völlig trockener Luft über längere Zeit stabil, reagiert aber langsam zu Lithiumnitrid (Li3N). In feuchter Luft bildet sich an der Oberfläche schnell eine mattgraue Lithiumhydroxid-Schicht. Wie alle Alkalimetalle reagiert elementares Lithium schon in Berührung mit der Hautfeuchtigkeit und führt so zu schweren Verätzungen und Verbrennungen. Viele Lithiumverbindungen, die in wässriger Lösung Lithiumionen bilden, sind im Gegensatz zu den entsprechenden Natrium- und Kaliumverbindungen als gesundheitsschädlich gekennzeichnet.
Als Spurenelement ist Lithium in Form seiner Salze ein häufiger Bestandteil von Mineralwasser. Im menschlichen Organismus sind geringe Mengen Lithium vorhanden; das Element ist jedoch nicht essenziell und hat keine bekannte biologische Funktion. Einige Lithiumsalze haben aber eine medizinische Wirkung und werden in der Lithiumtherapie bei bipolaren Affektstörungen, Manie, Depressionen und Cluster-Kopfschmerzen eingesetzt (siehe Medizin).
Geschichte


Als Entdecker des Lithiums gilt der Schwede Johan August Arfwedson, der im Jahr 1817 die Anwesenheit eines fremden Elements in Petalit (Li[4]Al[4][Si4O10]) und bald darauf auch in Spodumen (LiAl[Si2O6]) und Lepidolith (K(Li,Al)3[(Al,Si)4O10](F,OH)2) feststellte, als er Mineralienfunde von der Insel Utö in Schweden analysierte. Sein akademischer Lehrer Jöns Jakob Berzelius schlug Lithion, eine Ableitung zu griech. λίθος líthos ‚Stein‘, als Namen vor, der entsprechend den Bezeichnungen der andern beiden damals bekannten Alkalimetallen Natrium und Kalium auf das Material hinweist, aus dem es gewonnen wurde. Die latinisierte Form Lithium hat sich durchgesetzt.[20]
1818 bemerkte der deutsche Chemiker Christian Gottlob Gmelin, dass Lithiumsalze eine rote Flammenfärbung ergeben. Beide Wissenschaftler scheiterten in den folgenden Jahren mit Versuchen, dieses Element zu isolieren. Im Jahr 1818 gelang dies erstmals William Thomas Brande und Sir Humphry Davy mittels eines elektrolytischen Verfahrens aus Lithiumoxid (Li2O). Robert Bunsen und Augustus Matthiessen stellten 1855 durch Elektrolyse von Lithiumchlorid (LiCl) größere Mengen reinen Lithiums her. Im Jahr 1917 synthetisierte Wilhelm Schlenk aus organischen Quecksilberverbindungen die ersten lithiumorganischen Verbindungen.[21]
Mit der ersten kommerziellen Produktion begann 1923 die deutsche Metallgesellschaft in der Hans-Heinrich-Hütte in Langelsheim im Harz, indem eine Schmelze aus Lithium- und Kaliumchlorid (KCl) elektrolysiert wurde.
Bis kurz nach dem Zweiten Weltkrieg gab es bis auf die Anwendung als Schmiermittel (Mineralöl, angedickt mit Lithiumstearat) und in der Glasindustrie (Lithiumcarbonat oder Lithiumoxid) kaum Anwendungen für Lithium. Dies änderte sich, als in den Vereinigten Staaten Tritium, das sich aus Lithium gewinnen lässt, für den Bau von Wasserstoffbomben benötigt wurde. Man begann mit einer breit angelegten Förderung, vor allem in Kings Mountain (North Carolina).[22] Durch die auf Grund der kurzen Tritium-Halbwertszeit benötigten großen Lithium-Mengen wurde zwischen 1953 und 1963 ein großer Vorrat von Lithium angehäuft, das erst nach dem Ende des Kalten Krieges ab 1993 auf den Markt gebracht wurde.[22] Neben dem Bergbau wurde nun auch die billigere Gewinnung aus Salzlaugen wichtig. Größere Mengen Lithium werden mittlerweile für Batterien, für die Polymerisation von Elastomeren, in der Bauindustrie und für die organische Synthese von Pharmazeutika und Agrochemikalien eingesetzt. Seit 2007 sind Primärbatterien und Akkumulatoren (Sekundärbatterien) das wichtigste Segment.[23]
Vorkommen und Abbau
Vorkommen auf der Erde

Lithium hat an der Erdkruste einen Anteil von etwa 0,006 %.[24] Es kommt damit etwas seltener als Zink sowie häufiger als Kobalt, Zinn und Blei in der Erdkruste vor. Obwohl Lithium häufiger als beispielsweise Blei ist, ist seine Gewinnung durch die stärkere Verteilung schwierig.[25] Im Trinkwasser und einigen Nahrungsmitteln wie Fleisch, Fisch, Eiern und Milchprodukten ist Lithium enthalten. So enthalten 100 g Fleisch etwa 100 μg Lithium.[26] Verschiedene Pflanzen wie beispielsweise Tabak oder Hahnenfuß nehmen Lithiumverbindungen aus dem Boden auf und reichern sie an. Der durchschnittliche Anteil an der Trockenmasse von Pflanzen liegt zwischen 0,5 ppm und 3 ppm. Meerwasser enthält durchschnittlich 180 µg/L und Flusswasser etwa 3 µg/L.
Abbau und Reserven
Mengenmäßig wurden 2015 außerhalb der USA 35.000 Tonnen Lithium gewonnen und überwiegend als Lithiumcarbonat (Li2CO3) gehandelt. Im Jahr 2016 war Chile der größte Produzent. Australien verdreifachte seine Produktion zwischen 2016 und 2017 und steigerte sie bis 2018 nochmals um fast 50 %. Derzeit (2018) werden fast zwei Drittel des Lithiumvorrats in Australien im Hartgesteinsbergbau und nur etwa ein Drittel aus Solen gewonnen.[27] Die Reserven in den vorhandenen Minen werden auf rund 17 Millionen Tonnen geschätzt (Stand: Januar 2020). Das Weltvorkommen aus kontinentalen Solen, geothermischen Solen, aus dem Hectorit-Mineral, Ölfeld-Solen und aus dem magmatischen Gestein Pegmatit ist auf 80 Millionen Tonnen geschätzt worden.[28]
Die größten Ressourcen sind in Bolivien (21 Mio. Tonnen), Argentinien (17 Mio. Tonnen), Chile (9 Mio. Tonnen), USA (6,8 Mio. Tonnen), Australien (6,3 Mio. Tonnen) und China (4,5 Mio. Tonnen). In Europa haben Deutschland (2,5 Mio. Tonnen) und Tschechien (1,3 Mio. Tonnen) die größten Vorkommen.[28]
| Weltweite Produktion [Tonnen][28][29] | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 (geschätzt) | Minen-Reserven | Weltvorkommen |
|---|---|---|---|---|---|---|---|---|---|
| n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 9.000.000 | 21.000.000 | |
| 11.500 | 10.500 | 14.300 | 14.200 | 17.000 | 19.300 | 18.000 | 9.200.000 | 9.000.000 | |
| 2.300 | 2.000 | 2.300 | 6.800 | 7.100 | 10.800 | 14.000 | 1.500.000 | 4.500.000 | |
| 13.300 | 14.100 | 14.000 | 40.000 | 58.800 | 45.000 | 40.000 | 4.700.000 | 6.300.000 | |
| 3.200 | 3.600 | 5.800 | 5.700 | 6.400 | 6.300 | 6.200 | 1.900.000 | 17.000.000 | |
| 300 | 200 | 400 | 800 | 800 | 900 | 900 | 60.000 | 250.000 | |
| 160 | 200 | 200 | 200 | 300 | 2.400 | 1.900 | 95.000 | 400.000 | |
| n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 750.000 | 6.800.000 | |
| 900 | 900 | 1.000 | 800 | 1.600 | 1.200 | 1.200 | 220.000 | 540.000 | |
| n. v. | n. v. | n. v. | n. v. | 2.400 | 200 | n. v. | 530.000 | 1.700.000 | |
| n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 3.000.000 | |
| n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1.000.000 | |
| n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1.000.000 | |
| n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1.700.000 | |
| n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 50.000 | |
| Welt | 31.700 | 31.500 | 38.000 | 69.000 | 95.000 | 86.000 | 82.000 | 27.955.000 | 80.000.000 |
Primäre Lagerstätten
Lithium kommt in einigen Mineralien in Lithium-Pegmatiten vor. Die wichtigsten Minerale sind dabei Amblygonit (LiAl[PO4]F), Lepidolith (K(Li,Al)3[(Al,Si)4O10](F,OH)2), Petalit (Kastor; LiAl[Si4O10]) und Spodumen (Triphan; LiAl[Si2O6]). Diese Minerale haben einen Lithiumgehalt von bis zu 9 % (bei Amblygonit). Andere, seltenere Lithiumerze sind Kryolithionit (Li3Na3[AlF6]2), das den größten Lithiumgehalt aller Mineralien aufweist, Triphylin (Li(FeII,MnII)[PO4]) und Zinnwaldit (K(Li,Fe,Al)3[(Al,Si)4O10](F,OH)2). Lithiummineralien kommen in vielen Silikat-Gesteinen vor, aber meist nur in geringen Konzentrationen. Es gibt keine großen Lagerstätten. Da die Gewinnung von Lithium aus diesen Mineralien mit großem Aufwand verbunden ist, spielen sie heutzutage bei der Gewinnung von Lithium oder Lithiumverbindungen eine untergeordnete Rolle, dies könnte sich jedoch aufgrund der erwartet hohen Nachfrage ändern. Abbauorte sind vor allem die Greenbushes- und Mt.-Cattlin-Minen in Western Australia, in deren Pegmatit-Gesteinen eine hohe Lithiumkonzentration vorliegt und in denen Lithium als Nebenprodukt der Tantalgewinnung anfällt. Auch in einigen anderen Ländern wie Kanada und Russland, bis 1998 auch in Bassemer City, North Carolina, wird Spodumen zur Lithiumgewinnung abgebaut.[30]
Europa besitzt Li-reiche Pegmatitfelder auf der Kärntner Weinebene im Bezirk Wolfsberg, in der finnischen Region Österbotten, im Erzgebirge sowie zwischen Spanien (Almendra) und Portugal (Distrikt Guarda, Boticas).[31][32]
Während die erste kommerzielle Produktion von Lithiumverbindungen an sich bereits 1923 im Harz begann, könnte die Förderung in den nun neu erschlossenen bedeutenden Lagerstätten in Österreich und Finnland ab 2021 beginnen.[veraltet] Sie werden durch Global Strategic Metals bzw. Keliber betrieben. In Österreich an der Koralpe im Lavanttal haben Probestollen ein viel größeres Vorkommen von lithiumhaltigem Grundgestein ergeben, das auf 22 Millionen Tonnen geschätzt wird. Damit ist es eines der ersten groß angelegten Lithium-Abbauprojekte Europas und könnte 20 Jahre lang betrieben werden.[33][34] Das Vorkommen bei Zinnwald im Erzgebirge wird durch die Deutsche Lithium exploriert.[35][36]
Sekundäre Lagerstätten
Lithiumsalze, insbesondere Lithiumchlorid, kommen verbreitet auch in Salzlaugen, meist Salzseen, vor. Die Konzentration kann bis zu einem Prozent betragen. Neben der Konzentration des Lithiums ist für die Qualität der Salzlauge das Mengenverhältnis von Magnesium zu Lithium wichtig. Derzeit wird Lithium vor allem in Chile (Salar de Atacama, die mit 0,16 % mit den höchsten bekannten Lithiumkonzentration aufweist[25]), Argentinien (Salar de Hombre Muerto), den Vereinigten Staaten von Amerika (Silver Peak, Nevada) und der Volksrepublik China (Chabyêr Caka, Tibet; Taijinaier-See, Qinghai) gewonnen. Im bolivianischen Salzsee Salar de Uyuni mit geschätzt 5,4 Millionen Tonnen Lithium lagern möglicherweise die größten Ressourcen.[28][37] Das Staatsunternehmen Yacimientos de Litio Bolivianos investiert seit 2018 mit deutschen und chinesischen Partnern verstärkt in seine Industrialisierung, einschließlich der benachbarten Salar de Coipasa und Laguna Pastos Grandes. Es gibt weitere lithiumhaltige Salzseen, die (Stand April 2019) noch nicht zum industriellen Abbau genutzt werden, beispielsweise in China, Argentinien und Afghanistan. 2016 wurde bekannt, dass im Paradox-Becken im US-Bundesstaat Utah schon in den 1960er Jahren bei Ölexplorationsbohrungen hochsalinares Tiefengrundwasser (Sole) angetroffen wurde, aus dem sich, nach damaligen Analysen, bis zu 1700 mg/L reines Lithium gewinnen ließe.[38]
Als Kuppelprodukte bei der Lithiumgewinnung werden häufig Kaliumcarbonat (Pottasche), Borax, Caesium und Rubidium gewonnen.
Aufgrund der erwarteten starken Nachfrage nach Lithium für Batterien von Elektrofahrzeugen prüften 2010 einige Unternehmen den Abbau von lithiumhaltigen Mineralien und Salzlaugen in verschiedenen Regionen der Welt inklusive Europa.[39] Erforscht wird auch die Lithiumgewinnung aus Meerwasser. In den Weltmeeren sind ca. 230 Mrd. Tonnen Lithium gelöst. 2018 stellten Forscher eine Extraktionsmethode vor, bei der Lithium über solarbetriebene Elektrolyse aus Meerwasser gewonnen werden kann. Als einen Vorteil gegenüber herkömmlicher Gewinnung nannten sie, dass bei dem Prozess direkt metallisches Lithium anfällt und deshalb auf die (komplexe und energieaufwändige) Weiterverarbeitung verzichtet werden kann, wie sie bei der traditionellen Lithiumgewinnung aus Erzen notwendig ist.[40]
Beim Leibniz-Institut für Neue Materialien startete im November 2020 das auf zwei Jahre angesetzte Forschungsprojekt MERLIN (mining water lithium extraction), mit dem die Gewinnung von Lithium aus Grubenwasser getestet werden soll.[41]
Vorkommen außerhalb der Erde
Nach dem Urknall ist neben Wasserstoff- und Heliumisotopen auch eine nennenswerte Menge des Isotops 7Li entstanden. Dieses ist aber zum größten Teil heute nicht mehr vorhanden, da in Sternen Lithium mit Wasserstoff im Prozess der Proton-Proton-Reaktion II fusioniert und so verbraucht wurde.[42] In Braunen Zwergen sind Masse und Temperatur jedoch nicht hoch genug für eine Wasserstofffusion; ihre Masse erreicht nicht die dazu notwendige Größe von etwa 75 Jupitermassen. Das beim Urknall entstandene Lithium blieb somit in größeren Mengen nur in Braunen Zwergen erhalten. Lithium ist aus diesem Grund auch extraterrestrisch ein verhältnismäßig seltenes Element, kann aber zum Nachweis Brauner Zwerge dienen.[43]
Die Verteilung von Lithium in verschiedenen Sternen ist stark unterschiedlich, auch wenn das Alter, die Masse und die Metallizität ähnlich sind. Es wird angenommen, dass Planeten einen Einfluss auf den Lithiumgehalt eines Sterns besitzen. Besitzt ein Stern keine Planeten, so ist der Lithiumgehalt hoch, während Sterne wie die Sonne, die von Planeten umgeben sind, einen nur geringen Lithiumgehalt aufweisen, was auch als Lithium Dip bezeichnet wird. Als Ursache wird vermutet, dass die Gezeitenkräfte von Planeten zu einer stärkeren Durchmischung von äußeren und inneren Schichten in Sternen beitragen, so dass mehr Lithium in einen Bereich gelangt, der heiß genug ist, um dieses zu fusionieren.[44]
Produktionsprozess
Lithium wird vorwiegend aus Salzwasser (Grundwasser, Salzseen) durch Verdunstung gewonnen.[45] Selten ist die Gewinnung aus Gesteinen im offenen Tagebau.
Aus Salzwasser
Zur Lithiumgewinnung wird salzhaltiges Grundwasser an die Oberfläche gepumpt und über eine Kette von Verdunstungsteichen geleitet, in denen über mehrere Monate die Verdunstung an der Sonne stattfindet. Hat das Lithiumchlorid in den Teichen die nötige Konzentration erreicht, wird die Lösung in eine Aufbereitungsanlage gepumpt, wo unerwünschtes Bor oder Magnesium extrahiert und ausgefiltert werden. Dann wird sie mit Natriumcarbonat behandelt. Das dabei ausgefällte Lithiumcarbonat wird gefiltert und getrocknet. Überschüssige Rest-Sole wird in den Salzsee zurückgepumpt.[46] In trockenen Gegenden wie Chile wird durch die Grundwasserverwendung das Austrocknen der Landschaft gefördert.[47][48]
Darstellung
Aus lithiumhaltigen Salzlösungen wird durch Verdunsten des Wassers und Zugabe von Natriumcarbonat (Soda) Lithiumcarbonat ausgefällt. Dazu wird die Salzlake zunächst so lange an der Luft eingeengt, bis die Lithiumkonzentration 0,5 % überschreitet. Durch Zugabe von Natriumcarbonat fällt daraus das schwerlösliche Lithiumcarbonat aus:
- .
Zur Gewinnung von metallischem Lithium wird das Lithiumcarbonat zunächst mit Salzsäure umgesetzt. Dabei entstehen Kohlenstoffdioxid, das als Gas entweicht, und gelöstes Lithiumchlorid. Diese Lösung wird im Vakuumverdampfer eingeengt, bis das Chlorid auskristallisiert:
Die Apparate und Anlagen für die Lithiumchlorid-Gewinnung müssen aus Spezialstählen oder Nickellegierung sein, da die Salzlauge sehr korrosiv wirkt. Metallisches Lithium wird durch Schmelzflusselektrolyse eines bei 450–500 °C schmelzenden eutektischen Gemisches aus 52 Massenprozent Lithiumchlorid und 48 Massenprozent Kaliumchlorid hergestellt[1]:
Das Kalium wird bei der Elektrolyse nicht abgeschieden, weil es in der Chlorid-Schmelze ein niedrigeres Elektrodenpotential hat. Spuren von Natrium werden jedoch mit abgeschieden und machen das Lithium besonders reaktiv (vorteilhaft in der organischen Chemie, schlecht für Li-Batterien). Das flüssige Lithium sammelt sich an der Elektrolytoberfläche und kann so relativ einfach aus der Elektrolysezelle ausgeschleust werden. Es ist ebenfalls möglich, Lithium per Elektrolyse von Lithiumchlorid in Pyridin zu gewinnen. Diese Methode eignet sich besonders gut im Labormaßstab.
Wirtschaftliche Bedeutung und Rohstoffhandel
Nach seiner Gewinnung gelangt Lithium als Rohstoff über den Handel zu den weiterverarbeitenden Industrien. Im Rohstoffhandel, speziell an den Börsen für Metalle, wird kein reines Lithium gehandelt, das chemisch zu instabil wäre. Gehandelt werden stattdessen stabile Lithiumverbindungen, i. d. R. mit Lithiumsalzen bzw. Lithium-basierenden Kristallhaufwerken, überwiegend Lithiumkarbonat oder Lithiumhydroxidmonohydrat. Diese Stoffe werden u. a. an der London Metal Exchange gehandelt. 2020 wurden für Lithiumkarbonat (Minimalgehalt 99,5%) ein Preis von 8,75 USD / kg verzeichnet, für Lithiumhydroxidmonohydrat (Minimalgehalt 56,5%) 10,25 USD / kg.[49]
Neben der Quotierung des Lithiums als Rohstoff existieren seit 2010 Lithium-Indexfonds (ETFs), die börslich handelbar sind.[50][51] Mit diesen ETFs wird der Börsenwert von Unternehmen abgebildet, die an der Lithium-Wertschöpfungskette beteiligt sind. Seit 2010 gibt es einen Aktien-Performance-Index von Solactive, der die Marktkapitalisierung der größten börsennotierten Unternehmen nachzeichnet, die an Erkundung und Bergbau von Lithium sowie der Produktion von Lithium-Batterien beteiligt sind. Zu den zehn größten Werten in diesem Index zählen (nach Größe absteigend, Stand April 2020): Albemarle, SQM, Tesla, BYD, Samsung, Simplo Technology, LG Chem, Panasonic, GS Yuasa und Enersys.[52] Die wenigen Lithium-ETFs bilden überwiegend diesen Index ab.
Eigenschaften
Physikalische Eigenschaften
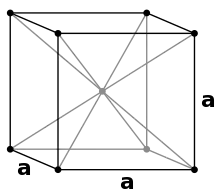
Lithium ist ein silberweißes, weiches Leichtmetall. Es ist bei Raumtemperatur das leichteste aller festen Elemente (Dichte 0,534 g/cm³[54]). Nur fester Wasserstoff bei −260 °C ist mit einer Dichte von 0,0763 g/cm³[54] noch leichter.
Lithium kristallisiert – wie die anderen Alkalimetalle – in einer kubisch-raumzentrierten Kugelpackung in der Raumgruppe Im3m (Raumgruppen-Nr. 229) mit dem Gitterparameter a = 351 pm und zwei Formeleinheiten pro Elementarzelle. Bei tiefen Temperaturen von 78 K ändert sich die Kristallstruktur durch Spontanumwandlung in eine hexagonale Struktur des Magnesium-Typs mit den Gitterparametern a = 311 pm und c = 509 pm oder nach Verformung in eine kubische Struktur des Kupfer-Typs (kubisch flächenzentriert) mit dem Gitterparameter a = 438 pm um. Die genauen Ursachen, welche Struktur gebildet wird, sind unbekannt.[53]
Lithium hat unter den Alkalimetallen den höchsten Schmelz- und Siedepunkt sowie die größte spezifische Wärmekapazität. Lithium besitzt zwar die größte Härte aller Alkalimetalle, lässt sich bei einer Mohs-Härte von 0,6[55] dennoch mit dem Messer schneiden. Als typisches Metall ist es ein guter Strom- (Leitfähigkeit: etwa 18 % von Kupfer[24]) und Wärmeleiter.
Lithium weist weitgehende Ähnlichkeit zu Magnesium auf, was sich auch in der Tatsache des Auftretens von heterotypen Mischkristallen aus Lithium und Magnesium, der sogenannten Isodimorphie zeigt. Obwohl Magnesium in der hexagonal dichtesten, Lithium dagegen in der kubisch raumzentrierten Kugelpackung kristallisiert, sind beide Metalle weitgehend heterotyp mischbar.[56] Dies erfolgt aber nur in einem beschränkten Konzentrationsbereich, wobei die im Überschuss vorhandene Komponente der anderen ihr Kristallgitter „aufzwingt“.
Das Lithium-Ion weist mit −520 kJ/mol[57] die höchste Hydratationsenthalpie aller Alkalimetallionen auf. Dadurch ist es in Wasser vollständig hydratisiert und zieht die Wassermoleküle stark an. Das Lithiumion bildet zwei Hydrathüllen, eine innere mit vier Wassermolekülen, die sehr stark über ihre Sauerstoffatome an das Lithiumion gebunden sind, und eine äußere Hülle, in der über Wasserstoffbrücken weitere Wassermoleküle mit dem Li[H2O]4+-Ion verbunden sind. Dadurch ist der Ionenradius des hydratisierten Ions sehr groß, sogar größer als diejenigen der schweren Alkalimetalle Rubidium und Caesium, die in wässriger Lösung keine derart stark gebundenen Hydrathüllen aufweisen.

Als Gas kommt Lithium nicht nur in einzelnen Atomen, sondern auch molekular als Dilithium Li2 vor. Das einbindige Lithium erreicht dadurch ein volles s-Atomorbital und somit eine energetisch günstige Situation. Dilithium hat eine Bindungslänge von 267,3 pm und eine Bindungsenergie von 101 kJ/mol.[58] Im gasförmigen Zustand liegt etwa 1 % (nach Masse) des Lithiums als Dilithium vor.
Chemische Eigenschaften

Lithium ist – wie alle Alkalimetalle – sehr reaktiv und reagiert bereitwillig mit sehr vielen Elementen und Verbindungen (wie Wasser) unter Wärmeabgabe. Unter den Alkalimetallen ist es allerdings das reaktionsträgste. Eine Besonderheit, die Lithium von den anderen Alkalimetallen unterscheidet, ist seine Reaktion mit molekularem Stickstoff zu Lithiumnitrid, die bereits bei Raumtemperatur langsam stattfindet:
- .
Dies wird durch die hohe Ladungsdichte des Li+-Ions und damit durch eine hohe Gitterenergie des Lithiumnitrids ermöglicht. Lithium hat mit −3,04 V[59] das niedrigste Normalpotential im Periodensystem und ist somit das unedelste aller Elemente.
Wie alle Alkalimetalle wird Lithium unter Petroleum oder Paraffinöl aufbewahrt, da es sonst mit dem in der Luft enthaltenen Sauerstoff und Stickstoff reagiert.
Da die Ionenradien von Li+- und Mg2+-Ionen vergleichbar groß sind, gibt es auch Ähnlichkeiten in den Eigenschaften von Lithium beziehungsweise Lithiumverbindungen und Magnesium oder Magnesiumverbindungen. Diese Ähnlichkeit in den Eigenschaften zweier Elemente aus benachbarten Gruppen des Periodensystems ist als Schrägbeziehung im Periodensystem bekannt. So bildet Lithium, im Gegensatz zu Natrium, viele metallorganische Verbindungen (Organolithium-Verbindungen), wie Butyllithium oder Methyllithium. Ähnliche Beziehungen bestehen auch zwischen Beryllium und Aluminium sowie zwischen Bor und Silicium.
Isotope
In der Natur kommen die beiden stabilen Isotope 6Li (7,6 %) und 7Li (92,4 %) vor. Daneben sind instabile Isotope, beginnend bei 4Li über 8Li bis 12Li, bekannt, die nur künstlich herstellbar sind. Ihre Halbwertszeiten liegen alle im Millisekundenbereich.[60]
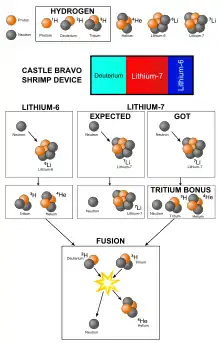
6Li spielt eine wichtige Rolle in der Technologie der Kernfusion. Es dient sowohl im Kernfusionsreaktor als auch in der Wasserstoffbombe als Ausgangsmaterial für die Erzeugung von Tritium, das für die energieliefernde Fusion mit Deuterium benötigt wird. Tritium entsteht im Blanket des Fusionsreaktors oder in der Wasserstoffbombe neben Helium durch Beschuss von 6Li mit Neutronen, die bei der Fusion anfallen, nach der Kernreaktion
- .
Die ebenfalls mögliche Reaktion
ist weniger geeignet (siehe Blanket). Die Trennung kann beispielsweise über einen Isotopenaustausch von Lithiumamalgam und einer gelösten Lithiumverbindung (wie Lithiumchlorid in Ethanol) erfolgen (sog. COLEX-Prozess). Dabei werden Ausbeuten von etwa 50 % erreicht.[61]
Ist in einer Dreistufenbombe neben 6Li auch 7Li vorhanden (wie es beispielsweise bei Castle Bravo der Fall war), reagiert dieses mit einigen der bei der Fusion erzeugten schnellen Neutronen. Dadurch entstehen wieder Neutronen, außerdem Helium und zusätzliches Tritium. Dies führt, obwohl die 7Li-Neutron-Reaktion zunächst Energie verbraucht, im Endergebnis zu erhöhter Energiefreisetzung durch zusätzliche Fusionen und mehr Kernspaltungen im Bombenmantel aus Uran. Die Sprengkraft ist deshalb höher, als wenn nur der 6Li-Anteil der Isotopenmischung in der Bombe umgewandelt worden wäre. Da vor dem Castle-Bravo-Test angenommen wurde, das 7Li würde nicht mit den Neutronen reagieren, war die Bombe etwa 2,5-mal so stark wie erwartet.[62]
Das Lithiumisotop 7Li entsteht in geringen Mengen in Kernkraftwerken durch eine Kernreaktion des (als Neutronenabsorber verwendeten) Borisotops 10B mit Neutronen.[63]
Die Isotope 6Li, 7Li werden beide in Experimenten mit kalten Quantengasen verwendet. So wurde das erste Bose-Einstein-Kondensat mit dem (Boson) Isotop 7Li erzeugt.[64] 6Li dagegen ist ein Fermion, und im Jahr 2003 ist es gelungen, Moleküle dieses Isotops in ein Suprafluid zu verwandeln.[65]
Verwendung
Die heute wichtigste und am schnellsten wachsende Anwendung für Lithium ist die Verwendung in Lithium-Ionen-Akkumulatoren (oft auch als wiederaufladbare Batterien bezeichnet), die z. B. in Smartphones, Laptops, Akkuwerkzeugen oder elektrisch betriebenen Fahrzeugen, wie Hybridautos, Elektroautos oder E-Bikes verwendet werden (siehe Diagramm rechts). Der größte Teil der produzierten Lithiumsalze wird nicht zum Metall reduziert, sondern entweder direkt als Lithiumcarbonat, Lithiumhydroxid, Lithiumchlorid, Lithiumbromid eingesetzt oder zu anderen Verbindungen umgesetzt. Das Metall wird nur in einigen Anwendungen benötigt. Die wichtigsten Verwendungszwecke von Lithiumverbindungen findet man im Abschnitt „Verbindungen“.
Metall
Ein Teil des produzierten Lithiummetalls wird für die Gewinnung von Lithiumverbindungen verwendet, die nicht direkt aus Lithiumcarbonat hergestellt werden können. Dies sind in erster Linie organische Lithiumverbindungen wie Butyllithium, Lithium-Wasserstoff-Verbindungen wie Lithiumhydrid (LiH) oder Lithiumaluminiumhydrid sowie Lithiumamid.
Lithium wird wegen seiner Fähigkeit, direkt mit Stickstoff zu reagieren, zu dessen Entfernung aus Gasen verwendet.
Metallisches Lithium ist ein sehr starkes Reduktionsmittel; es reduziert viele Stoffe, die mit anderen Reduktionsmitteln nicht reagieren. Es wird bei der partiellen Hydrierung von Aromaten (Birch-Reduktion) eingesetzt. In der Metallurgie wird es zur Entschwefelung, Desoxidation und Entkohlung von Metallschmelzen eingesetzt.
Da Lithium ein sehr niedriges Normalpotential besitzt, kann es in Batterien als Anode verwendet werden. Diese Lithium-Batterien haben eine hohe Energiedichte und können eine besonders hohe Spannung erzeugen. Nicht zu verwechseln sind die nicht wiederaufladbaren Lithium-Batterien mit den wiederaufladbaren Lithium-Ionen-Akkumulatoren, bei denen Lithiummetalloxide wie Lithiumcobaltoxid als Kathode und Graphit oder andere Lithiumionen einlagernde Verbindungen als Anode geschaltet sind.[66]
Kernfusion
Das für den Betrieb von Kernfusionsreaktoren nötige Tritium soll im Blanket des Reaktors aus Lithium-6 erbrütet werden.
Legierungsbestandteil
Lithium wird mit einigen Metallen legiert, um deren Eigenschaften zu verbessern. Oft reichen dafür schon geringe Mengen Lithium aus. Es verbessert als Beimischung bei vielen Stoffen die Zugfestigkeit, Härte und Elastizität. Ein Beispiel für eine Lithiumlegierung ist Bahnmetall, eine Bleilegierung mit circa 0,04 % Lithium, die als Lagermaterial in Eisenbahnen verwendet wird. Auch bei Magnesium-Lithium-Legierungen und Aluminium-Lithium-Legierungen werden die mechanischen Eigenschaften durch Zusatz von Lithium verbessert. Gleichzeitig sind Lithiumlegierungen sehr leicht und werden deshalb viel in der Luft- und Raumfahrttechnik verwendet.
Forschung (Atomphysik)
In der Atomphysik wird Lithium gerne verwendet, da es mit 6Li als einziges Alkalimetall ein stabiles fermionisches Isotop besitzt, weshalb es sich zur Erforschung der Effekte in ultrakalten fermionischen Quantengasen eignet (siehe BCS-Theorie). Gleichzeitig weist es eine sehr breite Feshbach-Resonanz auf, die es ermöglicht, die Streulänge zwischen den Atomen nach Belieben einzustellen, wobei die Magnetfelder aufgrund der Breite der Resonanz nicht besonders präzise gehalten werden müssen.
Medizin
Bereits 1859 wurde Lithium in der westlichen Medizin als Mittel gegen Gicht erstmals eingesetzt. Es erwies sich jedoch als unwirksam.[67] Erst 1949 beschrieb der australische Psychiater John Cade (1912–1980) ein mögliches Anwendungsgebiet für Lithiumsalze. Er hatte Meerschweinchen verschiedene chemische Verbindungen, darunter auch Lithiumsalze, injiziert, woraufhin diese weniger stark auf äußerliche Reize reagierten, ruhiger, aber nicht schläfrig wurden.[68] Im Nachhinein stellte sich heraus, dass der bei den Versuchstieren beobachtete Effekt auf eine Intoxikation zurückzuführen war.[69] Nach einem Selbstversuch von Cade wurde 1952–1954 die Verwendung von Lithiumcarbonat als Medikament zur Behandlung manisch-depressiver Patienten in einer Doppelblindstudie am Psychiatrischen Krankenhaus in Risskov (Dänemark) untersucht.[70] Damit war der Grundstein für die Lithiumtherapie gelegt.
Bei dieser wird Lithium in Form von Salzen, wie dem Lithiumcarbonat, gegen bipolare Affektstörungen, Manie und Depression aber auch außerhalb der Psychiatrie bei der Behandlung von Cluster-Kopfschmerz oder Infektionen mit Herpes simplex eingesetzt. Dabei ist die geringe therapeutische Breite zu beachten, die zwischen 0,6 mmol/L und 0,8 mmol/L liegt und Spiegelbestimmungen während der Therapie damit erforderlich macht.[71] Bereits wenn sich der Lithiumblutspiegel an der oberen Grenze der therapeutischen Breite bewegt, kann es bei empfindlichen Menschen zu beherrschbaren, reversiblen Nebenwirkungen kommen. Liegt der Lithiumblutspiegel jedoch deutlich über der therapeutischen Breite – also über 2,0 mmol/L – steigt die Gefahr deutlicher bis schwerer Nebenwirkungen wie Tremor, Rigor, Übelkeit, Erbrechen, Herzrhythmusstörungen und Leukozytose rasant an. Über 3,5 mmol/L besteht Lebensgefahr.[72] Der Grund ist, dass der Stoffwechsel von Lithium und Natrium ähnlich ist. Ein zu hoher Lithiumspiegel kann durch Schwitzen oder Natrium-ausschwemmende Medikamente (natriuretische Diuretika) mit sinkendem Natriumspiegel entstehen. Der Körper versucht, den Natriumverlust zu kompensieren, indem in den Nieren dem Primärharn Natrium entzogen und in das Blut zurücktransportiert wird (Natriumretention). Neben Natrium wird dabei auch Lithium reteniert, das normalerweise gleichmäßig von den Nieren ausgeschieden wird. Die Folge ist ein erhöhter Lithiumspiegel, was bei der Einnahme von Lithium ein Drug monitoring bedingt, bei dem regelmäßig der Lithiumspiegel bestimmt und die Dosis entsprechend angepasst wird. Auch bei korrekter Dosierung kann es unter Langzeit-Behandlung mit Lithium zu Wasser- und Natrium-Verlusten (Diabetes insipidus), Übersäuerung des Blutes (Azidose) und zur Lithium-Nephropathie mit Einschränkung der Nierenfunktion kommen.[73]
Eine Studie, die 1990 in den USA veröffentlicht wurde, beschreibt eine erhebliche Verringerung von Straftaten und Suiziden in Regionen mit erhöhten Lithiumkonzentrationen im Trinkwasser.[74] Eine österreichische Studie kam zu ähnlichen Ergebnissen.[75]
Die Wirkungsweise des Lithium als Psychopharmakon ist noch nicht hinreichend erforscht. Derzeit werden insbesondere die Beeinflussung des Inositol-Stoffwechsels durch Hemmung der myo-Inositol-1-Phosphatase (Enzymklasse 3.1.3.25)[76][77] und die Hemmung der Glykogensynthasekinase-3 (GSK-3) in Nervenzellen als mögliche Mechanismen diskutiert.[78] Die antidepressive Wirkung von Lithium beruht wahrscheinlich ebenfalls auf einer Verstärkung der serotonergen Neurotransmission, also einer erhöhten Ausschüttung von Serotonin in den Synapsen, während die antimanische Wirkung mit einer Hemmung dopaminerger Rezeptoren erklärt wird.[79][80] Eine weitere interessante Auswirkung von Lithiumsalzen auf den Menschen und Säugetiere wie Ratten ist die wohl damit zusammenhängende Veränderung der Circadianen Rhythmik.[81] Diese Wirkung konnte sogar bei Pflanzen wie der Kalanchoe nachgewiesen werden.[82][83] Andere serotonerge Substanzen wie LSD, Meskalin und Psilocybin zeigen ebenfalls solche Auswirkungen beim Menschen.[84] Durch Lithium ist es im Tierversuch an Fruchtfliegen (Drosophila melanogaster) gelungen, Symptome der Alzheimer-Krankheit – wie Vergesslichkeit – zu bekämpfen.[85] In Regionen mit höheren Lithiumgehalten scheint Demenz in geringerem Maße aufzutreten.[86] Die neuroprotektive Wirkung ist möglicherweise auf die durch Lithium verstärkte Autophagie zurückzuführen.[87]
Der Altersforscher Michael Ristow zeigte 2011 einen möglichen Zusammenhang zwischen dem Gehalt an Lithium in der Umwelt und der Lebenserwartung des Menschen: in einer japanischen Bevölkerungsstudie bestand danach zwischen einem höheren Gehalt von Lithium und einer höheren Lebenserwartung ein statistisch signifikanter Zusammenhang; des Weiteren verlängerten hohe Lithiumkonzentrationen die Lebenserwartung des Fadenwurms und Modellorganismus Caenorhabditis elegans.[88] Aufgrund der zahlreichen Effekte auf die menschliche Gesundheit wird diskutiert, ob Lithium womöglich ein Spurenelement darstellt.[89]
Nachweis

Lithiumverbindungen zeigen eine karminrote Flammenfärbung, die charakteristischen Spektrallinien liegen als Hauptlinien bei 670,776 und 670,791 nm; kleinere Linien liegen bei 610,3 nm. Darüber kann Lithium mit Hilfe der Flammenphotometrie nachgewiesen werden.
Ein quantitativer Nachweis mit nasschemischen Methoden ist schwierig, da die meisten Lithiumsalze leicht löslich sind. Eine Möglichkeit besteht über das Ausfällen des schwerlöslichen Lithiumphosphats. Dazu wird die zu untersuchende Probe zum Beispiel mit Natronlauge alkalisch gemacht und mit etwas Dinatriumhydrogenphosphat Na2HPO4 versetzt. Beim Erhitzen fällt bei Anwesenheit von Li+ ein weißer Niederschlag aus:
Eine weitere Möglichkeit ist die Verwendung des Eisenperiodatreagenz.
Gefahrenhinweise
Elementares Lithium in Form von Metallstaub entzündet sich an der Luft bereits bei Normaltemperatur.[15] Aus diesem Grund muss metallisches Lithium auch unter Luftausschluss, meist in Petroleum gelagert werden. Bei höheren Temperaturen ab 190 °C wird bei Kontakt mit Luft sofort überwiegend Lithiumoxid gebildet. In reinem Sauerstoff entzündet sich Lithium ab etwa 100 °C. In einer reinen Stickstoffatmosphäre reagiert Lithium erst bei höheren Temperaturen schneller zu Lithiumnitrid. Beim Kontakt mit sauerstoff- oder halogenhaltigen Substanzen kann Lithium explosionsartig reagieren.
Da Lithium mit gängigen Feuerlöschmitteln wie Wasser, Kohlendioxid, Stickstoff oder dem inzwischen verbotenen Tetrachlorkohlenstoff stark exotherm reagiert, müssen Brände mit inerten Gasen wie z. B. Argon oder anderen Metallbrandbekämpfungsmitteln wie Salz (z. B. NaCl) gelöscht werden.
Elementares Lithium verursacht wie alle Alkalimetalle bei Hautkontakt Schäden durch Verbrennungen oder alkalische Verätzungen, weil es mit Wasser unter starker Wärmeabgabe Lithiumhydroxid bildet; dafür genügt schon die Hautfeuchtigkeit.[15]
Verbindungen
Lithium ist sehr reaktiv und bildet mit den meisten Nichtmetallen Verbindungen, in denen es immer in der Oxidationsstufe +I vorliegt. Diese sind in der Regel ionisch aufgebaut, haben aber im Gegensatz zu Verbindungen anderer Alkalimetalle einen hohen kovalenten Anteil. Das zeigt sich unter anderem darin, dass viele Lithiumsalze – im Gegensatz zu den entsprechenden Natrium- oder Kaliumsalzen – gut in organischen Lösungsmitteln wie Aceton oder Ethanol löslich sind. Es existieren auch kovalente organische Lithiumverbindungen. Viele Lithiumverbindungen ähneln in ihren Eigenschaften auf Grund der ähnlichen Ionenradien den entsprechenden Magnesiumverbindungen (Schrägbeziehung im Periodensystem). Die folgende Grafik bietet eine Übersicht über die wichtigsten Reaktionen des Lithiums. Auf Stöchiometrie und genaue Reaktionsbedingungen ist hier nicht geachtet:
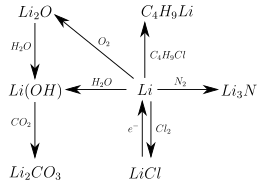
Wasserstoffverbindungen
Wasserstoff bildet mit Lithium Hydride. Die einfachste Lithium-Wasserstoff-Verbindung Lithiumhydrid LiH entsteht aus den Elementen bei 600–700 °C. Es wird als Raketentreibstoff und zur schnellen Gewinnung von Wasserstoff, beispielsweise zum Aufblasen von Rettungswesten,[24] verwendet. Es existieren auch komplexere Hydride wie Lithiumborhydrid LiBH4 oder Lithiumaluminiumhydrid LiAlH4. Letzteres hat in der organischen Chemie als selektiver Wasserstoffspender etwa zur Reduktion von Carbonyl- und Nitroverbindungen eine große Bedeutung.
Für die Erforschung der Kernfusion spielen Lithiumdeuterid (LiD) und Lithiumtritid (LiT) eine wichtige Rolle. Da reines Lithiumdeuterid die Energie der Wasserstoffbombe herabsetzt, wird dafür ein Gemisch aus LiD und LiT eingesetzt. Diese festen Substanzen sind leichter zu handhaben als Tritium mit seiner großen Effusionsgeschwindigkeit.
Sauerstoffverbindungen
Mit Sauerstoff bildet Lithium sowohl Lithiumoxid Li2O als auch Lithiumperoxid Li2O2.
Wenn Lithium mit Wasser reagiert, bildet sich Lithiumhydroxid, eine starke Base. Aus Lithiumhydroxid werden Lithiumfette hergestellt, die als Schmierfette für Autos verwendet werden. Da Lithiumhydroxid auch Kohlenstoffdioxid bindet, dient es in U-Booten zur Regenerierung der Luft.
Weitere Lithiumverbindungen


Lithium bildet mit den Halogeniden Salze der Form LiX. Dies sind Lithiumfluorid, Lithiumchlorid, Lithiumbromid und Lithiumiodid. Da Lithiumchlorid sehr hygroskopisch ist, wird es – außer als Ausgangsmaterial für die Lithiumgewinnung – auch als Trockenmittel eingesetzt. Es dient zum Trocknen von Gasen, beispielsweise von Erdgas, bevor es durch die Pipeline geführt wird oder bei Klimaanlagen zur Herabsetzung der Luftfeuchte (bis 2 % relativer Luftfeuchte). Lithiumchlorid dient ferner noch zur Herabsetzung von Schmelztemperaturen, in Schweiß- und Hartlötbädern und als Schweißelektroden-Ummantelung für das Schweißen von Aluminium. Lithiumfluorid findet als Einkristall in der Infrarotspektroskopie Verwendung.
Die technisch wichtigste Lithiumverbindung ist das schwerlösliche Lithiumcarbonat. Es dient zur Gewinnung der meisten anderen Lithiumverbindungen und wird in der Glasindustrie und bei der Herstellung von Email als Flussmittel eingesetzt. Auch in der Aluminiumherstellung wird es zur Verbesserung von Leitfähigkeit und Viskosität der Schmelze zugesetzt.
Lithiumseifen sind Lithiumsalze von Fettsäuren. Sie finden vor allem als Verdickungsmittel in hochwertigen Mineralöl-basierten Schmierfetten[90] und -wachsen sowie zur Herstellung von Bleistiften Verwendung.
Weitere Lithiumsalze sind:
- Lithiumperchlorat LiClO4,
- Lithiumsulfat Li2SO4,
- Lithiumnitrat LiNO3, wird mit Kaliumnitrat in der Gummiindustrie für die Vulkanisation verwendet,
- Lithiumnitrid Li3N, entsteht bei der Reaktion von Lithium mit Stickstoff,
- Lithiumniobat LiNbO3, ist in einem großen Wellenlängenbereich transparent und wird in der Optik und für Laser verwendet,
- Lithiumamid LiNH2, ist eine starke Base und entsteht bei der Reaktion von Lithium mit flüssigem Ammoniak.
- Lithiumstearat C18H35LiO2, ist ein wichtiger Zusatz für Öle, um diese als Schmierfette einzusetzen. Diese werden in Automobilen, in Walzenstraßen und bei Landmaschinen verwendet. Lithiumstearate sind in Wasser sehr schwer löslich, dadurch bleibt der Schmierfilm erhalten, wenn sie mit wenig Wasser in Berührung kommen. Die erhaltenen Schmierfette weisen eine hervorragende Temperaturstabilität (>150 °C) auf und bleiben bis −20 °C schmierfähig.[91]
- Lithiumacetat C2H3LiO2
- Lithiumcitrat C6H5Li3O7
- Lithiumhexafluorophosphat LiPF6 findet als Leitsalz in Lithium-Ionen-Akkus Verwendung.
- Lithiumphosphat Li3PO4, wird als Katalysator für die Isomerisation von Propylenoxid eingesetzt.
- Lithiummetaborat LiBO2 und Lithiumtetraborat Li2B4O7
- Lithiumbromid LiBr ist ein Reagenz zur Herstellung von Pharmazeutika, es wird aber auch in Absorptionskälteanlagen eingesetzt.
Organische Lithiumverbindungen
Im Gegensatz zu den meisten anderen Alkalimetallorganylen spielen Lithiumorganyle eine beachtliche Rolle insbesondere in der organischen Chemie. Von besonderer Bedeutung sind n-Butyllithium, tert-Butyllithium, Methyllithium und Phenyllithium, die in Form ihrer Lösungen in Pentan, Hexan, Cyclohexan beziehungsweise gegebenenfalls Diethylether auch kommerziell verfügbar sind. Man kann sie durch direkte Umsetzung metallischen Lithiums mit Alkyl-/Arylhalogeniden gemäß
oder durch Transmetallierung zum Beispiel aus Quecksilberorganylen gemäß
herstellen.
Mit elementarem Lithium in Tetrahydrofuran (THF) anstelle von Magnesium in Diethylether lassen sich Grignard-analoge Additionsreaktionen von Alkylhalogeniden an Carbonylverbindungen mit meist besserer Ausbeute durchführen.[92]
Auf Grund des deutlich kovalenten Charakters ist die Struktur von Lithiumorganylen nur selten durch eine einfache Li–C-Bindung zu beschreiben. Es liegen meist komplexe Strukturen, aufgebaut aus dimeren, tetrameren oder hexameren Einheiten, beziehungsweise polymere Strukturen vor. Lithiumorganyle sind hochreaktive Verbindungen, die sich an der Luft teilweise von selbst entzünden. Mit Wasser reagieren sie explosionsartig. Infolge ihrer extremen Basizität reagieren sie auch mit Lösungsmitteln, deren gebundener Wasserstoff kaum sauer ist, wie etwa THF, was die Wahl geeigneter Lösungsmittel stark einschränkt. Reaktionen mit ihnen sind nur unter Schutzgas und in getrockneten Lösungsmitteln möglich. Daher ist im Umgang mit ihnen eine gewisse Erfahrung erforderlich und große Vorsicht geboten.
Eine weitere Gruppe organischer Lithiumderivate sind die Lithiumamide des Typs LiNR2, von denen insbesondere Lithiumdiisopropylamid (LDA) und Lithium-bis(trimethylsilyl)amid (LiHMDS, siehe auch HMDS) als starke Basen ohne nukleophile Aktivität Verwendung finden.
Lithiumorganyle finden vielseitige Verwendung, so als Initiatoren für die anionische Polymerisation von Olefinen, als Metallierungs-, Deprotonierungs- oder Alkylierungsmittel.
Von gewisser Bedeutung sind die sogenannten Gilman-Cuprate des Typs R2CuLi.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1259–1270.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9, S. 83–129.
- M. Binnewies: Allgemeine und Anorganische Chemie. Spektrum Akademischer Verlag, Heidelberg 2004, ISBN 3-8274-0208-5, S. 334–336.
- Ernst Henglein: Technologie außergewöhnlicher Metalle. 1991, ISBN 3-8085-5081-3.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Richard Bauer: Lithium – wie es nicht im Lehrbuch steht. In: Chemie in unserer Zeit. 19, Nr. 5, 1985, S. 167–173, doi:10.1002/ciuz.19850190505.
- N. J. Birch: Inorganic Pharmacology of Lithium. In: Chem. Rev. 99, Nr. 9, 1999, S. 2659–2682, PMID 11749496.
- Jürgen Deberitz, Gernot Boche: Lithium und seine Verbindungen – Industrielle, medizinische und wissenschaftliche Bedeutung. In: Chemie in unserer Zeit. 37, Nr. 4, 2003, S. 258–266, doi:10.1002/ciuz.200300264.
- Michael Bauer, Paul Grof, Bruno Muller-Oerlinghausen (Hrsg.): Lithium in Neuropsychiatry: The Comprehensive Guide. 1. Auflage. Informa Healthcare, 2006, ISBN 1-84184-515-9.
Weblinks
- Zusammenfassung über Alkalimetalle von wiley-vch (PDF; 2,2 MB)
- Terra Xplore: Lithium fürs E-Auto – bald aus dem Rhein? auf YouTube, 28. September 2021.
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Lithium) entnommen.
- Angegeben ist der von der IUPAC empfohlene Standardwert, da die Isotopenzusammensetzung dieses Elements örtlich schwanken kann, ergibt sich für das mittlere Atomgewicht der in Klammern angegebene Massenbereich. Siehe: Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Report). In: Pure and Applied Chemistry. 2010, S. 1, doi:10.1351/PAC-REP-10-09-14.
- IUPAC, Standard Atomic Weights Revised 2013.
- Eintrag zu lithium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu lithium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Lithium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 97.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, 2005, ISBN 3-11-017485-5, S. 361.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Lithium) entnommen.
- M. Hesse, H. Meier, B. Zeeh: Spektroskopische Methoden in der organischen Chemie. Thieme, 2002.
- Eintrag zu Lithium im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Lithium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- Wolfgang Pfeiler: Quanten, Atome, Kerne, Teilchen. Walter de Gruyter GmbH & Co KG, 2017, ISBN 978-3-11-044571-8, S. 238.
- Max Mangold: Das Aussprachewörterbuch (= Der Duden in 12 Bänden. Band 6). 6. Auflage. 2005, ISBN 3-411-04066-1, S. 514.
- Helmut de Boor, Hugo Moser, Christian Winkler (Hrsg.): Siebs: Deutsche Aussprache. Reine und gemäßigte Hochlautung mit Aussprachewörterbuch.De Gruyter, Berlin 1969, S. 334 (eingeschränkte Vorschau in der Google-Buchsuche).
- Duden online gibt beide Aussprachevarianten an, siehe Lithium (mit Hörproben aus der Aussprachedatenbank der ARD).
- N. Figurowski: Die Entdeckung der chemischen Elemente und der Ursprung ihrer Namen. Aulis-Verlag Deubner, Köln 1981, ISBN 3-7614-0561-8, S. 135.
- Christoph Elschenbroich: Organometallchemie. 5. Auflage. Teubner, Leipzig 2005, S. 16.
- Jessica Elzea Kogel: Industrial minerals & rocks: commodities, markets, and uses. 7. Auflage. SME, 2006, ISBN 0-87335-233-5, S. 599 (Industrial minerals & rocks in der Google-Buchsuche).
- United States Geological Survey: Minerals Yearbook 2007: Lithium. (PDF; 75 kB), 2007.
- Hans Breuer: dtv-Atlas Chemie. Band 1, 9. Auflage. Deutscher Taschenbuch Verlag (dtv), München 2000, ISBN 3-423-03217-0.
- Lithium – ein Spannungsmacher auf Kreislaufkurs. (Memento vom 17. Juli 2011 im Internet Archive) In: VDI nachrichten. 7. Januar 2011, S. 3.
- Onmeda Nährstoff-Lexikon, Stand 10. Juni 2009.
- Peter Dolega, Matthias Buchert, Johannes Betz: Ökologische und sozio-ökonomische Herausforderungen in Batterie-Lieferketten: Graphit und Lithium. Kurzstudie erstellt im Rahmen des BMBF-Verbundprojektes Fab4Lib - Forschung zu Maßnahmen zur Steigerung der Material- und Prozesseffizienz bei der Herstellung von Lithium-Ionen-Batteriezellen entlang der gesamten Wertschöpfungskette (FKZ 03XP0142E). Hrsg.: Oeko-Institut. Freiburg, Darmstadt 29. Juli 2020.
- USGS [United States Geological Survey] (2020): Mineral Commodity Summaries 2020 - Lithium Data Sheet. URL:https://pubs.usgs.gov/periodicals/mcs2020/mcs2020-lithium.pdf (PDF; 130 kB) (Abruf=2020-09-07)
- USGS [United States Geological Survey] (2021): Mineral Commodity Summaries 2021. URL:https://pubs.usgs.gov/periodicals/mcs2021/mcs2021.pdf(PDF; 11,7 MB) (Abruf=2021-11-27)
- Meridian International Research: The trouble with Lithium 2. (PDF; 756 kB) Martainville, Mai 2008.
- Lithium supply in Portugal (2017).
- LITHIUM POTENTIALITIES IN NORTHERN PORTUGAL (2004).
- European Lithium. Abgerufen am 17. März 2021.
- Gold der Zukunft: Kärntner Lithium-Mine vor Start. Abgerufen am 16. Juli 2020.
- Zinnwald-Lithium-Projekt. Deutsche Lithium, abgerufen am 17. März 2021.
- Zacharias Zacharakis: Lithium: Der Berg erwacht. In: Die Zeit. Hamburg 13. November 2017 (zeit.de [abgerufen am 5. Dezember 2017]).
- Alix Arnold: Grandiose Landschaft und begehrter Rohstoff. Der Salar de Tunupa/Uyuni in Bolivien ist reich an Schönheit – und an Lithium. In: ila. Zeitschrift der Informationsstelle Lateinamerika. 395, Bonn, Mai 2016, S. 38–39.
- Stephan Bogner: Prima Diamond Corp. akquiriert das Green Energy Projekt in Utah mit historischen Lithiumkonzentrationen von 1700 mg/L. Rockstone Research, 18. Februar 2015 (PDF)
- Die weiße Hoffnung. In: FAZ. 27. Januar 2011, S. 19.
- Sixie Yang et al.: Lithium Metal Extraction from Seawater. In: Joule. 2018, doi:10.1016/j.joule.2018.07.006.
- Grubenwasser als Wertwasser – Bergbau trifft Elektromobilität (Pressemitteilung des INM)
- Wo das ganze Lithium geblieben ist. Auf: wissenschaft.de vom 15. August 2006. Beobachtung eines fernen Sternsystems bringt die Lösung eines kosmologischen Rätsels.
- Über braune Zwerge.
- Garik Israelian, Elisa Delgado Mena, Nuno C. Santos, Sergio G. Sousa, Michel Mayor, Stephane Udry, Carolina Domínguez Cerdena, Rafael Rebolo, Sofia Randich: Enhanced lithium depletion in Sun-like stars with orbiting planets. In: Nature. Nr. 462, 2009, S. 189–191, doi:10.1038/nature08483.
- Ulrich Wietelmann, Richard J. Bauer: Lithium and Lithium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 21, 2012, S. 344, doi:10.1002/14356007.a15_393.
- Terence Bell: An Overview of Commercial Lithium Production. The Balance, 11. Mai 2018, abgerufen am 16. Dezember 2018.
- zdf.de vom 9. September 2018, E-Autos: Ein nur scheinbar sauberes Geschäft. In: ZDF. 10. September 2018, archiviert vom Original am 15. November 2019. insbesondere der Abschnitt „Problemrohstoff Lithium“.
- ARD: Kann das Elektro-Auto die Umwelt retten?
- Lithium at the LME. lme.com-Internetportal (London Metal Exchange online), 2020, Website abgerufen am 21. März 2020 (englisch).
- Clyde Smith: Advanced battery technology, lithium and graphite mining ETFs: Global X Lithium & Battery Tech ETF (NYSE:LIT), Amplify Advanced Battery Metals (NYSE:BATT). born2invest.com-Internetportal, 10. April 2019 (englisch)
- Solactive Global Lithium (SOLLIT). investing.com-(UK)-Internetportal, Website abgerufen am 22. März 2020 (englisch)
- Solactive Global Lithium Index, Factsheet, Stand 2 April 2020.
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 30, 1974, S. 193–204, doi:10.1107/S0567740874002469.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 928–931.
- Lithium bei webelements.com, physikalische Eigenschaften.
- H. Malissa: Die Trennung des Lithiums vom Magnesium in Lithium-Magnesium-Legierungen. In: Fresenius’ Journal of Analytical Chemistry. 171, Nr. 4, 1959, S. 281–282, doi:10.1007/BF00555410.
- M. Binnewies: Allgemeine und Anorganische Chemie. Spektrum Verlag, 2006, S. 328.
- Mark J. Winter: Chemical Bonding. Oxford University Press, 1994, ISBN 0-19-855694-2.
- M. Binnewies: Allgemeine und Anorganische Chemie. Spektrum Verlag, 2006, S. 241.
- G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- Richard Bauer: Lithium – wie es nicht im Lexikon steht. In: Chemie in unserer Zeit. 19, Nr. 5, 1985, S. 167–173, doi:10.1002/ciuz.19850190505.
- Bericht über den Wasserstoffbombentest Castle Bravo (engl.)
- Martin Volkmer: Kernenergie Basiswissen. Inforum, 2006, ISBN 3-926956-44-5, S. 39 (PDF (Memento vom 17. Juni 2012 im Internet Archive)).
- C. C. Bradley, C. A. Sackett, J. J. Tollett, R. G. Hulet: Evidence of Bose-Einstein Condensation in an Atomic Gas with Attractive Interactions. In: Physical Review Letters. 75, Nr. 9, 1995, S. 1687–1690, doi:10.1103/PhysRevLett.75.1687.
- S. Jochim, M. Bartenstein, A. Altmeyer, G. Hendl, S. Riedl, C. Chin, J. Hecker Denschlag, R. Grimm: Bose-Einstein Condensation of Molecules. In: Science. 302, Nr. 5653, 2003, S. 2101–2103, doi:10.1126/science.1093280.
- Skript über Batterien der TU Graz (Memento vom 24. Januar 2009 im Internet Archive) (PDF; 3,4 MB).
- H. Gerdes: Lithium und Endokrinium. Springer, Berlin, Heidelberg 1978, ISBN 978-3-642-66830-2, S. 29–83, doi:10.1007/978-3-642-66830-2_2.
- J. Cade: Lithium salts in the treatment of psychotic excitement. In: Med. J. Australia. 36, 1949, S. 349–352. PMID 18142718.
- T. Bschor: 66 Jahre moderne Psychopharmakoltherapie. In: Nervenheilkunde. 34, 2015, S. 710–714.
- M. Schou: Lithiumbehandlung der manisch-depressiven Krankheit. Thieme, 2001, ISBN 3-13-593304-0.
- Lithium bei bipolarer Störung - die Dosierung macht’s! In: Ärzte Zeitung. 5. Februar 2007, abgerufen am 6. September 2021.
- H. D. Mühlbauer: Die Lithiumtherapie Nutzen, Risiken, Alternativen: Eine Einführung für Ärzte aller Fachrichtungen. Springer, Berlin, Heidelberg 1986, ISBN 978-3-642-96935-5, Die Lithiumintoxikation, S. 329–336, doi:10.1007/978-3-642-96935-5_31.
- R. Haussmann, M. Bauer, S. von Bonin, P. Grof, U. Lewitzka: Treatment of lithium intoxication: facing the need for evidence. In: International Journal of Bipolar Disorders. Band 3, Nr. 1, 2015, ISSN 2194-7511, S. 23, doi:10.1186/s40345-015-0040-2, PMID 26493348.
- Gerhard N. Schrauzer, Krishna P. Shrestha: Lithium in drinking water and the incidences of crimes, suicides, and arrests related to drug addictions. In: Biological Trace Element Research. 25, Mai 1990, S. 105–113, PMID 1699579.
- Nestor D. Kapusta, Nilufar Mossaheb, Elmar Etzersdorfer, Gerald Hlavin, Kenneth Thau, Matthäus Willeit, Nicole Praschak-Rieder, Gernot Sonneck, Katharina Leithner-Dziubas: Lithium in drinking water and suicide mortality. In: The British Journal of Psychiatry: The Journal of Mental Science. Band 198, Nr. 5, 2011, ISSN 1472-1465, S. 346–350, doi:10.1192/bjp.bp.110.091041, PMID 21525518.
- M. J. Berridge: Inositol trisphosphate and diacylglycerol as second messengers. In: Biochemical Journal. 220, Nr. 2, 1984, S. 345–360, PMC 1153635 (freier Volltext).
- D. H. Carney, D. L. Scott, E. A. Gordon, E. F. LaBelle: Phosphoinositides in mitogenesis: neomycin inhibits thrombin-stimulated phosphoinositide turnover and initiation of cell proliferation. In: Cell. 42, Nr. 2, 1985, S. 479–488, PMID 2992800.
- R. Williams, W. J. Ryves, E. C. Dalton, B. Eickholt, G. Shaltiel, G. Agam, A. J. Harwood: A molecular cell biology of lithium. In: Biochem. Soc. Trans. 32, 2004, S. 799–802, doi:10.1042/BST0320799.
- Psychopharmaka-Therapie.
- Brigitte Woggon: Behandlung mit Psychopharmaka. Huber, Bern 1998, S. 77–84.
- T. Hafen, F. Wollnik: Effect of lithium carbonate on activity level and circadian period in different strains of rats. In: Pharmacology Biochemistry & Behavior. 49, 1994, S. 975–983, PMID 7886116.
- E. Bünning, I. Moser: Influence of Valinomycin on Circadian Lead Movements of Phaseolus. In: Proc. Natl. Acad. Sci. USA. 69, Nr. 9, 1972, S. 2733, PMC 427027 (freier Volltext).
- W. Engelmann: Lithium slows down the Kalanchoe clock. In: Zeitschrift für Naturforschung B. 27, 1972, S. 477 (online). PMID 4403319.
- Grundlegendes zu Halluzinogenen. (Nicht mehr online verfügbar.) Ruprecht-Karls-Universität Heidelberg, archiviert vom Original am 17. Januar 2012; abgerufen am 11. Juni 2016.
- Sean M. J. McBride u. a.: Pharmacological and Genetic Reversal of Age-Dependent Cognitive Deficits Attributable to Decreased presenilin Function. In: The Journal of Neuroscience. 30, 28, 2010, S. 9510–9522, doi:10.1523/JNEUROSCI.1017-10.2010.
- Lars Vedel Kessing, Thomas Alexander Gerds, Nikoline Nygård Knudsen, Lisbeth Flindt Jørgensen, Søren Munch Kristiansen, Denitza Voutchkova, Vibeke Ernstsen, Jörg Schullehner, Birgitte Hansen, Per Kragh Andersen, Annette Kjær Ersbøll: Association of Lithium in Drinking Water With the Incidence of Dementia. In: JAMA Psychiatry. Band 74, Nr. 10, 2017, ISSN 2168-622X, S. 1005, doi:10.1001/jamapsychiatry.2017.2362.
- Yumiko Motoi, Kohei Shimada, Koichi Ishiguro, Nobutaka Hattori: Lithium and Autophagy. In: ACS Chemical Neuroscience. Band 5, Nr. 6, 2014, S. 434–442, doi:10.1021/cn500056q, PMID 24738557.
- Kim Zarse, Takeshi Terao, Jing Tian, Noboru Iwata, Nobuyoshi Ishii & Michael Ristow: Low-dose lithium uptake promotes longevity in humans and metazoans. In: Eur J Nutr. 50(5), 2011, S. 387–389; doi:10.1007/s00394-011-0171-x; PMID 21301855; PMC 3151375 (freier Volltext).
- Takeshi Terao: Is lithium potentially a trace element? In: World Journal of Psychiatry. Band 5, Nr. 1, 2015, S. 1–3, doi:10.5498/wjp.v5.i1.1.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh´sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 2386–2387.
- Periodensystem: Lithium. Uniterra.de.
- P. J. Pearce, D. H. Richards, N. F. Scilly: A one-step alternative to the Grignard reaction. In: J. Chem. Soc., Perkin Trans. 1. 1972, S. 1655–1660, doi:10.1039/P19720001655.

