Übergangsmetalle
Die chemischen Elemente mit den Ordnungszahlen von 21 bis 30, 39 bis 48, 57 bis 80 und 89 bis 112 werden üblicherweise als Übergangselemente bezeichnet. Da diese Elemente alle Metalle sind, wird auch der Ausdruck Übergangsmetalle benutzt. Dieser Name ist in ihrer Position im Periodensystem begründet, da sich dort der Übergang durch die aufeinanderfolgende Zunahme von Elektronen in den d-Atomorbitalen entlang jeder Periode zeigt. Übergangselemente werden von der IUPAC definiert als Elemente, die eine unvollständige d-Unterschale besitzen oder Ionen mit einer unvollständigen d-Unterschale ausbilden.[1] Nach dieser strengeren Definition sind die Elemente der Zinkgruppe keine Übergangselemente, da sie d10-Konfiguration besitzen. Traditionell wird jedoch die einfachere und weniger strikte Definition verwendet.
| 21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
| 39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
| 57 La |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
| 89 Ac |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
|
Lage im Periodensystem
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Elektronenkonfiguration
Hauptgruppenelemente, die sich im Periodensystem vor den Übergangsmetallen befinden (die Elemente mit den Ordnungszahlen von 1 bis 20), haben keine Elektronen in den d-Orbitalen, sondern nur in den s- und p-Orbitalen (obwohl angenommen wird, dass die leeren d-Orbitale im Verhalten solcher Elemente wie Silicium, Phosphor und Schwefel eine Rolle spielen).
Bei den d-Block-Elementen von Scandium bis Zink werden die d-Orbitale entlang der Periode aufgefüllt. Außer Kupfer und Chrom haben alle d-Block-Elemente der 4. Periode zwei Elektronen in ihrem äußeren s-Orbital, selbst Elemente mit unvollständigen 3d-Orbitalen. Das ist ungewöhnlich: niedrigere Orbitale werden normalerweise vor den äußeren Schalen aufgefüllt. Die s-Orbitale in den d-Block-Elementen befinden sich aber in einem niedrigeren Energiezustand als die d-Unterschalen. Da Atome bestrebt sind, einen möglichst niedrigen Energiezustand einzunehmen, werden die s-Schalen zuerst aufgefüllt. Die Ausnahmen bei Chrom und Kupfer – die nur ein Elektron in ihrem äußeren Orbital besitzen – sind durch Elektronenabstoßung begründet. Das Aufteilen der Elektronen auf s- und d-Orbitale führt zu niedrigeren Energiezuständen für die Atome, als zwei Elektronen im äußeren s-Orbital zu platzieren.
Nicht alle d-Block-Elemente sind Übergangsmetalle. Scandium und Zink passen nicht in die oben angegebene Definition. Scandium hat ein Elektron in seiner d-Unterschale und 2 Elektronen im äußeren s-Orbital. Da das einzige Scandiumion (Sc3+) keine Elektronen im d-Orbital hat, kann es natürlich auch kein „teilweise gefülltes“ d-Orbital haben. Ähnliches gilt für Zink, da sein einziges Ion, Zn2+, ein vollständig gefülltes d-Orbital hat.
Chemische und physikalische Eigenschaften
Übergangselemente zeichnen sich im Allgemeinen durch hohe Zugfestigkeiten, Dichten, Schmelzpunkte und Siedepunkte aus. So wie andere Eigenschaften der Übergangsmetalle sind auch diese auf die Fähigkeit der Elektronen der d-Orbitale zurückzuführen, innerhalb des Metallgitters delokalisiert zu sein. In metallischen Stoffen sind diese Eigenschaften umso stärker ausgeprägt, je mehr Elektronen zwischen den Kernen aufgeteilt werden.
Typische Eigenschaften der Übergangsmetalle sind:
- Sie bilden gefärbte Verbindungen.
- Sie können sehr viele verschiedene Oxidationszustände einnehmen.
- Sie sind gute Katalysatoren.
- Sie bilden Komplexe.
- Durch die Teilbesetzung der d-Orbitale können ungepaarte Elektronenspins auftreten, wodurch ein atomares magnetisches Moment entsteht. In diesem Fall zeigen sowohl die reinen Übergangsmetalle als auch deren Verbindungen paramagnetisches, ferromagnetisches, ferrimagnetisches oder antiferromagnetisches Verhalten.
Oxidationszustände
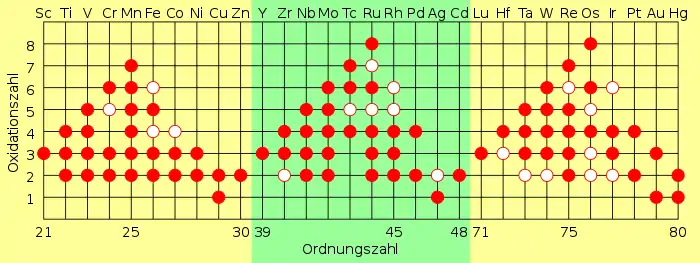
Im Vergleich zu Elementen der II. Gruppe wie Calcium gibt es die Ionen der Übergangselemente in zahlreichen Oxidationszuständen. Calciumatome geben nur zwei Elektronen ab, da sie so eine Edelgaskonfiguration erhalten. Sie liegen somit in der Oxidationsstufe +II vor, wohingegen ein Übergangselement bis zu acht Elektronen abgeben kann. Wenn man die Ionisationsenthalpien beider Gruppen betrachtet, erkennt man auch den Grund dafür. Die Energie, die zur Entfernung von Elektronen von Calcium notwendig ist, ist niedrig, solange bis man versucht, Elektronen unterhalb seines äußeren s-Orbitals zu entfernen. Ca3+ hat eine Ionisationsenthalpie, die so hoch ist, dass es normalerweise nicht vorkommt. Übergangselemente wie Vanadium dagegen haben wegen der geringen Energiedifferenz zwischen den 3d- und 4s-Orbitalen ziemlich linear ansteigende Ionisationsenthalpien entlang ihrer s- und d-Orbitale. Übergangselemente kommen daher auch mit sehr hohen Oxidationszahlen vor. Im Allgemeinen sind solche Elektronenkonfigurationen bevorzugt, die entweder voll oder halb besetzt sind.
Entlang einer Periode kann man bestimmte Verhaltensmuster erkennen:
- Die Anzahl der Oxidationszustände nimmt in der 4. Periode bis zum Mangan zu und sinkt dann wieder. Das ist auf die stärkere Anziehungskraft der Protonen im Kern zurückzuführen, wodurch die Abgabe von Elektronen erschwert wird.
- Die Elemente in ihren niedrigen Oxidationsstufen kommen normalerweise als einfache Ionen vor. In höheren Oxidationsstufen sind sie üblicherweise kovalent an andere elektronegative Elemente wie Sauerstoff oder Fluor gebunden, oft als Anionen.
Für die Übergangsmetalle der 6. Periode wurde erst kürzlich ein linearer Trend für die maximalen Oxidationsstufen vorhergesagt. Die maximalen Oxidationsstufen von Lanthan bis Osmium nehmen schrittweise von +III nach +VIII zu und fallen anschließend wieder linear ab bis zur Oxidationsstufe +IV für Quecksilber. Diese Vorhersage der maximalen Oxidationsstufen für die 5d-Übergangsmetallreihe wurde durch die Darstellung der Oxidationsstufe +IV für Quecksilber als HgF4 bestätigt.[2]
Eigenschaften in Abhängigkeit vom Oxidationszustand:
- Höhere Oxidationsstufen werden entlang der Periode weniger stabil.
- Ionen in höheren Oxidationsstufen sind gute Oxidationsmittel, wohingegen Elemente in niedrigen Oxidationsstufen Reduktionsmittel sind.
- Die (2+)-Ionen beginnen am Anfang der Periode als starke Reduktionsmittel und werden dann immer stabiler.
- Die (3+)-Ionen dagegen beginnen stabil und werden dann immer bessere Oxidationsmittel.
Katalytische Aktivität
Übergangsmetalle sind gute homogene oder heterogene Katalysatoren, z. B. ist Eisen der Katalysator für das Haber-Bosch-Verfahren. Nickel und Platin werden für die Hydrierung von Alkenen verwendet. Palladium (Pd) eignet sich gut für katalysierte C-C-Kupplungsreaktionen (Suzuki, Heck, Stille etc.). Rhodium (Rh), Iridium (Ir) und Ruthenium (Ru) werden z. B. in der asymmetrischen Hydrierung prochiraler Moleküle eingesetzt. In den meisten Fällen werden hier Phosphor-Verbindungen als Liganden für die Stereokontrolle eingesetzt. Die bekanntesten Liganden sind z. B. BINAP von R. Noyori (Nobelpreis 2001), DIOP von Kagan, JosiPhos/WalPhos, und DuPhos. Alle genannten Liganden haben gemeinsam, dass sie bidentat und chelatisierend sind, d. h. zwei Phosphoratome des Liganden binden gleichzeitig an das Metall.
Farbige Verbindungen
Wenn sich die Frequenz elektromagnetischer Strahlung verändert, können verschiedene Farben wahrgenommen werden. Sie resultieren aus der unterschiedlichen Zusammensetzung von Licht, nachdem es nach Kontakt mit einem Stoff reflektiert, transmittiert oder absorbiert wurde – man spricht auch von Remission. Wegen ihrer Struktur bilden Übergangsmetalle viele verschiedene farbige Ionen und Komplexe aus. Die Farben unterscheiden sich sogar bei ein und demselben Element – z. B. MnO4− (Mn in der Oxidationsstufe +7) ist eine violette Verbindung, Mn2+ ist aber blassrosa. Cr(II)-Verbindungen sind in der Regel blau, Cr(III)-Verbindungen grün, während Cr(VI)-Verbindungen gelb bis orange sind. Komplexbildung kann eine wesentliche Rolle bei der Farbgebung spielen. Die Liganden haben nämlich einen großen Einfluss auf die d-Schale. Sie ziehen teilweise die d-Elektronen an und spalten sie in höhere und niedrigere (in Bezug auf die Energie) Gruppen. Elektromagnetische Strahlung wird nur absorbiert, wenn ihre Frequenz der Energiedifferenz zweier Energiezustände des Atoms entspricht (wegen der Formel E=hν.) Wenn Licht auf ein Atom mit aufgespaltenen d-Orbitalen trifft, werden manche Elektronen in den höheren Zustand angehoben (d-d-Übergang). Verglichen mit einem nichtkomplexierten Ion können verschiedene Frequenzen absorbiert werden, und deshalb kann man auch verschiedene Farben beobachten.
Die Farbe eines Komplexes hängt ab von:
- der Art des Metallions, genau genommen von der Anzahl der Elektronen in den d-Orbitalen
- der Anordnung der Liganden um das Metallion (Komplexisomere können verschiedene Farben annehmen)
- der Art der Liganden um das Metallion. Je stärker die Liganden sind, desto größer ist die Energiedifferenz zwischen den beiden aufgespaltenen 3d-Gruppen.
Die Komplexe des d-Block-Elements Zink (streng genommen kein Übergangselement) sind farblos, da die 3d-Orbitale vollständig besetzt sind und daher auch keine Elektronen angehoben werden können.
Siehe auch
Weblinks
- Sebastian Riedel: The highest oxidation states of the transition metals. (englisch).
Einzelnachweise
- Eintrag zu transition metal. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.T06456 – Version: 2.3.1.
- Xuefang Wang, Lester Andrews, Sebastian Riedel, Martin Kaupp: Mercury is a Transition Metal: The First Experimental Evidence for HgF4; Angew. Chem. 2007, doi:10.1002/ange.200703710, Homepage of Dr. Sebastian Riedel
