Blei
Blei ist ein chemisches Element mit dem Elementsymbol Pb (lateinisch plumbum) und der Ordnungszahl 82. Es ist ein giftiges Schwermetall und steht in der 4. Hauptgruppe bzw. der 14. IUPAC-Gruppe (Kohlenstoffgruppe) und 6. Periode des Periodensystems. Blei ist leicht verformbar und hat einen vergleichsweise niedrigen Schmelzpunkt.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Blei, Pb, 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Metalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 14, 6, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | Bläulich weiß | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-100-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.273 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 18 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 207,2(1)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 180 (154) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f14 5d10 6s2 6p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 7.4166799(6) eV[4] ≈ 715.6 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 15.032499(7) eV[4] ≈ 1450.42 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 31.9373(6) eV[4] ≈ 3081.48 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 42.33256(10) eV[4] ≈ 4084.47 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 68.8(5) eV[4] ≈ 6640 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 11,342 g/cm³ (20 °C)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −1,6 · 10−5)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 600,61 K (327,43 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 2017 K[9] (1744 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 18,26 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 177 kJ·mol−1[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 4,85[10] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 1260 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 131[10] J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 4,76 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 35 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanisch [11] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poissonzahl | 0,44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,1251 V (Pb2+ + 2 e− → Pb) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,33 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[15] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Die Isotope 206Pb, 207Pb und 208Pb sind die schwersten stabilen Atome, Blei ist damit das Element mit der höchsten Massen- und Ordnungszahl, das noch stabil ist. Alle Bleiisotope haben die magische Protonenzahl 82, die diese Stabilität bewirkt. Bei 208Pb liegt sogar ein so genannter doppelt magischer Kern vor, weil er zusätzlich die magische Neutronenzahl 126 aufweist.
Da die Bleiisotope -206, -207 und -208 die Endprodukte der drei natürlichen Zerfallsreihen radioaktiver Elemente sind, ist relativ viel Blei entstanden; es kommt deshalb in der Erdkruste im Vergleich zu anderen schweren Elementen (Quecksilber, Gold u. a.) häufig vor.
Geschichte


Der bisher älteste Fund von metallischem Blei wurde in Çatalhöyük, etwa 50 km südöstlich von Konya auf dem Anatolischen Plateau, gemacht. Er besteht aus Bleiperlen zusammen mit Kupferperlen, die auf etwa 6500 vor Christus datiert wurden.[16]
In der frühen Bronzezeit wurde Blei neben Antimon und Arsen verwendet, um aus Legierungen mit Kupfer Bronzen zu erzeugen, bis sich Zinn weitgehend durchsetzte. Bereits die Babylonier kannten Vasen aus Blei. Die Assyrer mussten Blei (abāru) einführen, was von Tiglat-pileser I. unter anderem als Tribut von Melid belegt ist.[17] Im antiken Griechenland wurde Blei hauptsächlich in Form von Bleiglanz abgebaut, um daraus Silber zu gewinnen.[18] Im römischen Reich dagegen wurde der Stoff für eine Vielzahl von Anwendungsbereichen genutzt. Von besonderer Bedeutung war das Blei beispielsweise in der Architektur, wo Steinblöcke mithilfe von Bleiklammern aneinander befestigt wurden. So wurden für die Errichtung der Porta Nigra schätzungsweise sieben Tonnen Blei verbaut.[19] Weitere wichtige Einsatzbereiche waren die Verkleidung von Schiffsrümpfen zum Schutz vor Schädlingsbefall und die Herstellung von innerstädtischen Wasserleitungen. Hinzu kam die Nutzung von Blei als Rohstoff für die Herstellung von Gefäßen, als Material von Schreibtafeln oder für die sogenannten Tesserae, die zum Beispiel als Erkennungs- oder Berechtigungsmarke dienten.[20] Kleine Bleistücke, die sogenannten „Schleuderbleie“, dienten im römischen Heer als Schleudergeschoss.[21] Aufgrund des hohen Bedarfs fand auch ein Handel mit Blei über weite Strecken statt, der sich unter anderem durch Inschriften auf römischen Bleibarren nachweisen lässt.[20]
In der antiken Literatur war man der Ansicht, Blei und Zinn seien zwei Erscheinungsformen des gleichen Stoffes, sodass man Blei im Lateinischen als plumbum nigrum (von niger ‚schwarz‘), Zinn als plumbum candidum (von candidus ‚weiß‘) bezeichnete. Daher ist oft unklar, ob ein antiker Text mit plumbum Blei oder Zinn meint.[18] Schon der römische Autor Vitruv hielt die Verwendung von Blei für Trinkwasserrohre für gesundheitsschädlich und empfahl, stattdessen nach Möglichkeit Tonrohre zu verwenden.[22] Trotzdem waren Trinkwasserrohre aus Blei bis in die 1970er Jahre gebräuchlich, was beispielsweise auch in dem englischen Wort plumber ‚Rohrverleger‘ zum Ausdruck kommt. Aus heutiger Sicht besonders bedenklich war auch die Zugabe von Blei als Süßungsmittel zum Wein (sogenannter „Bleizucker“, siehe Blei(II)-acetat). Die häufige Nutzung von Blei in Rohren und im Wein wurde teilweise auch als Grund für den Untergang des Römischen Reiches diskutiert, eine Hypothese, die heutzutage in der Forschung allerdings abgelehnt wird.[20]
In Westfalen gewannen die Römer bis zu ihrem Rückzug nach der Varusschlacht Blei. Die für unterschiedliche Fundstellen typische Zusammensetzung der Isotope zeigt, dass das Blei für die Herstellung römischer Bleisärge, die im Rheinland gefunden wurden, aus der nördlichen Eifel stammt. Die römische Bleiverarbeitung hat zu einer bis heute nachweisbaren Umweltverschmutzung geführt: Eisbohrkerne aus Grönland zeigen zwischen dem 5. Jahrhundert v. Chr. und dem 3. Jahrhundert n. Chr. einen messbaren Anstieg des Bleigehalts in der Atmosphäre.
Auch später hatte Blei (von mittelhochdeutsch blī) eine wichtige Bedeutung. Es wurde beispielsweise zum Einfassen von Bleiglasfenstern, beispielsweise in Kirchen oder für das Eindecken von Bleidächern verwendet. Besonders wichtig wurde Blei vor allem nach Erfindung der Feuerwaffen für das Militär als Material für Projektile von Handfeuerwaffen. Da die Soldaten ihre Geschosse selbst herstellten, war es nicht unüblich, dass sie alles Blei stahlen, das sie finden konnten, um Geschosse daraus anzufertigen.
Blei spielte auch in der Alchemie eine wichtige Rolle. Auf Grund seiner Ähnlichkeit zu Gold (ähnlich weich und schwer) galt Blei als guter Ausgangsstoff für die Goldsynthese (Synthese als Farbumwandlung von Grau nach Gelb). Das alchemistische Symbol für Blei ist eine stilisierte Sichel (♄), da es bereits seit dem Altertum als Planetenmetall dem Gott und Planeten Saturn (lateinisch Saturnus) zugeordnet wurde.
Mit Beginn der industriellen Revolution wurde Blei dann in großen Mengen für die chemische Industrie, zum Beispiel für die Schwefelsäureproduktion im Bleikammerverfahren oder die Auskleidung von Anlagen zur Sprengstoffherstellung, benötigt. Es war damals das wichtigste Nichteisenmetall.
Beim Versuch, das Alter der Erde durch Messung des Verhältnisses von Blei zu Uran in Gesteinsproben zu bestimmen, stellte der US-amerikanische Geochemiker Clair Cameron Patterson etwa 1950 fest, dass die Gesteinsproben ausnahmslos mit großen Bleimengen aus der Atmosphäre verunreinigt waren. Als Quelle konnte er das als Antiklopfmittel in Kraftstoffen verwendete Tetraethylblei nachweisen. Nach Pattersons Befunden enthielt die Atmosphäre vor 1923 fast überhaupt kein Blei. Aufgrund dieser Erkenntnisse kämpfte er zeit seines Lebens für die Verringerung der Freisetzung von Blei in die Umwelt. Seine Bemühungen führten schließlich dazu, dass 1970 in den USA der Clean Air Act mit strengeren Abgasvorschriften in Kraft trat. 1986 wurde der Verkauf verbleiten Benzins in den Vereinigten Staaten, in Deutschland durch das Benzinbleigesetz schrittweise ab 1988[23], in der EU ab 2001 völlig verboten. Daraufhin sank der Bleigehalt im Blut der Amerikaner fast sofort um 80 Prozent. Da Blei jedoch in der Umwelt praktisch ewig erhalten bleibt, hat dennoch heute jeder Mensch etwa 600-mal mehr von dem Metall im Blut als vor 1923. Pro Jahr wurden um das Jahr 2000 immer noch legal etwa 100.000 Tonnen in die Atmosphäre freigesetzt. Die Hauptverursacher sind Bergbau, Metallindustrie und produzierendes Gewerbe.[24]

Im Jahr 2009 lag die Menge des gewonnenen Bleis bei den Nichteisenmetallen an vierter Stelle nach Aluminium, Kupfer und Zink. Es wird vor allem für Autobatterien (Bleiakkumulatoren) verwendet (60 % der Gesamtproduktion).[25]
Allgemein wird versucht, die Belastung von Mensch und Umwelt mit Blei und damit Bleivergiftungen zu verringern. Außer dem Verbot von bleihaltigem Benzin wurde ab 2002 durch die RoHS-Richtlinien die Verwendung von Blei in Elektro- und Elektronikgeräten eingeschränkt. 1989 wurden bleihaltige Anstriche und Beschichtungen vollständig verboten[26], der Einsatz von bleihaltiger Munition wurde ab 2005 in einigen Bundesländern teilweise verboten.[27] Als Material für Wasserrohre wurde Blei schon 1973 verboten, jedoch existiert noch keine Bestimmung zur Entfernung von Bleirohren aus Bestandsimmobilien, weswegen 2017 der deutsche Bundesrat ein Verbot bleihaltiger Trinkwasserleitungen forderte.[28][29] Seit 1. März 2018 ist das Verwenden (Lagern, Mischen, Gebrauchen zur Herstellung u. a.) und Inverkehrbringen von Blei – massiv (z. B. als Barren oder Pellets) oder als Pulver – ähnlich wie schon länger bei vielen Bleiverbindungen in der Europäischen Union von wenigen Ausnahmen abgesehen regelmäßig verboten, wenn das zum Verkauf an die breite Öffentlichkeit bestimmt ist und die Bleikonzentration darin 0,3 % oder mehr beträgt; im Übrigen muss der Lieferant gewährleisten, dass das vor dem Inverkehrbringen als „nur für gewerbliche Anwender“ gekennzeichnet ist.[30]
Vorkommen
Blei kommt in der Erdkruste mit einem Gehalt von etwa 0,0018 % vor[31] und tritt eher selten gediegen, das heißt in elementarer Form auf. Dennoch sind weltweit inzwischen rund 200 Fundorte für gediegen Blei bekannt (Stand: 2017), so unter anderem in Argentinien, Äthiopien, Australien, Belgien, Brasilien, Volksrepublik China, Deutschland, Finnland, Frankreich, Georgien, Griechenland, Grönland, Italien, Kanada, Kasachstan, Kirgisistan, Mexiko, der Mongolei, Namibia, Norwegen, Österreich, Polen, Russland, Schweden, Slowenien, Tschechien, der Ukraine, den US-amerikanischen Jungferninseln, im Vereinigten Königreich und den Vereinigten Staaten von Amerika (USA).[32]
Auch in Gesteinsproben des mittelatlantischen Rückens, genauer am nordöstlichen Rand der „Markov-Tiefe“ innerhalb der „Sierra-Leone-Bruchzone“ (Sierra-Leone-Schwelle), sowie außerhalb der Erde auf dem Mond im Mare Fecunditatis konnte Blei gefunden werden.[32]
An jedem Fundort weicht die Isotopenzusammensetzung geringfügig von den oben angegebenen Mittelwerten ab, so dass man mit einer genauen Analyse der Isotopenzusammensetzung den Fundort bestimmen und bei archäologischen Fundstücken auf alte Handelswege schließen kann. Zudem kann Blei ebenfalls fundortabhängig verschiedene Fremdbeimengungen wie Silber, Kupfer, Zink, Eisen, Zinn und/oder Antimon enthalten.[33]
In Bleierzen ist Blei zumeist als Galenit (Bleisulfid PbS, Bleiglanz) zugegen. Dieses Mineral ist auch die bedeutendste kommerzielle Quelle für die Gewinnung neuen Bleis. Weitere Bleimineralien sind Cerussit (Blei(II)-carbonat, PbCO3, auch Weißbleierz), Krokoit (Blei(II)-chromat, PbCrO4, auch Rotbleierz) und Anglesit (Blei(II)-sulfat, PbSO4, auch Bleivitriol). Die Bleiminerale mit der höchsten Bleikonzentration in der Verbindung sind Lithargit und Massicotit (bis 92,8 %) sowie Minium (bis 90,67 %). Insgesamt sind bisher 514 Bleiminerale bekannt (Stand: 2017).[34]
Die wirtschaftlich abbaubaren Vorräte werden weltweit auf 67 Millionen Tonnen geschätzt (Stand 2004).[35] Die größten Vorkommen findet man in der Volksrepublik China, den USA, Australien, Russland und Kanada. In Europa sind Schweden und Polen die Länder mit den größten Vorkommen.
Auch in Deutschland wurde in der nördlichen Eifel (Rescheid / Gruben Wohlfahrt und Schwalenbach; Mechernich / Grube Günnersdorf und auch Tagebau /Virginia; Bleialf), im Schwarzwald, im Harz (Goslar/Rammelsberg), in Sachsen (Freiberg/Muldenhütten), an der unteren Lahn (Bad Ems, Holzappel), sowie in Westfalen (Ramsbeck/Sauerland) in der Vergangenheit Bleierz abgebaut, verhüttet und veredelt.
Die bedeutendste Quelle für Blei ist heute das Recycling alter Bleiprodukte. Daher bestehen in Deutschland nur noch zwei Primärhütten, die Blei aus Erz herstellen, die Bleihütte Binsfeldhammer in Stolberg (Rhld.) und Metaleurop in Nordenham bei Bremerhaven. Sämtliche andere Hütten erzeugen so genanntes Sekundärblei, indem sie altes Blei (insbesondere aus gebrauchten Autobatterien) aufarbeiten.
Blei als Mineral

Natürliche Vorkommen an Blei in seiner elementaren Form waren bereits vor der Gründung der International Mineralogical Association (IMA) bekannt. Als vermutliche Typlokalität wird die manganreichen Eisenerz-Lagerstätte Långban in Schweden angegeben, wo derbe Massen von bis zu 50 kg[36] oder 60 kg[37] gefunden worden sein sollen. Blei ist daher als sogenanntes grandfathered Mineral als eigenständige Mineralart anerkannt.[38]
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Blei unter der System-Nummer 1.AA.05 (Elemente – Metalle und intermetallische Verbindungen – Kupfer-Cupalit-Familie – Kupfergruppe)[39] beziehungsweise in der veralteten 8. Auflage unter I/A.03 (Zinn-Blei-Gruppe) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.01.01.04 (Goldgruppe).[40]
In der Natur tritt gediegen Blei meist in Form von zentimetergroßen Blechen und Platten sowie in körnigen, dendritischen, haar- oder drahtförmigen Aggregaten auf.[41] Sehr selten finden sich auch oktaedrische, würfelige und dodekaedrische Bleikristalle, die meist winzig sind,[42] aber gelegentlich eine Größe zwischen 4 cm[36] und 6 cm erreichen können.[33]
Staaten mit der größten Förderung
| Rang | Land | Fördermengen (in 1000 t) |
Rang | Land | Fördermengen (in 1000 t) |
|---|---|---|---|---|---|
| 1 | 950 | 11 | 33,9 | ||
| 2 | 642 | 12 | 33 | ||
| 3 | 445 | 13 | 31,3 | ||
| 4 | 306,2 | 14 | 24 | ||
| 5 | 118,5 | 15 | 22 | ||
| 6 | 76,7 | 16 | 20 | ||
| 7 | 65,9 | 17 | 19 | ||
| 8 | 39,8 | 18 | 18,7 | ||
| 9 | 38 | 19 | 15 | ||
| 10 | 37,5 | 20 | 14,7 |
Die weltweit bedeutendsten Förderländer für Bleierz im Jahre 2004 waren die Volksrepublik China (950.000 Tonnen), Australien (642.000 Tonnen) und die USA (445.000 Tonnen), deren Anteil an den weltweit abgebauten 3,1 Millionen Tonnen zusammen etwa zwei Drittel betrug. In Europa sind Irland, Schweden und Polen als die größten Bleiproduzenten zu nennen.
Die wichtigsten Produzenten von raffiniertem Blei (Hüttenweichblei mit 99,9 % Reinheit) sind die Volksrepublik China (1,8 Millionen Tonnen), die USA (1,2 Millionen Tonnen) und Deutschland (403.000 Tonnen), deren Anteil zusammen rund die Hälfte der weltweit erzeugten 6,7 Millionen Tonnen beträgt. Weitere bedeutende Produzenten von raffiniertem Blei in Europa sind Großbritannien, Italien, Frankreich und Spanien.
Der weltweite Verbrauch bzw. Produktion von Blei stieg von etwa 7 Millionen Tonnen auf etwa 11 Millionen Tonnen in den Jahren 2013 bis 2016.[44][45]
Gewinnung und Darstellung
Das mit Abstand bedeutendste Bleimineral ist das Galenit. Dieses tritt häufig vergesellschaftet mit den Sulfiden anderer Metalle (Kupfer, Bismut, Zink, Arsen, Antimon u. a.) auf, die naturgemäß als Verunreinigung des Rohbleis bis zu einem Anteil von 5 % enthalten sind.
Das durch Zerkleinerung, Klassierung und Flotation auf bis zu 60 % Mineralgehalt aufbereitete Erz wird in drei verschiedenen industriellen Prozessen in metallisches Blei überführt. Dabei treten die Verfahren der Röstreduktion und der Röstreaktion zunehmend in den Hintergrund und werden durch Direktschmelzverfahren ersetzt, die sich einerseits wirtschaftlicher gestalten lassen und die andererseits umweltverträglicher sind.
Röstreduktionsarbeit
Dieses Verfahren verläuft in zwei Stufen, dem Rösten und der Reduktion. Beim Rösten wird das fein zerkleinerte Bleisulfid auf einen Wanderrost gelegt und 1000 °C heiße Luft hindurchgedrückt. Dabei reagiert es mit dem Sauerstoff der Luft in einer exothermen Reaktion zu Blei(II)-oxid (PbO) und Schwefeldioxid. Dieses wird über die Röstgase ausgetrieben und kann für die Schwefelsäureproduktion verwendet werden. Das Bleioxid ist unter diesen Bedingungen flüssig und fließt nach unten. Dort kann es gesintert werden.
- (Röstarbeit)
Anschließend erfolgt die Reduktion des Bleioxids mit Hilfe von Koks zu metallischem Blei. Dies geschieht in einem Schachtofen, ähnlich dem beim Hochofenprozess verwendeten. Dabei werden schlackebildende Zuschlagsstoffe wie Kalk beigefügt.
- (Reduktionsarbeit)
Röstreaktionsarbeit
Dieses Verfahren kommt vor allem bei hochgradig mit PbS angereicherten Bleierzen zum Einsatz und ermöglicht die Bleierzeugung in einem Schritt. Dabei wird das sulfidische Erz nur unvollständig geröstet. Anschließend wird das Bleisulfid/Bleioxid-Gemisch weiter unter Luftabschluss erhitzt. Dabei setzt das Bleioxid sich mit dem verbliebenen PbS ohne Zugabe eines weiteren Reduktionsmittels zu Blei und Schwefeldioxid um:
- (Röstarbeit),
- (Reaktionsarbeit).
Direktschmelzverfahren
Moderne Herstellungsverfahren für Blei basieren auf Direktschmelzverfahren, die auf Umweltverträglichkeit und Wirtschaftlichkeit hin optimiert wurden (z. B. das QSL-Verfahren[46]). Vorteilhaft ist die kontinuierliche Prozessführung mit Beschränkung auf einen Reaktionsraum, der als einziger Emittent für Schadstoffe auftritt – im Vergleich dazu weisen die klassischen Produktionsverfahren das Sintern als zusätzlichen emittierenden Schritt auf. Das Rösten und die Reduktion finden parallel in einem Reaktor statt. Das Bleisulfid wird ähnlich wie beim Röstreaktionsverfahren nicht vollständig geröstet. Ein Teil des Bleis entsteht somit durch Reaktion des Bleisulfids mit Bleioxid. Da der Reaktor leicht geneigt ist, fließen Blei und bleioxidhaltige Schlacke ab. Diese passiert die Reduktionszone, in die Kohlenstaub eingeblasen und das Bleioxid so zu Blei reduziert wird. Beim Rösten wird statt Luft reiner Sauerstoff verwendet. Dadurch verringert sich das Volumen an Abgasen erheblich, die andererseits eine im Vergleich zu konventionellen Verfahren höhere Konzentration an Schwefeldioxid aufweisen. Deren Verwendung für die Schwefelsäureherstellung gestaltet sich somit einfacher und wirtschaftlicher.
Raffination

Das entstehende Werkblei enthält 2–5 % andere Metalle, darunter Kupfer, Silber, Gold, Zinn, Antimon, Arsen, Bismut in wechselnden Anteilen. Das Aufreinigen und Vermarkten einiger dieser Beiprodukte, insbesondere des bis zu 1 % im Werkblei enthaltenen Silbers, trägt wesentlich zur Wirtschaftlichkeit der Bleigewinnung bei.
Die pyrometallische Raffination des Bleis ist ein mehrstufiger Prozess. Durch Schmelzen in Gegenwart von Natriumnitrat/Natriumcarbonat bzw. von Luft werden Antimon, Zinn und Arsen oxidiert und können als Bleiantimonate, -stannate und -arsenate von der Oberfläche der Metallschmelze abgezogen werden („Antimonabstrich“). Kupfer wie auch eventuell enthaltenes Zink, Nickel und Kobalt werden durch Seigern des Werkbleis aus dem Rohmetall entfernt. Dabei sinkt auch der Schwefelgehalt beträchtlich. Silber wird nach dem Parkes-Verfahren ggf. durch die Zugabe von Zink und das Ausseigern der sich bildenden Zn-Ag-Mischkristalle aus dem Blei abgeschieden („Parkesierung“), während die Bedeutung des älteren Pattinson-Verfahrens stark zurückgegangen ist (siehe auch Herstellung von Silber, Blicksilber). Bismut kann nach dem Kroll-Betterton-Verfahren durch Legieren mit Calcium und Magnesium als Bismutschaum von der Oberfläche der Bleischmelze abgezogen werden.
Eine weitere Reinigung kann durch elektrolytische Raffination erfolgen, jedoch ist dieses Verfahren bedingt durch den hohen Energiebedarf kostenintensiver. Blei ist zwar ein unedles Element, welches in der elektrochemischen Spannungsreihe ein negativeres Standardpotential als Wasserstoff aufweist. Dieser hat jedoch an Bleielektroden eine hohe Überspannung, so dass eine elektrolytische Abscheidung metallischen Bleis aus wässrigen Lösungen möglich wird, siehe elektrolytische Bleiraffination.
Raffiniertes Blei kommt als Weichblei bzw. genormtes Hüttenblei mit 99,9- bis 99,97%iger Reinheit (z. B. Eschweiler Raffiné) oder als Feinblei mit 99,985 bis 99,99 % Blei (DIN 1719, veraltet) in den Handel. Entsprechend dem Verwendungszweck sind auch Bezeichnungen wie Kabelblei für die Legierung mit ca. 0,04 % Kupfer verbreitet. Aktuelle Normen wie DIN EN 12659 kennen diese noch gebräuchlichen Bezeichnungen nicht mehr.
Eigenschaften
Physikalische Eigenschaften
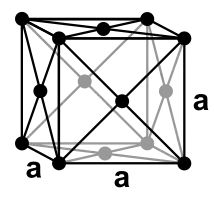
Blei ist ein unedles Metall mit einem Standardelektrodenpotential von etwa −0,13 V.[47] Es ist allerdings edler als viele andere Gebrauchsmetalle, wie Eisen, Zink oder Aluminium. Es ist ein diamagnetisches Schwermetall mit einer Dichte von 11,3 g/cm³, das kubisch-flächenzentriert kristallisiert und damit eine kubisch dichteste Kugelpackung mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225) aufweist. Der Gitterparameter beträgt bei reinem Blei 0,4950 nm[48] (entspricht 4,95 Å) bei 4 Formeleinheiten pro Elementarzelle.[49]
Darauf gründet die ausgeprägte Duktilität des Metalls und die geringe Mohshärte von 1,5. Es lässt sich daher leicht zu Blechen walzen oder zu Drähten formen, die jedoch wegen ihrer geringen Härte nur wenig beständig sind. Eine diamantartige Modifikation, wie sie von den leichteren Homologen der Gruppe 14 bekannt ist, tritt beim Blei nicht auf. Das liegt an der relativistisch bedingten Instabilität der Pb-Pb-Bindung und an der geringen Tendenz, vierwertig aufzutreten.
Frische Bleiproben sind von grauweißer bis metallisch weißer Farbe und zeigen einen typisch metallischen Glanz, der aber durch oberflächliche Oxidation sehr schnell abnimmt. Die Farbe wechselt dabei ins Dunkelgraue und wird matt. Auf Papier hinterlässt das weiche Metall einen (blei)grauen Strich. Aus diesem Grund wurde früher mit Blei geschrieben und gemalt. Der Name „Bleistift“ blieb bis heute erhalten, obwohl man seit langem dafür Graphit benutzt.
Der Schmelzpunkt des Bleis liegt bei 327 °C, sein Siedepunkt bei 1740–1751 °C (Werte in Fachliteratur unterschiedlich: 1740 °C,[50] 1746 °C,[47] 1751 °C[51]). Blei leitet als typisches Metall sowohl Wärme als auch Strom, dies aber deutlich schlechter als andere Metalle (vgl. elektrische Leitfähigkeit Blei: 4,8 · 106 S/m,[51] Silber: 62 · 106 S/m[51]). Unterhalb von 7,196 K zeigt Blei keinen elektrischen Widerstand, es wird zum Supraleiter vom Typ I. Die Schallgeschwindigkeit in Blei liegt bei etwa 1200 m/s, in der Literatur streuen die Werte etwas, wahrscheinlich bedingt durch unterschiedliche Reinheit oder Bearbeitung.
Chemische Eigenschaften
An der Luft wird Blei durch Bildung einer Schicht aus Bleioxid passiviert und damit vor weiterer Oxidation geschützt. Frische Schnitte glänzen daher zunächst metallisch, laufen jedoch schnell unter Bildung einer matten Oberfläche an. In feinverteiltem Zustand ist Blei leichtentzündlich (pyrophores Blei).
Auch in diversen Säuren ist Blei durch Passivierung unlöslich. So ist Blei beständig gegen Schwefelsäure, Flusssäure und Salzsäure, da sich mit den Anionen der jeweiligen Säure unlösliche Bleisalze bilden. Deshalb besitzt Blei für spezielle Anwendungen eine gewisse Bedeutung im chemischen Apparatebau.
Löslich ist Blei dagegen in Salpetersäure (Blei(II)-nitrat ist wasserlöslich), heißer, konzentrierter Schwefelsäure (Bildung des löslichen Pb(HSO4)2-Komplexes), Essigsäure (nur bei Luftzutritt) und heißen Laugen.
In Wasser, das keinen Sauerstoff enthält, ist metallisches Blei stabil. Bei Anwesenheit von Sauerstoff löst es sich jedoch langsam auf, so dass bleierne Trinkwasserleitungen eine Gesundheitsgefahr darstellen können. Wenn das Wasser dagegen viele Hydrogencarbonat- und Sulfationen enthält, was meist mit einer hohen Wasserhärte einhergeht, bildet sich nach einiger Zeit eine Schicht basischen Bleicarbonats und Bleisulfats. Diese schützt das Wasser vor dem Blei, jedoch geht selbst dann noch etwas Blei aus den Leitungen in das Wasser über.
Isotope
Natürlich vorkommendes Blei besteht im Mittel zu etwa 52,4 % aus dem Isotop 208Pb, zu etwa 24,1 % aus 206Pb, zu etwa 22,1 % aus 207Pb, und zu etwa 1,4 % 204Pb. Die Zusammensetzung ist je nach Lagerstätte geringfügig verschieden, so dass mit einer Analyse der Isotopenzusammensetzung die Bleiherkunft festgestellt werden kann. Das ist für historische Funde aus Blei und Erkenntnisse früherer Handelsbeziehungen von Bedeutung.
Die drei erstgenannten Isotope sind stabil. Bei 204Pb handelt es sich um ein primordiales Radionuklid. Es zerfällt unter Aussendung von Alphastrahlung mit einer Halbwertszeit von 1,4 · 1017 Jahren (140 Billiarden Jahre) in 200Hg. 208Pb besitzt einen doppelt magischen Kern; es ist das schwerste stabile Nuklid. (Das noch schwerere, lange für stabil gehaltene 209Bi ist nach neueren Messungen[52] instabil und zerfällt mit einer Halbwertszeit von (1,9 ± 0,2)· 1019 Jahren (19 Trillionen Jahre) unter Aussendung von Alphateilchen.)
Die stabilen Isotope des natürlich vorkommenden Bleis sind jeweils die Endprodukte der Uran- und Thorium-Zerfallsreihen: 206Pb ist das Endnuklid der beim 238U beginnenden Uran-Radium-Reihe, 207Pb ist das Ende der beim 235U beginnenden Uran-Actinium-Reihe und 208Pb das Ende der beim 244Pu bzw. 232Th beginnenden Thorium-Reihe. Durch diese Zerfallsreihen kommt es zu dem Effekt, dass das Verhältnis der Bleiisotope in einer Probe bei Ausschluss eines stofflichen Austausches mit der Umwelt zeitlich nicht konstant ist. Dies kann zur Altersbestimmung durch die Uran-Blei- bzw. Thorium-Blei-Methode genutzt werden, die auf Grund der langen Halbwertszeiten der Uran- und Thoriumisotope im Gegensatz zur Radiokarbonmethode gerade zur Datierung von Millionen Jahre alten Proben tauglich ist. Außerdem führt der Effekt zu differenzierten Isotopensignaturen im Blei aus verschiedenen Lagerstätten, was zum Herkunftsnachweis herangezogen werden kann.
Weiterhin existieren noch 33 instabile Isotope und 13 instabile Isomere von 178Pb bis 215Pb,[53] die entweder künstlich hergestellt wurden oder in den Zerfallsreihen des Urans bzw. des Thoriums vorkommen, wie etwa 210Pb in der Uran-Radium-Reihe. Das langlebigste Isotop unter ihnen ist 205Pb mit einer Halbwertszeit von 153 Millionen Jahren.
Verwendung
Die größten Bleiverbraucher sind die USA, Japan, Deutschland und die Volksrepublik China. Der Verbrauch ist stark von der Konjunktur in der Automobilindustrie abhängig, in deren Akkumulatoren etwa 60 % des Weltbedarfs an Blei verwendet werden. Weitere 20 % werden in der chemischen Industrie verarbeitet.
Strahlenabschirmung
Wegen seiner hohen Atommasse eignet sich Blei in ausreichend dicken Schichten oder Blöcken zur Abschirmung gegen Gamma- und Röntgenstrahlung; es absorbiert Röntgen- und Gammastrahlung sehr wirksam. Blei ist hierfür billiger und leichter zu verarbeiten, etwa als weiches Blech, als noch „atom-schwerere“, dichtere Metalle. Deshalb wird es ganz allgemein im Strahlenschutz (z. B. Nuklearmedizin, Radiologie, Strahlentherapie) zur Abschirmung benutzt. Ein Beispiel ist die Bleischürze, welche Ärzte und Patienten bei Röntgenaufnahmen tragen. Bleiglas wird ebenfalls zum Strahlenschutz verwendet.
Im Krankenhausbereich ist als technische Angabe bei baulichen Einrichtungen mit Abschirmfunktion wie Wänden, Türen, Fenster der Bleidickegleichwert üblich und oft angeschrieben, um die Wirksamkeit von Strahlenschutz und Strahlenbelastung berechnen zu können.
Blei wird deshalb z. B. auch für Streustrahlenraster eingesetzt.
Einen besonderen Anwendungsfall stellt die Abschirmung von Gamma-Spektrometern für die Präzisionsdosimetrie dar. Hierfür wird Blei mit möglichst geringer Eigen-Radioaktivität benötigt. Der natürliche Gehalt an radioaktivem 210Pb wirkt sich störend aus. Er fällt umso niedriger aus, je länger der Verhüttungszeitpunkt zurückliegt, denn mit der Verhüttung werden die Mutter-Nuklide aus der Uran-Radium-Reihe (Begleiter im Erz) vom Blei abgetrennt. Das 210Pb zerfällt daher vom Zeitpunkt der Verhüttung an mit seiner Halbwertszeit von 22,3 Jahren, ohne dass neues nachgebildet wird. Deshalb sind historische Bleigegenstände wie etwa Trimmgewichte aus gesunkenen Schiffen oder historische Kanonenkugeln zur Gewinnung von strahlungsarmem Blei für die Herstellung solcher Abschirmungen begehrt. Auch gibt es noch andere Forschungseinrichtungen, die aus ähnlichen Gründen dieses alte Blei benötigen.[54]
Metall
Blei wird vorwiegend als Metall oder Legierung verwendet. Im Gegensatz zu früheren Zeiten, als Blei eines der wichtigsten und meistverwendeten Metalle war, versucht man heute, Blei durch andere, ungiftige Elemente oder Legierungen zu ersetzen. Wegen seiner wichtigen Eigenschaften, vor allem seiner Korrosionsbeständigkeit und hohen Dichte sowie seiner einfachen Herstellung und Verarbeitung, hat es aber immer noch eine große Bedeutung in der Industrie. Elemente mit einer ähnlichen oder noch höheren Dichte beispielsweise sind entweder noch problematischer (Quecksilber, Uran) oder sehr selten und teuer (Wolfram, Gold, Platin).
Elektrotechnik
Das meiste Blei wird heutzutage für chemische Energiespeicher in Form von Bleiakkumulatoren (z. B. für Autos) verwendet. Ein Autoakku enthält eine Blei- und eine Blei(IV)-oxid-Elektrode sowie verdünnte Schwefelsäure (37 %) als Elektrolyt. Aus den bei der elektrochemischen Reaktion entstehenden Pb2+-Ionen bildet sich in der Schwefelsäure unlösliches Blei(II)-sulfat. Wiederaufladen ist durch die Rückreaktion von Blei(II)-sulfat zu Blei und Blei(IV)-oxid möglich. Ein Vorteil des Bleiakkumulators ist die hohe Nennspannung einer Akkuzelle von 2,06 Volt.
Maschinenbau
Da Blei eine hohe Dichte besitzt, wird es als Gewicht benutzt. Umgangssprachlich gibt es deshalb die Bezeichnung „bleischwer“ für sehr schwere Dinge. Bleigewichte wurden unter anderem als Ausgleichsgewichte zum Auswuchten von Autorädern benutzt. Dies ist aber seit dem 1. Juli 2003 bei PKW-Neuwagen und seit dem 1. Juli 2005 bei allen PKW (bis 3,5 t) verboten; die Bleigewichte sind durch Zink- oder Kupfergewichte ersetzt worden. Weitere Anwendungen unter Ausnutzung der hohen Dichte sind: Bleiketten zur Straffung von Gardinen und Tauchgewichte, um beim Tauchen den Auftrieb von Taucher und Ausrüstung auszugleichen. Außerdem wird Blei als Schwingungsdämpfer in vibrationsempfindlichen (Auto-)Teilen, zur Stabilisierung von Schiffen und für Sonderanwendungen des Schallschutzes verwendet.
Apparatebau
Blei ist durch Passivierung chemisch sehr beständig und widersteht u. a. Schwefelsäure und Brom. Daher wird es als Korrosionsschutz im Apparate- und Behälterbau eingesetzt. Eine früher wichtige Anwendung war das Bleikammerverfahren zur Schwefelsäureherstellung, da damals Blei das einzige bekannte Metall war, das den Schwefelsäuredämpfen widerstand. Auch frühere Anlagen und Räume zur Herstellung von Nitroglyzerin wurden an Boden und Wand mit Blei ausgekleidet.[55] Blei wurde auch häufig zur Ummantelung von Kabeln zum Schutz vor Umwelteinflüssen benutzt, beispielsweise bei Telefonkabeln. Heute ist Blei dabei meist durch Kunststoffe, z. B. PVC, abgelöst worden, wird aber bis heute bei Kabeln in Raffinerien eingesetzt, da es auch gegen Kohlenwasserstoffe unempfindlich ist.
Bauwesen

Da Blei leicht zu bearbeiten und zu gießen ist, wurde Blei in der Vergangenheit häufig für metallische Gegenstände verwendet. Zu den wichtigsten Bleiprodukten zählten u. a. Rohre. Aufgrund der Toxizität der aus dem Blei evtl. entstehenden chemischen Verbindungen (Bleivergiftung) kommen Bleirohre aber seit den 1970er Jahren nicht mehr zum Einsatz. Trotz einer gebildeten Karbonatschicht in den Rohren löst sich das Blei weiterhin im Trinkwasser. Erfahrungsgemäß wird bereits nach wenigen Metern der Grenzwert der geltenden Trinkwasserverordnung nicht mehr eingehalten.

Weitere Verwendung im Hochbau fand Blei zur Verbindung von Steinen durch eingegossene Metallklammern oder Metalldübel, etwa um Scharniere an einen steinernen Türstock zu befestigen oder ein Eisengeländer an einer Steintreppe. Diese Verbleiungstechnik ist in der Restaurierung noch weit verbreitet. So an der Turmspitze im Wiener Stephansdom oder der Brücke in Mostar. Auch für Fensterfassungen, z. B. an mittelalterlichen Kirchenfenstern, wurden oft Bleiruten verwendet. Blei (Walzblei) findet auch Verwendung als Dachdeckung (z. B. die Hauptkuppeln der Hagia Sophia) oder für Dachabschlüsse (z. B. bei den berühmten „Bleikammern“, dem ehemaligen Gefängnis von Venedig und im Kölner Dom) sowie zur Einfassung von Dachöffnungen. Auch wurde früher Farben und Korrosionsschutzanstrichen Blei beigemischt, insbesondere bei Anstrichen für Metalloberflächen. Noch heute stellt Blei bei Gebäuden im Bestand einen zu berücksichtigenden Gebäudeschadstoff dar, da es in vielen älteren Bau- und Anlageteilen weiterhin zu finden ist.
Pneumatiksteuerungen
Ein spezieller Anwendungsbereich von Bleirohren waren ab dem späten 19. Jahrhundert pneumatische Steuerungen für Orgeln (pneumatische Traktur), pneumatische Kunstspielklaviere und, als ein spezieller und sehr erfolgreicher Einsatzfall, die Steuerung der Link-Trainer, des ersten weitverbreiteten Flugsimulators. Die Vorteile von Bleirohren (billig, stabil, flexibel, kleiner Platzbedarf für die nötigen umfangreichen Rohrbündel, lötbar, mechanisch leicht zu verarbeiten, langlebig) waren dafür ausschlaggebend.
Militärtechnik
Ein wichtiger Abnehmer für Bleimetall war und ist das Militär. Blei dient als Grundstoff für Geschosse, sowohl für Schleudern als auch für Feuerwaffen. In sogenannten Kartätschen wurde gehacktes Blei verschossen. Der Grund für die Verwendung von Blei waren und sind einerseits die hohe Dichte und damit hohe Durchschlagskraft und andererseits die leichte Herstellung durch Gießen. Heutzutage wird das Blei meist von einem Mantel (daher „Mantelgeschoss“) aus einer Kupferlegierung (Tombak) umschlossen. Vorteile sind vor allem eine höhere erreichbare Geschossgeschwindigkeit, bei der ein nicht ummanteltes Bleigeschoss aufgrund seiner Weichheit nicht mehr verwendet werden kann, und die Verhinderung von Bleiablagerungen im Inneren des Laufes einer Feuerwaffe. Bleifreie Munition ist jedoch auch verfügbar.
Karosseriereparatur
Vor dem Aufkommen moderner 2-Komponenten-Spachtelmasse wurden Blei oder Blei-Zinn-Legierungen aufgrund ihres geringen Schmelzpunktes zum Ausfüllen von Schad- und Reparaturstellen an Fahrzeugkarosserien genutzt. Dazu wurde das Material mit Lötbrenner und Flussmittel auf die Schadstelle aufgelötet. Anschließend wurde die Stelle wie beim Spachteln verschliffen. Dies hat den Vorteil, dass das Blei im Gegensatz zu Spachtelmasse eine feste Bindung mit dem Blech eingeht und bei Temperaturschwankungen auch dessen Längenausdehnung mitmacht. Da die entstehenden Dämpfe und Stäube giftig sind, wird dieses Verfahren heute außer bei der Restaurierung historischer Fahrzeuge kaum noch verwendet.
Brauchtum
Ein alter Orakel-Brauch, den bereits die Römer pflegten, ist das Bleigießen, bei dem flüssiges Blei (heutzutage auch in Legierung mit Zinn) in kaltem Wasser zum Erstarren gebracht wird. Anhand der zufällig entstehenden Formen sollen Weissagungen über die Zukunft getroffen werden. Heute wird der Brauch noch gerne zu Neujahr geübt, um einen (nicht unbedingt ernst genommenen) Ausblick auf das kommende Jahr zu bekommen.
Wassersport
Beim Tauchen werden Bleigewichte zum Tarieren verwendet; der hohe Dichteüberschuss (gut 10 g/cm³) gegenüber Wasser liefert kompakt den Abtrieb, so dass ein Taucher auch in geringer Wassertiefe schweben kann. Für die Verwendung von Blei als Gewicht ist ferner der vergleichsweise niedrige Preis begünstigend: Ausgehend von den Weltmarktpreisen für Metalle vom Juli 2013 hat Blei ein hervorragendes Preis-Gewichts-Verhältnis. Die Verwendung erfolgt in Form von Platten an den Schuhsohlen eines Panzertauchanzugs, als abgerundete Blöcke aufgefädelt auf einem breiten Hüftgurt oder – modern – als Schrotkugeln in Netzen in den Taschen einer Tarierweste. Öffnen der Gurtschnalle oder der Taschen (unten) erlaubt es, den Ballast notfalls rasch abzuwerfen.
Der Kielballast von Segelyachten besteht bevorzugt aus Blei. Eisenschrott ist zwar billiger, aber auch weniger dicht, was bei den heute üblichen schlanken Kielen nicht optimal ist. Neben der Dichte ist ein weiter Vorteil, dass Blei nicht rostet und daher auch bei einem Schaden in der Kielverkleidung nicht degeneriert.
Legierungsbestandteil
Blei wird auch in einigen wichtigen Legierungen eingesetzt. Durch das Zulegieren weiterer Metalle ändern sich je nach Metall die Härte, der Schmelzpunkt oder die Korrosionsbeständigkeit des Materials. Die wichtigste Bleilegierung ist das Hartblei, eine Blei-Antimon-Legierung, die erheblich härter und damit mechanisch belastbarer als reines Blei ist. Spuren einiger anderer Elemente (Kupfer, Arsen, Zinn) sind meist in Hartblei enthalten und beeinflussen ebenfalls maßgeblich die Härte und Festigkeit. Verwendung findet Hartblei beispielsweise im Apparatebau, bei dem es neben der chemischen Beständigkeit auch auf Stabilität ankommt.

Eine weitere Bleilegierung ist das Letternmetall, eine Bleilegierung mit 60–90 % Blei, die als weitere Bestandteile Antimon und Zinn enthält. Es wird für Lettern im klassischen Buchdruck verwendet, spielt heute allerdings in der Massenproduktion von Druckgütern keine Rolle mehr, sondern allenfalls für bibliophile Editionen. Daneben wird Blei in Lagern als so genanntes Lagermetall verwendet.
Blei spielt eine Rolle als Legierungsbestandteil in Weichlot, das unter anderem in der Elektrotechnik Verwendung findet. In Weichloten ist Zinn neben Blei der wichtigste Bestandteil. Die Verwendung von Blei in Loten betrug 1998 weltweit etwa 20.000 Tonnen. Die EG-Richtlinie 2002/95/EG RoHS verbannt Blei seit Juli 2006 weitgehend aus der Löttechnik. Für spezielle Anwendungen gibt es jedoch eine Reihe von Ausnahmen.[56]
Blei ist ein häufiger Nebenbestandteil in Messing. Dort hilft ein Bleianteil (bis 3 %), die Zerspanbarkeit zu verbessern. Auch in anderen Legierungen, wie z. B. Rotguss, kann Blei als Nebenbestandteil enthalten sein. Daher ist es ratsam, nach längerem Stehen das erste aus Messingarmaturen kommende Wasser wegen etwas herausgelösten Bleis eher nicht zu trinken.[57]
Bleifrei
Bleihaltige Produkte und Anwendungen werden entweder vollständig ersetzt (wie Tetraethylblei im Benzin) oder der Bleigehalt durch Grenzwerte auf einen der technischen Verunreinigung entsprechenden Wert beschränkt (z. B. Zinn und Lot). Diese Produkte werden gern „bleifrei“ genannt. Grenzwerte gibt es u. a. in der Gesetzgebung um die so genannte RoHS (Richtlinie 2011/65/EU), die 1000 ppm (0,1 %) vorsieht. Strenger ist der Grenzwert für Verpackungen mit 100 ppm (Richtlinie 94/62/EG).
Der politische Wille zum Ersetzen des Bleis gilt auch dort, wo die Verwendung aufgrund der Eigenschaften technisch oder wirtschaftlich interessant wäre, die Gesundheitsgefahr gering und ein Recycling mit sinnvollem Aufwand möglich wäre (z. B. Blei als Dacheindeckung).
Bleiglas
Wegen der abschirmenden Wirkung des Bleis besteht der Konus von Kathodenstrahlröhren (d. h. der „hintere“ Teil der Röhre) für Fernseher, Computerbildschirme etc. aus Bleiglas. Das Blei absorbiert die in Kathodenstrahlröhren zwangsläufig entstehenden weichen Röntgenstrahlen. Für diesen Verwendungszweck ist Blei noch nicht sicher zu ersetzen, daher wird die RoHS-Richtlinie hier nicht angewendet. Glas mit sehr hohem Bleigehalt wird wegen dieser Abschirmwirkung auch in der Radiologie sowie im Strahlenschutz (zum Beispiel in Fensterscheiben) verwendet. Ferner wird Bleiglas wegen seines hohen Brechungsindexes für hochwertige Glaswaren als sogenanntes Bleikristall verwendet.
Toxizität
Elementares Blei kann vor allem in Form von Staub über die Lunge aufgenommen werden. Dagegen wird Blei kaum über die Haut aufgenommen. Daher ist elementares Blei in kompakter Form für den Menschen nicht giftig. Metallisches Blei bildet an der Luft eine dichte, schwer wasserlösliche Schutzschicht aus Bleicarbonat. Toxisch sind gelöste Bleiverbindungen sowie Bleistäube, die durch Verschlucken oder Einatmen in den Körper gelangen können. Besonders toxisch sind Organobleiverbindungen, z. B. Tetraethylblei, die stark lipophil sind und rasch über die Haut aufgenommen werden.
Seit 2006 werden einatembare Fraktionen von Blei und anorganische Bleiverbindungen von der MAK-Kommission der Deutschen Forschungsgemeinschaft als krebserzeugend eingestuft:[58]
- Bleiarsenat wird aufgrund seines Arsen- und Bleichromat aufgrund seines Chrom(VI)-Gehaltes in der Kategorie 1 (Substanzen, die sich beim Menschen oder im Tierversuch als krebserzeugend erwiesen haben),
- Blei und andere anorganische Bleiverbindungen außer Bleiarsenat und Bleichromat in der Kategorie 4 (Stoffe, mit krebserzeugenden Eigenschaften).
Blei reichert sich selbst bei Aufnahme kleinster Mengen, die über einen längeren Zeitraum stetig eingenommen werden, im Körper an, da es z. B. in Knochen eingelagert und nur sehr langsam wieder ausgeschieden wird. Blei kann so eine chronische Vergiftung hervorrufen, die sich unter anderem in Kopfschmerzen, Müdigkeit, Abmagerung und Defekten der Blutbildung, des Nervensystems und der Muskulatur zeigt. Bleivergiftungen sind besonders für Kinder und Schwangere gefährlich. Es kann auch Fruchtschäden und Zeugungsunfähigkeit bewirken. Im Extremfall kann die Bleivergiftung zum Tod führen. Die Giftigkeit von Blei beruht unter anderem auf einer Störung der Hämoglobinsynthese. Es hemmt mehrere Enzyme und behindert dadurch den Einbau des Eisens in das Hämoglobinmolekül. Dadurch wird die Sauerstoff-Versorgung der Körperzellen gestört.
Bleiglas und Bleiglasur eignen sich nicht für Ess- und Trinkgefäße, da Essig(säure) Blei als wasserlösliches Bleiazetat aus dem Silikatverbund herauslösen kann. Als Automotoren noch mit Benzin mit Bleitetraethyl liefen, war die Vegetation in der Nähe von Straßen und in den Städten mit Blei, als Oxidstaub, belastet. Raue und vertiefte Oberflächen, etwa die Einziehung rund um den Stängel eines Apfels, sind Fallen für Staub.
Bleibelastung der Umwelt
Luft
Die Bleibelastung der Luft wird hauptsächlich durch bleihaltige Stäube verursacht: Hauptquellen sind die Blei-erzeugende Industrie, die Verbrennung von Kohle und bis vor einigen Jahren vor allem der Autoverkehr durch die Verbrennung bleihaltiger Kraftstoffe in Automotoren – durch Reaktion mit dem Benzin zugesetzten halogenierten Kohlenwasserstoffen entstand aus dem zugesetzten Bleitetraethyl neben geringeren Mengen an Blei(II)-chlorid und Blei(II)-bromid vor allem Blei und Blei(II)-oxid. Infolge des Verbotes bleihaltiger Kraftstoffe ist die entsprechende Luftbelastung in den letzten Jahren deutlich zurückgegangen.
Am höchsten ist die Bleibelastung durch Bleistäube derzeit bei der Arbeit in Blei-produzierenden und -verarbeitenden Betrieben. Auch beim Reinigen und Entfernen alter Mennige-Anstriche durch Sandstrahlen entsteht Bleistaub. Die bei der Bleiraffination und der Verbrennung von Kohle entstehenden Bleioxidstäube konnten durch geeignete Filter verringert werden. Eine weitere Quelle, die mengenmäßig aber kaum ins Gewicht fällt, ist die Verbrennung von Hausmüll in Müllverbrennungsanlagen.
Sport- und andere Schützen sind erheblichen Belastungen durch im Mündungs- bzw. Zündfeuer enthaltene (Schwer)metalle ausgesetzt, darunter neben Antimon, Kupfer und Quecksilber eben auch Blei;[59] Vorsorge kann durch den Betrieb entsprechender Absauganlagen auf Schießständen sowie durch den Gebrauch bleifreier Munition getroffen werden.[60]
Boden
Auch Böden können mit Blei belastet sein. Der mittlere Bleigehalt der kontinentalen Erdkruste liegt bei 15 mg/kg. Böden enthalten von Natur aus zwischen 2 und 60 mg/kg Blei; wenn sie aus bleierzhaltigen Gesteinen entstanden sind, kann der Gehalt deutlich höher sein.[61] Der Großteil der Bleibelastung von Böden ist anthropogen, die Quellen dafür sind vielfältig. Der Großteil des Eintrags erfolgt über Bleistäube aus der Luft, welche mit dem Regen oder durch trockene Deposition in die Böden gelangen. Für Deutschland und das Jahr 2000 wurde der atmosphärische Eintrag in Böden auf 571 t Blei/Jahr geschätzt. Eine weitere Quelle ist belasteter Dünger, sowohl Mineraldünger (136 t Pb/a), insbesondere Ammonsalpeter, als auch Wirtschaftsdünger (182 t Pb/a). Klärschlämme (90 t Pb/a) und Kompost (77 t Pb/a) tragen ebenfalls zur Bleibelastung der Böden bei.[62] Ein erheblicher Eintrag erfolgt auch durch Bleischrot-Munition.[63][64] Bei Altlasten, wie z. B. an ehemaligen Standorten von bleiproduzierenden Industriebetrieben oder in der Umgebung von alten bleiummantelten Kabeln, kann der Boden ebenfalls eine hohe Bleibelastung aufweisen. Eine besonders große Bleiverseuchung hat beispielsweise im Ort Santo Amaro da Purificação (Brasilien) zu hohen Belastungen bei Kindern geführt[65].
Wasser
Die Bleibelastung der Gewässer resultiert hauptsächlich aus dem Ausschwemmen von Blei aus belasteten Böden. Dazu tragen auch geringe Mengen bei, die der Regen aus Bleiwerkstoffen wie Dachplatten löst. Die direkte Verschmutzung von Gewässern durch die Bleiindustrie und den Bleibergbau spielt (zumindest in Deutschland) auf Grund des Baus von Kläranlagen fast keine Rolle mehr. Der Jahreseintrag von Blei in Gewässer ist in Deutschland von ca. 900 t im Jahr 1985 auf ungefähr 300 t im Jahr 2000 zurückgegangen.[66]
In Deutschland beträgt der Grenzwert im Trinkwasser seit dem 1. Dezember 2013 10 µg/l (früher 25 µg/l)[29]; die Grundlage der Messung ist eine für die durchschnittliche wöchentliche Wasseraufnahme durch Verbraucher repräsentative Probe (siehe Trinkwasserverordnung).
Nahrung
Durch die Bleibelastung von Luft, Boden und Wasser gelangt das Metall über Pilze, Pflanzen und Tiere in die Nahrungskette des Menschen. Besonders hohe Bleibelastungen können in verschiedenen Pilzen enthalten sein. Auf den Blättern von Pflanzen lagert sich Blei als Staub ab, das war charakteristisch für die Umgebung von Straßen mit viel Kfz-Verkehr, als Benzin noch verbleit wurde. Dieser Staub kann durch sorgfältiges Waschen entfernt werden. Zusätzliche Quellen können bleihaltige Munition bei gejagten Tieren sein. Blei kann auch aus bleihaltigen Glasuren von Keramikgefäßen in Lebensmittel übergehen. In frischem Obst und Gemüse ist in den allermeisten Fällen Blei und Cadmium nicht oder nur in sehr geringen Spuren nachweisbar.[67]
Wasserleitungen aus Bleirohren können das Trinkwasser belasten. Sie sind in Deutschland erst seit den 1970er Jahren nicht mehr verbaut worden. Besonders in Altbauten in einigen Regionen Nord- und Ostdeutschlands sind Bleirohre immer noch anzutreffen. Bei über 5 % der Proben des Wassers aus diesen Gebäuden lagen die Bleiwerte des Leitungswassers laut Stiftung Warentest über dem aktuellen gesetzlichen Grenzwert.[68] Gleiches gilt für Österreich und betrifft Hauszuleitungen der Wasserversorgers und Leitungen im Haus, die Sache des Hauseigentümers sind. Aus bleihaltigem Essgeschirr kann Blei durch saure Lebensmittel (Obst, Wein, Gemüse) herausgelöst werden.
Wasserleitungsarmaturen (Absperrhähne, Formstücke, Eckventil, Mischer) sind meist aus Messing oder Rotguss. Messing wird für gute Zerspanbarkeit 3 % Blei zugesetzt, Rotguss enthält 4–7 %. Ob Blei- und andere Schwermetallionen (Cu, Zn, Ni) in relevantem Ausmaß ins Wasser übertreten, hängt von der Wasserqualität ab: Wasserhärte, pH-Wert, Sauerstoff, Salzgehalt. Mit 2013 wurde der Grenzwert für den Bleigehalt im Trinkwasser herabgesetzt auf 0,01 mg/L.[69][70] Grundsätzlich kann nach längerem Stehen des Wassers in der Leitung, etwa über Nacht, durch Laufenlassen der Wasserleitung von etwa einer Minute (Spülen) vor der Entnahme für Trinkwasserzwecke der Gehalt aller aus der Leitungswandung eingewanderten Ionen reduziert werden.
Analytik
Nachweis durch Kristallisation
Bleiionen können in einer mikroskopischen Nachweisreaktion als Blei(II)-iodid dargestellt werden. Dabei wird die Probe in verdünnter Salzsäure gelöst und vorsichtig bis zur Kristallisation eingedampft. Der Rückstand wird mit einem Tropfen Wasser aufgenommen und anschließend mit einem Kristall eines wasserlöslichen Iodids, z. B. Kaliumiodid (KI), versetzt. Es entstehen nach kurzer Zeit mikroskopisch kleine, gelbe, hexagonale Blättchen des Blei(II)-iodids.
Qualitativer Nachweis im Trennungsgang
Da Blei nach Zugabe von HCl nicht quantitativ als PbCl2 ausfällt, kann es sowohl in der HCl-Gruppe als auch in der H2S-Gruppe nachgewiesen werden. Das PbCl2 kann sowohl durch Zugabe von Kaliumiodid gemäß obiger Reaktion als gelbes PbI2 gefällt werden, als auch mit K2Cr2O7 als gelbes Bleichromat, PbCrO4.
Nach Einleiten von H2S in die salzsaure Probe fällt zweiwertiges Blei in Form von schwarzem PbS aus. Dieses wird nach Digerieren mit (NH4)SX und Zugabe von 4 M HNO3 als PbI2 oder PbCrO4 nachgewiesen.[71]
Instrumentelle quantitative Analytik des Bleis
Für die Spurenanalytik von Blei und seinen Organoderivaten steht eine Reihe von Methoden zur Verfügung. Allerdings werden in der Literatur laufend neue bzw. verbesserte Verfahren vorgestellt, auch im Hinblick auf die oft erforderliche Vorkonzentrierung. Ein nicht zu unterschätzendes Problem besteht in der Probenaufarbeitung.
Atomabsorptionsspektrometrie (AAS)
Unter den verschiedenen Techniken der AAS liefert die Quarzrohr- und die Graphitrohrtechnik die besten Ergebnisse für die Spurenanalytik von Bleiverbindungen. Häufig wird Blei mit Hilfe von NaBH4 in das leicht flüchtige Bleihydrid, PbH2, überführt. Dieses wird in eine Quarzküvette geleitet und anschließend elektrisch auf über 900 °C erhitzt. Dabei wird die Probe atomisiert und es wird unter Verwendung einer Hohlkathodenlampe die Absorbanz bei 283,3 nm gemessen. Es wurde eine Nachweisgrenze von 4,5 ng/ml erzielt. Gerne wird in der AAS auch eine Luft-Acetylenfackel (F-AAS) oder mikrowelleninduziertes Plasma (MIP-AAS) zur Atomisierung eingesetzt.[72]
Atomemissionsspektrometrie (AES)
In der AES haben sich das mikrowelleninduzierte Plasma (MIP-AES) und das induktiv gekoppelte Argon-Plasma (ICP-AES) zur Atomisierung bewährt. Die Detektion findet bei den charakteristischen Wellenlängen 283,32 nm und 405,78 nm statt. Mit Hilfe der MIP-AES wurde für Trimethylblei, (CH3)3Pb+, eine Nachweisgrenze von 0,19 pg/g ermittelt.[73] Die ICP-AES ermöglicht eine Nachweisgrenze für Blei in Trinkwasser von 15,3 ng/ml.[74][75]
Massenspektrometrie (MS)
In der Natur treten für Blei insgesamt vier stabile Isotope mit unterschiedlicher Häufigkeit auf. Für die Massenspektrometrie wird häufig das Isotop 206Pb genutzt. Mit Hilfe der ICP-Quadrupol-MS konnte dieses Isotop im Urin mit einer Nachweisgrenze von 4,2 pg/g bestimmt werden.[76]
Photometrie
Die am weitesten verbreitete Methode zur photometrischen Erfassung von Blei ist die sog. Dithizon-Methode. Dithizon ist ein zweizähniger, aromatischer Ligand und bildet bei pH 9–11,5 mit Pb2+-Ionen einen roten Komplex dessen Absorbanz bei 520 nm (ε = 6,9·104 l/mol·cm) gemessen wird. Bismut und Thallium stören die Bestimmung und sollten vorher quantitativ gefällt oder extrahiert werden.[77][78][79]
Voltammetrie
Für die elektrochemische Bestimmung von Spuren von Blei eignet sich hervorragend die subtraktive anodische Stripping-Voltammetrie (SASV). Dabei geht der eigentlichen voltammetrischen Bestimmung eine reduktive Anreicherungsperiode auf einer rotierenden Ag-Disk-Elektrode voraus. Es folgt die eigentliche Bestimmung durch Messung des Oxidationsstroms beim Scannen eines Potentialfensters von −800 mV bis −300 mV. Anschließend wird die Messung ohne vorangehende Anreicherung wiederholt und die so erhaltene Kurve von der ersten Messung subtrahiert. Die Höhe des verbleibenden Oxidationspeaks bei −480 mV korreliert mit der Menge an vorhandenem Blei. Es wurde eine Nachweisgrenze von 50 pM Blei in Wasser ermittelt.[80][81]
Bleiverbindungen


_sulfate.jpg.webp)
→ Kategorie:Bleiverbindung
Bleiverbindungen kommen in den Oxidationsstufen +II und +IV vor. Aufgrund des relativistischen Effekts ist die Oxidationsstufe +II dabei – im Gegensatz zu den leichteren Homologen der Gruppe 14, wie Kohlenstoff und Silicium – stabiler als die Oxidationsstufe +IV. Der Sachverhalt der Bevorzugung der um 2 erniedrigten Oxidationsstufe, findet sich in analoger Weise auch in anderen Hauptgruppen und wird Effekt des inerten Elektronenpaares genannt. Blei(IV)-Verbindungen sind deshalb starke Oxidationsmittel. In intermetallischen Verbindungen des Bleis (Plumbide: MxPby), vor allem mit Alkali- und Erdalkalimetallen, nimmt es auch negative Oxidationsstufen bis −IV an. Viele Bleiverbindungen sind Salze, es gibt aber auch organische Bleiverbindungen, die kovalent aufgebaut sind. Ebenso wie bei Bleimetall wird heutzutage versucht, Bleiverbindungen durch andere, ungiftige Verbindungen zu substituieren. So wurde „Bleiweiß“ (basisches Blei(II)-carbonat) als Weißpigment durch Titandioxid ersetzt.
Oxide
- Blei(II)-oxid PbO tritt in zwei Modifikationen, als rote Bleiglätte und als gelbes Massicolit, auf. Beide Modifikationen wurden früher als Pigmente verwendet. Es dient als Ausgangsstoff für andere Bleiverbindungen.
- Blei(II,IV)-oxid Pb3O4, auch Mennige genannt, ist ein leuchtend rotes Pulver, das früher verbreitet als Pigment und Rostschutzfarbe verwendet wurde. Es ist in Deutschland, seit 2005 auch in der Schweiz, als Rostschutz verboten. Pb3O4 wird in der Glasherstellung für die Bereitung von Bleikristall verwendet.
- Blei(IV)-oxid PbO2 ist ein schwarz-braunes Pulver, das als Elektrodenmaterial in Bleiakkumulatoren und als Oxidationsmittel in der chemischen Industrie (z. B. Farbstoffherstellung) verwendet wird.
Schwefelverbindungen
- Blei(II)-sulfid PbS ist als Galenit (Bleiglanz) das wichtigste Bleimineral. Es dient v. a. zur Herstellung metallischen Bleis.
- Blei(II)-sulfat PbSO4 kommt als Anglesit ebenfalls in der Natur vor und wurde als Weißpigment verwendet.
Weitere Bleisalze
- Blei(II)-acetat Pb(CH3COO)2 · 3H2O, auch Bleizucker genannt, war früher ein Zuckerersatzstoff z. B. für das Süßen von Wein. Aufgrund der Giftigkeit von Bleizucker starben früher Menschen an solcherart vergiftetem Wein.
- Blei(IV)-acetat (Pb(CH3COO)4) bildet farblose, an feuchter Luft nach Essig riechende Kristallnadeln. Mit Wasser zersetzt es sich zu Blei(IV)-oxid und Essigsäure. Es dient in der Organischen Chemie als starkes Oxidationsmittel.
- Bleiweiß, basisches Bleicarbonat 2 PbCO3 · Pb(OH)2, war früher ein beliebtes Weißpigment; es ist heute meist durch Titanoxid abgelöst.
- Blei(II)-nitrat Pb(NO3)2 ist ein giftiges, weißes Pulver, das für Sprengstoffe und zur Herstellung von Streichhölzern verwendet wurde.
- Blei(II)-chlorid PbCl2 dient als Ausgangsstoff zur Herstellung von Bleichromat.
- Blei(II)-chromat PbCrO4 ist ein orange-gelbes Pulver, welches früher als Pigment diente und heute wegen seiner Giftigkeit nicht mehr eingesetzt wird.
- Bleiazid Pb(N3)2 ist ein wichtiger Initialsprengstoff.
Organische Bleiverbindungen
Organische Bleiverbindungen liegen fast immer in der Oxidationsstufe +4 vor. Deren bekannteste ist Tetraethylblei Pb(C2H5)4 (TEL), eine giftige Flüssigkeit, die als Antiklopfmittel Benzin zugesetzt wurde. Heute wird Tetraethylblei nur noch in Flugbenzin verwendet.
Literatur
- Gerhart Jander, Ewald Blasius: Einführung in das anorganisch-Chemische Praktikum. 14. Auflage. S. Hirzel, Leipzig 1995, ISBN 3-7776-0672-3.
- William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5.
- Stefan Meier: Blei in der Antike. Bergbau, Verhüttung, Fernhandel. Dissertation. Zürich, Universität 1995.
- Raymund Gottschalk, Albrecht Baumann: Material provenance of late-Roman lead coffins in the Rheinland, Germany. In: European Journal of Mineralogy. 13, Stuttgart 2001, S. 197–200.
- Heiko Steuer, Ulrich Zimmermann: Alter Bergbau in Deutschland. (= Archäologie in Deutschland. Sonderheft). Konrad Theiss, Stuttgart 1993, ISBN 3-8062-1066-7.
Weblinks
- Mineralienatlas:Blei (Wiki)
- MATERIAL ARCHIV: Blei – Umfangreiche Materialinformationen und Bilder
- Lead Poisoning: A Historical Perspective – Historische Perspektive zur Bleivergiftung (englisch)
- Untersuchung von Batterieverwertungsverfahren und -anlagen hinsichtlich ökologischer und ökonomischer Relevanz unter besonderer Berücksichtigung des Cadmiumproblems (Memento vom 13. April 2012 im Internet Archive) (2001, PDF, S. 215–226; 1,37 MB)
- TRGS 505-Technische Regeln für Gefahrstoffe-Blei (PDF; 186 kB)
- Einträge von Blei in die Umwelt (PDF; 3,9 MB)
- Umweltbundesamt: Stoffmonografie Blei (1996) (Memento vom 27. September 2007 im Internet Archive) (PDF; 48 kB)
- Molekulare Ursache für Bleivergiftungen
- Lead and Human Health, Environmental Health & Toxicology, Specialized Information Services, National Library of Medicine (en.)
- Blei – Informationen des Bundesamts für Lebensmittelsicherheit und Veterinärwesen
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Blei) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu lead in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu lead bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Blei) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 482.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-142 – 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- C. A. Sutherland, E. F. Milner, R. C. Kerby, H. Teindl, A. Melin, H. M. Bolt: Lead. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2006, doi:10.1002/14356007.a15_193.pub2
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Blei) entnommen.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Blei) entnommen.
- Eintrag zu Lead im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Blei, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 21. April 2020.
- Gmelin-Institut für anorganische Chemie und Grenzg: Blei Teil A 1: Geschichtliches. Springer-Verlag, 2013, ISBN 978-3-662-11844-3, S. 6 (eingeschränkte Vorschau in der Google-Buchsuche).
- Betina Faist: Der Fernhandel des assyrischen Reiches zwischen dem 14. und dem 11. Jahrhundert vor Christus (= Alter Orient und Altes Testament. Band 265). Ugarit Verlag, Münster 2001, S. 45.
- Hans Schwerteck: Blei. In: Der Neue Pauly (DNP). Band 2, Metzler, Stuttgart 1997, ISBN 3-476-01472-X, Sp. 707–709, hier Sp. 707.
- Peter Kritzinger: Ein neues Zeugnis eines alten Bekannten: Bleisiegel, Bleihandel und Bleiproduktion im freien Germanien. In: Marburger Beiträge zur Antiken Handels-, Wirtschafts- und Sozialgeschichte. Band 35, 2017, S. 87–107, hier S. 102 (insbesondere Anm. 55) (online).
- Hans Schwerteck: Blei. In: Der Neue Pauly (DNP). Band 2, Metzler, Stuttgart 1997, ISBN 3-476-01472-X, Sp. 707–709, hier Sp. 708.
- Dietwulf Baatz: Schleudergeschosse aus Blei. Eine waffentechnische Untersuchung. In: Saalburg-Jahrbuch. Band 45, 1990, S. 59–67.
- Vitruv, De architectura 8,6,10–11 (Text: lat. dt.).
- BENZINBLEIGESETZ: BENZINBLEIGESETZ, abgerufen am 24. März 2018
- Bill Bryson: Eine kurze Geschichte von fast allem. Goldmann Verlag, 2011, ISBN 978-3-641-07924-6, S. 219 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Piersig: Blei – Metall der Antike, der Gegenwart, Mit Zukunft, ein Werkstoff Für Technik, Kultur, Kunst. GRIN Verlag, 2011, ISBN 978-3-656-07290-4, S. 8 (eingeschränkte Vorschau in der Google-Buchsuche).
- Bundesanstalt für Arbeitsschutz und Arbeitsmedizin: BAuA – Dokumentationen – Dokumentation des Stakeholder-Workshops „Sanierung von Holzfenstern mit bleihaltigen Anstrichen“ am 16. Februar 2009 – Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, abgerufen am 24. März 2018
- Technische Universität Dresden Fakultät Umweltwissenschaften: Untersuchungen zur Verbreitung bleifreier Jagdmunition – Eine diffusionstheoretische Betrachtung zur Akzeptanz einer potenziellen Umweltinnovation, Dissertation von Jan Engel
- Drucksache 700/17 (Beschluss) 15.12.17 zur Verordnung zur Neuordnung trinkwasserrechtlicher Vorschriften, Entschließung B 4.
- Niedersächsisches Landesgesundheitsamt: Fragen und Antworten zu Blei im Trinkwasser, abgerufen am 21. Januar 2020
- Art. 67 Abs. 1 der Verordnung (EG) Nr. 1907/2006 i. V. m. mit Anhang XVII Nr. 30 zu dieser sogenannten REACH-Verordnung und mit Anhang VI Teil 3 zur Verordnung (EG) Nr. 1272/2008 (die sogenannte CLP-Verordnung). Das Verbot erfolgte durch Aufnahme von Blei als Pulver (Partikelgröße unter 1 mm, Index-Nr. 082-13-00-1) oder massiv (Index-Nr. 082-14-00-7) in die Liste der fortpflanzungsgefährdenden Stoffe (hier der Kategorie 1A) gemäß Tabelle 3 zum zuvor genannten Anhang zur CLP-Verordnung und gemäß Anlage 5 zum zuvor genannten Anhang zur REACH-Verordnung durch die Verordnung (EU) 2017/1510 der Kommission vom 30. August 2017 mit Wirkung ab 1. März 2018. Ein Verstoß gegen dieses Verbot des Inverkehrbringens z. B. durch Verkauf von solchem Blei an „privat“ zum Bleigießen u. ä. ist daher in Deutschland nach § 5 Nr. 20 Chemikalien-Sanktionsverordnung i. V. m. § 27 Chemikaliengesetz eine Straftat (Stand Juli 2019).
- Hans Breuer: Allgemeine und anorganische Chemie. (= dtv-Atlas Chemie. Band 1). 9. Auflage. dtv, München 2000, ISBN 3-423-03217-0, S. 151.
- Fundortliste für gediegen Blei beim Mineralienatlas und bei Mindat
- Lead. In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.): Handbook of Mineralogy, Mineralogical Society of America. 2001 (handbookofmineralogy.org [PDF; 57 kB; abgerufen am 12. Januar 2018]).
- Webmineral – Mineral Species sorted by the element Pb (Lead) (englisch).
- Fraunhofer-Institut: Trends der Angebots- und Nachfragesituation bei mineralischen Rohstoffen. (Memento vom 10. März 2013 im Internet Archive) (PDF, 350 S.; 2,1 MB).
- Friedrich Klockmann: Klockmanns Lehrbuch der Mineralogie. Hrsg.: Paul Ramdohr, Hugo Strunz. 16. Auflage. Enke, Stuttgart 1978, ISBN 3-432-82986-8, S. 396 (Erstausgabe: 1891).
- Richard V. Gaines, H. Catherine W. Skinner, Eugene E. Foord, Brian Mason, Abraham Rosenzweig: Dana’s New Mineralogy. 8. Auflage. John Wiley & Sons, New York (u. a.) 1997, ISBN 0-471-19310-0, S. 5.
- IMA/CNMNC List of Mineral Names; July 2019 (PDF 1,67 MB; Blei (Lead) siehe S. 106)
- IMA/CNMNC List of Mineral Names; 2009 (PDF 1,8 MB, Blei (Lead) siehe S. 161).
- Webmineral – Minerals Arranged by the New Dana Classification. 01.01.01 Gold group
- Bildbeispiele von plattigem und dendritischem Blei bei mindat.org
- Bildbeispiel einer mikroskopischen Aufnahme von oktaedrischen Bleikristallen bei mindat.org
- United States Geological Survey.
- Statistik: Weltweiter Bleiverbrauch bis 2016 | Statistik, abgerufen am 24. März 2018
- Statistik: • Weltweite Bleiproduktion bis 2016 | Statistik, abgerufen am 24. März 2018
- QSL bei berzelius.de (Memento vom 29. September 2007 im Internet Archive)
- Michael Binnewies: Allgemeine und anorganische Chemie. Spektrum, Heidelberg 2004, ISBN 3-8274-0208-5.
- Ralph W. G. Wyckoff: Crystal Structures. 2. Auflage. Band 1. John Wiley & Sons, New York, London, Sydney 1963, S. 3 (im Anhang).
- Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. Chemical-structural Mineral Classification System. 9. Auflage. E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 35.
- Datenblatt Blei (PDF) bei Merck, abgerufen am 23. Februar 2010.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- P. de Marcillac, N. Coron, G. Dambier, J. Leblanc, J.-P. Moalic: Experimental detection of α-particles from the radioactive decay of natural bismuth. In: Nature. 422, 2003, S. 876–878; doi:10.1038/nature01541.
- G. Audi, O. Bersillon, J. Blachot, A.H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729. Amsterdam 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- Neutrino-Jagd, Blei aus antikem Schiff schützt Hightech-Experiment. In: Spiegel Online. 19. März 2010, abgerufen: 19. März 2010.
- F. Scheiding: Über die Schutzmaassregeln bei Herstellung des Nitroglycerins. In: Angewandte Chemie. 3, 20, 1890, S. 609–613; doi:10.1002/ange.18900032002.
- RoHS: Neue Ausnahmen von den Stoffverwendungsgeboten: RoHS: Neue Ausnahmen von den Stoffverwendungsgeboten (Memento vom 24. März 2018 im Internet Archive), abgerufen am 24. März 2018
- Zu viel Blei in Küchenarmaturen. auf: orf.at 19. August 2011, abgerufen am 28. April 2012.
- Ständige Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe: MAK- und BAT-Werte-Liste 2021. 57. Mitteilung. In: Deutsche Forschungsgemeinschaft (Hrsg.): Maximale Arbeitsplatzkonzentrationen und Biologische Arbeitsstofftoleranzwerte. Publisso, 2021, ISBN 978-3-9822007-1-2, doi:10.34865/mbwl_2021_deu.
- Katja Bauer: Giftstoffe auf Schießständen von Elitepolizisten? auf: badische-zeitung.de, 4. Juni 2016, (4. Juni 2016)
- Sportschützen sollen bleifreie Munition benutzen. In: badische-zeitung.de, Panorama. 9. Juni 2016. (11. Juni 2016)
- F. Scheffer, P. Schachtschabel: Lehrbuch der Bodenkunde. 13. Auflage. Enke Verlag, Stuttgart 1992, ISBN 3-432-84772-6, Kap. XXII 4 d.
- Umweltdaten (S. 31). (PDF; 3,9 MB).
- Bleischrot und Umwelt, Nabu; Kreisverband Aachen.
- Jagd mit Bleimunition, SWR.
- Carvalho FM, Neto AM, Peres MF, et al: Intoxicação pelo chumbo: Zinco protoporfirina no sangue de crianças de Santo Amaro da Purificação e de Salvador , J Pediatr (Rio J). 1996;72(5):295‐298. doi:10.2223/jped.629
- Umweltdaten (S. 28 und 35). (PDF; 3,9 MB).
- Schwermetalle in Lebensmitteln: Schwermetalle in Lebensmitteln, abgerufen am 24. März 2018
- Stiftung Warentest warnt vor Blei im Trinkwasser, 19. März 2010, abgerufen am 2. Januar 2013.
- Rotguss kontra Messing. (Memento vom 28. Mai 2013 im Internet Archive) auf: messing-sanitaer.de, abgerufen am 3. Februar 2014.
- Korrosion an metallischen Werkstoffen im Trinkwasser. auf: trinkwasserspezi.de, abgerufen am 3. Februar 2014.
- G. Jander, E. Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. 16. Auflage. S. Hirzel-Verlag, Stuttgart 2005, ISBN 3-7776-1388-6, S. 533, 472, 540–541.
- N. Maleki, A. Safavi, Z. Ramezani: Determination of lead by hydride generation atomic absorption spectrometry (HGAAS) using a solid medium for generating hydride. In: J Anal At Spectrom. 14, 1999, S. 1227–1230; doi:10.1039/A808429G.
- M. Heisterkamp, F. Adams: In situ propylation using sodium tetrapropylborate as a fast and simplified sample preparation for the speciation analysis of organolead compounds using GC-MIP-AES. In: J. Anal. At. Spectrom. 14, 1999, S. 1307–1311; doi:10.1039/A901340G.
- M. Zougagh, A. Garcia de Torres, E. Alonso, J. Pavon: Automatic on line preconcentration and determination of lead in water by ICP-AES using a TS-microcolumn. In: Talanta. 62, 2004, S. 503–510; doi:10.1016/j.talanta.2003.08.033.
- Z. Chen, N. Zhang, L. Zhuo, B. Tang: Catalytic kinetic methods for photometric or fluorometric determination of heavy metal ions. In: Microchim Acta. 164, 2009, S. 311–336; doi:10.1007/s00604-008-0048-8.
- A. Townsend, K. Miller, St. McLean, St. Aldous: The determination of copper, zinc, cadmium and lead in urine by high resolution ICP-MS. In: J. Anal. At. Spectrom. 13, 1998, S. 1213–1219; doi:10.1039/A805021J.
- R. Lobinski, Z. Marczenko: Spectrochemical Trace Analysis for Metals and Metalloids. Elsevier 1997, ISBN 0-444-82879-6.
- I. Oehme, O. S. Wolfbeis: Optical Sensors for Determination of Heavy Metal Ions. In: Microchim. Acta. 126, 1997, S. 177–192; doi:10.1007/BF01242319.
- B. Lange, Z. J. Vejdelek: Photometrische Analyse. Verlag Chemie, Weinheim 1980.
- Y. Bonfil, E. Kirowas-Eisner: Determination of nanomolar concentrations of lead and cadmium by anodic-stripping voltammetry at a silver electrode. In: Anal. Chim. Acta. 457, 2002, S. 285–296; (PDF) (Memento vom 30. Januar 2012 im Internet Archive)
- J. Wang: Stripping Analysis at Bismuth Electrodes: A Review. In: Electroanalysis. 17, 2005, S. 1341–1346; doi:10.1002/elan.200403270.




