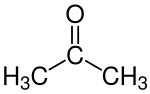
Aceton
Aceton oder Azeton [at͡səˈtoːn] ist der Trivialname für die organisch-chemische Verbindung Propanon bzw. Dimethylketon. Aceton ist eine farblose Flüssigkeit und findet Verwendung als polares aprotisches Lösungsmittel und als Ausgangsstoff für viele Synthesen der organischen Chemie. Es ist mit seinem Strukturmerkmal der Carbonylgruppe (>C=O), die zwei Methylgruppen trägt, das einfachste Keton.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aceton | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C3H6O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit süßlichem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 58,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,79 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
56 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[2] und vielen organischen Lösungsmitteln[6] | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Brechungsindex |
1,3588 (20 °C)[8] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Aceton wurde erstmals 1606 von Andreas Libavius durch Erhitzen von Blei(II)-acetat hergestellt. Robert Boyle stellte es 1661 aus Holzessig dar, der durch trockene Destillation von Holz gewonnen wurde.[11] Beschrieben wurde es erstmals 1610 im Tyrocinium Chymicum von Jean Beguin.
Eine Möglichkeit der Acetonherstellung besteht darin, Essigsäure mit Calciumcarbonat zu Calciumacetat (1) reagieren zu lassen und dieses zu erhitzen, wobei es in Aceton (2) und Calciumoxid zerfällt („Kalksalzdestillation“).
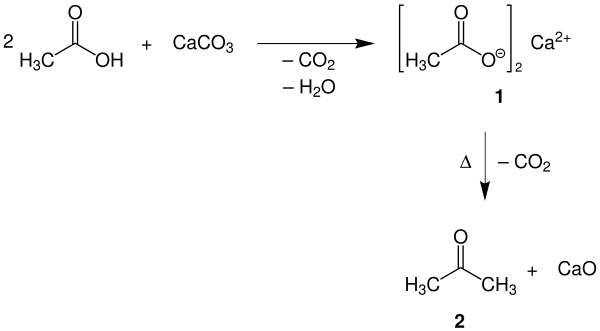
Dieses Verfahren geht auf die oben genannte historische Synthese von Libavius 1606 zurück.
1917 wurde Aceton erstmals großindustriell von Wacker in Burghausen hergestellt.[12] Dabei wurde das Aceton nach einem Kontaktverfahren durch Überleiten von Essigsäuredampf über erhitztes Metalloxid (Cersalz[12]) gewonnen.[13]
Bis in die Mitte des 20. Jahrhunderts war die von Chaim Weizmann entdeckte und patentierte Aceton-Butanol-Ethanol-Gärung ein weiteres wichtiges Verfahren zur Gewinnung auch von Aceton. In der industriellen Produktion kam das anaerobe Bakterium Clostridium acetobutylicum zum Einsatz.
Das wichtigste Herstellungsverfahren von Aceton ist heutzutage das Cumolhydroperoxid-Verfahren, das auch als Phenolsynthese nach Hock bekannt ist:
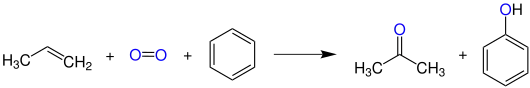
Hier werden Benzol und Propen zunächst durch eine Friedel-Crafts-Alkylierung im Sauren in Isopropylbenzol (Cumol) überführt. Dieses reagiert dann mit Sauerstoff in einer Radikalreaktion zum Hydroperoxid, das sich während der sauren Aufarbeitung zu Phenol und Aceton zersetzt.
Als weiteres Herstellungsverfahren dient die Dehydrierung bzw. Oxidehydrierung von Isopropanol.
Eigenschaften
Chemische Eigenschaften
Aceton besitzt aufgrund der elektronenziehenden Ketogruppe eine relativ starke CH-Acidität an den Methylgruppen. Folglich kann es durch starke Basen (hier als B– dargestellt) deprotoniert werden, wobei ein resonanzstabilisiertes Carbanion gebildet wird:

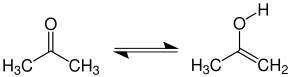
Es ist eine farblose, niedrigviskose Flüssigkeit mit charakteristischem, leicht süßlichem Geruch, leicht entzündlich und bildet mit Luft ein explosives Gemisch. Der Siedepunkt bei Normaldruck beträgt 56 °C. Es ist in jedem Verhältnis mit Wasser und den meisten organischen Lösungsmitteln mischbar. Das Acetonmolekül zeigt Keto-Enol-Tautomerie. Aceton kann aufgrund seiner polaren Carbonylgruppe mit Kationen auch Komplexverbindungen bilden.
Die Verbindung bildet mit einer Reihe anderer Lösungsmittel azeotrop siedende Gemische. Die azeotropen Zusammensetzungen und Siedepunkte finden sich in der folgenden Tabelle. Keine Azeotrope werden mit Wasser, Ethanol, 1-Propanol, 2-Propanol, n-Butanol, Benzol, Toluol, Ethylbenzol, Diethylether, Ethylacetat und Acetonitril gebildet.[14]
| Azeotrope mit verschiedenen Lösungsmitteln[14] | ||||||||||||
| Lösungsmittel | n-Pentan | n-Hexan | n-Heptan | Cyclohexan | Methanol | Chloroform | Tetrachlormethan | Diisopropylether | Methylacetat | |||
| Gehalt Aceton | in Ma% | 21 | 59 | 90 | 67 | 88 | 22 | 89 | 61 | 50 | ||
| Siedepunkt | in °C | 32 | 50 | 56 | 53 | 55 | 64 | 56 | 54 | 55 | ||
Thermodynamische Eigenschaften
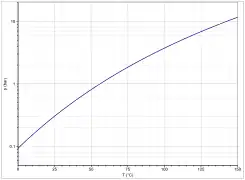
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,42448, B = 1312,253 und C = −32,445 im Temperaturbereich von 259,2 bis 507,6 K.[15]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−249,4 kJ·mol−1[16] −218,5 kJ·mol−1[16] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0gas | −1821,4 kJ·mol−1[17] | |
| Wärmekapazität | cp | 125,45 J·mol−1·K−1 (25 °C)[18] 2,16 J·g−1·K−1 (25 °C)[18] 75,02 J·mol−1·K−1 (25 °C)[19] 1,29 J·g−1·K−1 (25 °C)[19] |
als Flüssigkeit als Gas |
| Kritische Temperatur | Tc | 508,15 K[20] | |
| Kritischer Druck | pc | 47,582 bar[20] | |
| Kritische Dichte | ρc | 4,63 mol·l−1[20] | |
| Azentrischer Faktor | ωc | 0,30653[21] | |
| Schmelzenthalpie | ΔfH | 5,72 kJ·mol−1[22] | beim Schmelzpunkt |
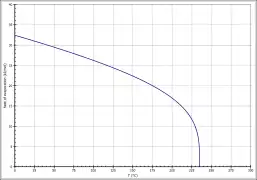
| Verdampfungsenthalpie | ΔVH | 29,1 kJ·mol−1[23] | beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 46,95 kJ/mol, β = 0,2826 und Tc = 508,2 K im Temperaturbereich zwischen 298 K und 363 K beschreiben.[23] Die spezifische Wärmekapazität kann im Temperaturbereich zwischen 5 °C und 50 °C über eine lineare Funktion mit cp = 1,337 + 2,7752·10−3 ·T (mit cp in kJ·kg−1·K−1 und T in K) abgeschätzt werden.[18]
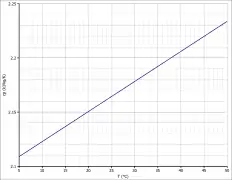 Spezifische Wärmekapazität von Aceton
Spezifische Wärmekapazität von Aceton
Sicherheitstechnische Kenngrößen
Aceton bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von −20 °C. Der Explosionsbereich liegt zwischen 2,5 Vol.‑% (60 g/m³) als untere Explosionsgrenze (UEG) und 14,3 Vol.‑% (345 g/m³) als obere Explosionsgrenze (OEG).[24] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −23 °C sowie einen oberen Explosionspunkt von 8 °C. Die Explosionsgrenzen sind druckabhängig. Eine Verringerung des Drucks führt zu einer Verkleinerung des Explosionsbereiches. Die untere Explosionsgrenze ändert sich bis zu einem Druck von 100 mbar nur wenig und steigt erst bei Drücken kleiner als 100 mbar an. Die obere Explosionsgrenze verringert sich mit sinkendem Druck analog.[25]
| Explosionsgrenzen unter reduziertem Druck (gemessen bei 100 °C)[25] | ||||||||||||
| Druck | in mbar | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | 25 |
| Untere Explosionsgrenze (UEG) | in Vol.‑% | 2,2 | 2,2 | 2,3 | 2,3 | 2,4 | 2,4 | 2,5 | 2,6 | 2,7 | 3,6 | 5,0 |
| in g·m−3 | 53 | 53 | 53 | 55 | 57 | 58 | 59 | 61 | 63 | 86 | 119 | |
| Obere Explosionsgrenze (OEG) | in Vol.‑% | 14,3 | 14,0 | 13,7 | 13,4 | 13,2 | 13,1 | 13,1 | 13,1 | 12,5 | 10,3 | 9,0 |
| in g·m−3 | 345 | 338 | 331 | 324 | 319 | 316 | 316 | 316 | 302 | 249 | 217 | |
| Maximaler Explosionsdruck unter reduziertem Druck [25] | ||||||||||||
| Druck | in mbar | 1013 | 800 | 600 | 400 | 300 | 200 | 100 | ||||
| Maximaler Explosionsdruck (in bar) | bei 20 °C | 9,3 | 7,5 | 5,5 | 3,6 | 2,7 | 1,8 | 0,8 | ||||
| bei 100 °C | 7,4 | 4,5 | ||||||||||
Der maximale Explosionsdruck beträgt 9,7 bar.[24] Mit steigender Temperatur und sinkendem Ausgangsdruck sinkt der maximale Explosionsdruck.[25] Die Grenzspaltweite wurde mit 1,04 mm (50 °C) bestimmt.[24] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[24] Mit einer Mindestzündenergie von 1,15 mJ sind Dampf-Luft-Gemische extrem zündfähig.[26][27] Die Zündtemperatur beträgt 535 °C.[24] Der Stoff fällt somit in die Temperaturklasse T1. Unter erhöhtem Druck wird ein starkes Absinken der Zündtemperatur beobachtet.[2] Die elektrische Leitfähigkeit ist mit 4,9·10−7 S·m−1 eher gering.[28]
| Zündtemperaturen unter erhöhtem Druck[2] | ||||||||||||
| Druck | in bar | 1 | 2 | 4 | 6,8 | 16,5 | ||||||
| Zündtemperatur | in °C | 535 | 345 | 290 | 265 | 250 | ||||||
Reaktionen (Auswahl)
Iodierung von Aceton
Als besondere Reaktion sei hier die Iodierung von Aceton als klassisches Beispiel für eine Reaktionskinetik pseudo-nullter Ordnung genannt. Da sich nur die Enolform iodieren lässt, Aceton aber nahezu zu 100 % als Keton vorliegt, kann man bei der Reaktion die Konzentration an 2-Propenol als konstant ansehen. Dessen C=C-Doppelbindung reagiert mit Iod unter Abspaltung eines Iodidions zu einem mesomeren Kation, das anschließend ein Proton auf ein Iodidion überträgt.[29]

Die Einstellung des Keto-Enol-Gleichgewichts ist säure- (und auch basen-) -katalysiert. Durch den entstehenden Iodwasserstoff wird die Iodierung daher stark beschleunigt (Autokatalyse).
Bildung von Dibenzalaceton
Aceton reagiert in Gegenwart von Benzaldehyd in alkalischer Lösung zum Dibenzalaceton. Die Reaktion findet nach dem allgemeinen Mechanismus der Aldol-Kondensation statt.
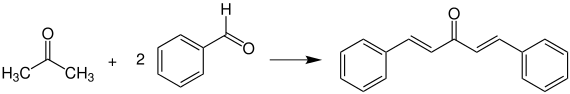
Auch Benzalanilin ist synthetisierbar – dabei reagiert das Anilin mit dem sich in alkalischer Lösung befindenden Aceton unter Wasserabspaltung zur Schiffschen Base (Azomethin). Sowohl Dibenzalaceton als auch Benzalanilin sind wertvolle Substanzen, da sie sehr reaktive Doppelbindungen besitzen, die von Nucleophilen angegriffen werden können.
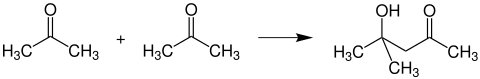
Bildung von Diacetonalkohol
Lässt man je zwei Acetonmoleküle unter dem Einfluss basischer Reagenzien aldolartig dimerisieren, so entsteht Diacetonalkohol:
Bildung von Acetonperoxid
Aceton reagiert mit Wasserstoffperoxid zum detonationsneigenden Acetonperoxid:

Reaktion mit Chloroform
Aceton und Chloroform dürfen nicht in höheren Konzentrationen gemischt werden, weil es in Gegenwart von Spuren von basisch reagierenden Stoffen zu einer sehr heftigen Reaktion kommt, bei der 1,1,1-Trichlor-2-methyl-2-propanol entsteht. Auch aus diesem Grund sollen im Labor chlorierte und nicht chlorierte Lösemittelabfälle getrennt gesammelt werden.[30]

Verwendung
Aceton ist in der chemischen Industrie Ausgangsstoff für zahlreiche Synthesen. Hauptsächlich dient es zur Herstellung von Polymethylmethacrylat (PMMA), umgangssprachlich als Acrylglas oder Plexiglas bezeichnet. Dazu wird das Aceton zunächst durch Addition von Blausäure in das Acetoncyanhydrin überführt, das im sauren Milieu leicht Wasser abspaltet (Mesomeriestabilisierung der Doppelbindung aufgrund der Konjugation zur Dreifachbindung der Nitrilgruppe). Das dabei entstehende 2-Methylpropennitril wird durch Zugabe eines Gemisches aus konzentrierter Schwefelsäure und Methanol zu Methylmethacrylat umgesetzt, das in einem weiteren Schritt zum Acrylglas polymerisiert wird.
Aceton dient industriell als Vorstufe zur Herstellung von Diacetonalkohol durch Aldoladdition und damit indirekt als Vorstufe für Mesityloxid und Methylisobutylketon.

Ferner wird Aceton in Kleinmengen als nützliches Lösungsmittel für Harze, Fette und Öle, Kolophonium, Celluloseacetat sowie als Nagellackentferner und Plastikkleber eingesetzt. Des Weiteren wird es zum Entfernen von durch Bauschaum entstandenen Verunreinigungen zum Beispiel der Reinigung von PU-Schaum-Pistolen eingesetzt. Es löst ein Vielfaches seines Volumens an Ethin (Acetylen).
In einigen Ländern wird Aceton in kleinen Anteilen (1:2000 – 1:5000) Benzin oder Diesel zugesetzt, um eine effektivere Verbrennung des Treibstoffs zu erreichen.
In der photochemischen Leiterplattenherstellung wird Aceton zur abschließenden Entfettung der Leiterplatte vor dem Löten eingesetzt.
Acetonhaltige Lösungen finden in der Zahnmedizin Verwendung zur Reinigung präparierter Dentinflächen und Wurzelkanäle.
Biochemie
Aceton ist ein in der Leber gebildeter Ketonkörper, der nicht in nennenswertem Umfang verstoffwechselt werden kann. Er wird deshalb über die Lunge oder im Ausnahmefall über den Harn abgegeben (Acetonurie, ein Symptom des Diabetes mellitus). Andere Ketonkörper sind Acetessigsäure und 3-Hydroxybutansäure. Diese können im Stoffwechsel verarbeitet werden und sind beteiligt an der Energiebereitstellung für die Muskeln.
Toxikologie
Auf der Haut verursacht Aceton Trockenheit, da es die Haut entfettet. Deshalb sollte man betroffene Stellen nach Kontakt einfetten. Inhalation größerer Dosen erzeugt Bronchialreizung, Müdigkeit und Kopfschmerz. Sehr hohe Dosen wirken narkotisch.
Hexadeuteroaceton

Deuteriertes Aceton[31] (Summenformel: C3D6O), auch Aceton-d6 genannt, findet in der Kernresonanzspektroskopie (NMR) als Lösungsmittel Verwendung.
Die physikalischen Eigenschaften unterscheiden sich geringfügig von der nichtdeuterierten Verbindung:[32]
- Schmelzpunkt: −93,8 °C
- Siedepunkt: 55,5 °C
- Dichte: 0,872 g/ml (25 °C)[33]
- Brechungsindex: 1,355 (20 °C)
Weblinks
- Eintrag zu Acetone in der Consumer Product Information Database
Einzelnachweise
- Eintrag zu ACETONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Februar 2020.
- Eintrag zu Aceton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Peter B. Fleming, Robert E. McCarley: Chemistry of Polynuclear Metal Halides. IV. Electronic Spectra of Some Niobium and Tantalum M6X12n+ Cluster Derivatives. In: Inorganic Chemistry. Band 9, Nr. 6, Juni 1970, S. 1347–1354, doi:10.1021/ic50088a011.
- Chiang, Y.; Kresge, A. J.; Tang, Y. S.; Wirz, J., "The pKa and keto-enol equilibrium constant of acetone in aqueous solution", J. Am. Chem. Soc., (1984) 106, 460–462. doi:10.1021/ja00314a055
- Bordwell, F. G., "Equilibrium Acidities in Dimethyl Sulfoxide Solution", Acc. Chem. Res., (1988) 21, 456–463. doi:10.1021/ar00156a004
- Eintrag zu Aceton. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-52.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-4.
- Eintrag zu Acetone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 67-64-1 bzw. Aceton), abgerufen am 2. November 2015.
- chemgapedia.de, Lerneinheit Aceton-Synthese.
- Wacker Chemie AG (Hrsg.): Menschen Märkte Moleküle – Die Erfolgsformel Wacker Chemie 1914–2014 (PDF; 38 MB). Piper Verlag GmbH, München 2014.
- Organische Chemie. In: Raphael Ed. Liesegang (Hrsg.): Naturwissenschaftliche Reihe. Band III. Verlag Theodor Steinkopf, Frankfurt a. M. 1921, S. 57 (archive.org).
- I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 27–29.
- D. Ambrose, C. H. S. Sprake, R. Townsend: Thermodynamic Properties of Organic Oxygen Compounds. XXXIII. The Vapour Pressure of Acetone. In: J. Chem. Thermodyn. 6, 1974, S. 693–700, doi:10.1016/0021-9614(74)90119-0.
- K. B. Wiberg, L. S. Crocker, K. M. Morgan: Thermochemical Studies of Carbonyl Compounds. 5. Enthalpies of Reduction of Carbonyl Groups. In: J. Am. Chem. Soc. 113, 1991, S. 3447–3450, doi:10.1021/ja00009a033.
- C. B. Miles, H. Hunt: Heats of Combustion. I. The Heat of Combustion of Acetone. In: J. Phys. Chem. 45, 1941, S. 1346–1359; doi:10.1021/j150414a002.
- R. Malhotra, L. A. Woolf: Thermodynamic Properties of Propanone (Acetone) at Temperatures from 278 K to 323 K and Pressures up to 400 Mpa. In: J. Chem. Thermodyn. 23, 1991, S. 867–876, doi:10.1016/S0021-9614(05)80282-4.
- J. Chao: Thermodynamic Properties of Key Organic Oxygen Compounds in the Carbon Range C1 to C4. Part 2. Ideal Gas Properties. In: J. Phys. Chem. Ref. Data. 15, 1986, S. 1369–1436, doi:10.1063/1.555769.
- A. N. Campbell, R. M. Chatterjee: The critical constants and orthobaric densities of acetone, chloroform benzene, and carbon tetrachloride. In: Canadian Journal of Chemistry. 47, 1969, S. 3893–3898, doi:10.1139/v69-646.
- J. Schmidt: Auslegung von Sicherheitsventilen für Mehrzweckanlagen nach ISO 4126-10. In: Chem. Ing. Techn. 83, 2011, S. 796–812, doi:10.1002/cite.201000202.
- K. K. Kelley: The heats capacities of isopropyl alcohol and acetone from 16 to 298 °K and the corresponding entropies and free energies. In: J. Am. Chem. Soc. 51, 1929, S. 1145–1150, doi:10.1021/ja01379a022.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- D. Pawel, E. Brandes: Abschlussbericht zum Forschungsvorhaben Abhängigkeit sicherheitstechnischer Kenngrößen vom Druck unterhalb des atmosphärischen Druckes. (Memento vom 2. Dezember 2013 im Internet Archive), Physikalisch-Technische Bundesanstalt (PTB), Braunschweig 1998.
- J. B. Fenn: Lean Flammability Limit and Minimum Spark Ignition Energy. Commercial Fluids and Pure Hydrocarbons. In: Ind. Eng. Chem. 43, 1951, S. 2865–2869; doi:10.1021/ie50504a057.
- H. F. Calcote, C. A. Gregory, C. M. Barnett, R. B. Gilmer: Spark Ignition – Effect of Molecular Structure. In: Ind. Eng. Chem. 44, 1952, S. 2656–2662; doi:10.1021/ie50515a048.
- Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
- F. A. Carey, R. J. Sundberg: Organische Chemie. Wiley-VCH Verlag, 2004, ISBN 3-527-29217-9.
- Lutz Roth, Ursula Weller: Gefährliche Chemische Reaktionen, ISBN 3-609-73090-0, ecomed Sicherheit; 2005.
- Externe Identifikatoren von bzw. Datenbank-Links zu Deuteriertes Aceton: CAS-Nummer: 666-52-4, EG-Nummer: 211-563-9, ECHA-InfoCard: 100.010.514, PubChem: 522220, ChemSpider: 455535, Wikidata: Q1032873.
- Datenblatt Acetone-d6 bei Sigma-Aldrich, abgerufen am 31. August 2019 (PDF).
- Im Vergleich zu 0,791 g/ml (25 °C) bei der nichtdeuterierten Verbindung. Datenblatt Acetone bei Sigma-Aldrich, abgerufen am 31. August 2019 (PDF).