Argon
Argon (altgriechisch ἀργός argós „untätig, träge“) ist ein chemisches Element mit dem Symbol Ar (bis 1957 nur A[2]) und der Ordnungszahl 18. Im Periodensystem steht es in der 8. Hauptgruppe bzw. der 18. IUPAC-Gruppe und zählt daher zu den Edelgasen. Wie die anderen Edelgase ist es ein farbloses, äußerst reaktionsträges, einatomiges Gas. In vielen Eigenschaften wie Schmelz- und Siedepunkt oder Dichte steht es zwischen dem leichteren Neon und dem schwereren Krypton.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Argon, Ar, 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Edelgase | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 18, 3, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | farbloses Gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-147-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.315 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 3,6 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 39,948 (39,792-39,963)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 106 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 188 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ne] 3s2 3p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 15.7596117(5) eV[4] ≈ 1520.57 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 27.62967(12) eV[4] ≈ 2665.86 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 40.735(12) eV[4] ≈ 3930 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 59.58(18) eV[4] ≈ 5749 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 74.84(17) eV[4] ≈ 7221 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 1,784 kg · m−3[6] bei 273 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −1,1 · 10−8)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 83,8 K (−189,3 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 87,15 K[8] (−186 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | (fest) 22,56 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 6,52 kJ/mol[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 1,18 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 319 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,01772 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Argon ist das häufigste auf der Erde vorkommende Edelgas, der Anteil an der Atmosphäre beträgt etwa 0,934 %. Damit ist Argon der dritthäufigste Bestandteil der Erdatmosphäre, nach Stickstoff und Sauerstoff. Dies ist großteils auf den Zerfall des Kaliumisotops 40K zurückzuführen, bei dem 40Ar entsteht.
Argon war das erste Edelgas, das als Stoff entdeckt und gewonnen wurde, daher der Name, der im Grunde zu jedem Edelgas passt. Helium (von griechisch helios für „Sonne“) wurde vorher lediglich spektroskopisch im Sonnenlicht sowie in irdischen Proben nachgewiesen und Neon erst später entdeckt. Argon wurde 1894 von Lord Rayleigh und William Ramsay durch fraktionierte Destillation von flüssiger Luft gefunden. Als preiswertestes Edelgas wird Argon in großen Mengen als Schutzgas etwa beim Schweißen und in der Produktion von manchen Metallen, aber auch als Füllgas von Glühlampen verwendet.
Geschichte

Einen ersten Hinweis auf das später entdeckte Argon fand Henry Cavendish, der 1783 die Reaktivität der Luft erforschte. Er erzeugte elektrische Entladungen in einer bestimmten Menge Luft, die mit Sauerstoff im Verhältnis von 5:3 angereichert war. Stickstoff und Sauerstoff reagierten miteinander und die entstandenen Stickoxide konnten ausgewaschen werden. Dabei blieb stets ein kleiner Rest nicht-reagierten Gases zurück. Cavendish erkannte jedoch nicht, dass es sich dabei um ein anderes Element handelte und setzte seine Experimente nicht fort.[9]
Nachdem John William Strutt, 3. Baron Rayleigh 1892 die Dichte von aus Luft isoliertem Stickstoff bestimmt hatte, fiel ihm auf, dass aus Ammoniak gewonnener Stickstoff eine niedrigere Dichte aufwies. Es gab verschiedene Spekulationen zu diesem Befund; so meinte James Dewar, es müsse sich um ein N3, also ein Stickstoff-Analogon zu Ozon handeln. Rayleigh wiederholte Cavendishs Experimente, indem er in einer luftgefüllten Glaskugel elektrische Funken erzeugte und so Stickstoff und Sauerstoff zur Reaktion brachte. Nach Bestätigung von Cavendishs Ergebnis eines unreaktiven Rückstandes untersuchte William Ramsay diesen ab 1894 durch Überleitung über heißes Magnesium genauer. Da Magnesium mit Stickstoff zum Nitrid reagiert, konnte er dem Gemisch weiteren Stickstoff entziehen. Dabei stellte er eine Erhöhung der Dichte fest und fand schließlich ein bislang unbekanntes, reaktionsträges Gas. Am 31. Januar 1895 gaben Ramsay und Rayleigh schließlich die Entdeckung des neuen Elements bekannt, das sie nach dem altgriechischen ἀργός argos, „träge“, Argon nannten.[10] Als William Ramsay ab 1898 das aus der Luft isolierte Argon weiter untersuchte, entdeckte er darin drei weitere Elemente, die Edelgase Neon, Krypton und Xenon.[11]
Erste technische Anwendungen fand das Gas in der Elektroindustrie: Es wurden unter anderem Gleichrichter auf der Basis der Glimmentladung in Argon hergestellt, die sogenannten Tungar-Röhren.[12]
Vorkommen
Argon zählt im Universum zu den häufigeren Elementen, in seiner Häufigkeit ist es vergleichbar mit Schwefel und Aluminium.[13] Es ist im Universum nach Helium und Neon das dritthäufigste Edelgas. Dabei besteht das primordiale Argon, das etwa in der Sonne oder Gasplaneten wie Jupiter gefunden wird, hauptsächlich aus den Isotopen 36Ar und 38Ar, während das dritte stabile Isotop, 40Ar, dort nur in geringer Menge vorkommt. Das Verhältnis von 36Ar zu 38Ar beträgt etwa 5,7.[14]
Auf der Erde ist Argon dagegen das häufigste Edelgas. Es macht 0,934 % des Volumens der Atmosphäre (ohne Wasserdampf) aus und ist damit nach Stickstoff und Sauerstoff der dritthäufigste Atmosphärenbestandteil.[15] Die Zusammensetzung des terrestrischen Argons unterscheidet sich erheblich von derjenigen des primordialen Argons im Weltall. Es besteht zu über 99 % aus dem Isotop 40Ar, das durch Zerfall des Kaliumisotops 40K entstanden ist. Die primordialen Isotope sind dagegen nur in geringen Mengen vorhanden.
Da das Argon durch den Kaliumzerfall in der Erdkruste entsteht, findet man es auch in Gesteinen. Beim Schmelzen von Gesteinen im Erdmantel gast das Argon, aber auch das bei anderen Zerfällen entstehende Helium aus. Es reichert sich daher vorwiegend in den Basalten der ozeanischen Erdkruste an.[16] Aus den Gesteinen wird das Argon an das Grundwasser abgegeben. Daher ist in Quellwasser, vor allem wenn es aus größerer Tiefe kommt, Argon gelöst.[17]
Gewinnung und Darstellung
Die Gewinnung des reinen Argons erfolgt ausschließlich aus der Luft, in der Regel im Rahmen der Luftverflüssigung im Linde-Verfahren. Das Argon wird dabei nicht in der Haupt-Rektifikationskolonne des Verfahrens von den Hauptluftbestandteilen getrennt, sondern in einer eigenen Argon-Kolonne. In dieser wird durch Rektifikation zunächst Rohargon hergestellt, das noch etwa 3–5 % Sauerstoff und 1 % Stickstoff enthält.
Anschließend wird das Rohargon in weiteren Stufen gereinigt. Das Gasgemisch wird zunächst auf Raumtemperatur erwärmt und auf 4–6 bar verdichtet. Um den restlichen Sauerstoff zu entfernen, wird danach Wasserstoff eingespritzt, der an Edelmetall-Katalysatoren mit dem Sauerstoff zu Wasser reagiert. Nachdem dieses entfernt wurde, wird in einer weiteren Kolonne das Argon, das sich am unteren Ende der Kolonne anreichert, vom restlichen Stickstoff getrennt, so dass Argon mit einer Reinheit von 99,9999 % (Argon 6.0) produziert werden kann.[18]
Weitere Quellen für die Gewinnung von Argon sind die Produktion von Ammoniak im Haber-Bosch-Verfahren sowie die Synthesegasherstellung, etwa zur Methanolproduktion. Bei diesen Verfahren, die Luft als Ausgangsstoff nutzen, reichern sich Argon und andere Edelgase im Produktionsprozess an und können aus dem Gasgemisch isoliert werden. Wie beim Linde-Verfahren werden auch hier die verschiedenen Gase durch Adsorption oder Rektifikation voneinander getrennt und so reines Argon gewonnen.[18]
Eigenschaften
Physikalische Eigenschaften

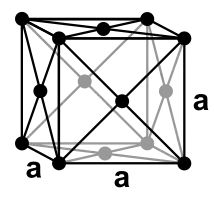
Argon ist bei Normalbedingungen ein einatomiges, farbloses und geruchloses Gas, das bei 87,15 K (−186 °C) kondensiert und bei 83,8 K (−189,3 °C) erstarrt. Wie die anderen Edelgase außer dem Helium kristallisiert Argon in einer kubisch dichtesten Kugelpackung mit dem Gitterparameter a = 526 pm bei 4 K.[19]
Wie alle Edelgase besitzt Argon nur abgeschlossene Schalen (Edelgaskonfiguration). Dadurch lässt sich erklären, dass das Gas stets einatomig vorliegt und die Reaktivität gering ist.
Mit einer Dichte von 1,784 kg/m3 bei 0 °C und 1013 hPa ist Argon schwerer als Luft, es sinkt also ab. Im Phasendiagramm liegt der Tripelpunkt bei 83,8 K und 689 hPa,[20] der kritische Punkt bei 150,86 K, 4896 kPa sowie einer kritischen Dichte von 0,536 g/cm3.[17]
In Wasser ist Argon etwas löslich. In einem Liter Wasser können sich bei 0 °C und Normaldruck maximal 53,6 ml Argon lösen.[21]
Chemische Eigenschaften
Als Edelgas reagiert Argon fast nicht mit anderen Elementen oder Verbindungen. Bislang ist nur das experimentell dargestellte Argonfluorohydrid HArF bekannt, das durch Photolyse von Fluorwasserstoff in einer Argonmatrix bei 7,5 K gewonnen wird und anhand neuer Linien im Infrarotspektrum identifiziert wurde. Oberhalb von 27 K zersetzt es sich.[22] Nach Berechnungen sollten weitere Verbindungen des Argons metastabil sein und sich verhältnismäßig schwer zersetzen; diese konnten jedoch experimentell bislang nicht dargestellt werden. Beispiele hierfür sind das Chloranalogon des Argonfluorohydrides HArCl, aber auch Verbindungen, bei denen das Proton durch andere Gruppen ersetzt ist, etwa FArCCH als organische Argonverbindung und FArSiF3 mit einer Argon-Silicium-Bindung.[23]
Argon bildet einige Clathrate, in denen es physikalisch in Hohlräume eines umgebenden Kristalls eingeschlossen ist. Bei −183 °C ist ein Argon-Hydrat stabil, jedoch ist die Geschwindigkeit der Bildung sehr langsam, da eine Umkristallisierung stattfinden muss. Ist das Eis mit Chloroform gemischt, bildet sich das Clathrat schon bei −78 °C.[24] Stabil ist auch ein Clathrat von Argon in Hydrochinon.[25]
Isotope
Insgesamt sind 23 Isotope sowie ein weiteres Kernisomer von Argon bekannt. Von diesen sind drei, nämlich die Isotope 36Ar, 38Ar und 40Ar, stabil und kommen in der Natur vor. Dabei überwiegt bei weitem 40Ar mit einem Anteil von 99,6 % am natürlichen irdischen Isotopengemisch. 36Ar und 38Ar sind mit einem Anteil von 0,34 % beziehungsweise 0,06 % selten. Von den instabilen Isotopen besitzen 39Ar mit 269 Jahren und 42Ar mit 32,9 Jahren die längsten Halbwertszeiten. Alle anderen Isotope besitzen kurze Halbwertszeiten im Bereich von unter 10 ps bei 30Ar bis 35,04 Tagen bei 37Ar.[26]
40Ar wird für die Altersbestimmung von Gesteinen genutzt (Kalium-Argon-Datierung). Dabei wird ausgenutzt, dass instabiles 40K, das in diesen enthalten ist, langsam zu 40Ar zerfällt. Je mehr Kalium zu Argon zerfallen ist, desto älter ist das Gestein.[27] Das kurzlebige Isotop 41Ar kann zur Überprüfung von Gasleitungen verwendet werden. Durch das Durchleiten von 41Ar kann die Leistungsfähigkeit einer Belüftung oder Dichtigkeit einer Leitung festgestellt werden.[17]
39Ar wird hingegen für die Altersbestimmung von Grund-, See- und Ozeanwasser sowie von Gletschereis verwendet. So lange das Wasser Kontakt zur Atmosphäre hat, löst sich Argon zu gleichen Teilen wie es in dieser vorkommt. Sobald das Wasser von der Atmosphäre abgeschlossen ist, verringert sich der Anteil des gelösten 39Ar aufgrund seines Zerfalls mit einer Halbwertszeit von 269 Jahren. Mittels Low Level Counting (LLC) oder Atom Trap Trace Analysis (ATTA) kann der verbliebene Anteil an 39Ar bestimmt und darüber das Alter berechnet werden.[28][29]
Biologische Bedeutung
Wie die anderen Edelgase hat Argon auf Grund der Reaktionsträgheit keine biologische Bedeutung und ist auch nicht toxisch. In höheren Konzentrationen wirkt es durch Verdrängung des Sauerstoffs erstickend.[30] Bei Drücken von mehr als 24 bar wirkt es narkotisierend.[31]
Verwendung

Als günstigstes und in großen Mengen verfügbares Edelgas wird Argon in vielen Bereichen verwendet. Die Produktion betrug 1998 weltweit etwa zwei Milliarden m³ bzw. zwei km³.[18] Der größte Teil des Argons wird als Schutzgas verwendet. Es wird immer dann genutzt, wenn der billigere Stickstoff nicht anwendbar ist. Dazu zählen vor allem Schweißverfahren für Metalle, die mit Stickstoff bei hohen Temperaturen reagieren, etwa Titan, Tantal und Wolfram. Auch beim Metallinertgasschweißen und Wolfram-Inertgasschweißen, die etwa beim Schweißen von Aluminiumlegierungen oder hoch legierten Stählen angewendet werden, dient Argon als Inertgas. Weiterhin wird es in der Metallurgie als Schutzgas, etwa für die Produktion von Titan, hochreinem Silicium oder der Schmelzraffination sowie zum Entgasen von Metallschmelzen genutzt.
Argon ist ein Lebensmittelzusatzstoff (E 938) und dient als Treib- und Schutzgas bei der Verpackung von Lebensmitteln und der Weinherstellung.[32]
Argon wird als gasförmiges Löschmittel vorwiegend für den Objektschutz, vor allem bei elektrischen und EDV-Anlagen eingesetzt und wirkt dabei durch Sauerstoffverdrängung. Für diesen Zweck wird reines Argon oder ein Gasgemisch zusammen mit Stickstoff verwendet.
In der Analytik wird Argon als Träger- und Schutzgas für die Gaschromatographie und das induktiv gekoppelte Plasma (ICP-MS, ICP-OES) verwendet.[18]
Glühlampen werden häufig mit Argon-Stickstoff-Gemischen gefüllt, weil eine Gasfüllung die Sublimation des Glühfadens vermindert. Argon hat dabei eine geringere Wärmeleitfähigkeit als leichtere Gase, ist aber preiswerter als andere schwerere und damit noch geringer wärmeleitende Gase wie Krypton oder Xenon. Ein Vorteil der geringeren Wärmeleitfähigkeit ist eine höhere mögliche Glühtemperatur und damit höhere Lichtausbeute. Ebenfalls wegen der geringen Wärmeleitfähigkeit wird es als Füllgas für Isolierglasscheiben verwendet. Auch in Gasentladungslampen dient Argon als Leuchtgas mit einer typischen violetten Farbe. Wird etwas Quecksilber dazugegeben, ändert sich die Farbe ins Blaue. Weiterhin ist Argon das Lasermedium in Argon-Ionen-Lasern.
Im Bereich der Stahlerzeugung kommt Argon eine besonders wichtige Rolle im Bereich der Sekundärmetallurgie zu. Mit der Argon-Spülung kann die Stahllegierung entgast und gleichzeitig homogenisiert werden, speziell wird dabei der unerwünschte, gelöste Stickstoff aus der Schmelze entfernt.[33]
Beim Tauchen wird Argon – insbesondere bei der Nutzung des heliumhaltigen Trimix als Atemgas – dazu verwendet, um Trockentauchanzüge zu füllen bzw. damit zu tarieren. Hierbei wird ebenfalls die geringe Wärmeleitfähigkeit des Gases genutzt, um das Auskühlen des Anzugträgers zu verzögern.[34]
Seit Mai 2014 ist Argon auf der Dopingliste der Welt-Anti-Doping-Agentur (WADA). Durch den bei der Inhalation von Argon entstehenden Sauerstoffmangel wird offensichtlich die Bildung von körpereigenem Erythropoetin (EPO) aktiviert. Aus demselben Grund ist auch Xenon auf der Dopingliste.[35]
Literatur
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a17_485.
- Eintrag zu Argon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 417–429.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Argon) entnommen.
- Angegeben ist der von der IUPAC empfohlene Standardwert, da die Isotopenzusammensetzung dieses Elements örtlich schwanken kann, ergibt sich für das mittlere Atomgewicht der in Klammern angegebene Massenbereich. Siehe: IUPAC Commission on Isotopic Abundances and Atomic Weights: Standard Atomic Weights of 14 Chemical Elements Revised. In: Chemistry International. 40, 2018, S. 23, doi:10.1515/ci-2018-0409.
- Eintrag zu argon in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu argon bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Eintrag zu Argon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. April 2017. (JavaScript erforderlich)
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5, S. 211–216.
- John Meurig Thomas: Argon und das nichtinerte Paar: Rayleigh und Ramsay. In: Angew. Chem. 116, 2004, S. 6578–6584, doi:10.1002/ange.200461824.
- William Ramsay: The Rare Gases of the Atmosphere. Nobelpreisrede, 12. Dezember 1904.
- Fritz Von Schröter: Die Bedeutung der Edelgase für die Elektrotechnik. In: Naturwissenschaften. 8, 32, 1920, S. 627–633, doi:10.1007/BF02448916.
- A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews. 15, 1970, S. 121–146 (PDF).
- P. R. Mahaffy, H. B. Niemann, A. Alpert, S. K. Atreya, J. Demick, T. M. Donahue, D. N. Harpold, T. C. Owen: Noble gas abundance and isotope ratios in the atmosphere of Jupiter from the Galileo Probe Mass Spectrometer. In: J. Geophys. Res. 105, 2000, S. 15061–15071 (Abstract).
- David R. Williams: Earth Fact Sheet. NASA, Greenbelt, Stand 20. Mai 2009.
- Chris J. Ballentine: Geochemistry: Earth holds its breath. In: Nature. 449, 2007, S. 294–296, doi:10.1038/449294a.
- Eintrag zu Argon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006, doi:10.1002/14356007.a17_485.
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica Section B. 30, 1974, S. 193–204, doi:10.1107/S0567740874002469.
- Eintrag zu Argon (Phase change data). In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 17. November 2019.
- Gase-Handbuch der Firma Messer Griesheim, 3. Auflage, korrigierter Nachdruck 1989, S. 226.
- Leonid Khriachtchev, Mika Pettersson, Nino Runeberg, Jan Lundell, Markku Räsänen: A stable argon compound. In: Nature. 406, 2000, S. 874–876, doi:10.1038/35022551.
- Arik Cohen, Jan Lundell, R. Benny Gerber: First compounds with argon–carbon and argon–silicon chemical bonds. In: J. Chem. Phys. 119, 2003, S. 6415–6417, doi:10.1063/1.1613631.
- R. M. Barrer, D. J. Ruzicka: Non-stoichiometric clathrate compounds of water. Part 4. – Kinetics of formation of clathrate phases. In: Transactions of the Faraday Society. 58, 1962, S. 2262–2271, doi:10.1039/TF9625802262.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, The Elements, S. 4-4.
- G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- Eintrag zu Kalium-Argon-Methode. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- H.H. Loosli: A dating method with39Ar. In: Earth and Planetary Science Letters. Band 63, Nr. 1, April 1983, S. 51–62, doi:10.1016/0012-821X(83)90021-3 (elsevier.com [abgerufen am 5. Januar 2021]).
- F. Ritterbusch, S. Ebser, J. Welte, T. Reichel, A. Kersting: Groundwater dating with Atom Trap Trace Analysis of 39 Ar. In: Geophysical Research Letters. Band 41, Nr. 19, 16. Oktober 2014, S. 6758–6764, doi:10.1002/2014GL061120 (wiley.com [abgerufen am 5. Januar 2021]).
- Sicherheitsdatenblatt Argon (PDF; 71 kB), Linde AG, Stand 1. Juni 2006.
- Walter J. Moore, Dieter O. Hummel: Physikalische Chemie. 4. Auflage. de Gruyter, 1986, ISBN 3-11-010979-4, S. 284.
- Zusatzstoff-Zulassungsverordnung: Anlage 3 (zu § 5 Abs. 1 und § 7) Allgemein zugelassene Zusatzstoffe.
- Jörg Niederstraßer: Funkenspektrometrische Stickstoffbestimmung in niedriglegierten Stählen unter Berücksichtigung der Einzelfunkenspektrometrie. Kapitel 4: Stickstoffbewegung von der Roheisen- bis zur Stahlerzeugung. (PDF; 121 kB), Dissertation. Universität Duisburg, 2002.
- Ausrüstung: Argon. bei dir-m.com, abgerufen am 20. August 2013.
- Doping: Xenon und Argon explizit verboten. In: Pharmazeutische Zeitung. 21. Mai 2014.


