Selen
Selen (zeˈleːn, griech. σελήνη [selḗnē], „Mond“) ist ein chemisches Element mit dem Elementsymbol Se und der Ordnungszahl 34. Im Periodensystem steht es in der 4. Periode sowie der 6. Hauptgruppe, beziehungsweise der 16. IUPAC-Gruppe und zählt zu den Chalkogenen.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Selen, Se, 34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halbmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 16, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | grau, glänzend | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-957-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.029.052 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,8 ppm[1] Häufigkeit Nr. 59 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 78,971(8)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 115 (103) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 120 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 190 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d10 4s2 4p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 9.752392(15) eV[4] ≈ 940.96 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 21.196(10) eV[4] ≈ 2045.1 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 31.697(19) eV[4] ≈ 3058.3 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 42.947(3) eV[4] ≈ 4143.8 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 68.30(10) eV[4] ≈ 6589.9 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Ionisierungsenergie | 81.83(3) eV[4] ≈ 7895 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | schwarz bei 60 °C: 4,28 g/cm3 grau bei 25 °C: 4,819 g/cm3 rot bei 25 °C: 4,48 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −1,9 · 10−5)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 494 K (221 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 958,2 K[7] (685 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 16,42 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 95,5 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 5,4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 3350 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 5,9 eV[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,52 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | ±2, 4, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,67 V (Se + 2 e− → Se2−) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,55 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Selen ist ein Nichtmetall, seine Eigenschaften ähneln denen von Schwefel und Tellur. Es bildet mehrere polymorphe und allotrope Modifikationen, von denen die graue, metallähnliche Form die stabilste ist. Meist kommt es in Metallsulfiderzen vor, wo es teilweise den Schwefel ersetzt, selten in elementarer Form oder als reine Erzverbindung. Der schwedische Mediziner und Chemiker Jöns Jacob Berzelius entdeckte Selen 1817. Kommerziell fällt Selen bei der Aufarbeitung von Metallerzen an. Technisch wird es in der Glasherstellung, für Pigmente sowie Photozellen verwendet. Früher wurde es für die Herstellung von elektronischen Bauteilen verwendet.
Selen ist ein für den Menschen essenzielles Spurenelement und unter anderem Bestandteil des antioxidativen Enzyms Glutathionperoxidase. Die Spanne zwischen Mangelernährung und toxischen Konzentrationen bei der Selenaufnahme ist sehr gering, was eine sorgfältige Kontrolle der Zufuhr erforderlich macht. Sowohl elementares Selen als auch Selensalze können schon in geringen Dosen giftig sein und Selenose verursachen.
Geschichte

Selen wurde 1817 von Jöns Jakob Berzelius im Bleikammerschlamm seiner Schwefelsäurefabrik in der Nähe von Gripsholm entdeckt.[11] Der dort verwendete Pyrit aus dem Bergwerk von Falun bildete in den Bleikammern einen roten Niederschlag, von dem Berzelius zunächst annahm, dass es sich um eine Arsenverbindung handele. Bei der Verbrennung entwickelte der Niederschlag jedoch einen ausgeprägten Geruch nach Rettich, der nicht typisch für Arsen, aber charakteristisch für Tellur, das nach der lateinisch tellus ‚Erde‘ benannt war, zu dem Selen einige Ähnlichkeiten aufweist.[11]
In einem Brief an Alexander Marcet erwähnte Berzelius, dass er eine Tellurverbindung gefunden hätte. Doch das Fehlen von Tellurverbindungen in den Mineralien des Bergwerks von Falun veranlasste Berzelius dazu, den roten Niederschlag erneut zu analysieren. Berzelius schloss 1818 im Rahmen seiner Experimente schließlich, dass es sich um ein neues Element handelte. Er schrieb einen weiteren Brief an Marcet, in dem er das neu gefundenes Element beschrieb, das dem Schwefel und dem Tellur ähnlich war. Um auf die Ähnlichkeit zum Tellur hinzuweisen, nannte er es Selen, nach der griechischen Mondgöttin Selene.[11]
_b_788.jpg.webp)
Im Jahr 1873 stellte Willoughby Smith fest, dass der elektrische Widerstand von grauem Selen von der Belichtung abhängt.[12] Dies erlaubt die Verwendung von Selen in Photozellen. Die ersten kommerziellen selenhaltigen Photozellen entwickelte Mitte der 1870er Jahre Werner von Siemens, deren Leitfähigkeit im Sonnenlicht um den Faktor 14,8 höher war als ohne Beleuchtung.[13] Alexander Graham Bell entwickelte 1878 das sogenannte Photophon. Dabei wurde Licht auf einen Spiegel geleitet, der durch ein Megaphon zum Vibrieren gebracht wurde. Die Vibrationen des Megaphons wurden über den Spiegel übertragen, das Licht wurde an ein Empfängersystem geschickt, das aus einem Photoelement, einer Batterie und einem Telefon bestand. Obwohl es sich um das erste drahtlose Telefonsystem handelte, erlangte das System keine Bedeutung.[14]
Ab dem Jahr 1910 untersuchte August von Wassermann die Chemotherapie von Mäusekarzinomen und -sarkomen. Die Injektion einer nicht genau definierten Komponente aus Eosin Y und Selen in die Blutbahn führte zunächst zu einer Nekrose der Tumorzellen und schließlich zur Heilung der betroffenen Organe.[15][16] Versuche zur Tumortherapie beim Menschen mit Natriumselenat führten dagegen durch Überdosierung zu Todesfällen. Die Erforschung der Wirksamkeit von Selen in der Tumortherapie erlitt einen weiteren Rückschlag, als es in den 1930er Jahren zu einer Massenvergiftung von Schafen und Kühen in den Great-Plains-Staaten durch das Fressen von Tragant-Arten kam, wobei etwa 15.000 Schafe an einer Selenvergiftung starben.[17]
Im Jahr 1954 entdeckte Jane Pinsent, dass neben Spuren von Molybdaten auch Selen für die Bildung einer Formiatdehydrogenase bei coliformen Bakterien wesentlich ist.[18] Die Erforschung des Selens erfuhr einen neuen Auftrieb, als eine Forschergruppe um Klaus Schwarz 1957 feststellte, dass Selen einer nekrotischen Leberdegeneration vorbeugt und ein notwendiges Spurenelement ist.[15][19]
Vorkommen
Irdische Vorkommen
Die Bodenkonzentration von Selen liegen im Bereich von 0,01 bis 2,0 Milligramm pro Kilogramm mit einem Mittelwert von etwa 0,4 Milligramm pro Kilogramm. Lokal kommen wesentlich höhere Konzentrationen bis zu 1200 Milligramm pro Kilogramm vor. Neben der Ausgangsgeologie kann es durch natürliche Quellen wie Vulkanausbrüchen oder anthropogene Quellen wie der Kohleverbrennung zu einer Anreicherung an Selen kommen.[20]
Der Selengehalt von Steinkohle beträgt im Durchschnitt etwa 1,6 ppm, der von Braunkohle etwa 1 ppm. In der Asche ist die Konzentration etwa um den Faktor 6 bis 8 erhöht. Das Selen kommt in Kohlen sowohl organisch gebunden als auch anorganisch vor, etwa als Selenid in Form von Clausthalit. Zum Teil liegt es in einer auslaugbaren Selenatform vor, zum Teil ersetzt es isomorph den Schwefel in Pyrit.[21]
Der Selengehalt der Troposphäre wird auf etwa 13 bis 19.000 Tonnen geschätzt. Etwa 60 % der stammen aus natürlichen Quellen wie der marinen Biosphäre, die größte anthropogene Quelle ist die Kohleverbrennung. Die Emissionen scheinen überwiegend gasförmig zu sein.[22]
.jpg.webp)
Als essenzielles Spurenelement ist Selen Bestandteil der 21. biogenen Aminosäure Selenocystein. Selenocystein ist der spezifische katalytische Bestandteil der selenabhängigen Enzyme. In Hefen und Pflanzen kommt Selen vor allem als Selenomethionin vor. Selenomethionin wird an Stelle von Methionin unspezifisch in viele Proteine eingebaut, ohne dabei eine Funktion auszuüben; es wird als Selenspeicher verwendet. Weitere natürlich vorkommende Organoselenverbindung sind Dimethylselenid und Methylselenocystein.
Die Menge von Selen in Nahrungsmitteln hängt stark vom Selengehalt des Bodens ab. Selenarme Böden finden sich in Europa insbesondere in Deutschland, Schottland, Dänemark, Finnland, in Teilen des Balkans und in der Schweiz.[23] In manchen selenarmen Gebieten werden dem Boden selenathaltige Düngemittel zugeführt, zum Beispiel in Finnland seit 1984.[24] In selenreichen Böden reichern Tragant-Arten, Brassica oder Knoblauch Selen als Methylselenocystein an. In der Trockensubstanz von Astragalus Bisulcatus finden sich Selengehalte von bis zu 0,65 %. Eine bekannte Selenquelle unter den Nahrungsmitteln ist die Paranuss. Der Selengehalt einer einzelnen Paranuss beträgt etwa 50 Mikrogramm Selen.[25]
Extraterrestrische Vorkommen
Die Selenkonzentration in Mondbasalten entspricht in etwa terrestrischen Werten, jedoch ist die Isotopenzusammensetzung zu schwereren Selenisotopen verschoben.[26] Im nahen Ultraviolett-Spektrum der metallarmen Sterne HD 108317 und HD 128279 wurde mittels des Goddard High Resolution Spectrographen des Hubble-Weltraumteleskops Selen neben anderen Elementen entdeckt.[27] In Meteoriten wurde Selen, meist vergesellschaftet mit Schwefel, nachgewiesen.[28]
Selen als Mineral
Natürliche Vorkommen an Selen in elementarer Form waren bereits vor der Gründung der International Mineralogical Association (IMA) bekannt. Daher ist Selen als bestandgeschütztes, sogenanntes grandfathered Mineral, als eigenständige Mineralart anerkannt.[29] Erstmals entdeckt und beschrieben wurde gediegen vorkommendes Selen 1934 durch Charles Palache.[30] Als Typlokalität gilt die United Verde Mine bei Jerome im US-Bundesstaat Arizona.[31]
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Selen unter der System-Nummer 1.CC.10 (Elemente – Halbmetalle (Metalloide) und Nichtmetalle – Schwefel-Selen-Iod – Selengruppe)[32] beziehungsweise in der veralteten 8. Auflage unter I/B.03 (Schwefel-Selen-Gruppe) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.03.04.01 (Elemente – Halbmetalle und Nichtmetalle).[33]
Selen als Mineral bildet nur selten gute Kristalle, die dann aber bis zu zwei Zentimeter groß werden können. Ihr Habitus ist gewöhnlich nadel- bis röhrenförmig und gelegentlich hohl. Oft bilden die Kristalle auch blättrige Gruppen oder verfilzte Matten. Als Metall ist Selen im Normalfall undurchsichtig (opak), kann aber in sehr dünnen Splittern transparent sein.[34] Gediegen vorkommendes Selen ist selten zu finden. Im Jahr 2021 waren weltweit nur rund 160 Vorkommen für gediegen Selen dokumentiert.[35]
Auch Selenminerale wie beispielsweise Clausthalit (Selenblei, PbSe) und Naumannit (Selensilber, Ag2Se) sind selten. Den höchsten Selengehalt mit jeweils fast 74 Gew.-% Se haben die beiden Eisenselenid-Modifikationen Dzharkenit und Ferroselit (FeSe2). Insgesamt waren 2021 je nach Quelle bisher zwischen 127[36] und 270[37] Minerale bekannt, die Selen enthalten.
Böden enthalten Selen oft in löslichen Formen wie Selenaten, die leicht ausgewaschen werden. Meerwasser enthält erhebliche Mengen an Selen.
 Selen in Sandstein aus einer Uranmine nahe Grants, New Mexico
Selen in Sandstein aus einer Uranmine nahe Grants, New Mexico Dunkelgrau glänzende Selenkriställchen in Matrix aus der Absetzerhalde Lichtenberg, Ronneburg (Thüringen), Sichtfeld 5 mm
Dunkelgrau glänzende Selenkriställchen in Matrix aus der Absetzerhalde Lichtenberg, Ronneburg (Thüringen), Sichtfeld 5 mm Clausthalit aus der Grube Brummerjan, Zorge (Walkenried), Niedersachsen, Deutschland (Sichtfeld 1,5 cm)
Clausthalit aus der Grube Brummerjan, Zorge (Walkenried), Niedersachsen, Deutschland (Sichtfeld 1,5 cm) Ferroselit aus El Quemado, Departamento General Lamadrid, La Rioja, Argentinien
Ferroselit aus El Quemado, Departamento General Lamadrid, La Rioja, Argentinien
Gewinnung und Darstellung
Elementares Selen
Selen findet sich meist in Form von Metallseleniden, als Begleiter schwefelhaltiger Erze der Metalle Kupfer, Blei, Zink, Gold und Eisen. Industriell wird Selen als Nebenprodukt bei der elektrolytischen Kupfer- und Nickelherstellung aus dem Anodenschlamm durch Abrösten gewonnen. Beim Abrösten dieser Erze sammelt sich das feste Selendioxid im nachgeschalteten Naßwäscher. Durch ebenfalls absorbiertes Schwefeldioxid wird es dort zum metallischen Selen reduziert, wobei Schwefelsäure entsteht.
Das abgeschiedene Selen wird abgefiltert und anschließend durch eine Vakuumdestillation bei etwa 280 °C im Vakuum gereinigt.[38]
Im Labormaßstab kann Selen über die Umsetzung von Seleniger Säure mit Iodwasserstoff dargestellt werden.[39]
Die Gesamtproduktion der bekannten Produzentenländer lag 2020 bei 2900 Tonnen, der Preis lag im selben Jahr bei etwa 44 US-Dollar pro Kilogramm. Die Reserven werden auf etwa 100.000 Tonnen geschätzt. Die Gewinnung von Selen aus Kohleflugasche ist technisch möglich, wird aber wegen der hohen Kosten nicht durchgeführt.[40] Ein kleiner Teil des gewonnenen Selens stammt aus dem Recycling von Elektronik- und Fotokopiererkomponenten.
Selenomethionin
In der Lebensmittelergänzung und Tierernährung (in der Tierernährung in der EU seit Mai 2005 zugelassen) wird seit einigen Jahren eine organische Selenquelle eingesetzt, die durch die Zucht bestimmter Brauhefen des Typs Saccharomyces cerevisiae (Sel-Plex, LalminTM) auf selenreichem Nährmedium (Melasse und Natriumselenit) erzeugt wird.[41] Hefen synthetisieren hohe Anteile an Selenomethionin als Aminosäure und binden so bis zu 2000 ppm Selen auf organische Weise. Die größte Anlage zur Erzeugung solcher natürlicher Selenhefen wurde 2004 in São Pedro im brasilianischen Bundesstaat Paraná errichtet.
Eigenschaften
Physikalische Eigenschaften
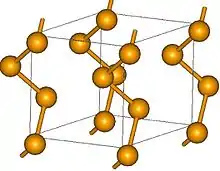

Selen kommt kristallin in einer grauen, drei roten und einer schwarzen allotropen Modifikationen vor; die drei roten kristallinen Modifikationen sind polymorph.[42][43][44] Des Weiteren tritt es als schwarzes Selen in einer amorphen Phase auf, die sich bei Temperaturerhöhung auf etwa 80 °C in eine schwarze, glasigen Phase umwandelt, die auch beim Abschrecken von Selenschmelzen auf Raumtemperatur entsteht. Schwarzes Selen ist ein spröder, glänzender Feststoff, der in Kohlenstoffdisulfid schwer löslich ist. Diese Phase wird bei Temperaturen ab 50 °C plastisch. Phasen mit Ringen aus sechs und sieben Gliedern sind synthetisierbar. Diese sind jedoch nicht haltbar und wandeln sich schnell in andere Formen um.
Unter Normalbedingungen ist nur die graue Modifikation stabil, die anderen sind metastabil und wandeln sich im Laufe der Zeit in das graue Selen um.[44] Es hat ein hexagonales Kristallgitter und verhält sich wie ein Halbmetall, das Halbleitereigenschaften aufweist. Es besteht aus helical angeordneten Ketten mit einer dreizähligen Schraubenachse mit Se–Se–Winkeln von 103 °. Innerhalb eines Kristalls weisen die Ketten eine einheitliche Schraubrichtung auf. Einkristalle von grauem Selen sind daher optisch aktiv und bilden Enantiomere.[45] Im Gegensatz zu den anderen Allotropen ist es in Kohlenstoffdisulfid unlöslich. Graues Selen leitet Strom nur schlecht, Verunreinigungen mit Halogeniden oder die Bestrahlung mit Licht erhöhen die Leitfähigkeit.
Zwei der roten Modifikationen kristallisieren monoklin. Sie werden als α- und β-Selen bezeichnet und unterscheiden sich durch ihre Achsenlängen. Sie werden durch Extraktion mit Kohlenstoffdisulfid aus schwarzem Selen hergestellt. Durch die Variation der Verdampfungsrate des Lösungsmittels lassen sich die beiden Phasen gezielt herstellen. Eine als γ-Selen bezeichnete Form, die durch Kristallisation aus einer Lösung von Dipiperidinotetraselan in Kohlenstoffdisulfid gewonnen wird, kristallisiert ebenfalls monoklin, in der Raumgruppe P21/c.[46] Das in Kohlenstoffdisulfid lösliche rote Selen besteht zu etwa 30 % aus gefalteten Se8-Ringen und zu 70 % aus Se8+n, welches sich unter Duck, bei Temperaturen oberhalb von 120 °C oder in Gegenwart eines Katalysators in das graue Selen umwandelt. In den Se8-Ringen beträgt der Se-Se-Abstand 233,5 Picometer und der Se-Se-Se-Winkel 105,7 °. Eine amorphe rote Modifikation entsteht durch das Abschrecken von geschmolzenem Selen. Elementares rotes Selen ist ein Isolator.[44]
Oberhalb des Schmelzpunktes von 220 °C bildet Selen eine schwarze Flüssigkeit. Der bei weiterer Temperaturerhöhung entstehende Selendampf ist gelb. Bei der Abscheidung aus der Dampfphase an einer kühleren Oberfläche scheidet es sich in Form hexagonaler, metallisch-grauer Kristallnadeln ab.
Durch Belichtung ändert es seine elektrische Leitfähigkeit. Die Bandlücke des Selens beträgt etwa 1,74 Elektronenvolt, an der Grenze vom sichtbaren Licht zum Infrarot. Zusätzlich zeigt es einen photovoltaischen Effekt. Die Leitfähigkeit wird nicht durch Elektronen in einem Leitungsband verursacht, sondern durch Leitung von Löchern (siehe bei Elektrische Leitfähigkeit und Defektelektron), also positiv geladenen Elektronenfehlstellen, wodurch unter anderem das Vorzeichen des Hall-Effekts negativ wird. Als Mechanismus für diese Löcherleitung wird eine so genannte „Hopping-Leitfähigkeit“ (der Löcher von einer Kristallfehlstelle zur nächsten) vorgeschlagen.[47]
Chemische Eigenschaften
Selen ähnelt in seinen chemischen Eigenschaften und Verhalten sehr dem Schwefel. Die kann durch ähnliche Kovalenzradien sowie eine ähnliche Elektronegativität der beiden Elemente erklärt werden. Der Kovalenzradius von Schwefel beträgt 103 Picometer, der von Selen 117 Picometer. Die Elektronegativität von Schwefel auf der Allred-Rochow-Skala beträgt 2,4, die von Selen 2,5.[48]
Selen hat die Valenzelektronenkonfiguration 3d104s2 4px2 py1pz1. Durch zwei kovalente Bindungen oder die Aufnahme zweier Elektronen erreicht es die Edelgaskonfiguration. So bildet Selen mit Wasserstoff oberhalb von 400 °C Selenwasserstoff (H2Se). Mit Metallen bildet es Selenide, zum Beispiel Natriumselenid (Na2Se), die als Salze des Selenwasserstoffs aufgefasst werden können.
Beim Erhitzen in Luft verbrennt Selen mit blauer Flamme zum Selendioxid, SeO2.
Das chemische Verhalten ist dem Schwefel ähnlich, jedoch ist Selen schwerer oxidierbar. Die Reaktion mit Salpetersäure bildet Selenige Säure, eine Selen(IV)-Verbindung.
Die Umsetzung mit Grignard-Verbindungen, R–Mg–Hal, führt zu Organoselenverbindungen, R-Se-Mg-Hal, aus denen sich durch Hydrolyse Selenole, R–Se–H herstellen lassen.
Isotope
Das Selen weist eine Vielzahl von Isotopen auf. Von den sieben natürlich vorkommenden Isotopen sind fünf stabil. Die prozentuale Häufigkeit der stabilen Isotope ist folgendermaßen verteilt: 74Se (0,9 %), 76Se (9,0 %), 77Se (7,6 %), 78Se (23,6 %) und 80Se (49,7 %). 79Se mit einer Halbwertszeit von 327.000 Jahren ist in kleinen Mengen Bestandteil von Uranerzen. Es entsteht bei der Spaltung von Uran mit einer Häufigkeit von 0,04 % und findet sich ebenfalls in abgebranntem Kernbrennmaterial. 82Se als radioaktives Isotop besitzt mit etwa 1020 Jahren eine der längsten bekannten Halbwertszeiten überhaupt und zerfällt durch doppelten Betazerfall zu 82Kr. Es kann praktisch als stabil angesehen werden, seine Häufigkeit beträgt 9,2 %.[49]
Daneben sind weitere 21 radioaktive Isotope bekannt, unter denen 75Se mit einer Halbwertszeit von 120 Tagen eine besondere Bedeutung hat.[50][51] 75Se findet zur Konstruktion spezieller Gammastrahlenquellen zur zerstörungsfreien Prüfung von Schweißnähten Anwendung.[52] 75Se dient in der Nuklearmedizin in Verbindung mit Methionin als Tracer zur Beurteilung der Pankreasfunktion und mit Homotaurocholsäure (SeHCAT) zur Beurteilung der Resorption von Gallensäuren.[53]
Verwendung
Selen ist für alle Lebensformen essenziell. Selenverbindungen werden daher als Nahrungsergänzung angeboten und zu Futter- und Düngemittelzusätzen verarbeitet. In der Glasindustrie wird es zum Entfärben grüner Gläser sowie zur Herstellung rotgefärbter Gläser verwendet.
Technische Anwendungen
| Jahr | Glas- herstellung | Chemikalien und Pigmente | Elektronische Anwendungen | Metallurgische Anwendungen | andere Anwendungen |
|---|---|---|---|---|---|
| 1970 | 30 % | 14 % | 37 % | 0 % | 19 % |
| 1980 | 30 % | 25 % | 35 % | 0 % | 10 % |
| 1990 | 25 % | 20 % | 35 % | 0 % | 20 % |
| 2000 | 25 % | 22 % | 10 % | 24 % | 19 % |
- Belichtungstrommeln für Fotokopierer und Laserdrucker
- Halbleiterherstellung
- Latexzusatz zur Erhöhung der Abrasionsbeständigkeit
- Toner für Schwarz-Weiß-Fotografien zur Kontrasterhöhung (helle Töne bleiben unverändert, es werden dunklere Schwärzen erreicht, die dunklen Teile wirken insgesamt plastischer), Haltbarkeitserhöhung (nicht eindeutig nachgewiesen) und zur leichten Färbung der dunklen Bildbestandteile ins Aubergine-farbene (ebenfalls zur Plastizitätserhöhung)
- zur Herstellung roter Farbpigmente und Quantenpunkte auf der Basis von Cadmiumselenid (CdSe)
- Legierungszusatz zur Verbesserung der mechanischen Bearbeitbarkeit für Automatenstähle und Kupfer-Legierungen

- Verwendung in dem Selen-Gleichrichter und der Selen-Zelle, heute jedoch weitgehend durch Silicium (Halbleiter) abgelöst.
- zur Brünierung von Aluminium, Messing o. Ä. (Selendioxid)
- mit Kupfer und Indium Bestandteil der photoaktiven Schicht von CIGS-Solarzellen
- in analogen Belichtungsmessern für die Fotografie
- Als Zinkselenid wird es zur Herstellung optisch hochreflektiver Oberflächen verwendet, im Infrarotbereich ist es aber transparent und wird hier zur Herstellung von Fenstern und Fokuslinsen für zum Beispiel CO2-Laser verwendet
- Größere Mengen von Selendioxid werden bei der Elektrolyse von Mangan verbraucht. Der Zusatz von Selendioxid verringert den Energieverbrauch bei der Elektrolyse. Pro Tonne Mangan werden bis zu 2 kg Selendioxid verbraucht.[54]
Medizinische Verwendung
Bei einem Selenmangel, der nicht durch Ernährung ausgeglichen werden kann, etwa bei Verdauungs- und Verwertungsstörungen, oder bei einer Fehl- und Mangelernährung wird Selen als Natriumselenit verabreicht.
In Anti-Schuppen-Haarshampoos wird Selendisulfid in Konzentrationen bis 1 % und medizinisch in Konzentrationen von beispielsweise 2,5 % zur Vorbeugung und Therapie von Pityriasis versicolor, einer durch einen Hefepilz verursachten Hauterkrankung, verwendet. Selenhaltige Anti-Schuppen-Shampoos eignen sich ebenfalls zur Behandlung des Juckreizes bei Pferden.[55]
Biologische Bedeutung
Selen ist ein essenzielles Spurenelement für Menschen und Tiere. Es ist in Selenocystein enthalten, einer Aminosäure im aktiven Zentrum des Enzyms Glutathionperoxidase und vieler weiterer Selenoproteine. Selenocystein ist auch als 21. Aminosäure bekannt und wird während der Proteinbiosynthese über eine eigene transfer-RNA eingebaut. Das selenenthaltende Enzym Glutathionperoxidase (GSHPx), welches in allen tierischen Zellen vorkommt, ist entscheidend am Abbau von membranschädigenden Oxidantien sowie Radikalfolgeprodukten beteiligt. Es dient dem Schutz der Zellmembranen vor oxidativer Zerstörung durch Peroxide, die während des normalen Fettstoffwechsels gebildet werden.[56] Dazu gehören die zelluläre oder klassische Glutathionperoxidase 1 (GSHPx-1), die im Zytosol und der Mitochondrienmatrix wirkt sowie die gastrointestinale GSHPx-2, die in der Darmschleimhaut wirkt. Die extrazelluläre Plasmaglutathionperoxidase (GSHPx-3) und die GSHPx-4 wirken in den Phospholipiden von Lipidmembranen oder im Strukturprotein im Schwanzstück von Spermien. Durch eine reduzierte Glutathionperoxidaseaktivität lässt sich eine Reihe von Selenmangelsyndromen erklären. Es sind etwa 25 Selenoproteine im menschlichen Proteom bekannt.[57] Selen spielt eine wichtige Rolle bei der Produktion der Schilddrüsenhormone, genauer bei der „Aktivierung“ von Thyroxin (T4) zu Triiodthyronin (T3).[58][59][60] Es ist Bestandteil des Enzyms Thyroxin-5′-Deiodinase, die für die Entfernung eines Iodatoms aus T4 verantwortlich ist. Durch diese Deiodierung entsteht T3. Ein Selenmangel führt zu einem Mangel an Thyroxin-5′-Deiodase, wodurch nur noch ein Teil des verfügbaren T4 deiodiert werden kann. Da T3 im Stoffwechsel wesentlich wirksamer ist, resultiert aus einem T3-Mangel eine Schilddrüsenunterfunktion (Hypothyreose).
Thioredoxinreduktase (TrxR), die das für das Zellwachstum wichtige Thioredoxin reduziert, aber auch zahlreiche weitere nieder- und hochmolekulare Substrate. Iodthyronin-5′-Deiodinasen (Schilddrüsenhormondeiodinasen; ID-I, ID-II, ID-III) katalysieren die Synthese von Schilddrüsenhormonen.
Selenoproteine, die im Zentrum die modifizierte Aminosäure Selenocystein tragen, darunter Selenprotein H, I, K, M, N, O und P dienen als Transportprotein für Selen zwischen Körperzellen; R, die Methioninsulfoxid-Reduktase sowie S, T, V und W kommen in der Muskulatur vor. Selenophosphatsynthetase 2, katalysiert die Synthese von Monoselenophosphat, einem Vorläufer von Selenocystein.
Selen wirkt in höheren Konzentrationen stark toxisch, wobei die Spanne zwischen Konzentrationen, die Mangelerscheinungen hervorrufen, und toxischen Konzentrationen sehr gering ist. Zudem ist die Toxizität von Selen abhängig von der chemischen Bindungsform.
Selenanreicherung in der Nahrungskette
Algen und Mikroorganismen in aquatischer Umgebung können Selen aus dem Wasser aufnehmen und um das Millionenfache der wässrigen Konzentration anreichern.[61] Pflanzen bauen Selen je nach Bodengehalt anstelle des Schwefels unspezifisch in Aminosäuren ein, besonders in Selenomethionin und in geringem Umfang Selenocystein beziehungsweise in dessen Derivate wie Methylselenocystein. Nur die sogenannten „Selensammlerpflanzen“ (Selenakkumulator-Pflanzen, zum Beispiel Paradiesnuss), die in selenreichen Gebieten mit aridem Klima vorkommen, speichern Selen darüber hinaus als organisch gebundenes, wasserlösliches Selen oder Selensalze. Der Umfang der Aufnahme hängt ab von der Bioverfügbarkeit des Selens. Hohe organische Anteile adsorbieren Selen und reduzieren es, so dass es immobilisiert ist und durch Pflanzen nicht aufgenommen werden kann. Als selenarme Böden gelten Böden mit Konzentrationen unter 0,1 Parts per million (ppm), bei Selenkonzentrationen über 0,5 ppm gelten Böden als selenreich.[61]
Selenaufnahme
Basierend auf der Sättigung des Selenoproteins P mit Selen wurde die empfohlene Tagesdosis in Deutschland, Österreich und der Schweiz auf 70 Mikrogramm pro Tag für einen Mann, 60 Mikrogramm pro Tag für eine Frau und 75 Mikrogramm pro Tag für stillende Frauen festgelegt.[62][63] Der Bedarf bei Kindern und Jugendlichen wird altersabhängig geringer geschätzt.[62] Der Wissenschaftliche Ausschuss für Lebensmittel der Europäischen Kommission legte 1993 einen Referenzwert von 55 Mikrogramm Selen pro Tag für Erwachsene fest.[64] Einer Bewertung des Ausschusses zufolge soll die tägliche Gesamtaufnahme 300 Mikrogramm pro Tag nicht übersteigen.[65] Das deutsche Bundesinstitut für Risikobewertung (BfR) empfiehlt für Nahrungsergänzungsmittel die Tagesdosis auf 45 Mikrogramm zu beschränken.[66] Das US-amerikanische National Institutes of Health empfiehlt als normale Dosis für Erwachsene 55 Mikrogramm Selen pro Tag, und als obere Toleranzgrenze, bei der noch keine negativen Auswirkungen auf die Gesundheit zu erwarten sind, 400 Mikrogramm pro Tag.[67] In der Milchviehfütterung wird Selen zugesetzt, da der natürliche Selengehalt der Futtermittel oft nicht zur Versorgung der Nutztiere ausreicht.
Medizinische Aspekte
Die Europäische Behörde für Lebensmittelsicherheit (EFSA) befand ausreichend wissenschaftlich belegt, dass Selen beitrage zu einer normalen Spermatogenese, zur Erhaltung von Haaren und Nägeln, zur normalen Funktion des Immunsystems und zum Schutz der Zellen vor oxidativem Stress sowie zur normalen Schilddrüsenfunktion.[68][69]
Eine Veröffentlichung der Zeitschrift Pharmainformation vom Juni 2005 behandelte die zusätzliche Selengabe mit Blick auf postulierte Nützlichkeit bei verschiedenen Krankheiten: Keine der verfügbaren Studien erbrachte Hinweise für einen Nutzen von Selen in irgendeinem Zusammenhang. Zwar scheint eine positive Beeinflussung verschiedener Krebsarten möglich, andererseits die Begünstigung anderer Karzinome nicht unwahrscheinlich.[70] Ein solcher Zusammenhang wird für Herz-Kreislauf-Erkrankungen diskutiert.[71][72] Die experimentelle Hypertonie an der Ratte kann durch prophylaktische Selengabe wesentlich reduziert werden.[73] Interessant ist in diesem Zusammenhang die protektive Selenwirkung bei der Kryokonservierung von Herzmuskelfragmenten.[74]
Die zur Untersuchung der protektiven Wirkung von Selen und Vitamin E gegenüber Krebs initiierte „SELECT“-Studie („Selenium and Vitamin E Cancer Prevention Trial“) wurde 2008 vor dem geplanten Ende abgebrochen, da ein Nutzen zu dem Zeitpunkt bereits ausgeschlossen werden konnte.[75] Verschiedene randomisierte kontrollierte Studien konnten mit hoher Evidenz keine positive Wirkung der Gabe von Selenpräparaten auf die Verringerung des Krebsrisikos zeigen. Wiederkehrende Studien über mehrere Jahre zeigten zum Teil einen umgekehrten, zum Teil keinen und zum Teil einen direkten Zusammenhang zwischen der Selenexposition und dem Krebsrisiko, jedoch gab es in keiner Studie einen Hinweis auf eine Dosis-Wirkungs-Beziehung. Offen ist, ob Selen das Krebsrisiko bei Personen mit einem bestimmten genetischen Hintergrund oder Ernährungszustand verändern kann, sowie die mögliche Wirkungen verschiedener Selenformen.[76] Untersuchungen über einen Effekt von Selen auf die Linderung von Nebenwirkungen von Chemo- und Strahlentherapie boten ebenfalls keine Grundlage für eine Empfehlung für oder gegen eine Selensupplementierung.[77] Die Selenkonzentration wurde bei diesen Studien entweder im Blutplasma, im Blutserum oder in den Zehennägeln gemessen. Die Bestimmung des Selengehalts in Zehennägeln unterliegt geringeren Schwankungen als die im Serum oder Plasma, daher sind diese Werte meist aussagekräftiger.[78]
Ähnlich verliefen Studien über den Effekt von selenhaltigen Nahrungsergänzungsmitteln auf die Entwicklung von Herz-Kreislauf-Erkrankungen bei gesunden Erwachsenen, die bereits über die normale Ernährung ausreichend mit Selen versorgt waren. Dabei konnte ebenfalls weder ein Vorteil noch ein Nachteil beobachtet, Herz-Kreislauferkrankungen konnten durch eine Selengabe nicht verhindert werden.[79] Es gab vermehrte Diabetes-2-Fälle in der Selen-Substitutionsgruppe, der Unterschied war jedoch nicht signifikant. Jedoch kam es vermehrt zu Alopezie und Dermatitis. Eine dauerhafte zusätzliche Zuführung von Selen (Supplementierung) ist mit schädlichen Wirkungen in Verbindung gebracht worden. Nachdem 2007 eine Studie zur Selen-Supplementierung unerwartet ein übermäßiges Risiko für einen Typ-2-Diabetes ergeben hatte, gab es eine Reihe weiterer Studien dazu.[80] Eine systematische Übersichtsarbeit aus dem Jahr 2018 kam zu dem Schluss, dass Selen das Risiko für Typ-2-Diabetes über eine breite Expositionsspanne hinweg erhöhen kann, insgesamt sei das Risiko jedoch gering.[81]
Selenmangelkrankheiten
Bekannte Selenmangelkrankheiten sind die Keshan-Krankheit (juvenile Kardiomyopathie), benannt nach der nordostchinesischen Stadt Keshan im Distrikt Heilongjiang in der Mandschurei sowie die Kaschin-Beck-Krankheit des Menschen, eine nutritive Gelenkknorpeldegeneration, benannt nach den russischen Militärärzten Nikolai Iwanowitsch Kaschin (1825–1872) und Jewgeni Wladimirowitsch Beck (1865–1915). In Kuba kommt die epidemische Neuropathie des Menschen. Selenmangel verursacht eine Mutation des Influenza-A/Bangkok/1/79-Virus, das dadurch virulent wird. Bei einem Selenmangel, der nicht durch Ernährung ausgeglichen werden kann, etwa bei Verdauungs- und Verwertungsstörungen, oder bei einer Fehl- und Mangelernährung, wird Selen arzneilich eingesetzt (Natriumselenit, oral oder parenteral).
In der Veterinärmedizin ist die Weißmuskelkrankheit (nutritive Myodegeneration (NMD), nutritive Muskeldystrophie, enzootische Myodystrophie, nutritive Rhabdomyolyse, nutritive Rhabdomyopathie, myopathisch-dyspnoisches Syndrom, Kälberrheumatismus, Hühnerfleischigkeit, Fischfleischigkeit) bekannt, die bei Wiederkäuern, Schweinen und Truthähnen auftritt und bei denen Selenmangel als eine (Mit-)Ursache gilt. Bei ruminierenden Rindern kommt in den Selenmangelgebieten der Erde die paralytische Myoglobinurie, exerzitionale Rhabdomyolyse vor, vor allen bei Rindern ab acht Monaten.
Nachweise
Die quantitative Bestimmung von Spuren (0,003 %) an Selenat kann elektrochemisch mittels Polarografie erfolgen. In 0,1-molarer Ammoniumchloridlösung zeigt sich eine Stufe bei −1,50 V (gegen SCE). Im Ultraspurenbereich bietet sich die Atomspektrometrie an, wobei mittels Flammen-AAS 100 μg/l (ppb), per Graphitrohr-AAS 0,5 und per Hydridtechnik 0,01 µg/l Selen nachgewiesen werden können.[82]
Sicherheitshinweise
Selen und Selenverbindungen sind giftig. Direkter Kontakt schädigt die Haut (Blasenbildung) und Schleimhäute. Eingeatmetes Selen kann zu langwierigen Lungenproblemen führen.
Eine Vergiftung durch übermäßige Aufnahme von Selen wird als Selenose bezeichnet. Eine erste Beschreibung einer Selenvergiftung, ohne deren Natur zu kennen, stammt von Marco Polo, der bei der Durchquerung der Shaanxi-Provinz beobachtete, dass sich bei Pferden und anderen Lasttieren nach dem Verzehr bestimmter Pflanzen, die als Selenakkumulatoren bekannt sind, die Hufe spalteten und abfielen.[83] Eine Selen-Aufnahme von mehr als 3000 µg/d kann zu Leberzirrhose, Haarausfall und Herzinsuffizienz führen. Beschäftigte in der Elektronik-, Glas- und Farbenindustrie gelten als gefährdet.[84] Nach anderen Quellen treten schon ab 400 µg/d Vergiftungserscheinungen auf wie Übelkeit und Erbrechen, Haarverlust, Nagelveränderungen, periphere Neuropathie und Erschöpfung.[85]
Selenverbindungen
In Verbindungen tritt Selen am häufigsten in den Oxidationsstufen −II (Selenwasserstoff, Selenide) und +IV (Tetrahalogenide, Selendioxid und Selenate(IV), veraltet Selenite) auf. In den Selenidionen tritt Selen mit nicht-ganzzahligen negativen Oxidationszahlen auf. Seltenere positive Oxidationszahlen sind +I (Halogenide Se2X2) und +VI (Selenhexafluorid, Selensäure). Dabei sind Selenverbindungen mit der Oxidationszahl +VI stärkere Oxidationsmittel als die analogen Schwefel- und Tellurverbindungen. So lösen Mischungen aus konzentrierter Selen(VI)-säure mit Salzsäure Metalle wie Gold und Platin auf.
Wasserstoffverbindungen
Selenwasserstoff (H2Se) ist ein farbloses, sehr giftiges Gas, das durch Reaktion von Seleniden (MxSey) mit starken Säuren, zum Beispiel Salzsäure (HCl) entsteht. Aus den Elementen Wasserstoff und Selen ist die Verbindung als stark endotherme Verbindung bei Temperaturen über 350 °C darstellbar. Selenwasserstoff zersetzt sich bei Zimmertemperatur langsam in die Elemente, der Zerfall wird durch Lichteinfluss beschleunigt. Die wässrige Lösung (Selenwasserstoffsäure) reagiert schwach sauer; die Säurestärke liegt mit Ks=1,88·10−4 in der gleichen Größenordnung wie die von salpetriger Säure (HNO2).
Selenide
Mit den meisten Metallen bildet Selen binäre Selenide, die das Selenid-Anion Se2− enthalten. Darüber hinaus sind Diselenide Se22− und Polyselenide Senm− bekannt, die durch die Reaktion eines Metalls mit einem Überschuss Selen erhalten werden können:
Die Synthese ist durch Zusammenschmelzen der Elemente oder in Lösung möglich. Die Selenide sind hydrolyse- und oxidationsempfindlich. Außer den ionischen Seleniden ist die molekulare Verbindung Kohlenstoffdiselenid, Se=C=Se, bekannt.
- Beispiele für Polyselenide
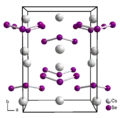 Elementarzelle von Cs2Se3
Elementarzelle von Cs2Se3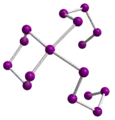 Das Se164−-Ion in der Kristallstruktur von Cs4Se16
Das Se164−-Ion in der Kristallstruktur von Cs4Se16
Natriumhydrid reduziert elementares Selen zu Natriumdiselenid (Na2Se2).[86]
Sauerstoffverbindungen und Interchalkogene
Selendioxid (Selen(IV)-oxid) ist ein farbloser, kristalliner Feststoff, der durch Verbrennen von Selen an der Luft erhalten werden kann. In Wasser bildet es Selenige Säure, H2SeO3. Es ist ein relativ starkes Oxidationsmittel und wird leicht zu Selen reduziert.
Selentrioxid (Selen(VI)-oxid) kann durch Entwässerung von Selensäure, H2SeO4 gewonnen werden. Es ist ebenfalls ein kristalliner Feststoff und ein starkes Oxidationsmittel.
Daneben gibt es die festen, kristallinen, gemischtvalenten Selen(IV,VI)oxide Se2O5 und Se3O7.
Selenmonoxid, SeO, ist nur als instabile Zwischenstufe bekannt.
Selensulfid SeS ≈2 (eine unstöchiometrische Selen-Schwefel-Verbindung, die aus schwefelähnlichen cyklischen Molekülen variabler Größe und Zusammensetzung besteht, wegen des ungefähren Verhältnisses SeS2 auch Selendisulfid genannt).
Selenate sind die Salze der Selensäure mit den Anionen SeO42−. Orthoselenate wie das trigonal-bipyramidale Anion SeO54− und das oktaedrische SeO66− werden nur selten beobachtet.
Selenhalogenide
Selenhexafluorid ist kann durch die Reaktion von Selen mit elementarem Fluor dargestellt werden. Es ist zwar reaktiver als Schwefelhexafluorid, reagiert aber unter Normalbedingungen nicht mit Wasser.
Die wichtigsten Selenhalogenide sind die Tetrahalogenide, ein Selentetraiodid konnte nicht synthetisiert werden. Die Tetrahalogenide können aus den Elementen dargestellt werden. Sie können als Lewis-Basen unter Bildung von :SeX3+ wie auch als Lewissäuren (Bildung von SeX62−) reagieren. Die mit allen Halogenen bekannten Dihalogenide und Monohalogenide sind instabil.
Selenorganische Verbindungen
Selenorganische Verbindungen treten hauptsächlich mit den Oxidationsstufen <II, II und IV auf. Die selenorganischen Verbindungen umfassen im Wesentlichen folgende Substanzgruppen;
- Selane (organische Selenide) RSeR, etwa Dimethylselenid
- Diselane (Diselenide) RSeSeR
- Triselane (Triselenide) RSeSeSeR
- Selenole RSeH
- Selenenyle RSeX
- Selenoxide R–Se(=O)–R
- Selenone R2SeO2
- Selone R2C=Se, die Selenanaloga der Ketone
Selenpolykationen
Durch vorsichtige Oxidation von Selen können zahlreiche Selenpolykationen Senx+ dargestellt und mit einem geeigneten Gegenion kristallisiert werden.[87] Das Gegenion muss eine schwache Lewis-Base sein, da die Selenpolykationen verhältnismäßig starke Lewissäuren sind. Geeignete Oxidationsmittel sind häufig Halogenide der Übergangsmetalle, die bei Temperaturen von typischerweise 200 °C direkt die gewünschte Verbindung ergeben:
Häufig ist die Kristallisation unter den Bedingungen des chemischen Transports erfolgreich, bisweilen müssen aber wasserfreie Lösungsmittel wie Zinn(IV)-chlorid oder Siliciumtetrabromid verwendet werden.
Ist das Metallhalogenid kein geeignetes Oxidationsmittel, wie das bei Halogeniden der Hauptgruppenelemente oft der Fall ist, können die entsprechenden Tellurtetrahalogenide als Oxidationsmittel verwendet werden:
Durch Variation des Gegenions und des Reaktionsmediums konnte eine große Vielfalt von Polykationen dargestellt werden; gemischte Selen-Tellurpolykationen sind durch entsprechende Wahl der Reaktanten der Synthese zugänglich.
- Beispiele für Selenpolykationen
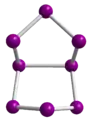 Se82+ in Se8[AlCl4]2
Se82+ in Se8[AlCl4]2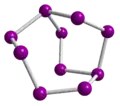 Se102+ in Se10[Bi4Cl14]2
Se102+ in Se10[Bi4Cl14]2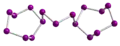 Se172+ in Se17[WCl6]2
Se172+ in Se17[WCl6]2
Literatur
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 693–728 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- W. Marktl: Physiologie und Ernährungsphysiologie von Selen. In: Journal für Mineralstoffwechsel. Band 8, Nr. 3, 2001, S. 34–36.(PDF)
- P. F. Surai: Natural Antioxidants. Nottingham University Press, 2002, ISBN 1-897676-95-6.
- Dolph L. Hatfield u. a. (Hrsg.): Selenium: Its Molecular Biology and Role in Human Health. 3. Auflage. Springer, New York 2012, ISBN 978-1-4614-1024-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gary S. Bañuelos u. a. (Hrsg.): Selenium in the Environment and Human Health. CRC Press/Balkema, Leiden 2014, ISBN 978-1-138-00017-9. (eingeschränkte Vorschau in der Google-Buchsuche)
Weblinks
- Office of Dietary Supplements Fact Sheet: Selenium
- Selen in der Krebsmedizin – Dokumentation (Memento vom 28. Februar 2013 im Internet Archive) (PDF-Datei; 901 kB)
- Selen. In: Mineralienatlas Lexikon. Stefan Schorn u. a., abgerufen am 10. August 2021.
- Selenium search results. In: rruff.info. Database of Raman spectroscopy, X-ray diffraction and chemistry of minerals (RRUFF), abgerufen am 10. August 2021 (englisch).
- American-Mineralogist-Crystal-Structure-Database – Selenium. In: rruff.geo.arizona.edu. Abgerufen am 10. August 2021 (englisch).
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Selen) entnommen.
- IUPAC, Standard Atomic Weights Revised 2013.
- Eintrag zu selenium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu selenium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, 2005, ISBN 3-11-017485-5, S. 361.
- Eintrag zu Selenium im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Selen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- Jan Trofast: Berzelius' Discovery of Selenium. In: Chemistry International, 33.5., 2011.
- William Grylls Adams, Richard Evan Day: IX. The action of light on selenium. In: Philosophical Transactions of the Royal Society of London. 167, 1877, S. 313–349, doi:10.1098/rstl.1877.0009.
- Engen Obach: Research on selenium. In: Journal of the Society of Telegraph Engineers. 6.20, 1877, S. 498–506.
- M. E. Levinshtein, G. S. Simin: Earliest semiconductor device. Getting to Know Semiconductors. World Scientific, Singapore, New Jersey, London, Hong Kong, ISBN 978-981-02-3516-1, S. 77–79.
- Gerhard N. Schrauzer, Peter F. Surai: Selenium in human and animal nutrition: Resolved and unresolved issues. A partly historical treatise in commemoration of the fiftieth anniversary of the discovery of the biological essentiality of selenium, dedicated to the memory of Klaus Schwarz (1914–1978) on the occasion of the thirtieth anniversary of his death. In: Critical Reviews in Biotechnology. 29, 2009, S. 2–9, doi:10.1080/07388550902728261.
- A. Wassermann, Franz Keysser, Michael Wassermann: Beiträge zum Problem: Geschwülste von der Blutbahn aus therapeutisch zu beeinflussen. In: DMW - Deutsche Medizinische Wochenschrift. 37, 1911, S. 2389–2391, doi:10.1055/s-0028-1131175.
- Arthur Galston: Green Wisdom. The Blind Staggers. Basic Books, Inc. 1981. ISBN 978-0465027125, S. 57.
- Jane Pinsent: The need for selenite and molybdate in the formation of formic dehydrogenase by members of the Coli-aerogenes group of bacteria. In: Biochemical Journal. 57, 1954, S. 10–16, doi:10.1042/bj0570010.
- Klaus Schwarz, Calvin M. Foltz: Selenium as an integral part of Factor 3 against dietary necrotic liver degeneration. In: Journal of the American Chemical Society. 79, 1957, S. 3292–3293, doi:10.1021/ja01569a087.
- Susan J. Fairweather-Tait: Selenium in Human Health and Disease. In: Antioxidants & Redox Signaling, 14, 2011, S. 1337–1387, doi: 10.1089/ars.2010.3275.
- Ya. E. Yudovich, M. P. Ketris: Selenium in coal: A review. In: International Journal of Coal Geology. 67, 2006, S. 112–126, doi:10.1016/j.coal.2005.09.003.
- Byard W. Mosher, Robert A. Duce: A global atmospheric selenium budget. In: Journal of Geophysical Research. 92, 1987, S. 13289–13298, doi:10.1029/JD092iD11p13289.
- Selen-Gehalte überwachen. In: schweizerbauer.ch. 22. November 2018, abgerufen am 22. November 2018.
- Selen in der Umweltmedizin. In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. 49, 2006, S. 88, doi:10.1007/s00103-005-1185-4.
- Christine D. Thomson, Alexandra Chisholm, Sarah K. McLachlan, Jennifer M. Campbell: Brazil nuts: an effective way to improve selenium status. In: The American Journal of Clinical Nutrition. 87, 2008, S. 379–384, doi:10.1093/ajcn/87.2.379.
- Hauke Vollstaedt, Klaus Mezger, Ingo Leya: The selenium isotope composition of lunar rocks: Implications for the formation of the Moon and its volatile loss. In: Earth and Planetary Science Letters. 542, 2020, S 116289, doi:10.1016/j.epsl.2020.116289.
- Ian U. Roederer u. a.: New Detections of Arsenic, Selenium, and other heavy Elements in two metal-poor Stars. In: The Astrophysical Journal. 791, 2014, S. 32–44, doi:10.1088/0004-637X/791/1/32.
- G. Dreibus, H. Palme, B. Spettel, J. Zipfel, H. Wanke: Sulfur and selenium in chondritic meteorites. In: Meteoritics, 30, 1995, S. 439–445, doi:10.1111/j.1945-5100.1995.tb01150.x.
- Malcolm Back, William D. Birch, Michel Blondieau und andere: The New IMA List of Minerals – A Work in Progress – Updated: July 2021. (PDF; 3,52 MB) In: cnmnc.main.jp. IMA/CNMNC, Marco Pasero, Juli 2021, abgerufen am 10. August 2021 (englisch).
- Charles Palache: Contributions to crystallography: Claudetite; minasragrite; samsonite; native selenium; indium. In: American Mineralogist. Band 19, 1934, S. 194–205 (englisch, rruff.info [PDF; 599 kB; abgerufen am 10. August 2021]).
- United Verde Mine. In: Mineralienatlas Lexikon. Stefan Schorn u. a., abgerufen am 10. August 2021.
- Ernest H. Nickel, Monte C. Nichols: IMA/CNMNC List of Minerals 2009. (PDF; 1,82 MB) In: cnmnc.main.jp. IMA/CNMNC, Januar 2009, abgerufen am 11. August 2021 (englisch).
- David Barthelmy: Minerals Arranged by the New Dana Classification – 01.03 Native Elements with semi-metallic and non-metallic elements. In: webmineral.com. Abgerufen am 11. August 2021 (englisch).
- Selenium. In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.): Handbook of Mineralogy, Mineralogical Society of America. 2001 (englisch, handbookofmineralogy.org [PDF; 60 kB; abgerufen am 11. August 2021]).
- Localities for Selenium. In: mindat.org. Hudson Institute of Mineralogy, abgerufen am 11. August 2021 (englisch).
- David Barthelmy: Mineral Species containing Selenium (Se). In: webmineral.com. Abgerufen am 11. August 2021 (englisch).
- Search Minerals By Chemistry – Minerals that include Se. In: mindat.org. Hudson Institute of Mineralogy, abgerufen am 11. August 2021 (englisch).
- S. Ramachandra Rao: Resource Recovery and Recycling from Metallurgical Wastes. Elsevier, Oxford, Amsterdam, 2006, ISBN 978-0-08-045131-2, S. 425.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 8. Auflage. de Gruyter, 2011, ISBN 3-11-022566-2, S. 458.
- W. C. Butterman, R. D. Brown Jr.: Mineral Commodity Profiles: Selenium. USGS, Open File Report No. 2003-18. 2004.
- G. N. Schrauzer: Selenium yeast: Composition, quality, analysis, and safety. In: Pure and Applied Chemistry. 78, 2006, S. 105–109, doi:10.1351/pac200678010105.
- Eintrag zu allotropic transition. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00244 – Version: 3.0.1.
- Eintrag zu polymorphic transition. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.P04748 – Version: 3.0.1.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 618–646.
- Peter Paetzold: Chemie – Eine Einführung. Walter de Gruyter, Berlin 2009, ISBN 978-3-11-020268-7, S. 167.
- Olav Foss, Vitalijus Janickis: Crystal structure of γ-monoclinic selenium. In: J. Chem. Soc., Dalton Trans. 1980, S. 624–627, doi:10.1039/DT9800000624.
- N. F. Mott: Conduction in non-crystalline materials. In: Philosophical Magazine. 19, 1969, S. 835–852, doi:10.1080/14786436908216338.
- Ralf Steudel: Chemie der Nichtmetalle: Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 978-3-11-019448-7, S. 432.
- webelements.com
- ptb.de: Die Halbwertszeit von Se-79.
- G. Jörg, R. Bühnemann, S. Hollas, N. Kivel, K. Kossert, S. Van Winckel, Ch. Lierse v. Gostomski: Preparation of radiochemically pure 79Se and highly precise determination of its half-life. In: Applied Radiation and Isotopes, 68.12, 2010, S. 2339–2351, doi:10.1016/j.apradiso.2010.05.006.
- Patent DE60033511T2: Gamma-Strahlungsquelle. Veröffentlicht am 27. April 1999, Erfinder: Mark Golder, Aston Clinton. Patent über Gamma-Strahlungsquelle, die 75Se enthält.
- Torsten Kuwert, Frank Grünwald, Uwe Haberkorn, Thomas Krause (Hrsg.): Nuklearmedizin. Stuttgart 2008, ISBN 978-3-13-118504-4.
- Selenium and Tellurium. In: 2010 Minerals Yearbook. abgerufen am 31. Juli 2021.
- Ben Curnow: Diagnosis and management of the itchy horse. In: InPractice , 42.1, 2020, S. 47–55, doi:10.1136/inp.l6929.
- P. Oehme, W. Krause, E. Göres, N. Michael, O. Gomazkov: Selen in der Medizin. In: Arzneimitteltherapie. Heft 11, 1993, S. 355–357.
- U. Schweizer, A. U. Bräuer, J. Köhrle, R. Nitsch, N. E. Savaskan: Selenium and brain function: a poorly recognized liaison. In: Brain research. Brain research reviews. Band 45, Nummer 3, Juli 2004, S. 164–178, doi:10.1016/j.brainresrev.2004.03.004. PMID 15210302 (Review).
- D. Behne, A. Kyriakoupoulos, H. Meinhold, J. Köhrle: Identification of type I iodothyronine 5′-deiodinase as a selenoenzyme. In: Biochem. Biophys. Res. Comm. Nr. 173, 1990, S. 1143–1149, PMID 2268318.
- J. R. Arthur, F. Nicol, G. J. Beckett: Selenium deficiency, thyroid hormone metabolism, and thyroid hormone deiodinases. In: Am. J. Clinical Nutrition. Nr. 57, 1993, S. 236–239 (Abstract).
- C. Ekmekcioglu: Spurenelemente auf dem Weg ins 21. Jahrhundert – zunehmende Bedeutung von Eisen, Kupfer, Selen und Zink. In: Journal für Ernährungsmedizin. Nr. 2 (2), 2000, S. 18–23 (PDF – Ausgabe für Österreich).
- L. L. Stillings: Selenium. In: K. J. Schulz, J. H. DeYoung Jr., R. R. Seal II, D. C. Bradley (Hrsg.): Critical mineral resources of the United States—Economic and environmental geology and prospects for future supply. Kapitel Q, 2017, U.S. Geological Survey Professional Paper 1802, S. Q1–Q55, doi:10.3133/pp1802Q, ISSN 2330-7102.
- A. P. Kipp, D. Strohm, R. Brigelius-Flohé, L. Schomburg, A. Bechthold, E. Leschik-Bonnet, H. Heseker: Revised reference values for selenium intake. In: Journal of trace elements in medicine and biology : organ of the Society for Minerals and Trace Elements. Band 32, Oktober 2015, S. 195–199, doi:10.1016/j.jtemb.2015.07.005. PMID 26302929.
- K. S. Prabhu, X. G. Lei: Selenium. In: Advances in nutrition. Band 7, Nummer 2, März 2016, S. 415–417, doi:10.3945/an.115.010785. PMID 26980826, PMC 4785479 (freier Volltext).
- Scientific Committee on Food: Reports of the Scientific Commitees for Food. 31st series, 1993 (PDF)
- Scientific Committee on Food, Scientific Panel on Dietetic Products, Nutrition and Allergies: Tolerable upper intake levels of individual vitamins and minerals. 2006 (PDF)
- Anke Weißenborn u. a.: Höchstmengen für Vitamine und Mineralstoffe in Nahrungsergänzungsmitteln. In: Journal of Consumer Protection and Food Safety. 13, 2018, S. 25–39, doi:10.1007/s00003-017-1140-y.
- Selenium – Fact Sheet for Health Professionals, bei nih.gov, abgerufen am 10. August 2021.
- Europäische Behörde für Lebensmittelsicherheit: Scientific Opinion. In: EFSA Journal. Band 7, Nr. 9, 2009, S. 1220 doi:10.2903/j.efsa.2009.1220
- Europäische Behörde für Lebensmittelsicherheit: Scientific Opinion. In: EFSA Journal. Band 8, Nr. 10, 2010, S. 1727 doi:10.2903/j.efsa.2010.1727
- Gibt es Indikationen für eine Selengabe? In: Pharmainformation. Jahrgang 20, Nr. 2, Juni 2005, abgerufen am 29. Mai 2013.
- W. Krause, P. Oehme: Zur potentiellen Bedeutung von Selenverbindungen für die Medizin. Teil I: Selen als essentielles Spurenelement – Wirkungsmechanismen, Folgen eines Selenmangels. In: Dt. Gesundh.-Wesen. Band 34, 1979, S. 1713–1718.
- W. Krause, P. Oehme: Zur potentiellen Bedeutung von Selenverbindungen für die Medizin. Teil II: Einige Ansatzpunkte für die therapeutische Anwendung von Selenverbindungen. In: Dt. Gesundh.-Wesen. Band 34, 1979, S. 1769–1773.
- H. Hilse, P. Oehme, W. Krause, K. Hecht: Effect of sodium selenite on experimental hypertension in rat. In: Acta physiologica et pharmacologica bulgarica. Band 1, Nr. 3, 1979, S. 47–50.
- G. Matthes, H. A. Hackensellner, K. D. Wagenbreth, H. Wendtlandt, P. Oehme, K. D. Jentzsch: Zur Konzentrationsabhängigkeit der Selenwirkung im Rahmen der Kryokonservierung von Herzmuskelfragmenten. In: Probl. Häm. Transf. Transpl. Band 7, 1980, S. 174–231.
- Scott M. Lippman, Eric A. Klein u. a.: Effect of Selenium and Vitamin E on Risk of Prostate Cancer and Other Cancers. In: JAMA. 301, 2009, S. 39, doi:10.1001/jama.2008.864.
- Marco Vinceti u. a.: Selenium for preventing cancer. In: Cochrane Database of Systematic Reviews., doi:10.1002/14651858.CD005195.pub4.
- Gabriele Dennert, Markus Horneber: Selenium for alleviating the side effects of chemotherapy, radiotherapy and surgery in cancer patients. In: Cochrane Database of Systematic Reviews. 2017, doi:10.1002/14651858.CD005037.pub2.
- Reinhard Saller u. a.: Zur klinischen Bedeutung von Selen: Ein systematischer Review. In: Schweizerische Zeitschrift für Ganzheitsmedizin, 19.6, 2007, S. 333–340.
- Karen Rees, Louise Hartley, Camilla Day, Nadine Flowers, Aileen Clarke, Saverio Stranges: Selenium supplementation for the primary prevention of cardiovascular disease. In: Cochrane Database of Systematic Reviews. 2013, doi:10.1002/14651858.CD009671.pub2.
- S. Stranges, J. R. Marshall, R. Natarajan, R. P. Donahue, M. Trevisan, G. F. Combs, F. P. Cappuccio, A. Ceriello, M. E. Reid: Effects of Long-Term Selenium Supplementation on the Incidence of Type 2 Diabetes: A Randomized Trial. In: Annals of Internal Medicine. Band 147, Nr. 4, 2007, S. 217.
- Selenium exposure and the risk of type 2 diabetes: a systematic review and meta-analysis. In: European Journal of Epidemiology. Band 33, Nr. 9, 2018, S. 789–810. doi:10.1007/s10654-018-0422-8
- G. Schwedt: Analytische Chemie. Thieme Verlag, Stuttgart 1995, S. 197.
- J. E. Oldfield: Selenium: A historical perspective. In: D. L. Hatfield, M. J. Berry, V. N. Gladyshev (Hrsg.): Selenium. 2006, Springer, Boston, MA., ISBN 978-0-387-33826-2, S. 1–6.
- Cornelia A. Schlieper: Selen. In: Cornelia A. Schlieper: Grundfragen der Ernährung. Verlag Dr. Felix Büchner, 2000, ISBN 3-582-04475-0.
- Robert M. Russell (für die deutsche Ausgabe: Hans-Joachim F. Zunft): Vitamine und Spurenelemente – Mangel und Überschuss. In: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (Hrsg.): Harrisons Innere Medizin. Berlin 2003, ISBN 3-936072-10-8.
- Alain Krief, Michel Derock: Synthesis of diselenides and selenides from elemental selenium. In: Tetrahedron Letters. 43, 2002, S. 3083–3086, doi:10.1016/S0040-4039(02)00277-0.
- J. Beck: Rings, cages and chains – The rich structural chemistry of the polycations of the chalcogens. In: Coordination Chemistry Reviews. 163, 1997, S. 55–70, doi:10.1016/S0010-8545(97)00009-X.

