Ytterbium
Ytterbium [ʏˈtɛrbiʊm, ] ist ein chemisches Element mit dem Elementsymbol Yb und der Ordnungszahl 70. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der Seltenen Erden. Wie die anderen Lanthanoide ist Ytterbium ein silberglänzendes Schwermetall. Die Eigenschaften des Ytterbiums folgen nicht der Lanthanoidenkontraktion, und auf Grund seiner Elektronenkonfiguration besitzt das Element eine deutlich geringere Dichte sowie einen niedrigeren Schmelz- und Siedepunkt als die benachbarten Elemente.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Ytterbium, Yb, 70 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Lanthanoide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | La, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-173-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.339 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 2,5 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 173,045(10)[3][4] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 175 (222) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 187 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f14 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.254160(12) eV[5] ≈ 603.43 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 12.179185(25) eV[5] ≈ 1175.11 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 25.053(25) eV[5] ≈ 2417.2 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 43.61(4) eV[5] ≈ 4210 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 65.6(3) eV[5] ≈ 6330 kJ/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | Kubisch-flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 6,973 g/cm3 (25 °C)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 3,4 · 10−5)[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1097 K (824 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 1703 K[10] (1430 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 24,84 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 159 kJ·mol−1[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 7,6 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 1590 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 4,0 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 39 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [11] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2, 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,22 V (Yb3+ + 3 e− → Yb) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ytterbium wurde 1878 von Jean Charles Galissard de Marignac bei der Untersuchung von Gadolinit entdeckt. 1907 trennten Georges Urbain, Carl Auer von Welsbach und Charles James unabhängig voneinander ein weiteres Element, das Lutetium, von Marignacs Ytterbium ab. Der bisherige Name wurde dabei nach längerer Diskussion entgegen den Wünschen Welsbachs, der Aldebaranium vorgeschlagen hatte, beibehalten.
Technisch werden das Element und seine Verbindungen auf Grund der komplizierten Abtrennung von den anderen Lanthanoiden nur in geringen Mengen, unter anderem als Dotierungsmittel für Yttrium-Aluminium-Granat-Laser genutzt. Ytterbium(III)-chlorid und Ytterbium(II)-iodid sind Reagenzien in verschiedenen organischen Synthesereaktionen.
Geschichte

Ytterbium wurde 1878 vom Schweizer Chemiker Jean Charles Galissard de Marignac entdeckt. Er untersuchte Gadolinit genauer und versuchte durch Zersetzung von Nitraten in heißem Wasser das unlösliche Erbium von den anderen Mineralbestandteilen abzutrennen. Dabei entdeckte er, dass die erhaltenen Kristalle nicht einheitlich aus rotem Erbiumnitrat bestanden, sondern weitere farblose Kristalle zurückblieben. Das gemessene Absorptionsspektrum zeigte, dass es sich um Kristalle eines bislang unbekannten Elements handeln muss. Dieses nannte er nach dem Fundort des Gadolinites in Ytterby (Schweden) sowie wegen der Ähnlichkeit zum Yttrium Ytterbium. Eine Trennung der beiden Elemente gelang in einem anderen Experiment durch die Zugabe von hyposchwefliger Säure zu einer Lösung der Chloride.[13][14]
1907 erkannten unabhängig voneinander der Franzose Georges Urbain, der Österreicher Carl Auer von Welsbach und der Amerikaner Charles James, dass das von Marignac gefundene Ytterbium kein Reinelement ist, sondern ein Gemisch zweier Elemente darstellt. Sie konnten dieses Gemisch in das nun reine Ytterbium und in Lutetium trennen. Dabei nannte Carl Auer von Welsbach die Elemente Aldebaranium (nach dem Stern Aldebaran) und Cassiopeium, während Urbain Neoytterbium und Lutetium als Namen festlegte.[15][16] 1909 wurde vom internationalen Atomgewichts-Ausschuss, bestehend aus Frank Wigglesworth Clarke, Wilhelm Ostwald, Thomas Edward Thorpe und Georges Urbain, bestimmt, dass Urbain die Entdeckung des Lutetiums zusteht und damit auch die von ihm bestimmten Namen Bestand haben.[17] Es wurde jedoch für das Ytterbium der alte Name Marignacs beibehalten.
Elementares Ytterbium wurde erstmals 1936 von Wilhelm Klemm und Heinrich Bommer erhalten. Sie gewannen das Metall durch Reduktion von Ytterbium(III)-chlorid mit Kalium bei 250 °C. Weiterhin bestimmten sie die Kristallstruktur und die magnetischen Eigenschaften des Metalls.[18]
Vorkommen
Ytterbium ist auf der Erde ein seltenes Element, seine Häufigkeit in der kontinentalen Erdkruste beträgt etwa 3,2 ppm.[19]
Ytterbium kommt als Bestandteil von Seltenerd-Mineralen, vor allem denjenigen des Yttriums und der schwereren Lanthanoide wie Xenotim und Gadolinit vor. So enthält Xenotim aus Malaysia bis zu 6,2 % Ytterbium. Ceriterden wie Monazit und Bastnäsit enthalten dagegen geringere Anteile an Ytterbium, so enthält Monazit je nach Lagerstätte zwischen 0,12 und 0,5 % des Elements.[20]
Es sind mehrere seltene Minerale bekannt, in denen Ytterbium das häufigste Seltenerdmetall ist. Dazu zählen Xenotim-(Yb) mit einem Anteil von 32 Gewichtsprozent Ytterbium am Mineral und der Verhältnisformel (Yb0,40Y0,27Lu0,12Er0,12Dy0,05Tm0,04Ho0,01)PO4[21] und Keiviit-(Yb) mit der Verhältnisformel (Yb1,43Lu0,23Er0,17Tm0,08Y0,05Dy0,03Ho0,02)2Si2O7.[22] Diese Minerale sind jeweils Teile einer Mischkristallreihe, aus der auch andere natürlich vorkommende Zusammensetzungen, vor allem mit Yttrium als Hauptbestandteil, bekannt sind.
Wichtigste Quellen für Ytterbium sind die Monazit- und Xenotimvorkommen in China und Malaysia (dort als Begleitmineral von Kassiterit). Auf Grund der geringen Nachfrage wird die Situation der Versorgung mit Ytterbium nicht als kritisch angesehen.[23]
Gewinnung und Darstellung

Die Gewinnung von Ytterbium ist vor allem durch die schwierige Trennung der Lanthanoide kompliziert und langwierig. Die Ausgangsminerale wie Monazit oder Xenotim werden zunächst mit Säuren oder Laugen aufgeschlossen und in Lösung gebracht. Die Trennung des Ytterbiums von den anderen Lanthanoiden ist dann durch verschiedene Methoden möglich, wobei die Trennung durch Ionenaustausch die technisch wichtigste Methode für Ytterbium, wie auch für andere seltene Lanthanoide, darstellt. Dabei wird die Lösung mit den seltenen Erden auf ein geeignetes Harz aufgetragen, an das die einzelnen Lanthanoid-Ionen unterschiedlich stark binden. Anschließend werden sie in einer Trennsäule mit Hilfe von Komplexbildnern wie EDTA, DTPA oder HEDTA vom Harz gelöst, und durch die unterschiedlich starke Bindung am Harz erzielt man somit die Trennung der einzelnen Lanthanoide.[20][24][25]
Eine chemische Trennung ist über unterschiedliche Reaktionen von Ytterbium-, Lutetium- und Thuliumacetat mit Natriumamalgam möglich. Dabei bildet Ytterbium ein Amalgam, während die Lutetium- und Thuliumverbindungen nicht reagieren.[26]
Die Gewinnung metallischen Ytterbiums kann durch Elektrolyse einer Schmelze aus Ytterbium(III)-fluorid und Ytterbium(III)-chlorid erfolgen, mit Alkali- oder Erdalkalimetallhalogeniden zur Schmelzpunktreduktion, sowie flüssigem Cadmium oder Zink als Kathode. Daneben lässt es sich auch durch metallothermische Reduktion von Ytterbium(III)-fluorid mit Calcium, oder Ytterbium(III)-oxid mit Lanthan oder Cer herstellen. Wird die letzte Reaktion im Vakuum ausgeführt, destilliert Ytterbium ab und kann so von anderen Lanthanoiden getrennt werden.[20]
Eigenschaften
Physikalische Eigenschaften
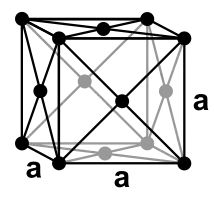
Ytterbium ist wie die anderen Lanthanoide ein silberglänzendes, weiches Schwermetall. Es besitzt mit 6,973 g/cm3 eine ungewöhnlich niedrige Dichte, die deutlich niedriger ist als diejenige der benachbarten Lanthanoide wie Thulium bzw. Lutetium und vergleichbar mit der von Neodym oder Praseodym ist. Vergleichbares gilt auch für den verhältnismäßig niedrigen Schmelzpunkt von 824 °C und den Siedepunkt von 1430 °C (Lutetium: Schmelzpunkt 1652 °C, Siedepunkt 3330 °C). Diese Werte stehen der sonst geltenden Lanthanoidenkontraktion entgegen und werden durch die Elektronenkonfiguration [Xe] 4f14 6s2 des Ytterbiums verursacht. Durch die vollständig gefüllte f-Schale stehen nur zwei Valenzelektronen für metallische Bindungen zur Verfügung und es kommt daher zu geringeren Bindungskräften und zu einem deutlich größeren Metallatomradius.[27]
Es sind drei verschiedene Kristallstrukturen bei Atmosphärendruck sowie drei weitere Hochdruckmodifikationen des Ytterbiums bekannt. Bei Raumtemperatur kristallisiert das Metall in einer kubisch-dichtesten Kugelpackung mit dem Gitterparameter a = 548,1 pm.[28] Bei höheren Temperaturen und Drücken geht diese Struktur in eine kubisch-innenzentrierte Kugelpackung über, wobei bei Atmosphärendruck die Übergangstemperatur bei etwa 770 °C, und bei Raumtemperatur der Übergangsdruck bei 4 GPa liegt.[29] Bei tiefen Temperaturen ist eine hexagonal-dichteste Struktur stabil, wobei der strukturelle Phasenübergang, welcher zwischen 0 und 45 °C liegt, stark abhängig ist von Reinheit, Druck und Spannungen im Metall. Diese Phasen besitzen unterschiedlichen Magnetismus. Während die hexagonale Phase (wie durch die vollständig besetzten Orbitale zu erwarten) diamagnetisch ist, zeigt die kubisch-flächenzentrierte Struktur Paramagnetismus (wahrscheinlich durch geringe Mengen Yb3+ im Metall).[30]
Die Reihenfolge der Hochdruckmodifikationen entspricht nicht der bei anderen Lanthanoiden häufig zu findenden Reihenfolge. So sind keine Modifikationen des Ytterbiums mit einer doppelt-hexagonal-dichtesten Struktur oder einer Samarium-Struktur bekannt. Auf die ab 4 GPa stabile kubisch-innenzentrierte Struktur folgt bei 26 GPa eine hexagonal-dichteste Phase. Der nächste Phasenübergang erfolgt bei weiterer Druckerhöhung bei 53 GPa und oberhalb dieses Druckes bildet sich wiederum eine kubisch-dichteste Struktur aus. Ein weiterer bekannter Phasenübergang erfolgt bei 98 GPa. Ab diesem Druck ist bis mindestens 202 GPa eine hexagonale Struktur am stabilsten, mit der Raumgruppe P3121 (Raumgruppen-Nr. 152), was auch hP3-Struktur genannt wird. Mit der Druckerhöhung erfolgt auch eine Änderung der Elektronenstruktur des Ytterbiums, wobei ein Elektron vom f-Orbital in ein d-Orbital übergeht, und die Elektronenkonfiguration ist dann wie bei anderen Lanthanoiden dreiwertig (trivalent).[31]
Chemische Eigenschaften
Ytterbium ist ein typisches unedles Metall, das vor allem bei höheren Temperaturen mit den meisten Nichtmetallen reagiert. Mit Sauerstoff reagiert es bei Standardbedingungen an trockener Luft langsam, schneller bei Anwesenheit von Feuchtigkeit. Feinverteiltes metallisches Ytterbium ist, wie andere unedle Metalle, an Luft und unter Sauerstoff entzündlich. Mischungen von feinverteiltem Ytterbium und Organohalogenverbindungen wie Hexachlorethan oder Polytetrafluoroethylen brennen mit smaragdgrüner Flamme.[32] Die Reaktion von Ytterbium mit Wasserstoff ist keine vollständige, denn der Wasserstoff tritt in die Oktaederlücken der Metallstruktur ein und es bilden sich nicht-stöchiometrische Hydrid-Phasen aus, wobei die Zusammensetzung von der Temperatur und dem Wasserstoffdruck abhängt.[27][20]
In Wasser löst sich Ytterbium nur langsam, in Säuren schneller unter Wasserstoffbildung. In Lösung liegen meist dreiwertige, farblose Ytterbiumionen in Form des Hydrates [Yb(H2O)9]3+vor. Das gelbgrüne zweiwertige Ytterbiumion ist in wässriger Lösung nicht stabil, es oxidiert unter Wasserstoffbildung mit einer Halbwertszeit von etwa 2,8 Stunden zum dreiwertigen Ion.[27] Wird Ytterbium in flüssigem Ammoniak gelöst, bildet sich wie bei Natrium durch solvatisierte Elektronen eine blaue Lösung.[33]
Isotope
Es sind insgesamt 33 Isotope zwischen 148Yb und 181Yb sowie weitere 12 Kernisomere des Ytterbiums bekannt. Von diesen kommen sieben mit unterschiedlicher Häufigkeit in der Natur vor. Das Isotop mit dem größten Anteil an der natürlichen Isotopenzusammensetzung ist 174Yb mit einem Anteil von 31,8 %, gefolgt von 172Yb mit 21,9 %, 173Yb mit 16,12 %, 171Yb mit 14,3 % und 176Yb mit 12,7 %. 170Yb und 168Yb sind mit Anteilen von 3,05 bzw. 0,13 % deutlich seltener.[34]
Das radioaktive Isotop 169Yb mit einer Halbwertszeit von 32 Tagen entsteht zusammen mit dem kurzlebigen 175Yb (Halbwertszeit 4,2 Tage) durch Neutronenaktivierung bei der Bestrahlung von Ytterbium in Kernreaktoren. Es kann als Gammastrahlenquelle, etwa in der Nuklearmedizin und Radiographie, genutzt werden.[35][33]
Verwendung
Ytterbium und seine Verbindungen werden nur in sehr geringem Umfang kommerziell eingesetzt. Als Legierungsbestandteil verbessert es die Kornfeinung, Festigkeit und mechanischen Eigenschaften rostfreien Stahls. Es wurde untersucht, Ytterbiumlegierungen in der Zahnmedizin zu nutzen.[36]
Ytterbium wird wie andere Lanthanoide als Dotierungsmittel für Yttrium-Aluminium-Granat-Laser (Yb:YAG-Laser) genutzt. Vorteile gegenüber Nd:YAG-Lasern liegen in der höheren möglichen maximalen Dotierung, einer längeren Lebensdauer des höheren Energieniveaus sowie einer größeren Absorptions-Bandbreite.[37] Auch in Faserlasern ist Ytterbium ein wichtiges Dotierungsmittel, das auf Grund ähnlicher Vorteile wie beim YAG-Laser besonders für Hochleistungsfaserlaser genutzt werden kann. Dazu zählen die hohe Dotierung, ein großer Absorptionsbereich zwischen 850 und 1070 nm und ebenso der große Emissionsbereich zwischen 970 und 1200 nm.[38]
Experimentell wurde Ytterbium als Alternative zu Caesium für den Betrieb von Atomuhren untersucht. Dabei konnte eine viermal so hohe Präzision wie bei einer Caesium-Atomuhr gemessen werden.[39]
Ytterbium wird zurzeit als Ersatz für Magnesium in schweren Wirkladungen für kinematische Infrarottäuschkörper untersucht. Dabei zeigt Ytterbium aufgrund einer deutlich höheren Emissivität von Ytterbium(III)-oxid im Infrarotbereich im Vergleich zu Magnesiumoxid eine höhere Strahlungsleistung als herkömmliche Wirkmassen auf der Basis von Magnesium/Teflon/Viton (MTV).[40]
Biologische Bedeutung und Toxizität
Ytterbium kommt nur in minimalen Mengen im Körper vor und besitzt keine biologische Bedeutung. Nur wenige Lebewesen wie Flechten sind in der Lage, Ytterbium aufzunehmen, und besitzen Ytterbiumgehalte von über 900 ppb.[36] Bei Braunalgen (Sargassum polycystum) wurde eine Biosorption von 0,7 bis 0,9 mmol·g−1 gemessen.[41]
Ytterbium und seine löslichen Verbindungen sind leicht toxisch, für Ytterbium(III)-chlorid wurde bei Mäusen ein LD50-Wert von 395 mg/kg für intraperitoneale und 6700 mg/kg für perorale Gabe bestimmt. Im Tierversuch an Kaninchen reizt Ytterbiumchlorid die Augen nur leicht und Haut nur bei Verletzungen.[42] Ytterbium gilt als teratogen; in einer Studie mit Goldhamster-Embryos wurden nach Gabe von Ytterbiumchlorid Skelettänderungen wie zusammengewachsene oder zusätzliche Rippen oder Veränderungen an der Wirbelsäule festgestellt.[43]
Verbindungen
Es sind Verbindungen des Ytterbiums in der Oxidationsstufe +2 und +3 bekannt, wobei wie bei allen Lanthanoiden +3 die häufigere und stabilere Stufe ist.
Halogenide
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Ytterbium zwei Reihen von Salzen mit den Formeln YbX2 und YbX3. Die Dihalogenide oxidieren dabei leicht zu den Trihalogeniden, bei höheren Temperaturen disproportionieren sie zu Ytterbiumtrihalogeniden und Ytterbium.
Mehrere Ytterbiumhalogenide werden als Reagenz in organischen Synthesen verwendet. So ist Ytterbium(III)-chlorid eine Lewis-Säure und kann als Katalysator etwa in Aldol-Reaktionen,[44] Diels-Alder-Reaktionen oder Allylierungen genutzt werden.[45] Ytterbium(II)-iodid kann wie Samarium(II)-iodid als Reduktionsmittel oder für Kupplungsreaktionen eingesetzt werden.[46]
Ytterbium(III)-fluorid wird als inerter und nicht giftiger Füllstoff in der Zahnmedizin verwendet. Es setzt kontinuierlich das für die Zahngesundheit wichtige Fluorid frei und ist zudem ein gutes Röntgenkontrastmittel.[47]
Metallorganische Verbindungen
Es sind eine Reihe von metallorganischen Verbindungen bekannt. Verbindungen mit einer Sigma-Bindung zwischen Ytterbium und Kohlenstoff sind nur in geringem Umfang bekannt, da es bei diesen wie bei vielen Übergangsmetallen leicht zu Folgereaktionen wie β-Hydrideliminierungen kommt. Sie sind daher mit sterisch anspruchsvollen Resten wie der tert-Butylgruppe oder einer größeren Zahl kleiner Reste wie in einem Hexamethylytterbat-Komplex [Yb(CH3)6]3+ stabil. Die wichtigsten Liganden des Ytterbiums sind Cyclopentadienyl und dessen Derivate. Sandwichkomplexe des Ytterbiums sind nicht mit Cyclopentadienyl, sondern nur mit größeren Liganden wie Pentaphenylcyclopentadienyl bekannt.[48] Weiterhin kennt man Komplexe mit η5 koordinierten Cyclopentadienyl-Liganden: CpYbX2, Cp2YbX und Cp3Yb (X kann dabei ein Halogenid, Hydrid, Alkoxid oder weiteres sein).[49]
Weitere Verbindungen
Mit Sauerstoff reagiert Ytterbium zu Ytterbium(III)-oxid, Yb2O3, das wie die anderen dreiwertigen Oxide der schwereren Lanthanoide in der kubischen Lanthanoid-C-Struktur kristallisiert. Dieses lässt sich durch Reaktion mit elementarem Ytterbium zu Ytterbium(II)-oxid reduzieren, das in einer Natriumchlorid-Struktur kristallisiert.[27]
Eine Übersicht über Ytterbiumverbindungen bietet die Kategorie:Ytterbiumverbindung.
In der Popkultur
In der Serie Warehouse 13 befindet sich die Büchse der Pandora in einer Kammer aus Ytterbium im Warehouse, bis dieses zerstört wird und die Hoffnung die Büchse verlässt.
Literatur
- Ian McGill: Rare Earth Elements. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a22_607.
Weblinks
- Eintrag zu Ytterbium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Februar 2012.
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Ytterbium) entnommen.
- Standard Atomic Weight of Ytterbium Revised, 24 Aug 2015 16:53 ciaaw.org
- iupac.org.
- Eintrag zu ytterbium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu ytterbium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Ytterbium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1579.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Ytterbium) entnommen.
- Datenblatt Ytterbium bei Sigma-Aldrich, abgerufen am 26. April 2017 (PDF).
- Jean Charles Galissard de Marignac: Sur l’ytterbine, terre nouvelle, contenu dans la gadolinite. In: Comptes Rendus. 87, 1878, S. 578–581 (Digitalisat auf Gallica).
- Per Enghag: Encyclopedia of the elements: technical data, history, processing, applications. John Wiley & Sons, 2004, ISBN 3-527-30666-8, S. 448 (eingeschränkte Vorschau in der Google-Buchsuche).
- C. Auer v. Welsbach: Die Zerlegung des Ytterbiums in seine Elemente. In: Monatshefte für Chemie. 29, 1908, S. 181–225, doi:10.1007/BF01558944.
- M. G. Urbain: Un nouvel élément, le lutécium, résultant du dédoublement de l'ytterbium de Marignac. In: Comptes rendus. 145, 1908, S. 759–762 (Digitalisat auf Gallica).
- F. W. Clarke, W. Ostwald, T. E. Thorpe, G. Urbain: Bericht des Internationalen Atomgewichts-Ausschusses fuer 1909. In: Berichte der deutschen chemischen Gesellschaft. 42, 1909, S. 11–17, doi:10.1002/cber.19090420104.
- W. Klemm, H. Bommer: Zur Kenntnis der Metalle der seltenen Erden. In: Zeitschrift für anorganische und allgemeine Chemie. 231, 1937, S. 138–171, doi:10.1002/zaac.19372310115.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea, S. 14-18.
- Ian McGill: Rear Earth Elements. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a22_607.
- Harvey M. Buck, Mark A. Cooper, Petr Cerny, Joel D. Grice, Frank C. Hawthorne: Xenotime-(Yb), YbPO4, a new mineral species from the Shatford Lake pegmatite group, southeastern Manitoba, Canada. In: Canadian Mineralogist. 37, 1999, S. 1303–1306 (Abstract in American Mineralogist, S. 1324.; PDF; 81 kB).
- A. V. Voloshin, Ya. A. Pakhomovsky, F. N. Tyusheva: Keiviite Yb2Si2O7, a new ytterbium silicate from amazonitic pegmatites of the Kola Peninsula. In: Mineralog. Zhurnal. 5-5, 1983, S. 94–99 (Abstract in American Mineralogist, S. 1191.; PDF; 853 kB).
- Harald Elsner: Kritische Versorgungslage mit schweren Seltenen Erden – Entwicklung „Grüner Technologien“ gefährdet? In: Commodity Top News. Nr. 36, 2011. (pdf)
- V. M. Gelis, E. A. Chuveleva, L. A. Firsova, E. A. Kozlitin, I. R. Barabanov: Optimization of Separation of Ytterbium and Lutetium by Displacement Complexing Chromatography. In: Russian Journal of Applied Chemistry. 78, 2005, S. 1420–1426, doi:10.1007/s11167-005-0530-6.
- Halina Hubicka, Dorota Drobek: Anion-exchange method for separation of ytterbium from holmium and erbium. In: Hydrometallurgy. 47, 1997, S. 127–136, doi:10.1016/S0304-386X(97)00040-6.
- Joseph K. Marsh: 4. Rare-earth metal amalgams. Part III. The separation of ytterbium from its neighbours. In: Journal of the Chemical Society (Resumed). 1943, S. 8, doi:10.1039/JR9430000008.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1938–1944.
- H. T. Hall, J. D. Barnett, L. Merrill: Ytterbium: Transition at High Pressure from Face-Centered Cubic to Body-Centered Cubic Structure. In: Science. 139, 1963, S. 111–112, doi:10.1126/science.139.3550.111.
- A. Jayaraman: Fusion Curve of Europium, Fusion, and fcc-bcc Transformation in Ytterbium at High Pressures. In: Physical Review. 135, 1964, S. A1056–A1059, doi:10.1103/PhysRev.135.A1056.
- E. Bucher, P. Schmidt, A. Jayaraman, K. Andres, J. Maita, K. Nassau, P. Dernier: New First-Order Phase Transition in High-Purity Ytterbium Metal. In: Physical Review B. 2, 1970, S. 3911–3917, doi:10.1103/PhysRevB.2.3911.
- Gary Chesnut, Yogesh Vohra: Structural and Electronic Transitions in Ytterbium Metal to 202 GPa. In: Physical Review Letters. 82, 1999, S. 1712–1715, doi:10.1103/PhysRevLett.82.1712.
- Ernst-Christian Koch, Volker Weiser, Evelin Roth, Sebastian Knapp, Stefan Kelzenberg: Combustion of Ytterbium Metal. In: Propellants, Explosives, Pyrotechnics. 37, 2012, S. 9–11, doi:10.1002/prep.201100141.
- Eintrag zu Ytterbium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Februar 2012.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- R. Halmshaw: Industrial radiology: theory and practice. 2. Auflage. Springer, 1995, ISBN 0-412-62780-9, S. 60–61 (eingeschränkte Vorschau in der Google-Buchsuche).
- John Emsley: Nature's building blocks: an A-Z guide to the elements. Oxford University Press, 2001, ISBN 0-19-850341-5, S. 492–494 (eingeschränkte Vorschau in der Google-Buchsuche).
- John C. Ion: Laser processing of engineering materials: principles, procedure and industrial application. Butterworth-Heinemann, 2005, ISBN 0-7506-6079-1, S. 97 (eingeschränkte Vorschau in der Google-Buchsuche).
- Michel J. F. Digonnet: Rare-Earth-Doped Fiber Lasers and Amplifiers. 2. Auflage. CRC Press, 2001, ISBN 0-8247-4164-1, S. 167–170 (eingeschränkte Vorschau in der Google-Buchsuche).
- N. Lemke, A. Ludlow, Z. Barber, T. Fortier, S. Diddams, Y. Jiang, S. Jefferts, T. Heavner, T. Parker, C. Oates: Spin-1/2 Optical Lattice Clock. In: Physical Review Letters. 103, 2009, S. 063001–063004, doi:10.1103/PhysRevLett.103.063001.
- Ernst-Christian Koch, Arno Hahma: Metal-Fluorocarbon Pyrolants. XIV: High Density-High Performance Decoy Flare Compositions Based on Ytterbium/Polytetrafluoroethylene/Viton®. In: Zeitschrift für anorganische und allgemeine Chemie. 2012, S. 721–724, doi:10.1002/zaac.201200036.
- Vivian Diniz, Bohumil Volesky: Biosorption of La, Eu and Yb using Sargassum biomass. In: Water Research. 39, 2005, S. 239–247, doi:10.1016/j.watres.2004.09.009.
- Thomas J. Haley, N. Komesu, A.M. Flesher, L. Mavis, J. Cawthorne, H.C. Upham: Pharmacology and toxicology of terbium, thulium, and ytterbium chlorides. In: Toxicology and Applied Pharmacology. 5, 1963, S. 427–436, doi:10.1016/0041-008X(63)90014-0.
- T.F. Gale: The embryotoxicity of ytterbium chloride in golden hamsters. In: Teratology. 11, 1975, S. 289–295. PMID 807987.
- Sha Lou, John A. Westbrook, Scott E. Schaus: Decarboxylative Aldol Reactions of Allyl β-keto Esters via Heterobimetallic Catalysis. In: Journal of the American Chemical Society. 126, 2004, S. 11440–11441, doi:10.1021/ja045981k.
- Xinggao Fang, John G. Watkin, Benjamin P. Warner: Ytterbium trichloride-catalyzed allylation of aldehydes with allyltrimethylsilane. In: Tetrahedron Letters. 41, 2000, S. 447–449, doi:10.1016/S0040-4039(99)02090-0.
- P. Girard, J. L. Namy, H. B. Kagan: Divalent lanthanide derivatives in organic synthesis. 1. Mild preparation of samarium iodide and ytterbium iodide and their use as reducing or coupling agents. In: Journal of the American Chemical Society. 102, 1980, S. 2693–2698, doi:10.1021/ja00528a029.
- Per Enghag: Encyclopedia of the elements: technical data, history, processing, applications. John Wiley & Sons, 2004, ISBN 3-527-30666-8, S. 490 (eingeschränkte Vorschau in der Google-Buchsuche).
- Glen B. Deacon, Craig M. Forsyth, Florian Jaroschik, Peter C. Junk, Danielle L. Kay, Thomas Maschmeyer, Anthony F. Masters, Jun Wang, Leslie D. Field: Accessing Decaphenylmetallocenes of Ytterbium, Calcium, and Barium by Desolvation of Solvent-Separated Ion Pairs: Overcoming Adverse Solubility Properties. In: Organometallics. 27, 2008, S. 4772–4778, doi:10.1021/om800501z.
- Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner Wiesbaden, 2008, ISBN 978-3-8351-0167-8, S. 573–583.

