Essigsäure
Essigsäure (systematisch Ethansäure, lateinisch acidum aceticum) ist eine farblose, ätzende, hygroskopische, brennbare Flüssigkeit aus der Gruppe der Carbonsäuren. Es handelt sich um eine einfache Carbonsäure der Zusammensetzung C2H4O2 und der Halbstrukturformel CH3COOH. Sie weist einen charakteristischen sauren Geschmack und Geruch auf. Sie ist eine schwache Säure, die in wässriger Lösung nur teilweise dissoziiert.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
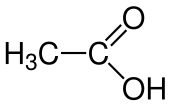 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Essigsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C2H4O2 | |||||||||||||||||||||
| Kurzbeschreibung |
stechend riechende Flüssigkeit mit charakteristischem Geruch[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 60,05 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,05 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
118 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
4,76[4] | |||||||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser (20 °C)[3] | |||||||||||||||||||||
| Dipolmoment | ||||||||||||||||||||||
| Brechungsindex |
1,3726 (20 °C, λ = 589,3 nm)[6] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
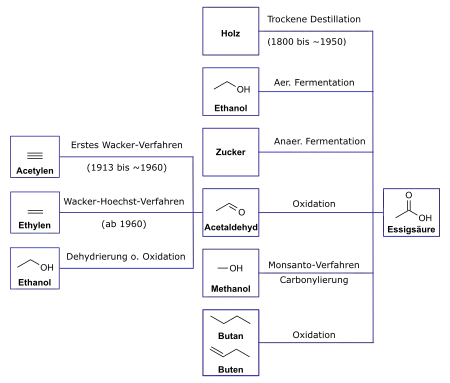
Essigsäure ist eine wichtige Industriechemikalie zur Herstellung von Polymeren wie Polyvinylacetat oder Celluloseacetat. Der globale Bedarf betrug 2014 etwa zehn Millionen Jahrestonnen.[10] Essigsäure für industrielle Zwecke wird meist durch die Carbonylierung von Methanol oder durch die Oxidation von Acetaldehyd gewonnen.
Die im Haushalt verwendete Essigsäure, in verdünnter wässriger Lösung als Essig bezeichnet, wird ausschließlich durch Essigsäuregärung von Ethanol gewonnen. Als Lebensmittelzusatzstoff trägt sie die E-Nummer E 260. Neben der Verwendung als Lebensmittel wird verdünnte Essigsäure als Entkalkungsmittel eingesetzt.
Nomenklatur
Die International Union of Pure and Applied Chemistry (IUPAC), eine Institution, die unter anderem Empfehlungen zur Nomenklatur und Terminologie von chemischen Verbindungen vergibt, bevorzugt den Trivialnamen Essigsäure als Standardnamen. Zugleich hat die IUPAC den Namen Ethansäure als systematischen Namen festgelegt, der sich aus der substitutiven Nomenklatur ergibt.[11]
Der englische Namensbestandteil acetic, der deutsche Name des Essigsäure-Anions, Acetat, und die veralteten Namen Acetylsäure und Acetoxylsäure leiten sich vom lateinischen Wort für Essig, acetum, ab.[12] In den chemischen Kurzbezeichnungen AcOH oder HAc steht das Ac für die Acetylgruppe respektive die Acetoxygruppe, OH steht für die OH-Gruppe der Carboxygruppe und H für das Proton der Säure.
Die Bezeichnung Eisessig bezieht sich auf die Eigenschaft von wasserfreier Essigsäure, bei einer Temperatur von 16,6 °C oder niedriger zu eisähnlichen Kristallen zu gefrieren.[13] Der Name Holzessig bezieht sich auf Essigsäure, die aus der trockenen Destillation von Holz gewonnen wurde. Die Namen Methylameisensäure, Methancarbonsäure und Methylcarbonsäure stammen aus älteren substitutiven Nomenklaturen.
Geschichte
Die europäische und die asiatische Küche nutzen Essig seit vielen Jahrhunderten als Würzmittel zur Säuerung und zur Konservierung von Lebensmitteln. Auch die Verwendung als Ingredienz kosmetischer Mittel im alten Ägypten ist belegt.[14] In Europa geht die Verwendung als Lebensmittel bis in die Antike zurück. Posca, ein Getränk aus Essigwasser, war ein nichtalkoholisches Getränk im Römischen Reich. Der antibakteriell wirkende Essig erlaubte den Genuss von möglicherweise mikrobiologisch belastetem Wasser.[15] Bekannt war damals bereits die chemische Verwendung der Essigsäure. Im dritten Jahrhundert vor Christus beschrieb der griechische Philosoph und Naturforscher Theophrastos von Eresos die Einwirkung von Essig auf Blei zur Herstellung von Bleiweiß, ein im Altertum bedeutendes Weißpigment.[16] Noch zu Ende des 18. und Beginn des 19. Jahrhunderts herrschte die Meinung, Essigsäure sei die einzige pflanzliche Säure und alle anderen beständen aus ihren zusammengesetzten Formen. Carl Wilhelm Scheele widerlegte dies 1786 durch die Isolierung der Gallussäure. Es brauchte jedoch lange, bis sich die Erkenntnis allgemein durchsetzte.[17] 1814 ermittelte Jöns Jakob Berzelius die Zusammensetzung der Essigsäure.[18] Im 18. Jahrhundert galt die Anwendung von „Pestessig“ oder „Vierräuberessig“, ein Kräuterauszug auf Essigbasis, als Schutz vor ansteckenden Krankheiten. Vor dem Kontakt mit Kranken sollten damit der Mund und die Nase ausgespült und die Hände gewaschen werden.[19]
Fermentation von Wein

Wie bei dem bekannten Aceto balsamico in der italienischen Region Modena gewannen die Hersteller den Essig traditionell aus Wein, der offen stehengelassen wurde und dabei vergor. Das im Mittelalter in Frankreich entwickelte Orléans-Verfahren (Offene Gärung) gewann den Essig aus Wein, der in große und flache Bottiche gefüllt und offen hingestellt wurde. Taufliegen, auch als Frucht- oder Essigfliegen bekannt, trugen Essigsäurebakterien ein, die eine Kahmhaut auf der Weinoberfläche bildeten, die sogenannte Essigmutter.[20] Nach diesem Verfahren werden heute noch hochwertige Weinessige hergestellt.
Eine Weiterentwicklung erfolgte im 19. Jahrhundert durch das Schüzenbach-Verfahren, auch Schnellessig- oder Fesselverfahren genannt, und dem Rundpumpverfahren mit den ersten Oberflächenfermentern. Eine Weiterentwicklung war das Großraumbildnerverfahren.[21] Dabei wurde beim Fessel-, Generator- oder Spanbildnerverfahren die wein- beziehungsweise alkoholhaltige Lösung durch große Holzgeneratoren gerieselt, die beispielsweise mit Buchenspänen gefüllt waren und als natürlicher Träger für die Ansiedlung der Bakterien dienten. Die von der Reaktionswärme angetriebene Luftzirkulation gewährleistete die Sauerstoffzufuhr über eine Belüftung am Boden der Behälter. Ähnliche Verfahren zur Herstellung von Essig sind bis in die heutige Zeit im Einsatz.[20]
Der französische Wissenschaftler Louis Pasteur entdeckte 1856 die Rolle der Bakterien bei der Essigherstellung. 1868 arbeitete er erstmals selektive Wachstumsbedingungen für die Essigsäurebakterien aus und setzte diese ein. Damit legte er den Grundstein für die kontrollierte Herstellung von Essig in Form von Weinessig mit einem Essigsäureanteil von etwa 6 %.[22][20] Das Verfahren und die Ausbeute verbesserten sich erst 1949 durch die Einführung eines Submersverfahrens in Form des „Frings-Acetators“, benannt nach dem Unternehmen Heinrich Frings GmbH & Co KG in Bonn, das maßgeblich an der Entwicklung beteiligt war. Das Submersverfahren ist die häufigste Produktionsform für biogene Essigsäure.[20]
Trockene Destillation von Holz
Um 1800 begann die Herstellung von Essigsäure aus Holzessig nach Lowitz. Dabei lieferte Buchenholz etwa 6 % der Trockenmasse an Essigsäure.[24] Der Holzessig, der billiger herzustellen war als der durch Fermentation gewonnene Essig, reagierte mit Kalk zu Calciumacetat, dem Graukalk. Aus diesem konnte durch Reaktion mit Mineralsäuren Essigsäure in hoher Konzentration gewonnen werden, die durch Destillation weiter aufkonzentriert wurde.[25] Die deutsche Industrie stellte zu Beginn des 20. Jahrhunderts nach diesem Verfahren etwa 35.000 Jahrestonnen Essigsäure her.[10]
Industrielle Herstellung

Dem deutschen Chemiker Hermann Kolbe gelang 1845 die Synthese von Essigsäure aus anorganischen Verbindungen. Die photochemische Reaktion von Tetrachlorethen in Gegenwart von Wasser und Chlor führte zu Trichloressigsäure, einer starken Säure (pKS-Wert: 0,65), die sich mit Natriumamalgam in Essigsäure überführen ließ. Die Reaktion fand indes keine technische Anwendung.[26]
Die erste großtechnische Herstellung erfolgte im Ersten Wacker-Verfahren durch die Hydratisierung von Acetylen unter Quecksilbersulfat/Schwefelsäure-Katalyse zu Acetaldehyd. Dieser wurde unter Mangankatalyse weiter zu Essigsäure oxidiert. Die Wacker Chemie entwickelte dieses Verfahren 1913.
Nachdem in den 1960er Jahren große Mengen an Ethylen zur Verfügung standen, löste das Wacker-Hoechst-Verfahren das Erste Wacker-Verfahren ab. Dabei entsteht der Acetaldehyd durch Oxidation von Ethylen. Die installierte Produktionskapazität betrug in den 1970er Jahren etwa 2,6 Millionen Jahrestonnen.
Mit dem Ausbau der Erdölverarbeitung fielen in den Raffinerien große Mengen von gasförmigen Kohlenwasserstoffen an, die zunächst weder als Kraftstoffe noch in der chemischen Industrie verwendet wurden. Das anfallende Butan und die Butene wurden ab 1952 in der Butanoxidation, die bereits seit 1884 bekannt war, großtechnisch genutzt. Es entstanden Essig-, Ameisen-, Propion- und Buttersäure sowie neutrale Produkte wie Ketone, Aldehyde, Ester und Alkohole.
Der BASF-Chemiker Walter Reppe zeigte 1941 die Wirksamkeit der Carbonyle als Katalysatoren für die Herstellung von Carbonylverbindungen. Basierend auf diesen Arbeiten entwickelte die BASF einen Prozess, mit dem unter hohem Druck und Temperaturen Methanol und Kohlenstoffmonoxid zu Essigsäure umgesetzt wurden. Das Methanol selbst stellte einen Rohstoff dar, der nicht primär auf Erdöl basierte, sondern über Synthesegas aus verschiedenen Rohstoffquellen wie Erdgas und Kohle gewonnen wurde. 1960 wurde der BASF-Prozess erstmals großtechnisch in einer Anlage in Ludwigshafen am Rhein umgesetzt. Die BASF steigerte die Kapazität von anfänglich 3600 Jahrestonnen kontinuierlich auf 45.000 Jahrestonnen im Jahr 1981. 1966 baute die amerikanische Borden Chemical Co. eine weitere Anlage auf der Basis des BASF-Prozesses mit einer Kapazität von 45.000 Jahrestonnen in Geismar in Louisiana, die bis 1981 auf 64.000 t/a aufgestockt wurde.[27]
In den späten 1960er Jahren entwickelte Monsanto den Monsanto-Prozess, in dem Essigsäure durch Carbonylierung von Methanol mit Kohlenstoffmonoxid hergestellt wird. 1970 baute Monsanto die erste Anlage in Texas City mit einer Startkapazität von 135.000 Jahrestonnen, die bis 1975 auf 270.000 Jahrestonnen erhöht wurde. Bereits kurze Zeit nach diesem Start wurde der BASF-Prozess im Vergleich unwirtschaftlicher und konnte nicht mehr konkurrieren. 1978 baute Celanese die Clear Lake Plant in Seabrook in Texas auf der Basis des Monsanto-Prozesses mit einer Startkapazität von 27.000 Jahrestonnen. Prozessverbesserungen steigerten die Kapazität auf 900.000 Jahrestonnen.[27]
1986 kaufte BP chemicals die Rechte am Monsanto-Prozess ohne die Modifikationen von Celanese und modifizierte ihn mit einem Iridium-Katalysator. Dieser als Cativa-Prozess bezeichnete Weg wurde in den frühen 1990er Jahren weiterentwickelt und ersetzte und verbesserte den Prozess in der Monsanto-Fabrik in Texas City.[27]
Vorkommen und biologische Bedeutung
Freie Essigsäure
Essigsäure ist ein Bestandteil von Pflanzensäften und ätherischen Ölen. Alkoholische Getränke, die für längere Zeit der Luft ausgesetzt sind, bilden durch Oxidation des Ethanols Essigsäure. Die in der Umwelt weit verbreiteten Essigsäurebakterien treten fast überall dort auf, wo Hefepilze Glucose oder andere Zucker zu Ethanol vergären. Die Bakterien oxidieren das entstehende Ethanol weiter zu Essigsäure. Im Darmtrakt von Insekten, die sich von Kohlenhydraten ernähren, bilden Essigsäurebakterien einen Teil der Darmflora. Die Assimilation der Essigsäure ergänzt gegebenenfalls die Bienenernährung.[28][29] Die Herstellung von Essigsäure durch Bakterien tritt bei der Erzeugung von Silagen wie Maissilage als unerwünschte Nebenreaktion auf; ein zu hoher Essigsäureanteil in der Silage macht diese für das Vieh nicht mehr zuträglich.
Acetobacter aceti, ein Gram-negatives Bakterium, sowie das Bakterium Clostridium acetobutylicum scheiden Essigsäure als Teil ihres Stoffwechsels aus. Diese Mikroorganismen treten überall dort auf, wo Ethanol als Teil der Zuckerfermentation vorkommt. Acetobacter aceti wächst am besten bei Temperaturen von 25 bis 30 °C und einem pH-Wertbereich von 5,4 bis 6,3. Essigsäure ist auch Bestandteil der Vaginalschmierung des Menschen und anderen Primaten, wo es als ein mildes antibakterielles Mittel dient.[30]
Bei der Propionsäuregärung zur Reifung von Hartkäse fermentieren Streptokokken und Milchsäurebakterien Lactose zu Milchsäure; im weiteren Verlauf setzen Propionsäurebakterien die Milchsäure zu Essigsäure und Propionsäure um, die Komponenten des Käsearomas sind.[31]
Ein Teil der globalen Methanproduktion stammt aus dem Acetatstoffwechsel von Archaeen wie Methanosarcina thermophila.[32] Im Fermentationsweg unterliegt Essigsäure einer Decarboxylierung zu Methan und Kohlenstoffdioxid:
Organische Säuren wie Ameisen- und Essigsäure sind Bestandteile der globalen Troposphäre und tragen zum Ansäuern von Niederschlägen bei. Essigsäure gelangt etwa bei Waldbränden in die Atmosphäre.[33] Ameisen- und Essigsäure repräsentieren etwa ein Viertel der atmosphärischen Nicht-Methan-Kohlenwasserstoffe. Neben Emissionen aus Biomasse tragen photochemische Reaktionen zur Bildung von Essigsäure in der Atmosphäre bei.[34]
Interstellares Vorkommen von Essigsäure wurde zuerst 1996 in der molekularen Wolke von Sagittarius B2 Nord, genannt die Heimat der großen Moleküle, ungefähr 390 Lichtjahre vom Milchstraßenzentrum und etwa 25.000 Lichtjahre von der Erde entfernt, entdeckt.[35][36] Unter Laborbedingungen wurde nachgewiesen, dass Kohlenstoffdioxid und Methan bereits bei 12 K unter dem Einfluss energiereicher Strahlung über einen Radikalmechanismus zu Essigsäure reagieren.
Dieser Mechanismus könnte die Bildung der interstellaren Vorkommen erklären.[37]
Salze der Essigsäure
Die natürlich vorkommenden, aber sehr seltenen Mineralien wie Hoganit [Cu(CH3COO)2·H2O] oder Paceit [CaCu(CH3COO)4·6 H2O] sind Beispiele für Acetatvorkommen in der unbelebten Natur. Die Mineralien entstanden vermutlich durch die Reaktion von Erzen mit Essigsäure pflanzlichen Ursprungs.[38] Ein weiterer Vertreter der Acetatmineralien ist das Calclacit [Ca(CH3COO)Cl·5 H2O]. Dieses entsteht durch die Reaktion von calciumhaltigem Material mit Essigsäure, die aus pflanzlichem Material wie Holz freigesetzt wurde.
Organische Essigsäureverbindungen
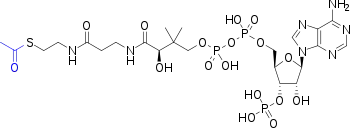
Acetylierte Verbindungen, das heißt Austausch von einem Wasserstoffatom durch die Acetylgruppe der Essigsäure an den funktionellen Gruppen –OH, –SH und –NH2, aber auch direkt an einer –C–H-Bindung, sind in der Natur weit verbreitet und haben vielfältige Funktionen.
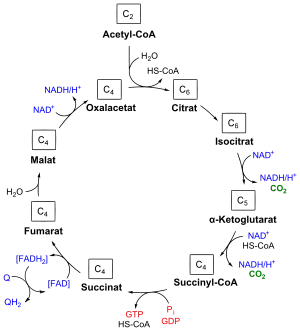
- Acetyl-Coenzym A (Acetyl-CoA), die Acetylgruppe als Thioester an Coenzym A gebunden, ist zentral für den Stoffwechsel von Kohlenhydraten und Fetten und essenziell bei der Synthese und Oxidation von Fettsäuren und der Oxidation von Pyruvat im Citratzyklus. Die Thioesterbindung ist eine sehr reaktive Bindung, die Hydrolyse ist mit −31,5 kJ/mol exergonisch. Konrad Bloch und Feodor Lynen, dem 1951 die Isolierung aktivierter Essigsäure, Acetyl-Coenzym A, aus Hefezellen gelang, erhielten 1964 für ihre Entdeckungen, die den Acetyl-CoA- und den Fettsäuremetabolismus verknüpften, den Nobelpreis für Physiologie oder Medizin.[39]
- Acetylcholin, ein Ester der Essigsäure und des Aminoalkohols Cholin, ist einer der wichtigsten Neurotransmitter in vielen Organismen, so auch im Menschen. Er spielt eine wichtige Rolle bei Lern- und Gedächtnisprozessen.[40]
- Die synthetische Acetylsalicylsäure (Markenname: Aspirin) und das synthetische Acetylcystein werden als Medikamente verwendet.
Bei Biopolymeren modifiziert Acetylierung die Polymereigenschaften. Peracetylierte Polymere haben eine sehr geringe Löslichkeit:
- Chitin (Acetylglucosamin) ist das in der Natur am weitesten verbreitete Aminozucker-Polymer.[41] Bei Pilzen ist es der Hauptbestandteil der Zellwand und bei Gliederfüßern die Hauptkomponente des Exoskeletts.[42]
Acetylierung ist – nach Phosphorylierung – die zweithäufigste selektive, posttranslationale Modifikation in eukaryontischen Zellen. Acylierung (oder nachfolgende Deacetylierung) sorgt für biologisch unterschiedlich aktive Populationen:
- N-Acetylierung von Lysin in Histonen reduziert die positiven Oberflächenladungen dieser Proteine und somit auch ihre Bindungen an die DNA.
- N-terminale Acetylierung von Proteinen spielt eine wichtige Rolle bei der Synthese, Stabilität und Lokalisierung von Proteinen.
Herstellung
Weltweit bestehen Produktionskapazitäten für Essigsäure in Höhe von etwa 7 Mio. Tonnen pro Jahr.[43] Zwischen 1998 und 2006 gab es weltweit ein durchschnittliches Wachstum der Produktion von 3 % bis 4 % pro Jahr, wobei etwa 70 % der Jahresproduktion in den USA (1996: 36 %; 2006: 32 %), Westeuropa (1996: 24 %; 2006: 17 %) und Japan (1996: 16 %; 2006: 11 %) hergestellt werden. Die ostasiatische Produktion stieg im Vergleich zu diesen Regionen von 1996 mit 14 % auf etwa 18 % im Jahr 2006.[44] Die katalytische Oxidation von Leichtbenzin sowie die Rektifikation von Holzessig wird nur noch selten genutzt.[24] Etwa 190.000 Tonnen werden jährlich weltweit fermentativ hergestellt, wobei etwa 70 % des Weltbedarfs an Speiseessig im Submersverfahren in etwa 700 Bioreaktoren produziert werden.[20]
Biotechnische Herstellung
Die biotechnische, fermentative Herstellung von Essigsäure ist die Oxidation („Veratmung“) von Ethanol durch Bakterien der Gattungen Acetobacter und Gluconobacter. Es handelt sich biochemisch betrachtet um eine partielle Oxidation und nicht, wie es irrtümlich beschrieben wird, um eine Gärungsform. Die Bakterien wandeln etwa durch Gärungsprozesse entstandenes Ethanol durch eine „subterminale Oxidation“ über Acetaldehyd in Essigsäure um.[22]
Die Oxidation erfolgt durch membranassoziierte Alkoholdehydrogenasen (ADH) und Aldehyddehydrogenasen (ALDH), die als prosthetische Gruppe Pyrrolochinolinchinon (PQQ) und bei den ADH zusätzlich Häm c enthalten. Die bei der Oxidation freiwerdenden Elektronen werden über Ubichinon auf eine ebenfalls membrangebundene Oxidase übertragen.[22]
Ausgangsstoffe für die Essigsäurebildung können Wein, Bier oder Malz sein. Dabei sind die Bakterien von einer ausreichenden Sauerstoffversorgung abhängig und reagieren auf sauerstoffarme Bedingungen sehr empfindlich. Bereits bei einer Unterbrechung der Sauerstoffversorgung von wenigen Minuten kommt es zu einer signifikanten Abnahme der Ethanoloxidation. Steht Ethanol als Substrat nicht zur Verfügung, kommt es zu einem oxidativen Abbau der Essigsäure zu Kohlenstoffdioxid und Wasser.[22] Die Bakterien bauen Kohlenhydrate sowohl über die Glykolyse als auch über den Entner-Doudoroff-Weg zu Pyruvat ab, das im Citratzyklus weiter verstoffwechselt wird.[22]
Manche Arten von anaeroben Bakterien, etwa einige der Gattung Clostridium, können Zucker ohne die Zwischenstufe Ethanol nach folgender chemischer Reaktionsgleichung direkt in Essigsäure umwandeln:
Durch den Mangel an Säureresistenz der Bakterien liegt die Konzentration der so erzeugten Essigsäure jedoch unter der Konzentration von Ethanol metabolisierenden Stämmen und macht eine Anreicherung durch Destillation notwendig. Die Essigsäuregärung von Ethanol ist daher die kostengünstigere Herstellungsform.[45]
Butan- und Butenoxidation
Für die C4-Kohlenwasserstoffe Butan, 1-Buten und 2-Buten, die in verschiedenen Raffinerieprozessen anfallen, gab es anfangs weder Verwendung als Kraftstoff noch als Rohstoff für die chemische Industrie. Dass die Oxidation von Butan zu Essigsäure möglich ist, war lange bekannt. Verschiedene Firmen wie die Chemischen Werke Hüls entwickelten technische Prozesse zur Butan- und Butenoxidation. Ab den frühen 1950er Jahren wurden Anlagen für die Flüssigphasenoxidation von Butan bei etwa 170 bis 200 °C und 60 bis 80 bar im Hüls-Butan-Prozess gebaut; ein analoges Verfahren geht von Buten aus.[10]
Der Celanese-n-Butan-LPO-Prozess arbeitet bei 54 bar und 175 °C mit Cobaltacetat als Katalysator.[46]
Der Anfall von Nebenprodukten wie anderen niedermolekularen Säuren, Ketonen und anderen Oxidationsprodukten erschwerte die Aufarbeitung des Reaktionsgemischs. Durch die komplexe Aufarbeitung und alternative Verwendungen für den C4-Schnitt wurde der Betrieb dieser Anlagen unwirtschaftlich.[47]
Wacker-Hoechst-Verfahren
Große Mengen an Essigsäure werden mittels des Wacker-Hoechst-Verfahrens über die Oxidation von Ethylen erzeugt. Dabei entsteht durch Oxidation von Ethylen in Gegenwart von Palladium(II)-chlorid als Katalysator Acetaldehyd. Der Sauerstoff der Oxidationsreaktion stammt dabei aus dem als Lösungsmittel verwendeten Wasser. Der im Verfahren verwendete Sauerstoff dient der Reoxidation des Katalysators mittels Kupfer(II)-chlorid. Die folgenden Bilanzgleichungen fassen den ablaufenden katalytischen Kreisprozess zusammen:
mit der Gesamtbilanz:
- .
Die Teilreaktionen (a) bis (c) lassen sich als gekoppelte Reaktionen darstellen:[48]
Der als Zwischenprodukt entstehende Acetaldehyd wird durch Oxidation mit Luft oder Sauerstoff unter Verwendung von Mangan(II)-acetat als Katalysator zur Essigsäure oxidiert. In einer Zwischenstufe entsteht Peressigsäure, die durch den Katalysator zur Essigsäure reduziert wird.
Ein älteres Verfahren gewann Acetaldehyd aus Ethylen über die säurekatalysierte Hydratisierung zum Ethanol, welches bei höheren Temperaturen im Lebedew-Prozess zu Acetaldehyd dehydriert wurde.
Monsanto- und Cativa-Prozess
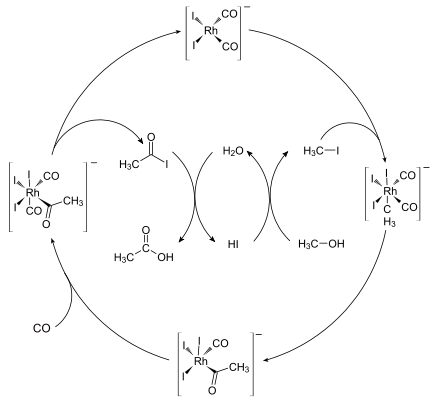
Neuere Anlagen für die industrielle Synthese der Essigsäure arbeiten mit der katalytischen Umsetzung von Methanol mit Kohlenmonoxid unter einem Druck von 30 bis 60 bar und bei Temperaturen von 150 bis 200 °C im Monsanto-Prozess.[49]
Der Prozess verwendet einen Rhodium-Katalysator und hat eine Selektivität von über 99 % bezogen auf Methanol. Als aktive Katalysator-Spezies gilt der anionische Komplex cis-[Rh(CO)2I2]−. Der Prozess ist ein Beispiel für ein homogenkatalytisches Verfahren und besteht aus mehreren Teilreaktionen.
Als Nebenreaktion wird die Wassergas-Shift-Reaktion katalysiert, wobei geringe Mengen an Kohlenstoffdioxid und Wasserstoff entstehen. Weiterhin fällt durch Carbonylierung von Ethanol, das als Verunreinigung des Methanols in den Prozess gelangt, Propionsäure an.
Eine Verfahrensvariante entwickelte BP Chemicals 1966.[50] Mittels eines Iridium(III)-iodid-Katalysator-Präkursors im Cativa-Prozess konnte ein höherer Umsatz sowie ein geringerer Kapitaleinsatz beim Bau neuer Anlagen erreicht werden; als aktive Spezies gilt der Iridium-Komplex [Ir(CO)2I2]−. Im Jahr 2000 wurde die erste Anlage nach diesem Verfahren in Malaysia in Betrieb genommen.
Eigenschaften
Molekulare Eigenschaften
Die Bindungslänge der Kohlenstoff-Kohlenstoff-Bindung beträgt 154 pm, die der Kohlenstoff-Sauerstoff-Doppelbindung 124 pm, die der Kohlenstoff-Sauerstoff-Einfachbindung 129 pm und die der intermolekularen Wasserstoffbrücke 261 pm.[52]
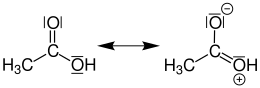
Die Bindungswinkel der Carboxygruppe betragen 120°, wobei die Kohlenstoff-Sauerstoff-Einfachbindung einen partiellen π-Charakter aufweist. Die Bindung des Sauerstoffatoms der Hydroxygruppe zum Carboxykohlenstoffatom erfolgt über sp2-Orbitale. Die Struktur kann durch zwei mesomere Grenzstrukturen mit einer negativen Partialladung an einem Sauerstoffatom und einer positiven am partiell doppelgebundenen Sauerstoff der Hydroxygruppe dargestellt werden.[53]
Physikalische Eigenschaften
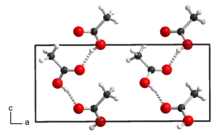

Essigsäure kristallisiert in der orthorhombischen Raumgruppe Pna21 (Raumgruppen-Nr. 33) mit den Gitterparametern a = (1332 ± 2) pm, b = (408 ± 1) pm und c = (577 ± 1) pm. Die Moleküle sind über Wasserstoffbrückenbindungen zu endlosen Ketten verbunden.[52]
Essigsäure besitzt mit 118 °C eine relativ hohe Siedetemperatur gegenüber polaren Stoffen mit etwa gleicher molarer Masse; beispielsweise beträgt der Siedepunkt von 1-Propanol 97 °C. Die Ursache dafür ist die Fähigkeit der Essigsäure-Moleküle, über ihre Carboxygruppen Wasserstoffbrückenbindungen auszubilden. In der Flüssigphase bilden die Essigsäuremoleküle Kettenstrukturen aus. In der Gasphase stellt das Dimer aus zwei Essigsäure-Molekülen, die sich wie ein Molekül doppelter molarer Masse verhalten, die stabilste Form dar.[55] Das Aufbrechen der Kettenstrukturen und der Übergang der Dimere in die Gasphase erfordert einen höheren Energieaufwand, erkennbar an der „erhöhten“ Siedetemperatur.
Die Dampfdruckfunktion ergibt sich nach der Antoine-Gleichung entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,68206, B = 1642,540 und C = −39,764 im Temperaturbereich von 290,26 bis 391,01 K.[56]
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·exp(−αTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 22,84 kJ/mol, α = 0,0184, β = −0,0454 und Tc = 592,7 K im Temperaturbereich zwischen 298 und 392 K beschreiben.[57]
Reine Essigsäure hat als potentieller Elektrolyt eine, nur auf der Autoprotolyse beruhende, sehr geringe Leitfähigkeit für elektrischen Strom. Die Leitfähigkeit reiner Essigsäure beträgt bei 25 °C 6·10−7 S·m−1.[58] Erst bei Zugabe von Wasser tritt Dissoziation und die Erhöhung der Leitfähigkeit ein. Wasserfreie Essigsäure erstarrt schon bei 16,6 °C zu eisähnlichen Kristallen.
| Eigenschaft | Typ | Wert und Einheit | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−484,5 kJ·mol−1 −433 kJ·mol−1[59] | |
| Standardentropie | S0l, 1 bar S0g |
158,0 J·mol−1·K−1[60] 282,84 J·mol−1·K−1[61] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −875,16 kJ·mol−1[62] | |
| Wärmekapazität | cp | 123,1 J·mol−1·K−1 (25 °C)[60] 2,05 J·g−1·K−1 (25 °C)[60] 63,44 J·mol−1·K−1 (25 °C)[63] 1,06 J·g−1·K−1 (25 °C)[63] |
als Flüssigkeit als Gas |
| Kritische Temperatur | Tc | 318,8 °C[64] | |
| Kritischer Druck | pc | 57,86 bar[64] | |
| Azentrischer Faktor | ωc | 0,46652[64] | |
| Schmelzenthalpie | ΔfH0 | 11,72 kJ·mol−1[60] | am Schmelzpunkt |
| Schmelzentropie | ΔfS0 | 40,5 kJ·mol−1[60] | am Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 ΔVH |
51,6 kJ·mol−1[57] 23,7 kJ·mol−1[57] |
beim Normaldrucksiedepunkt |
Chemische Eigenschaften
Flüssige Essigsäure ist ein polares, hydrophiles und protisches Lösungsmittel. Die Dielektrizitätskonstante ε beträgt 6,2 (bei 25 °C).[65] Sie mischt sich leicht mit polaren und unpolaren Lösungsmitteln wie Wasser, Chloroform und Hexan. Essigsäure löst sowohl polare Verbindungen wie anorganische Salze und Zucker, als auch unpolare Verbindungen wie niedermolekulare Alkane. Mit höheren Alkanen wie Octan ist Essigsäure nicht mehr vollständig mischbar; die Mischbarkeit nimmt mit zunehmender Kettenlänge der Alkane ab.
In wässriger Lösung reagiert Essigsäure als mittelstarke Säure; der pKS-Wert beträgt 4,76. In einer protolytischen Reaktion stellt sich ein Gleichgewicht zwischen der Essigsäure und dem Acetat-Ion ein, das stark auf Seiten der Säure liegt. Wie bei allen Carbonsäuren ist die Carboxylatgruppe des Acetat-Ions durch Mesomerie stabilisiert, was wesentlich zur sauren Reaktion der Carbonsäuren beiträgt:
Der Dissoziationsgrad der Säure liegt in verdünnten Lösungen nur im Bereich einiger Prozente. In einer 1-molaren Lösung beträgt er nur etwa 0,5 %. Das dabei entstehende Oxoniumion (H3O+) führt zu einer sauren Lösung (pH-Wert < 7). Bei einer 30%igen Lösung, entsprechend einer 5-molaren Lösung, beträgt der pH 1,7,bei einer 40%igen Lösung 1,53 und bei einer 50%igen Lösung 1,31.
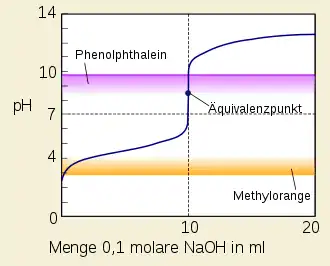
Wird der pH-Wert einer Essigsäurelösung durch Zusatz einer starken Base oder durch Zusatz von Acetaten erhöht, wird eine Pufferlösung gebildet. Ist der pH-Wert der Lösung gleich dem pKS-Wert der Essigsäure, liegen Essigsäure und Acetat-Ion in derselben Konzentration vor. Dies ist der optimale Punkt eines Essigsäure-Acetat-Puffers, an dem die Änderung des pH-Werts beim Zusatz von Säuren oder Basen maximal abgepuffert wird. Dieses im Sauren effektive Puffersystem ist bedeutend für biochemische Systeme, da es einen günstigen pKS-Wert hat und die beteiligten Komponenten die meisten Organismen und Biomoleküle nicht negativ beeinflussen. Er ist ein stabiles Puffersystem, das heißt, das konjugierte Säure-Base-Paar verbleibt in Lösung und kann nicht wie beim Hydrogencarbonatpuffer aus dem System entweichen.
Essigsäure oxidiert an der Luft vollständig unter Hitzeentwicklung zu Wasser und Kohlenstoffdioxid. Dies geschieht bei Raumtemperatur jedoch nur extrem langsam.
Die Salze der Essigsäure werden als Acetate bezeichnet. Es sind zumeist kristalline Salze, die in ihren Kristallgittern (Ionengittern) das Acetat-Anion (CH3COO−) enthalten. Unedle Metalle wie Magnesium, Calcium, Zink oder Eisen lösen sich in verdünnter Essigsäure unter Bildung wasserlöslicher Acetate und Freisetzung von Wasserstoff auf. Mit Kupfer reagiert die Essigsäure in Gegenwart von Sauerstoff zu Kupferacetat, einem grünen, gesundheitsschädlichen Salz, das besser unter dem Namen „Grünspan“ bekannt ist. Essigsäure wird in verdünnter Form zum Kalklösen verwendet gemäß folgender Reaktionsgleichung:
Essigsäure reagiert mit Ethanol säurekatalysiert zu Essigsäureethylester, einem vielverwendeten Lösungsmittel. Wird 1-Pentanol statt Ethanol verwendet, entsteht Essigsäureamylester, eine stark riechende Verbindung. Mit Glycerin setzt sich Essigsäure zu Triacetin um, das als Weichmacher für Lacke und Klebstoffe dient.[66] Allylacetat findet als Riechstoff Verwendung.
Essigsäure reagiert bei 800 °C unter Dehydratisierung zu Keten. Dieses wiederum reagiert mit überschüssiger Essigsäure zu Essigsäureanhydrid.
Mit Thionylchlorid lässt sich Essigsäure in Acetylchlorid überführen, das für Veresterungsreaktionen verwendet wird. Die Chlorierung führt zu Chloressigsäure, die zur Herstellung von Carboxymethylcellulosen, Mercaptoessigsäure, Pflanzenschutzmitteln, Farbstoffen oder Arzneimitteln verwendet wird. Mit Ammoniak entsteht zunächst Ammoniumacetat, das durch Erhitzen in Acetamid überführt wird.
Verwendung
Ernährung
Essigsäure hat eine große Bedeutung als Geschmacksstoff. Essigsäure (E 260) und ihre Salze Kaliumacetat (E 261), Natriumacetat (E 262) und Calciumacetat (E 263) werden als Säuerungsmittel für Obst und Gemüse in Dosen und Gläsern (0,5–3 % Essigsäure) oder als Teigsäuerungsmittel verwendet. Die Essigsäure im Sauerteig wird durch heterofermentative Sauerteigbakterien gebildet.[67] Außerdem wird Essigsäure bei Fisch in allen Variationen, Konserven, verschiedenen Marinaden, Feinkostsalaten, Mayonnaisen und Salatsoßen zusammen mit Sorbinsäure (E 200) oder Benzoesäure (E 210) verwendet. Sauergemüse sind Gemüse, die unter anderem durch Essigsud haltbar gemacht werden.
Auch verschiedene Milchprodukte werden unter Verwendung von Essigsäure hergestellt: Mascarpone wird aus Rahm hergestellt, der mit Essigsäure eingedickt wird, ebenso Ziger, ein Molkenkäse, der aus Molke durch Ausfällung von Resteiweiß durch Essigsäure gewonnen wird. Bleiacetat, auch als Bleizucker bekannt, wurde bis in die Neuzeit als Zuckerersatz zum Süßen von Wein genutzt, die Giftigkeit des Bleizuckers war lange Zeit nicht bekannt.[68] Der Geruch von Wein nach Essig, der sogenannte Essigstich, gilt als Weinfehler.[69]
Das Einlegen und Abwaschen von frischem Fleisch geschieht ebenfalls mit Hilfe von Essigsäure. Der bakterizide Effekt der Essigsäure besteht darin, dass durch den erniedrigten pH-Wert physiologische Prozesse unterbunden werden und Eiweiße denaturieren.[70] Haushaltsessig besteht aus biogenem Essig und enthält 5 % Essigsäure.
| Handelssorten des Essigs | Konzentration |
|---|---|
| Speise- od. Tafelessig | 3,5–5 % |
| Einmachessig | 5 % |
| Weinessig | 6 % |
| Doppelessig | 7 % |
| Dreifachessig oder Essigspirit | 10,5 % |
| Essigessenz | 25 % |
Essigessenz ist eine 25%ige Essigsäurelösung in Wasser, riecht stark stechend, und darf nur verdünnt in Speisen verwendet werden. Essigessenz wird gern als biologischer Haushaltsreiniger verwendet. Wässrige Lösungen der Essigsäure mit einem Säuregehalt größer als 15,5 % dürfen offiziell nicht mehr als Essig bezeichnet werden.[71]
Folgeprodukte

Für die stoffliche Nutzung wird fast ausschließlich großtechnisch hergestellte Essigsäure genutzt. Dabei werden mehr als 65 % der Weltproduktion für Polymere auf der Basis von Vinylacetat (43 %) und Celluloseacetat (25 %) aufgewendet. Vinylacetat ist die Grundlage für Polyvinylacetat (PVAc), das unter anderem in Farben und Klebstoffen verwendet wird, in geringerem Umfang in Vinylacetat-Copolymeren wie Ethylenvinylacetaten und Polyvinylalkohol.[72] Celluloseacetat wird vor allem zur Produktion von Zigarettenfiltern, Folien und Kunststoffprodukten verwendet. Essigsäure dient als Lösungsmittel bei der Herstellung von Terephthalsäure mittels Flüssigphasenoxidation. Sie ist ein wichtiges Zwischenprodukt zur Herstellung von Riechstoffen und Medikamenten.[73]
Weitere Verwendungen umfassen verschiedene Ester wie Essigsäure-n-butylester und Essigsäureisopropylester, zusammen etwa 11 %, die als Lösungsmittel für Kosmetika und Parfüms verwendet werden. Weitere 10 % werden für die Herstellung von Essigsäureanhydrid, Acetanilid, Essigsäurechlorid und Ammoniumacetat genutzt.[72] Salze wie Aluminiumdiacetat sind Hilfsmittel in der Textil- und Lederindustrie und dienen dort zur Imprägnierung.
Bei der Umsetzung von Organochlorsilanen wie Dichlordimethylsilan mit Essigsäure entstehen Acetoxysilane. In Reaktion mit Silanolen reagieren diese unter Kondensation und Freisetzung von Essigsäure zu Silikonen.[74]
Essigsäure reagiert mit Wasserstoffperoxid unter Bildung von Peroxyessigsäure.[75] Industriell entsteht sie bei der Oxidation von Acetaldehyd mit Luft. Peroxyessigsäure ist ein starkes Oxidationsmittel, das antimikrobiell wirkt und zur Desinfektion eingesetzt wird. Außerdem epoxidiert Peroxyessigsäure verschiedene Alkene zu Epoxiden.
| Handelssorten der Essigsäure | Konzentration |
|---|---|
| Eisessig, Acidum glaciale | 99 % |
| Essigessenz | 15–25 % |
| Technische Essigsäure | 30–50 % |
| Rohe Essigsäure | 40–80 % |
| Essigsäure DAB 7 | 99 % |
Sonstige Verwendung
Die Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation führt Essigsäure als ein für die Behandlung von HNO-Erkrankungen des Kindesalters angewandtes Mittel.
Essigsäure wird beim Screening für die Erkennung von Gebärmutterhalskrebs in Subsahara-Afrika angewendet.[76] Die Essigsäure wird dazu auf den Gebärmutterhals aufgetragen. Färbt sich der Bereich nach etwa einer Minute weiß, gilt der Test als positiv.[76]
Essigsäure wird zum Ansäuern von Hygiene- und Kosmetikprodukten verwendet, etwa zum Peeling. Die Essigsäure lässt die obere Schicht abgestorbener Hautzellen abblättern und hinterlässt eine glattere Oberfläche. Der Effekt wurde schon von der ägyptischen Herrscherin Kleopatra genutzt, deren Milchbäder ebenfalls hautglättende Essigsäure enthielt.[14]
In der Fotolaborpraxis der „nassen“ oder analogen Fotografie wird verdünnte Essigsäure (3–5 %) zur Neutralisation der Entwickler-Bäder als sogenanntes „Stoppbad“ eingesetzt. Vielfach wird die Lösung mit einem Indikatorfarbstoff versetzt, der anzeigt, wann das Stoppbad alkalisch und somit unwirksam wird.
Latex, eine Suspension von Naturkautschuk im wässrigen Medium, wird mit Essigsäure in geringer Konzentration koaguliert. Die geladenen Latexpartikel stoßen sich gegenseitig ab, durch Zugabe von Essigsäure wird diese Ladung neutralisiert und der Latex gerinnt.[77]
Eisessig kann zur Präparation von kalkigen Fossilien in Kreide verwendet werden.[78] Hierbei wird das Gestein mit der Säure übergossen. Eine Reaktion kann hierbei nicht stattfinden, da sich das entstehende Calciumacetat nicht lösen kann. Erst nach dem Verdünnen findet eine Reaktion im gesamten Gestein statt.
Gefahrenhinweise
Die Einstufung und Kennzeichnung nach den Gefahrgutvorschriften hängt von der Konzentration ab.[3] Eisessig oder Lösungen mit mehr als 80 Masse-% Säure werden der Gefahrgutklasse 8 (Ätzende Stoffe) mit der Verpackungsgruppe II (Stoffe mit mittlerer Gefahr) zugeordnet. Als Nebengefahr muss die Gefahrgutklasse 3 (Entzündbare Flüssigkeiten) mit gekennzeichnet werden (Gefahrzettel 8/3). Lösungen mit mindestens 50 Masse-% und höchstens 80 Masse-% Säure werden nur noch der Klasse 8 (Ätzende Stoffe) mit der Verpackungsgruppe II (Stoffe mit mittlerer Gefahr) zugeordnet (Gefahrzettel 8). Für Lösungen mit mehr als 10 Masse-% und weniger als 50 Masse-% Säure gilt die Klasse 8 (Ätzende Stoffe) mit der Verpackungsgruppe III (Stoffe mit geringer Gefahr) (Gefahrzettel: 8).
Reine Essigsäure gilt als entzündliche Flüssigkeit. Oberhalb des Flammpunktes können sich entzündliche Dampf-Luft-Gemische bilden. Die Verbindung hat einen Flammpunkt bei 38,5 °C.[3] Der Explosionsbereich liegt zwischen 6 Vol.‑% (148 g/m³) als untere Explosionsgrenze (UEG) und 17 Vol.‑% (430 g/m³) als obere Explosionsgrenze (OEG).[3] Der maximale Explosionsdruck beträgt 6,3 bar.[3] Die Sauerstoffgrenzkonzentration liegt bei 200 °C bei 10,6 Vol-%.[79] Die Grenzspaltweite wurde mit 1,69 mm bestimmt.[3] Es resultiert damit eine Zuordnung in die Gasgruppe IIA.[3] Die Zündtemperatur beträgt 485 °C.[80] Der Stoff fällt somit in die Temperaturklasse T1. Der Heizwert beträgt 14,49 MJ/kg.[81] Die Geruchsschwelle liegt bei 8–10 ppm. Bei etwa 80%iger Konzentration entspricht die Ätzwirkung der von konzentrierter Salzsäure.
Nach dem Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) gilt Essigsäure als entzündbare Flüssigkeiten der Kategorie 3 mit Ätzwirkung auf die Haut (Kategorie 1A). Die anwendbaren H- und P-Sätze sind H314 (Verursacht schwere Verätzungen der Haut und schwere Augenschäden), H226 (Flüssigkeit und Dampf entzündbar) sowie P280 (Schutzhandschuhe/Schutzkleidung/Augenschutz/Gesichtsschutz tragen), P305+P351+P338 (Bei Kontakt mit den Augen: Einige Minuten lang behutsam mit Wasser spülen. Vorhandene Kontaktlinsen nach Möglichkeit entfernen. Weiter spülen) und P310 (Sofort Giftinformationszentrum oder Arzt anrufen).[82]
Toxikologie
Essigsäure kann über den Verdauungstrakt, die Atemluft und die Haut aufgenommen werden. Essigsäure wird über den Citratzyklus und die Atmungskette in allen Zellen des Körpers unter Energiegewinnung zu Kohlenstoffdioxid (CO2) und Wasser (H2O) als letztendliche Stoffwechselprodukte veratmet. Essigsäure kann über die Lungen ausgeatmet werden. Konzentrierte Essigsäure wirkt stark reizend auf die Haut und die Schleimhäute.[83] Nach körperlichem Kontakt mit der Säure muss daher mit angemessener Sorgfalt gehandelt werden, um Verätzungen, Augenschäden und Reizungen der Schleimhäute zu vermeiden; Hautblasen treten zum Teil erst Stunden nach der Einwirkung auf. Längerer Hautkontakt mit Eisessig führt zur Gewebezerstörung der betroffenen Partien.
Eine Exposition in der Atemluft über acht Stunden bei einer Konzentration von 10 ppm kann zu Reizungen der Augen sowie der Nasen- und Mundschleimhäute sowie Reizungen des Luftwegs im Hals führen. Konzentrationen über 1000 ppm führen zu starken Reizungen und können nicht über einen längeren Zeitraum ertragen werden. Als letale Dosis gelten 20 bis 50 Gramm Essigsäure, bei Kindern liegt der Wert bei 5 bis 10 Gramm.[83]
Längerfristiger Kontakt mit Essigsäure entfettet die Haut und führt gegebenenfalls zu Ekzemen. Ein direkter Kontakt der Essigsäure mit den Augen, etwa durch Spritzer, führt möglicherweise zur Erblindung. Eine Sensibilisierung gegenüber Essigsäure ist selten, ist aber aufgetreten.[84]
Essigsäure ist im Wasser leicht biologisch abbaubar und ist nicht bioakkumulativ. Als Acetat ist es nicht akut fischgiftig bis zu Konzentrationen von 1000 mg/l. Auf Insekten wie den Kupferfarbenen Buntgrabläufer wirkt es nicht toxisch bis zu einer Austragsrate von 1000 l/ha. Bei Ratten wurde als mittlere letale Dosis (LD50-Wert) 3310 mg je kg Körpergewicht festgestellt.[85]
Nachweis
Essigsäure lässt sich durch den Eisenchloridtest nachweisen. Dabei bildet Essigsäure mit einer Eisen(III)-chlorid-Lösung eine intensive Rotfärbung.[86]
Im 13C-NMR, gemessen in Deuterochloroform, liefert der Carbonylkohlenstoff einen Peak bei einer chemischen Verschiebung von 178,12 ppm und der Kohlenstoff der Methylgruppe einen Peak bei einer chemischen Verschiebung von 20,8 ppm.[87] Im 1H-NMR, gemessen in Deuterochloroform, liefert der Wasserstoff der Säurefunktion einen Peak bei einer chemischen Verschiebung von 11,42 ppm und die Wasserstoffe der Methylgruppe einen Peak bei 2,098 ppm.[87]
Gängige und quantitative Bestimmung von Essigsäure wird mittels Gaschromatographie durchgeführt.[88]
Literatur
- Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a01_045.
Weblinks
- Eintrag zu Acetic acid in der Spectral Database for Organic Compounds (SDBS) des National Institute of Advanced Industrial Science and Technology (AIST)
Einzelnachweise
- Eintrag zu E 260: Acetic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu ACETIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Februar 2020.
- Eintrag zu Essigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- chem.wisc.edu: pKa Data, Compiled by R. Williams (PDF; 645 kB).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-52.
- Myron L. Bender: Intermediates in the Reactions of Carboxylic Acid Derivatives. II. Infrared Absorption Spectra as Evidence for the Formation of Addition Compounds of Carboxylic Acid Derivatives 1,2. In: Journal of the American Chemical Society. Band 75, Nr. 23, Dezember 1953, ISSN 0002-7863, S. 5986–5990, doi:10.1021/ja01119a063.
- Eintrag zu Acetic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 64-19-7 bzw. Essigsäure), abgerufen am 2. November 2015.
- Eintrag zu Acetic acid, glacial in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Michael Röper: Die Geschichte der Essigsäureproduktion auf chemanager-online.com.
- IUPAC Provisional Recommendations 2004: Chapter P-12.1 (PDF; 346 kB), S. 4.
- Lateinische Übersetzung von Essig. auf de.pons.com.
- Charles E. Mortimer, Ulrich Müller: Chemie – Das Basiswissen der Chemie. Georg Thieme Verlag, 2003, ISBN 3-13-484308-0, S. 214.
- Carol Ann Rinzler: The Encyclopedia of Cosmetic and Plastic Surgery. Facts on File, 2009, ISBN 978-0-8160-6285-0, S. 3.
- Sylvia Feil, Jörg Resag, Kristin Riebe: Chemie in der Menschheitsgeschichte. Faszinierende Chemie. Springer Verlag, 2017, ISBN 978-3-662-49919-1, S. 199–230.
- John Emsley: Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford University Press, 2001, ISBN 0-19-850340-7, S. 229.
- Edvard Hjelt: Geschichte der Organischen Chemie: Vieweg, 1916, ISBN 978-3-663-06328-5, S. 10.
- Meyers Großes Konversations-Lexikon. Band 6, Leipzig 1906, S. 120–122.
- Ursula Lang, Sabine Anagnostou: Vinaigre de Quatre Voleurs – Legende, Geheimmittel oder Antiseptikum? IGGP Berlin, September 14 – 17, 2011. (PDF)
- Christoph Syldatk: Organische Säuren. Essigsäure (Acetat). In: Garabed Antranikian: Angewandte Mikrobiologie. Springer, Berlin/ Heidelberg, 2006, ISBN 3-540-24083-7, S. 344–347.
- E. Bames, B. Beyer, J. Grossfeld: Handbuch der Lebensmittelchemie. Band IX: Essig Bedarfsgegenstände Geheimmittel. Springer, 1942, ISBN 978-3-642-88892-2 (Reprint), S. 4–7.
- Rolf D. Schmid: Taschenatlas der Biotechnologie und Gentechnik. 2. Auflage. Wiley-VCH, Weinheim 2006, ISBN 3-527-31310-9, S. 18–19.
- Perstorp Holding AB: Annual Report 2005. S. 32.
- H. M. Binburry, W. Elsner: Die trockene Destillation des Holzes. Verlag Julius Springer, 1925, S. 133.
- Max Klar: Technologie der Holzverkohlung und der Fabrikation von Essigsäure, Acteton, Methylalkohol und sonstiger Holzdestillate. Springer, 1903, S. 116–124.
- Carl Graebe: Geschichte der Organischen Chemie. Springer Verlag, 1972, ISBN 3-642-65018-X, S. 148.
- Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, S. 4–10, doi:10.1002/14356007.a01_045 (Abschnitt „Carbonylation of Methanol“).
- E. Crotti, A. Rizzi, B. Chouaia, I. Ricci, G. Favia, A. Alma, L. Sacchi, K. Bourtzis, M. Mandrioli, A. Cherif, C. Bandi, D. Daffonchio: Acetic Acid Bacteria, Newly Emerging Symbionts of Insects. In: Applied and Environmental Microbiology. Band 76, 2010, S. 6963, doi:10.1128/AEM.01336-10.
- Vincent G. Martinson, Brayn N. Danforth, Robert L. Minchley: A simple and distinctive microbiota associated with honey bees and bumble bees. In: Molecular Ecology. Band 20, 2011, S. 619–628 doi:10.1111/j.1365-294X.2010.04959.
- A. N. Chaudry, P. J. Travers, J. Yuenger, L. Colletta, P. Evans, J. M. Zenilman, A. Tummon: Analysis of Vaginal Acetic Acid in Patients Undergoing Treatment for Bacterial Vaginosis. In: Journal of Clinical Microbiology. Band 42, 2004, S. 5170–5175, doi:10.1128/JCM.42.11.5170-5175.2004.
- Benno Kunz: Lebensmittelbiotechnologie. Behr’s Verlag, 2016, ISBN 978-3-95468-276-8, S. 42.
- J. G. Ferry: Enzymology of the fermentation of acetate to methane by Methanosarcina thermophila. In: BioFactors. Band 6, Nr. 1, 1997, S. 25–35. PMID 9233537 (Review).
- R. J. Yokelson u. a.: Emissions of formaldehyde, acetic acid, methanol, and other trace gases from biomass fires in North Carolina measured by airborne Fourier transform infrared spectroscopy. In: Journal of Geophysical Research: Atmospheres. Band 104, 1999, S. 30109–30125, doi:10.1029/1999JD900817.
- Puja Khare, N. Kumar, K. M. Kumari, S. S. Srivastava: Atmospheric formic and acetic acids: An overview. In: Reviews of Geophysics. Band 37, 1999, S. 227, doi:10.1029/1998RG900005.
- David M. Mehringer, Lewis E. Snyder, Yanti Miao, Frank J. Lovas: Detection and Confirmation of Interstellar Acetic Acid. In: The Astrophysical Journal. Band 480, S. L71–L75, doi:10.1086/310612.
- Thomas Bührke: All-Chemie mit dem Radioteleskop (Memento vom 22. August 2017 im Internet Archive).
- Chris J. Bennett, Ralf I. Kaiser: The Formation of Acetic Acid (CH3COOH) in Interstellar Ice Analogs. In: The Astrophysical Journal. Band 660, 2007, S. 1289, doi:10.1086/513267.
- D. E. Hibbs, U. Kolitsch, P. Leverett, J. L. Sharpe, P. A. Williams: Hoganite and paceite, two new acetate minerals from the Potosi mine, Broken Hill, Australia. In: Mineralogical Magazine. Band 66, S. 459–464, doi:10.1180/0026461026630042.
- The Nobel Prize in Physiology or Medicine 1964.
- Barbara E. Jones: From waking to sleeping: neuronal and chemical substrates. In: Trends in Pharmacological Sciences. Band 26, 2005, S. 578, doi:10.1016/j.tips.2005.09.009.
- D. Elieh-Ali-Komi, M. R. Hamblin: Chitin and Chitosan: Production and Application of Versatile Biomedical Nanomaterials. In: International journal of advanced research. Band 4, Nummer 3, März 2016, S. 411–427. PMID 27819009, PMC 5094803 (freier Volltext).
- Severian Dumitriu: Polysaccharides in Medicinal Applications. CRC Press, 1996, ISBN 0-8247-9540-7, S. 631 (google.com).
- Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, S. 1, doi:10.1002/14356007.a01_045 (Abschnitt „Introduction“).
- Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, S. 24–25, doi:10.1002/14356007.a01_045 (Abschnitt „Economic Aspects“).
- F. E. Fontaine, W. H. Peterson, E. McCoy, M. J. Johnson, G. J. Ritter: A New Type of Glucose Fermentation by Clostridium thermoaceticum. In: Journal of bacteriology. Band 43, Nr. 6, Juni 1942, S. 701–715. PMID 16560531, PMC 373636 (freier Volltext).
- Adalbert Wollrab: Organische Chemie: Eine Einführung für Lehramts- und Nebenfachstudenten. 4. Auflage. Springer, 2014, ISBN 978-3-642-45143-0, S. 588.
- R. Brockhaus: Katalytische Gasphasen-Oxidation von Butenen zu Essigsäure. In: Chemie Ingenieur Technik – CIT. Band 38, 1966, S. 1039, doi:10.1002/cite.330381005.
- Dirk Steinborn: Grundlagen der metallorganischen Komplexkatalyse. Teubner, Wiesbaden 2007, ISBN 978-3-8351-0088-6, S. 283–292.
- James F. Roth: The production of acetic acid. In: Platinum metals review. Band 19.1, 1975, S. 12–14.
- Glenn J Sunley, Derrick J Watson: High productivity methanol carbonylation catalysis using iridium. In: Catalysis Today. Band 58, 2000, S. 293, doi:10.1016/S0920-5861(00)00263-7.
- Eugen Müller: Neuere Anschauungen der Organischen Chemie. Springer Verlag, 1957, ISBN 978-3-642-87592-2, S. 256.
- R. E. Jones, D. H. Templeton: The crystal structure of acetic acid. In: Acta Crystallographica. Band 11, 1958, S. 484–487, doi:10.1107/S0365110X58001341.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. 5. Auflage. Georg Thieme Verlag, 2005, ISBN 3-13-541505-8, S. 263–264.
- Strukturdaten von R. Boese, D. Bläser, R. Latz, A. Bäumen: Acetic acid at 40K. In: Acta Crystallographica. Band C55, 1999, doi:10.1107/S0108270199099862 (nur CIF-Datei).
- Minhua Zhang, Lihang Chen, Huaming Yang, Jing Ma:nTheoretical Study of Acetic Acid Association Based on Hydrogen Bonding Mechanism. In: The Journal of Physical Chemistry A. Band 121, 2017, S. 4560–4568, doi:10.1021/acs.jpca.7b03324.
- R. A. McDonald, S. A. Shrader, D. R. Stull: Vapor Pressures and Freezing Points of 30 Organics. In: J. Chem. Eng. Data. Band 4, 1959, S. 311–313, doi:10.1021/je60004a009.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford, 1985, ISBN 0-632-01529-2.
- Berufsgenossenschaftliche Regeln für Sicherheit und Gesundheit bei der Arbeit; BGR 132: Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen. Jedermann-Verlag, Heidelberg 2004, ISBN 3-86825-146-4.
- Eintrag zu Essigsäure. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 20. Juli 2012.
- J. F. Martin, R. J. L. Andon: Thermodynamic properties of organic oxygen compounds. Part LII. Molar heat capacity of ethanoic, propanoic, and butanoic acids. In J. Chem. Thermodynam. Band 14, 1982, S. 679–688, doi:10.1016/0021-9614(82)90083-0.
- W. Weltner Jr.: The vibrational spectrum, associative and thermodynamic properties of acetic acid vapor. In: J. Am. Chem. Soc. Band 77, 1955, S. 3941–3950, doi:10.1021/ja01620a003.
- W. V. Steele, R. D. Chirico, A. B. Cowell, S. E. Knipmeyer, A. Nguyen: Thermodynamic properties and ideal-gas enthalpies of formation for 2-aminoisobutyric acid (2-methylalanine), acetic acid, (4-methyl-3-penten-2-one), 4-methylpent-1-ene, 2,2'-bis(phenylthio)propane, and glycidyl phenyl ether (1,2-epoxy- 3-phenoxypropane). In: J. Chem. Eng. Data. Band 42, 1997, S. 1052–1066, doi:10.1021/je970099y.
- J. Chao: Thermodynamic properties of key organic oxygen compounds in the carbon range C1 to C4. Part 2. Ideal gas properties in J. Phys. Chem. Ref. Data 15 (1986) 1369–1436.
- J. Schmidt: Auslegung von Sicherheitsventilen für Mehrzweckanlagen nach ISO 4126-10. In: Chem. Ing. Techn. Band 83, 2011, S. 796–812, doi:10.1002/cite.201000202.
- Alfons Hädener, Heinz Kaufmann: Grundlagen der allgemeinen und anorganischen Chemie. Birkhäuser Verlag, 2006, ISBN 3-7643-7041-6, S. 119.
- Patent US5288318: Cellulose acetate and starch based biodegradable injection molded plastics compositions and methods of manufacture. Veröffentlicht am 22. Februar 1994, Erfinder: Jean M. Mayer, Glenn R. Elion.
- Lehrinformation Bäckereitechnologie: Mikrobiologische Aspekte der Sauerteiggärung – Regulation der Essigsäurebildung (als PDF).
- Brigitte M. Gensthaler: Tödliches Zusammenspiel. In: Pharmazeutische Zeitung. Band 30, 2001.
- Werner Back: Mikrobiologie der Lebensmittel: Getränke. Behr’s Verlag, 2008, ISBN 978-3-89947-360-5, S. 237.
- M.-S. Rhee, S.-Y. Lee, R. H. Dougherty, D.-H. Kang: Antimicrobial Effects of Mustard Flour and Acetic Acid against Escherichia coli O157:H7, Listeria monocytogenes, and Salmonella enterica Serovar Typhimurium. In: Applied and Environmental Microbiology. Band 69, 2003, S. 2959–2962, doi:10.1128/AEM.69.5.2959-2963.2003.
- Verordnung über den Verkehr mit Essig und Essigessenz, § 1 Abs. 1.
- Hosea Cheung, Robin S. Tanke, G. Paul Torrence: Acetic Acid. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, S. 19–20, doi:10.1002/14356007.a01_045 (Abschnitt „Uses“).
- Fred Winter: Riechstoffe und Parfümierungstechnik. Verlag Julius Springer, 1933, S. 94.
- Herman F. Mark: Encyclopedia of Polymer Science and Technology. John Wiley & Sons, 2007, ISBN 978-0-470-04610-4, S. 1103.
- B. Phillips, P. S. Starcher, B. D. Ash: Preparation of Aliphatic Peroxyacids. In: J. Org. Chem. Band 23, 1958, S. 1823–1826. doi:10.1021/jo01106a001
- Joël Fokom-Domgue, Christophe Combescure, Victoire Fokom-Defo, Pierre Marie Tebeu, Pierre Vassilakos, André Pascal Kengne, Patrick Petignat: Performance of alternative strategies for primary cervical cancer screening in sub-Saharan Africa: systematic review and meta-analysis of diagnostic test accuracy studies. In: BMJ. S. h3084, doi:10.1136/bmj.h3084.
- Rudolf Ditmar: Der Kautschuk. Springer, 1912, S. 25–27.
- Jan Kresten Nielsen, Sten Lennart Jakobsen: Extraction of Calcareous Macrofossils from the Upper Cretaceous White Chalk and Other Sedimentary Carbonates in Denmark and Sweden: The Acid-Hot Water Method and the Waterblasting Technique. (pdf, 762 kB). In: Palaeontologia Electronica. Band 7, Nr. 4, S. 1–11.
- P. M. Osterberg, J. K. Niemeier, C. J. Welch, J. M. Hawkins, J. R. Martinelli, T. E. Johnson, T. W. Root, S. S. Stahl: Experimental Limiting Oxygen Concentrations for Nine Organic Solvents at Temperatures and Pressures Relevant to Aerobic Oxidations in the Pharmaceutical Industry. In: Org. Process Res. Dev. Band 19, 2015, S. 1537–1542, doi:10.1021/op500328f.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Henry Portz: Brand- und Explosionsschutz von A – Z. Vieweg & Sohn, Wiesbaden, 2005, ISBN 978-3-322-80198-2, S. 297.
- GHS-Einstufungkriterien Essigsäure.
- Karlheinz Lohs, Peter Elstner, Ursula Stephan: Fachlexikon Toxikologie. Springer Verlag, 2009, ISBN 978-3-540-27334-9, S. 156.
- NIOSH Pocket Guide to Chemical Hazards: Acetic acid.
- Registrierungsdossier zu Acetic Acid bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. Dezember 2017.
- Günther Harsch, Rebekka Heimann: Der Estercyclus – ein experimentelles Projekt zur Schulung ressourcenbewußten Denkens und Handelns. (PDF; 2,6 MB). In: Chem. Sch. Band 41, 1994, Beiheft, S. 7.
- Daten aus der Spectral Database for Organic Compounds.
- Methoden der organischen Chemie. Band 15: Synthese von Peptiden II. 4., völlig neu gestaltete Auflage. Georg Thieme Verlag, 1974, ISBN 3-13-216304-X, S. 553 (google.com).




