Phosphor
Phosphor (von altgriechisch φωσφόρος phōsphóros, deutsch ‚lichttragend‘, vom Leuchten des weißen Phosphors bei der Reaktion mit Sauerstoff) ist ein chemisches Element mit dem Symbol P und der Ordnungszahl 15. Im Periodensystem steht es in der fünften Hauptgruppe, bzw. 15. IUPAC-Gruppe oder Stickstoffgruppe.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Phosphor, P, 15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Nichtmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 15, 3, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | weiß-beige (W) dunkelrot (R) schwarz (S) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer |
7723-14-0 (rot) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-115-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.286 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,09 %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 30,973761998(5)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 100 (98) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 107 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ne] 3s2 3p3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 10.486686(15) eV[4] ≈ 1011.81 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 19.76949(4) eV[4] ≈ 1907.47 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 30.20264(9) eV[4] ≈ 2914.11 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 51.44387(12) eV[4] ≈ 4963.58 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 65.02511(12) eV[4] ≈ 6273.97 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | orthorhombisch (schwarz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | weiß: 1,83 g/cm3[7] rot: 2,0 … 2,4 g/cm3[8] schwarz: 2,69 g/cm3[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (rot: χm = −1,9 · 10−5[10] schwarz: χm = −2,9 · 10−5)[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | weiß: 317,3 K (44,2 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | weiß: 553,2 K[11] (280 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 17,02 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 51,9 kJ·mol−1 (P4)[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 0,64 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | rot: 3900 Pa[8] weiß: 3300[7] Pa bei 293 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | rot: 685,6[1] J·kg−1·K−1 bei 298 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,236 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | ±3, 4, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,19 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,02 mg·m−3 (weißer/gelber Phosphor, einatembarer Staub)[14] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxikologische Daten |
Weißer Phosphor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Phosphor kommt in mehreren, sich stark unterscheidenden Modifikationen vor. Der aus P4-Molekülen aufgebaute weiße Phosphor ist die am einfachsten herzustellende, jedoch thermodynamisch nicht die stabilste Modifikation.
Phosphorverbindungen sind für alle Lebewesen essenziell und bei Aufbau und Funktion der Organismen in zentralen Bereichen beteiligt, wie der DNA und der zellulären Energieversorgung (ADP/ATP). Die biogeochemische Umsetzung von Phosphor erfolgt im Rahmen des Phosphorkreislaufs.
Geschichte
.jpeg.webp)



Phosphor wurde 1669 von Hennig Brand, einem deutschen Apotheker und Alchemisten, entdeckt, als er – auf der Suche nach dem „Stein der Weisen“ – Urin bis zur Trocknung eindampfte.[20] Als Brand den trockenen Urin-Rückstand, der – wie heute bekannt – auch Phosphate (Salze der Phosphorsäure) enthält, unter Luftabschluss – also in Abwesenheit eines Oxidationsmittels – glühte, entstand durch Reduktion der Phosphate mit den im Urin ebenfalls enthaltenen organischen Verbindungen als Reduktionsmittel weißer Phosphor, der im Dunkeln aufgrund seiner Chemilumineszenz leuchtete.
Obwohl Phosphor zu dieser Zeit noch keine Verwendung außer als Nachtlampe fand, wurde er mit Gold aufgewogen. Hennig Brand wurde durch diese Entdeckung trotzdem nicht reich und verkaufte das Herstellungsrezept an den Alchemisten Johann Daniel Kraft, der damit ein Vermögen machte. Er demonstrierte die Herstellung von Phosphor 1677 vor Robert Boyle. Bemerkenswert ist, dass Hennig Brand seinen Phosphorus in Hannover auch dem Wissenschaftler und Philosophen Gottfried Wilhelm Leibniz vorstellte, der aus Begeisterung über den geheimnisvollen Lichtträger „Phosphorus Mirabilis“ ein Gedicht verfasste.
Weißer Phosphor wurde anfangs auf Grund seiner Chemilumineszenz – als Heilmittel verwendet. Nach 1830 erhielt er eine wichtige Bedeutung bei der Streichholzherstellung. Da weißer Phosphor hochgiftig ist, kam es jedoch oft zu schweren Vergiftungen bei Arbeitern, die mit ihm in Berührung kamen. Die Phosphordämpfe drangen vorwiegend über schadhafte Zähne in den Körper ein und führten zur Phosphornekrose besonders des Kiefers. Der Phosphorkiefer, englisch phossy jaw, war eine der ersten Berufskrankheiten, die als solche diagnostiziert wurden.[21]
Weißer Phosphor spielte in der Militärgeschichte als Waffe eine Rolle. Er wurde als Füllmaterial von Brandbomben, den sogenannten Phosphorbomben, verwendet. So setzte die britische Luftwaffe im Zweiten Weltkrieg ein Gemisch aus weißem Phosphor und Kautschuk ein. Durch den Kautschuk klebt die zähflüssige Masse und lässt sich deshalb schlecht abstreifen. Sie verursachte auf der Haut schlecht heilende Wunden.
Schon früh entdeckten Chemiker, dass weißer Phosphor, der Licht ausgesetzt war, rot wurde, auch im Vakuum.[22] Jöns Jakob Berzelius vermutete, dass dies eine Modifikation des weißen Phosphors war, nachgewiesen wurde das erst 1847 von Anton Schrötter von Kristelli (Anton Schrötter) in Wien, der die Substanz isolierte und analysierte.[23][24] Violetten Phosphor entdeckte 1865 Johann Wilhelm Hittorf.[25] und die Hochdruckvariante schwarzer Phosphor Percy Williams Bridgman 1914.[26]
Vorkommen
Auf der Erde, insbesondere der Erdkruste, kommt Phosphor ausschließlich in gebundener Form, das heißt nicht gediegen, meist in Form der Phosphate vor (Gehalt in der Erdkruste: ~ 0,09 %[27], etwa 1,2 Kilogramm pro Tonne). Typische Mineralien sind etwa die Apatite Ca5(PO4)3(F,Cl,OH). Besonders der Fluorapatit und der mit Calciumcarbonat durchsetzte Phosphorit stellen ökonomisch die wichtigsten Phosphate dar. Darüber hinaus gibt es weitere phosphorhaltige Mineralien, wie beispielsweise den Wavellit Al3(PO4)(F,OH) · 5 H2O, den Vivianit Fe3(PO4)2 · 8 H2O und den Türkis CuAl6[(PO4)(OH2)]4 · 4 H2O.
Die größten Vorkommen an Phosphat-Mineralien findet man in Afrika, in China und den USA (Florida). Vier Länder besitzen rund 80 % an den weltweiten Phosphatgestein-Reserven, die mit derzeitiger Technologie wirtschaftlich abbaubar sind: Marokko (zusammen mit Westsahara 36,5 %), China (23,7 %), Jordanien und Südafrika (je 9,6 %). Die kontinentalen Vorkommen reichen nur noch für wenige Jahrzehnte; Schätzungen aus den 2000er Jahren variieren zwischen 50 (2008)[28] und 130 Jahren (2006).[29] Infolge neu gefundener Lagerstätten hauptsächlich in Nordafrika und Irak geht eine Schätzung der Bundesregierung von 2012 jedoch davon aus, dass keine Verknappung unmittelbar bevorsteht und die bisher bekannten Vorräte noch bis etwa zum Jahr 2400 reichen.[30] Weiterhin existieren große Vorkommen unter Wasser, die momentan aber nicht ökonomisch abgebaut werden können.[31]
Außer in Mineralien kommt Phosphor auch in Ablagerungen von Vogelkot von Meeresvögeln, dem sogenannten Guano (enthält 7–8 %, selten bis 60 % Chilesalpeter und maximal etwa 40 % Phosphate)[32] vor. Dieser findet sich vorwiegend auf einigen Inseln im Pazifischen Ozean, wie Nauru oder Kiribati und in Südamerika (Peru/Chile). Auf Nauru gehen die Phosphor-Vorräte seit Mitte der 1970er Jahre kontinuierlich zurück und sind mittlerweile fast völlig erschöpft.
Klärschlamm enthält große Mengen an Phosphaten.[33] Durch Urban Mining kann die Phosphorsäure aus dem Klärschlamm zurückgewonnen werden.[34]
Von den weltweit jährlich geförderten etwa 180 Millionen Tonnen (Stand 2010) an Rohphosphaten werden etwa 90 % zur Herstellung von Düngemitteln verwendet. Phosphor kann in Düngemitteln durch keinen anderen Stoff ersetzt werden.[35]
Phosphor hat auch in der organischen Welt (als gebundenes oder partikulär gebundendes organisches Phosphat in Organismen und im Detritus[36]) eine wichtige Bedeutung und kommt in verschiedensten Bereichen der Fauna und Flora vor: etwa als Hydroxylapatit Ca5(PO4)3OH, der einer der Hauptbestandteile der Gerüstsubstanz ist, die in Knochen und Zähnen vorkommt. Weiterhin spielen Phosphorverbindungen als Bestandteile der Nukleinsäuren und als Bestandteil des Energieträgers ATP eine wichtige Rolle in lebenden Organismen und ist essenziell für alle bekannten Lebewesen.
Phosphor entsteht in massereichen Sternen beim Sauerstoffbrennen aus Sauerstoff bei Temperaturen über 1,5·109 Kelvin und Dichten von mindestens 1010 kg/m3.
Es wird postuliert, dass der für frühe Lebewesen verwertbare Phosphor erst durch Meteorite verfügbar war, die während des Hadaikums auf die Erde gelangten.[37] Im Jahr 2020 zeigten Astronomen anhand von Daten von ALMA und ROSINA einen Weg zur Entstehung von Phosphor auf: während der Entstehung von Sternen in Gaswolken wie „AFGL 5142“. Zudem belegen sie, dass dieses dann über Kometen – wie Tschurjumow-Gerassimenko – in Form von Phosphor-Monoxid auf die Erde gelangt sein könnte.[38][39][40] Das bereits auf der Erde vorkommende Phosphat ist reaktionsträge und schwer löslich und wäre daher für die ersten Lebewesen nur begrenzt nutzbar gewesen. Dagegen reagieren die von den Meteoriten mitgebrachten Schreibersite mit Wasser zu reduzierten Phosphiden. Diese wären für eine präbiotische Synthese phosphorylierter Biomoleküle (wie Ribonukleinsäure) plausible Ausgangsstoffe.
Gewinnung und Darstellung
.svg.png.webp)
Gewonnen wird Phosphor aus Phosphatmineralien wie Phosphorit oder Apatit, in dem diese in einem elektrischen Schmelz-Reduktionsofen zusammen mit Quarzkies auf 1500 °C erhitzt und so zu weißem Phosphor umgesetzt werden. Der Ofen ist als geschlossener Niederschachtofen ausgeführt, die Wärme wird über Söderberg-Elektroden zugeführt.[41]
Die in der Elektrode enthaltene Kohlenstoffmasse wirkt dabei als Reduktionsmittel und das Siliciumdioxid des Quarzes dient als Schlackenbildner. Der beim Prozess gasförmig anfallende Phosphor wird kondensiert und unter Wasser gesammelt.
Hersteller
Nach der Pleite von Thermphos, dem letzten europäischen Hersteller, basiert die Versorgung mit weißem Phosphor fast ausschließlich auf der Firma Kazphosphate, die ein Werk in Schymkent betreibt. Weitere Hersteller sind Monsanto mit einem Werk in Soda Springs (Idaho)[42] sowie verschiedene chinesische Firmen.[43]
Modifikationen und Eigenschaften
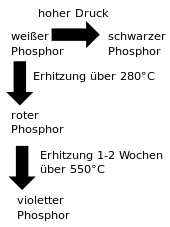
Phosphor tritt in vier allotropen Modifikationen als weißer, roter, schwarzer und violetter Phosphor auf. Jeder dieser Grundtypen bildet verschiedene Kristallstrukturen. Dadurch kommt es zu sehr großen Unterschieden in physikalischen Eigenschaften und Reaktivität.[44]
Da die anderen Modifikationen schwer direkt zu gewinnen sind, wird zunächst immer weißer Phosphor produziert und dieser dann in andere Modifikationen umgewandelt. Diese können durch hohen Druck und hohe Temperatur ineinander überführt werden. Der schwarze Phosphor ist bei Raumtemperatur die eigentlich stabile Modifikation, die anderen sind allerdings auf Grund der geringen Umwandlungsgeschwindigkeit metastabil. Weißer Phosphor kann im Labor durch Erhitzung von rotem Phosphor unter Ausschluss von Sauerstoff hergestellt werden. Umgekehrt kann roter Phosphor auch durch mehrstündiges Erhitzen von weißem Phosphor auf etwa 180–350 °C erzeugt werden.[45]
Gasförmiger Zustand
Im Phosphordampf überwiegen unterhalb von 1200 °C P4-Tetraeder als kleinste molekulare Einheiten.
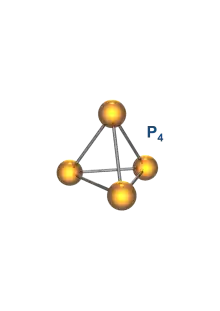
Der P-P-Abstand in den tetraedrischen P4-Molekülen beträgt rg = 2.1994(3) Å, der P-P-P-Winkel 60°.[46] Die Struktur wurde mit Gas-Elektronenbeugung bestimmt.
Der Dissoziationsgrad beträgt bei 800 °C ~ 1 %. Zwischen 1200 und 2000 °C überwiegen P2-Moleküle mit stickstoffanaloger Valenzelektronenstruktur, oberhalb von 2000 °C dissoziieren diese mit steigenden Temperaturen schließlich langsam zu atomarem Phosphor.[47]
Weißer Phosphor

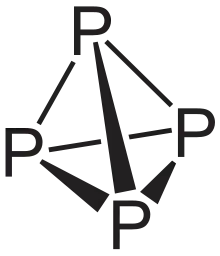

Weißer Phosphor ist die flüchtigste und reaktivste Modifikation des Phosphors. Er hat eine Dichte von 1,82 g/cm3, einen Schmelzpunkt von 44,25 °C und einen Siedepunkt von 280 °C und ist durchscheinend und wachsartig. Verunreinigt wird der weiße Phosphor auch als gelber Phosphor bezeichnet[48]. Der kubische weiße Phosphor ist in Phosphortrichlorid und Kohlenstoffdisulfid CS2 sehr leicht löslich; 100 g Kohlenstoffdisulfid lösen mehr als 1 kg Phosphor. In Tetrachlorkohlenstoff, Benzol oder Ether ist Phosphor schwach löslich. In Wasser ist er praktisch unlöslich.
Bei −76,9 °C geht die kubische Form (α-Form) in eine hexagonale Form (β-Form) über (Rotation der freien Außenelektronen „eingefroren“). In jeder Form (α-, β-, in Lösung) bildet weißer Phosphor P4-Tetraeder mit Bindungswinkeln von 60°. Die β-Form des weißen Phosphors enthält drei leicht unterschiedliche P4-Moleküle, d. h. 18 verschiedene P-P-Bindungslängen zwischen 2.1768(5) und 2.1920(5) Å. Die durchschnittliche P-P-Bindungslänge beträgt 2.183(5) Å.[49]
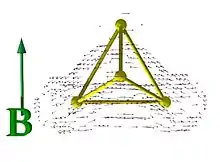
Die Art der Bindung in diesem P4-Tetraeder kann durch sphärische Aromatizität oder Cluster-Bindung beschrieben werden, d. h. die Elektronen sind stark delokalisiert. Dies wurde durch Berechnungen der magnetisch induzierten Ströme veranschaulicht, die 29 nA/T betragen, also viel mehr als im aromatischen Molekül Benzol (11 nA/T).[50]
In fein verteiltem Zustand entzündet sich weißer Phosphor an der Luft von selbst, ab etwa 50 °C entzünden sich auch kompakte Stücke und verbrennen zu Phosphor(V)-oxid. Daher muss weißer Phosphor unter Wasser aufbewahrt werden. Brennender Phosphor darf nicht mit Wasser gelöscht werden, da die Gefahr besteht, dass der Phosphorstaub in feine Ritzen gespült wird und sich nach Verdunstung des Wassers wieder selbst entzündet. Brennender Phosphor wird am besten mit Sand gelöscht.
An der Luft kann weißer Phosphor eine bläuliche Chemilumineszenz zeigen.[51] Diese entsteht aus dem durch den hohen Dampfdruck des weißen Phosphors in der Umgebung vorhandenen gasförmigen P4, das durch Gasphasenoxidation über P4O6 zu P4O10 reagiert. Meist in heftiger exothermer Reaktion verbindet sich Phosphor mit Halogenen, Metallen oder Schwefel. Die hieraus entstehenden Verbindungen sind Phosphorsulfide, Phosphor(III)- oder Phosphor(V)-Verbindungen sowie Phosphide. Unter Einwirkung von starken Laugen bei hoher Temperatur disproportioniert Phosphor zu Phosphan und Hypophosphit. Phosphor hat eine hohe Affinität zu Sauerstoff, wirkt also stark reduzierend. So wird z. B. Schwefelsäure beim Erwärmen mit weißem Phosphor zu Schwefeldioxid reduziert.
Das bei der Verbrennung von Phosphor entstehende Phosphorpentoxid ist stark hygroskopisch und bildet mit der Luftfeuchtigkeit dichte Nebel aus Phosphorsäure. Weißer Phosphor wird deshalb in Nebelgranaten verwendet.
Weißer Phosphor ist hochgiftig; schon etwa 50 mg können für einen erwachsenen Menschen tödlich sein. Der Tod tritt erst nach fünf bis zehn Tagen ein. Auch wird weißer Phosphor nur langsam ausgeschieden. Die langsame Giftwirkung macht(e) Phosphor als Rattengift geeignet. Hierzu waren sogenannte „Phosphorlatwergen“ in Gebrauch.[52] Wegen der allgemeinen Gefahren,[53] und weil geeignetere Mittel zur Verfügung stehen, ist weißer Phosphor als Rattengift obsolet.
Die Toxizität des weißen Phosphors wird vor allem auf sein hohes Reduktionsvermögen zurückgeführt, wodurch intrazelluläre oxidative Stoffwechselabläufe wie Eiweiß- und Kohlenhydratsynthese gestört werden. Dies betrifft vorwiegend enzymatisch gesteuerte Stoffwechselvorgänge in der Leber. Eine weitere Gefahr bilden die durch Reaktion mit Wasser gebildeten hochgiftigen Phosphane, die als starke Stoffwechselgifte eine besondere Affinität zum Zentralnervensystem besitzen.[54] Weißer Phosphor kann mit einer Kupfer(II)-sulfat-Lösung unschädlich gemacht werden. Dabei bildet sich schwerlösliches Kupfer(I)-phosphid.[55]
Seit 1845 wurden bei Arbeitern, vorwiegend in der industriellen Produktion von Streichhölzern mit weißem Phosphor, schwere Kiefer-Nekrosen beobachtet (englisch phossy jaw). Die im 19. Jahrhundert vollkommen ungeschützt mit Phosphorbädern hantierenden Arbeiter (oft auch Kinder und Jugendliche, die beim Verpacken der Streichhölzer beschäftigt waren) wurden schnell arbeitsunfähig. Eine wirksame Therapie gab es nicht. Die Patienten wurden stark entstellt, oft arbeitslos, die Letalität betrug 20 %. Das arbeitsmedizinische Problem der Phosphornekrosen, insbesondere der massiven Kiefernekrosen, führte zu den ersten arbeitsmedizinischen Konsequenzen in der Geschichte der modernen Medizin. Die Berner Konvention führte 1906 zum Verbot des weißen Phosphors in der Streichholzherstellung. Ähnliche Kiefernekrosen sieht man heute bei der Bisphosphonat-Therapie (Bisphosphonatassoziierte Knochennekrose).
Schwarzer Phosphor
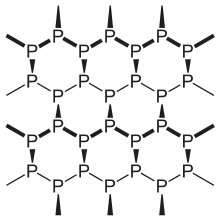
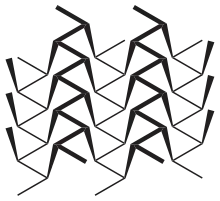


Die bei Zimmertemperatur stabilste Modifikation existiert in einer amorphen und drei kristallinen Formen. Schwarzer Phosphor ist aufgrund seiner polymeren Form unlöslich, deutlich schwerer entflammbar, sehr reaktionsträge und besitzt eine Dichte von 2,69 g/cm3. Daher ist der schwarze Phosphor ebenso wie der rote Phosphor ungiftig. Das dem schwarzen Phosphor zugrundeliegende Kristallgitter besteht aus gewellten Doppelschichten, in dem die Phosphoratome pyramidal mit drei weiteren in der Nachbarschaft befindlichen Phosphoratomen in einem Bindungswinkel von 100° verbunden sind. In dieser Konfiguration besitzt Phosphor Halbleitereigenschaften. In feuchter Luft wird schwarzer Phosphor etwas schneller oxidiert als roter Phosphor, überzieht sich dabei aber mit einer farblosen, viskosen Flüssigkeitshaut aus Phosphorsäuren, so dass der weitere Sauerstoffzutritt verhindert und eine Entzündung erschwert wird. Wenige Schichten von Schwarzem Phosphor können die Polarisation von Licht verändern.[56] Der normale schwarze Phosphor kristallisiert orthorhombisch; bei 80.000 Bar wandelt sich dieser reversibel in eine rhomboedrische und bei 110.000 Bar in eine kubische metallische Modifikation.
Schwarzer Phosphor entsteht unter hohem Druck (12.000 Bar) und erhöhter Temperatur (200 °C) aus weißem Phosphor[27] und unterscheidet sich durch seine Farbe stark von der vorgenannten Modifikation. Er sieht grau-schwarz, glänzend und faserig wie Holz aus. Neuerdings wurde auch eine Niederdruckmodifikation hergestellt.[57][58]
Roter Phosphor
Eine Reihe amorpher und kristalliner Formen mit Dichtevariationen zwischen 2,0 und 2,4 g/cm3 und Schmelzpunkten zwischen 585 °C und 610 °C werden unter der Bezeichnung roter Phosphor zusammengefasst. Gemeinhin ist roter Phosphor amorph, lässt sich aber durch Rekristallisation aus geschmolzenem Blei in den monoklinen Hittorfschen (violetten) Phosphor überführen, welcher eine dreidimensional vernetzte polymere Form bildet.
Gewonnen wird roter Phosphor durch mehrstündiges Erhitzen von weißem Phosphor auf etwa 260 °C unter Luftabschluss. Eine langsame Umwandlung geschieht auch bei Lichteinwirkung. Iod katalysiert die Umwandlung von weißem in roten Phosphor.
Die Unterschiede zwischen den kristallinen Anteilen im roten Phosphor bedingen die verschiedenen Formen desselben. Einfluss haben hier die Korngröße, die Art des Gitters, Verunreinigungen und die verschiedenen Absättigungen der Randgruppen mit Halogenen, Sauerstoff und Hydroxygruppen.
Roter Phosphor ist zwar nicht selbstentzündlich, kann aber mit starken Oxidationsmitteln durch geringe Energiezufuhr (Reibung, Schlag) zur schlagartigen Entzündung oder gar zur Explosion gebracht werden. Ein Beispiel hierfür ist die Armstrongsche Mischung, die zur Zündung von Sicherheitsstreichhölzern verwendet wird. Bezogen auf die Reaktivität gleicht der violette Phosphor eher dem schwarzen Phosphor, während sich der Schencksche Phosphor sehr viel reaktionsfreudiger zeigt als „normaler“ roter Phosphor.
Roter Phosphor ist, im Gegensatz zu weißem Phosphor, nicht giftig. Seine Erstbeschreibung wird Anton Schrötter von Kristelli zugeschrieben.
Hellroter Phosphor
Der Hellrote oder auch Schencksche Phosphor (Rudolf Schenck, 1902) entsteht durch Kochen von weißem Phosphor in Phosphortribromid (PBr3). Das Produkt ist eine Mischverbindung aus Phosphor mit 10 bis 30 % Brom, deren Dichte bei 1,88 g/cm3 liegt.
Violetter/Hittorfscher Phosphor
Violetter Phosphor entsteht beim ein- bis zweiwöchigen Erhitzen von weißem Phosphor auf ca. 550 °C.[59]
Entdeckt wurde er von Johann Wilhelm Hittorf. Es handelt sich um ein nichtleitendes Polymer, das unlöslich in CS2 ist. Die Strukturaufklärung gelang Ende der 1960er Jahre an der Universität Stuttgart durch Herbert Thurn.[60][61] Auch der violette Phosphor ist ungiftig.
Phosphor-Nanostäbchen
Im August 2004 ist es deutschen Forschern gelungen, zwei weitere Modifikationen des vielgesichtigen Elements zu isolieren und strukturell zu charakterisieren: Phosphor-Nanostäbchen. Bei diesen beiden Modifikationen liegen die Phosphoratome in Form von Kettenmolekülen (Polymeren) vor. Entdecker der neuen Modifikationen sind Arno Pfitzner von der Universität Regensburg und Hellmut Eckert von der Westfälischen Wilhelms-Universität Münster.[62] Die rotbraunen Fasern, die sich deutlich von der roten Phosphormodifikation unterscheiden, sind an der Luft in trockenem Zustand über Wochen stabil. Elektronenmikroskopisch zeigte sich diese rotbraune Phosphor-Form als lange, parallel ausgerichtete Nanostäbe mit Durchmessern von ungefähr 0,34 nm (Nanometer) bis 0,47 nm.
Isotope
Phosphor hat nur ein stabiles Isotop, 31P; dies ist das einzige in der Natur vorkommende Isotop des Phosphors. Er ist somit ein Reinelement (anisotop).
Phosphor hat mehrere weitere Isotope, die allerdings alle radioaktiv sind. Das Phosphorisotop 33P hat mit 25,3 Tagen die längste Halbwertszeit. 32P hat eine Halbwertszeit von 14,3 Tagen und wird in der Medizin verwendet. Außerdem dient es in der Molekularbiologie als Tracer. Es kann beispielsweise verwendet werden, um Gensonden radioaktiv zu markieren und mittels Autoradiographie nachzuweisen.
Verwendung
Der größte Teil (80 %) des hergestellten weißen Phosphors wird zu Phosphor(V)-oxid (P2O5) verbrannt, das als Ausgangsmaterial für die Phosphorsäureherstellung sowie für die Darstellung verschiedener Phosphate verwendet wird. Die Hauptmenge aller Phosphate hingegen kommt als Dünger zum Einsatz.[63] Phosphor(V)-oxid hat außerdem noch als eine der wirksamsten wasserentziehenden Substanzen (Trocknungsmittel) Bedeutung.
Ein weiterer Teil wird zu Phosphortrichlorid (PCl3) und Phosphor(V)-sulfid (P4S10) verarbeitet, die wiederum als Grundstoffe für die Herstellung von Flammschutzmitteln, Additiven, Weichmachern und Pflanzenschutzmitteln dienen.
Roter Phosphor findet Verwendung bei der Streichholzherstellung. Paradoxerweise wird roter Phosphor in fein verteilter Form auch Kunststoffen (z. B. Polyamid) als Flammschutzmittel zugesetzt: Die Reaktionsprodukte von Phosphor, Luftsauerstoff und Wasser (Luftfeuchte, Restfeuchte im Kunststoff) bilden dabei eine verkohlte Schutzschicht gegen die Flammen. Außerdem fungieren gebildete Phosphorsuboxide, z. B. PO, als Radikalfänger und unterbrechen auf diese Weise die Verbrennung in der Gasphase.[64]
Des Weiteren werden die als Dünger wichtigen Phosphate direkt aus Calciumphosphat gewonnen, indem dieses mit Schwefelsäure aufgeschlossen wird. Es entsteht das sogenannte Superphosphat. Hierzu werden etwa 60 % der weltweiten Schwefelsäureerzeugung benötigt.
Roter und weißer Phosphor werden auch für militärische Zwecke genutzt. Der sehr giftige und selbstentzündliche weiße Phosphor wird in Brandmunition wie etwa Phosphorbomben verwendet und wurde früher auch in Nebelmunition eingesetzt. In moderner Nebelmunition wird jedoch der ungiftige rote Phosphor in Mischungen mit Oxidationsmitteln und metallischen Brennstoffen verwendet.[65] Ist Nebel das Ziel, versucht man möglichst feinen Staub von P2O5 zu erhalten, von dem jeder Partikel hygroskopisch als Kondensationskeim für Luftfeuchte wirkt. Der Nebel besteht dann aus kleinen Tröpfchen verdünnter Phosphorsäure, einer eher schwachen Säure.
Bis in die 1980er-Jahre wurde mit weißem Phosphor auch in Schulen experimentiert, was aus gesundheitlichen Gründen verboten wurde. Nun darf nur noch roter Phosphor in Experimenten eingesetzt werden.
Das radioaktive Phosphorisotop 32P wird in Medizin und Forschung als Tracer benutzt, um Stoffwechselprozesse zu beobachten (beispielsweise beim 32P-Postlabeling) oder Krankheiten zu behandeln, wie bei der nuklearmedizinischen Therapie der Polycythaemia vera. Ein veraltetes Verfahren zur Diagnostik des Aderhautmelanoms war der Radiophosphortest.
Im Boden
Auf natürlichem Wege gelangt Phosphor einerseits über die Apatit-Verwitterung in den Boden oder aber aus zersetzter organischer Materie. Die atmosphärische Deposition spielt bei Phosphor nur eine untergeordnete Rolle. Phosphor ist ein wichtiger Kernnährstoff.[66] Durch Kunstdünger erhöht der Mensch den Phosphorgehalt im Boden. Als Hauptfaktoren der Verluste kann die Erosion betrachtet werden. Die direkte Auswaschung in das Grundwasser ist sehr gering und abgesehen von vernachlässigbaren Mengen von Phosphin-Gas kommt es zu keiner Ausgasung aus dem Boden. Phosphate besitzen eine sehr schlechte Löslichkeit. So führt zum Beispiel eine Adsorption an Fe- und Al-Hydroxide in sauren Böden zu einer Phosphatfixierung. In basischen Böden kommt es zu einer Ausfällung mit Calcium.
Generell können Phosphatfraktionen im Boden auf verschiedene Art und Weise eingeteilt werden. Zwei häufig verwendete Einteilungen sind die Gliederung nach der Löslichkeit und die Gliederung nach Phosphattypen.
Einteilung von drei unterschiedlichen Phosphatfraktionen im Boden nach der Löslichkeit:
- In der Bodenlösung verfügbares Phosphat ist direkt pflanzenverfügbar. Jedoch ist diese mit 1–2 kg/ha die kleinste Fraktion.
- Labiles Phosphat ist durch spezifische Sorption an Eisen- und Aluminium-Oxide oder an Tonminerale locker gebunden. 450–900 kg/ha können so im Boden vorliegen. Durch Resorption kann aus dieser Fraktion pflanzenverfügbares Phosphat gebildet werden.
- Stabiles Phosphat hat praktisch keine Bedeutung für die Pflanzenernährung, obwohl es mit 3000–6000 kg/ha die größte der drei Fraktionen ist. Als wichtigste Vertreter seien hier Apatite und Calciumphosphate genannt.
Diese Fraktionen stehen zueinander in einem dynamischen Gleichgewicht und können über teilweise sehr lange Zeiträume ineinander übergehen.
Einteilung von drei unterschiedlichen Phosphatfraktionen im Boden nach den Phosphattypen:
- Anorganisches Phosphat ist jener Anteil, der in primären Phosphormineralien (z. B.: Apatit), in sekundären Phosphormineralien (Fe-, Al- oder Ca-Mineralien) oder adsorbiert an Fe- und Al-Hydroxiden vorliegt.
- Gelöstes Phosphat ist jener Anteil der in gelöster Form in der Bodenlösung als H2PO4− oder als HPO42− vorliegt. Gelöstes Phosphat ist direkt pflanzenverfügbar.
- Organisches Phosphat ist ein Sammelbegriff für alle weiteren organischen Verbindungen, die im Boden vorliegen. Dies schließt Phosphor im Humus, an organische Moleküle adsorbierten Phosphor, mikrobiellen Phosphor und Phosphor in Pflanzenrückständen mit ein.
Der Zeitpunkt, zu dem die maximale globale Phosphatproduktion erreicht wird, wird als Peak Phosphor bezeichnet.
Biologische Bedeutung
Physiologie
Phosphor ist für alle biologischen Organismen essenziell. Phosphorverbindungen sind Bestandteil der DNA- und RNA-Moleküle, der Trägersubstanz der Erbinformationen aller Lebewesen. Die stark phosphorhaltige Verbindung Adenosintriphosphat spielt die entscheidende Rolle beim Energiestoffwechsel (aktivierte Zucker) der Zellen. Phosphor ist weiterhin in Zuckerphosphaten, Phospholipiden und Coenzymen enthalten. Die Phosphorylierung ist einer der wichtigsten Regulationsmechanismen in Organismen. Phosphate sind auch ein elementarer Bestandteil des pH-Puffersystems im Blut.
Die Trockenmasse von terrestrischen Pflanzen enthält 0,15 % bis 0,50 % Phosphor,[67] die von Säugetieren wie Menschen ca. 4 %. Die Gerüstsubstanz von Knochen und Zähnen besteht hauptsächlich aus Hydroxylapatit (Ca5(PO4)3OH). Der Körper eines Menschen von 70 kg Gewicht enthält etwa 700 Gramm Phosphor, wovon 600 g fest im Knochensystem gebunden sind.
Der Tagesbedarf eines erwachsenen Menschen beträgt ca. 0,75 Gramm Phosphor; vor allem in Milchprodukten, Fleisch, Fisch und Brot ist er reichhaltig vorhanden. Die Phosphatverfügbarkeit wirkt für Pflanzen vielfach als limitierender Wachstumsfaktor, weswegen in der Landwirtschaft große Mengen phosphathaltigen Düngers ausgebracht werden müssen.[68]
Weißer Phosphor und Phosphorverbindungen wie Phosphan sowie zahlreiche Phosphorsäureester sind sehr giftig.
Pflanzen
In Pflanzen erfüllt Phosphor verschiedene essenzielle Funktionen. Er ist Bestandteil von Lipiden und somit Strukturelement. In der DNA und RNA ist er die Brücke zwischen zwei Ribosen. Kovalent an Adenosin gebunden dient er als universelle Form des Energietransfers in Zellen. Des Weiteren hat Phosphor Einfluss auf den Kohlenhydrathaushalt, die Photosynthese und den Wasserhaushalt von Pflanzen.
Um den im Boden vorkommenden Phosphor für den Stoffwechsel verfügbar zu machen, müssen Pflanzen organisch oder anorganisch gebundenes Phosphor freisetzen, den sie als H2PO4− aufnehmen können. Dasselbe gilt für Mikroorganismen und Pilze, die im Boden leben. Viele Mikroorganismen, Pilze und Pflanzen geben Enzyme in den Boden ab, die die organischen Phosphorsäureester hydrolysieren und somit anorganisches Phosphat freisetzen, welches von den Organismen aufgenommen und metabolisiert werden kann. Diese Enzyme heißen Phosphatasen. Man unterscheidet je nach optimalem pH-Bereich der Phosphatase zwischen sauren (pH 4–5) und basischen Phosphatasen. Nimmt die Pflanze mehr Phosphat auf als sie in Lipiden, Nucleinsäuren und an Adenosin gebunden gebrauchen kann, speichert sie den Überschuss als organisch gebundene Form in den Vakuolen. Phosphatasen helfen auch an dieser Stelle, das Phosphat wieder in die anorganische freie Form zu überführen.
Leiden Pflanzen unter Phosphatmangel, zeigen sie verschiedene Symptome. Die Blattflächen sind verkleinert und der Habitus ist insgesamt reduziert; es kann zu einer Anthocyan-Verfärbung kommen, Nekrosen können sich entwickeln. Durch die Akkumulation von Stärke in den Chloroplasten kommt es zur „Starrtracht“, eine starre Haltung der Blätter. Die Entwicklung von Blüten, Samen und Früchten ist reduziert bzw. verzögert. Da die Chlorophyllsynthese durch Phosphatmangel nicht so stark reduziert wird, wie im Verhältnis die Blattfläche abnimmt, kommt es zu einer Hyperchlorophyllierung in den Blättern, was sich durch eine tiefgrüne Färbung ausdrückt.
Da in der Rhizosphäre, gerade im Bereich von ein bis zwei mm um die Wurzel herum, die Phosphatkonzentration stark reduziert ist, reagieren manche Pflanzen auf Phosphatmangel mit einem verstärkten Wurzelwachstum.[69]
Ökologie
Der Phosphorkreislauf oder Phosphorzyklus ist die stetige Wanderung und biogeochemische Umsetzung des Bioelementes Phosphor in Gewässern, in Böden und in Biomasse.[70]
Wegen der ökologisch zentralen Bedeutung des Phosphats spielt auch die quantitative Phosphoranalytik eine wichtige Rolle in der Praxis der chemischen Gewässer- und Bodenüberwachung, etwa bei der Feststellung von Phosophatverunreinigung (erhöhte Phosphatkonzentration) von Gewässern durch überdüngte landwirtschaftliche Flächen in der Umgebung.
Nachweis
Spektroskopisch
Die Methode der Wahl für den Nachweis von Phosphorverbindungen ist die 31P-NMR-Spektroskopie. 31P ist das einzige natürlich vorkommende Phosphor-Isotop und hat eine Kernspin-Quantenzahl von 1⁄2. Im Vergleich zum Wasserstoff beträgt die relative Empfindlichkeit nur 6,6 %. Der Resonanzbereich beträgt ca. 700 ppm (P4 hat beispielsweise eine Verschiebung von −520 ppm). Als Standard kann 85%ige Phosphorsäure verwendet werden. Da Phosphor ein Spin-1⁄2-Kern ist, sind die Spektren sehr gut auszuwerten. Wenn zusätzlich der Wasserstoff entkoppelt wird, resultiert meist ein scharfes Signal. Die Phosphorverschiebung ist stark abhängig von seinen Bindungspartner, er ist also sehr gut für die Identifikation von bekannten Verbindungen geeignet. Bei unbekannten Verbindungen ist die Aussagekraft oft beschränkt, weil einem Spektrenbereich nur selten eine Verbindungsklasse exklusiv zuzuordnen ist.
| Derivate mit | Chemische Verschiebung (δ in ppm) |
|---|---|
| 3-bindigem P | −180 bis +200 |
| 4-bindigem P | −120 bis +130 |
| 5-bindigem P | −100 bis −20 |
| 6-bindigem P | −220 bis −130 |
Nasschemisch
Die quantitative und qualitative Bestimmung von Phosphor erfolgt über das Phosphat (genauer Orthophosphat PO43−). Gebundener Phosphor wird hierzu gegebenenfalls durch oxidierenden Aufschluss in Phosphat überführt.
Qualitativer Nachweis

Bei der Nachweisreaktion mit Natriummolybdat erhält man in saurer Lösung eine gelbe Lösung von Natriummolybdophosphat, der Lösung wird ein Farbreagens aus gelöster Ascorbinsäure hinzugegeben und im Wasserbad erhitzt. Daraus ergibt sich Molybdänblau, welches quantitativ, fotometrisch bestimmt werden kann.
Bei der Nachweisreaktion mit Ammoniumheptamolybdat erhält man in saurer Lösung einen gelben Niederschlag von Ammoniummolybdophosphat. Unter Berücksichtigung, dass das Heptamolybdat in wässriger Lösung ein Gleichgewicht eingeht:
ergibt sich folgende Reaktionsgleichung:
In alkalischer Ammoniaklösung fällt Phosphat bei Anwesenheit von Magnesium-Ionen als Magnesiumammoniumphosphat aus:
Der Nachweis ist auch in Form von Zirconiumhydrogenphosphat durchführbar:
Nicht korrekt ist, wie in vielen Lehrbüchern angegeben, die Form Zr3(PO4)4, in wässrigen Lösungen bildet sich diese Verbindung nicht!
Historisch ist die Mitscherlich-Probe zum Nachweis von weißem Phosphor interessant, die allem voran bei vermuteten Phosphorvergiftungen eingesetzt wurde. Hierbei wird der Mageninhalt mit Wasser erhitzt, wobei der weiße Phosphor, der mit dem Wasserdampf flüchtig ist, anschließend kondensiert und bei Berührung mit Luftsauerstoff durch ein Leuchten (Chemilumineszenz) in Erscheinung tritt.
Bei Strukturuntersuchungen von Verbindungen, in denen Phosphor enthalten ist, eignet sich die 31P-Kernspinresonanzspektroskopie.
Gravimetrie
Für eine gravimetrische Bestimmung kann aus Phosphat und Molybdationen in stark salzsaurer Lösung ein gelbes Molybdophosphation gebildet werden:
Mit 8-Hydroxychinolin (kurz HOx oder Oxin genannt) bildet sich ein schwer löslicher Niederschlag von Oxin-12-molybdo-1-phosphat, der anschließend bei 160 °C getrocknet und in wasserfreier Form gewogen wird.
- Fällungsform:
- Wägeform:
- (Farbe: dunkelorange)
Der grobkristalline Niederschlag enthält nur 1,37 % Phosphor. Somit sind vor allem kleinere Phosphatmengen gut bestimmbar (siehe Mikromol-Verfahren).
Volumetrie
Volumetrische Phosphatbestimmungen werden durch Fällung mit La3+ oder mit Bi3+-Maßlösungen und anschließender Rücktitration mit EDTA durchgeführt.
Colorimetrie/Photometrie
Für die Bestimmung geringer Konzentrationen an Phosphat in Süßwasserproben wird ein tiefblauer Antimon-Phosphormolybdat-Komplex gebildet, der seine intensive Färbung erst durch ein Reduktionsmittel, meist Ascorbinsäure, erhält. Damit sind empfindliche Nachweise bis in den Bereich von ca. 0,6 mg PO4 /l (ca. 0,2 mg P/l) möglich.
Das Verfahren ist in EN ISO 6878 (früher EN 1189 bzw. DIN 38405 D11) genormt.
Sicherheitshinweise
Weißer Phosphor
Weißer Phosphor kann sich an der Luft entzünden, wenn er fein verteilt vorliegt. Die Selbstentzündungstemperatur liegt bei rund 34 °C, also relativ nahe bei Raumtemperatur. Die Reaktion zu Phosphorpentoxid ist stark exotherm. Mit Wasser und Alkalihydroxiden können giftige Phosphane entstehen. Starke Oxidationsmittel reagieren meist explosionsartig.
Die Entsorgung phosphorhaltiger Munition nach dem Zweiten Weltkrieg in flachen Ostseeabschnitten führt immer wieder zu schweren Verletzungen und Todesfällen. Die bernsteinfarbenen Phosphorklumpen werden angespült und gefährden damit vor allem Fischer oder Touristen. Statistiken zufolge starben nach dem Zweiten Weltkrieg 168 Menschen durch Munitionsreste in der Ostsee, 250 Menschen wurden zum Teil schwer verletzt.[71][72] Mittlerweile gehen Experten sogar davon aus, dass die Zahlen deutlich höher liegen.[73]
Akute Vergiftungen mit weißem Phosphor (Phosphorvergiftungen) äußern sich durch gastrointestinale Störungen, Leberschädigung mit schweren Stoffwechselstörungen sowie Schädigung von Herz und Nieren. Chronische Vergiftungen führen auch in geringen Mengen zu Störung des Allgemeinbefindens und Schädigung von Blut und der Knochen (Osteoporose), besonders am Kiefer.
Dosen ab 15 mg weißem Phosphor können schwere toxische Wirkungen auslösen. Mengen ab 50 mg (~1 mg/kg Körpergewicht) können bereits letal wirken.[7]
Schulversuche mit weißem Phosphor, wie zum Beispiel der Phosphorglockenversuch, sind nach neueren Regelungen nicht zulässig, weißer Phosphor darf aufgrund seiner Gefährlichkeit an Schulen nicht gelagert werden.[74]
Andere Modifikationen
Die anderen bekannten Modifikationen von Phosphor sind wegen ihrer Wasserunlöslichkeit und geringeren Reaktivität in reiner Form ungiftig. Auch entzünden sie sich erst bei höherer Temperatur (roter Phosphor erst bei 260 °C).
Verbindungen
Phosphor ist sehr reaktiv und bildet mit sehr vielen Nichtmetallen kovalente Verbindungen. Dabei kommt er in allen Oxidationsstufen zwischen −3 und +5 und den Koordinationszahlen 1 bis 6, meist 3 bis 4, vor. Die Oxidationszahlen −3 und +5 sind dabei bevorzugt.
Wasserstoffverbindungen
Phosphane (die alte Bezeichnung Phosphine ist nicht mehr IUPAC-konform, wird aber in der chemischen Literatur, vor allem in der angelsächsischen, fast ausschließlich verwendet) bezeichnen Verbindungen des dreibindigen Phosphors mit Wasserstoff oder Ersatz einer oder mehrerer Wasserstoffatome durch organische Gruppen als Bindungspartner. Die organische Gruppe muss über die Kohlenstoffatome des Grundgerüstes direkt mit dem Phosphoratom verbunden sein. Wird die organische Gruppe durch ein Sauerstoffatom an das Phosphoratom gebunden (also Einheit P-O-C, z. B. im P(OPh)3), spricht man von Phosphorigsäureestern oder Phosphiten.
Oxide
Mit Sauerstoff bildet Phosphor verschiedene Verbindungen der allgemeinen Formel P4On (n=6–10, 18)[75], da Phosphor in mehreren Oxidationsstufen vorliegen kann. Dabei sind sowohl Phosphor-Sauerstoff-Einfachbindungen als auch Doppelbindungen sowie verbrückende Phosphor-Sauerstoff-Phosphor-Bindungen möglich.
Phosphoroxide bilden dem Adamantan ähnliche Strukturen:
- Phosphortrioxid P4O6 ist eine weiße, weiche Verbindung, die sehr giftig und reaktiv ist und schnell zu Phosphorpentoxid weiterreagiert.
- Phosphortetroxid P2O4 ist ein Mischoxid. Man kann es durch Oxidation von Phosphortrioxid in Tetrachlormethan gewinnen.
- Phosphorpentoxid P4O10 ist das wichtigste Phosphoroxid. Es ist sehr hygroskopisch und wird als Trocknungsmittel verwendet.
Daneben existieren noch weitere Phosphoroxide, die unter Normalbedingungen nicht isolierbar sind. Von diesen ist das Phosphormonoxid PO das wohl häufigste phosphorhaltige Molekül in interstellaren Wolken.[75]
Sauerstoffsäuren und Salze
Von diesen Oxiden können eine große Zahl von Phosphor-Sauerstoff-Säuren und ihre entsprechenden Salze mit einem oder mehreren Phosphoratomen abgeleitet werden:
| Oxidationsstufe des Phosphors |
Strukturformel | Name der Säure | Name der Salze | |
|---|---|---|---|---|
| Monophosphorsäuren | ||||
| +I | 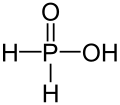 |
Phosphinsäure | Phosphinate | |
| +III | 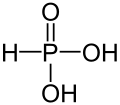 |
Phosphonsäure | Phosphonate | |
| P(OH)3 | Phosphorigsäure | Phosphite | ||
| +V | 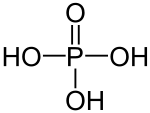 |
Phosphorsäure | Phosphate | |
| +V | 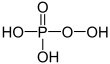 |
Peroxomonophosphorsäure | Peroxomonophosphate | |
| Diphosphorsäuren | ||||
| +II | 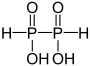 |
Hypodiphosphonsäure | Hypodiphosphonate | |
| +III | 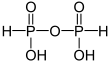 |
Diphosphonsäure | Diphosphonate/Bisphosphonate | |
| +IV | 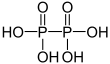 |
Hypodiphosphorsäure | Hypodiphosphate | |
| +V | 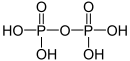 |
Diphosphorsäure | Diphosphate | |
| +V | 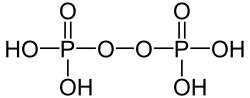 |
Peroxodiphosphorsäure | Peroxodiphosphate | |
Es existieren auch schwefelhaltige Derivate dieser Säuren, z. B. die Thiophosphorsäure, deren Salze Thiophosphate heißen.
Es gibt außerdem eine Reihe von phosphorhaltigen Mineralien, die wichtigsten darunter sind Hydroxylapatit und Fluorapatit. Weitere Phosphormineralien findet man in der Kategorie:Phosphormineral.
Halogenverbindungen
Phosphor bildet eine große Zahl von Verbindungen mit den Halogenen Fluor, Chlor, Brom und Iod (Halogenide). Die wichtigsten Verbindungentypen sind dabei PX3, P2X4 und PX5. Die Fluorverbindungen sind gasförmig, die Chlorverbindungen meist flüssig, Brom- und Iodverbindungen fest. Viele Phosphorhalogenverbindungen sind giftig. Alle Verbindungen sind hydrolyseempfindlich und müssen bei der Lagerung vor Luftfeuchtigkeit geschützt werden.
Beispiele für diese Verbindungsklasse sind Phosphortrichlorid, Phosphorpentachlorid, Diphosphortetrafluorid und Phosphortriiodid. Außerdem kennt man noch Sauerstoff- und Schwefelhalogenverbindungen des Typs POX3 (z. B. Phosphoroxychlorid) und PSX3, sowie polymere Oxidhalogenide des Typs (POX)n. Die Halogenide des Phosphors gehören zu den ersten nichtmetallischen Halogeniden, die bereits zu Beginn des 19. Jahrhunderts von Forschern wie Joseph Louis Gay-Lussac, Humphry Davy und Pierre Louis Dulong untersucht wurden.
Weitere anorganische Verbindungen
Phosphor bildet mit Schwefel eine Reihe von Phosphorsulfiden, die in ihrer Struktur zum Teil den Phosphor-Sauerstoff-Verbindungen ähneln. Der Struktur liegt ein P4-Tetraeder zugrunde, die Tetraederkanten und -spitzen sind unterschiedlich mit Schwefelatomen besetzt. Sie haben die allgemeine Formel P4Sx (x = 3–10). Hergestellt werden sie durch Erhitzen von rotem Phosphor und Schwefel in den entsprechenden Mengenverhältnissen. Phosphorpentasulfid (P4S10) ist hiervon die bedeutendste Verbindung. Tetraphosphortrisulfid (P4S3) wird teilweise noch für die Zündmasse von Streichhölzern benutzt. Auch Verbindungen mit Selen sind bekannt.
Stickstoff bildet mit Phosphor Nitride der Zusammensetzung PN und P3N5. Phosphornitridchloride (Phosphornitrildichloride) sind im monomeren Zustand nicht bekannt. Sie haben die allgemeine Formel (PNCl2)x mit einer ring- oder kettenförmigen Struktur. Sie entstehen durch Reaktion von Ammoniumchlorid mit Phosphorpentachlorid und gehören zur Gruppe der Phosphazene, Verbindungen der allgemeinen Formel (PNH2)x. Polydichlorphosphazen hat Eigenschaften wie Synthesekautschuk, ist aber unbeständig. Durch Ersatz der Chloratome mit Alkoxygruppen oder Perfluoralkoxygruppen erhält man aber chemisch und thermisch beständige Polymere mit elastomeren Eigenschaften.
Organische Verbindungen
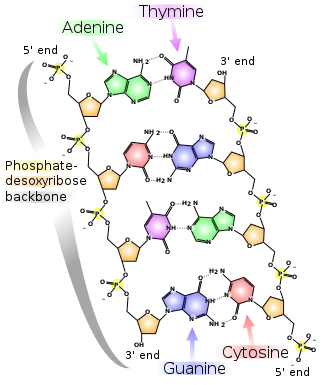
Unter den organischen Phosphorverbindungen kann man unterscheiden in solche mit einer Phosphor-Kohlenstoff-Bindung und ohne Phosphor-Kohlenstoff-Bindung. Unter den ersten gehören Derivate der Phosphane, bei denen Wasserstoffatome durch einen oder mehrere organische Reste ersetzt sind. Ebenso gehören in diese Gruppe Phosphinoxide (R3PO), Alkylphosphinsäuren (R2PO(OH)) und Alkylphosphonsäuren (R-PO(OH)2) bzw. deren Salze. Beispiele für die zweite Gruppe sind Ester der Phosphinsäure, der Phosphonsäure oder der Phosphorsäure, die man als Phosphite, Phosphonate bzw. Phosphate bezeichnet. Organische Phosphorverbindungen – beispielsweise Triphenylphosphan, Dichlor(phenyl)phosphan oder Phosphorylide – spielen in vielen organischen Reaktionen, z. B. der Wittig-Reaktion eine wichtige Rolle.
In der Biochemie sind vor allem die Phosphorsäureester relevant. Sie sind lebenswichtiger Teil von vielen Stoffwechselprozessen und Teil der DNA. Wichtige Moleküle sind:
Literatur
- John Emsley: Phosphor – ein Element auf Leben und Tod. Weinheim 2001, ISBN 3-527-30421-5.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3.
- F. Krafft: Phosphor. Von der Lichtmaterie zum chemischen Element. In: Angewandte Chemie. 81 (17/18), 1969, S. 634–645; doi:10.1002/ange.19690811703.
- Ludwig Maier: Phosphorverbindungen und ihre technische Bedeutung. In: Chemie in unserer Zeit. 9. Jahrg., Nr. 4, 1975, S. 109–116; doi:10.1002/ciuz.19750090403.
- Jochen Metzger: Zeitbombe Phosphor. Wenn dieser Rohstoff ausgeht, droht die Apokalypse. In: P.M.-Welt des Wissens. Nr. 8, 2010, ISSN 1863-9313, S. 58–64.
Weblinks
- Deutsche Phosphor-Plattform DPP e.V. – Netzwerk zur Förderung der Rückgewinnung von Phosphor und zum nachhaltigen Einsatz der rückgewonnenen Produkte
- Phosphorama – Ohne Phosphor kein Leben – Artikelserie mit Hintergrund-Recherchen rund um die lebenswichtige Ressource Phosphor bei RiffReporter.de
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Phosphor) entnommen.
- IUPAC, Standard Atomic Weights Revised 2013.
- Eintrag zu phosphorus in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu phosphorus bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Phosphor) entnommen.
- Eintrag zu Tetraphosphor (weißer Phosphor) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016. (JavaScript erforderlich)
- Eintrag zu Phosphor, roter in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 747.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-142 – 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Phosphor) entnommen.
- Eintrag zu roter/weißer Phosphor im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. Dezember 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 12185-10-3 bzw. Phosphor weiss/gelb), abgerufen am 2. November 2015.
- National Technical Information Service. Vol. AD-B011-150.
- Eintrag zu Phosphorus in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Pesticide Chemicals Official Compendium. Association of the American Pesticide Control Officials, Inc., 1966, S. 901.
- American Heart Journal. Vol. 84, 1972, S. 139.
- Archives of Internal Medicine. Vol. 83, 1949, S. 164.
- Alphons Oppenheim: Brand, Hennig. In: Allgemeine Deutsche Biographie (ADB). Band 3, Duncker & Humblot, Leipzig 1876, S. 236.
- Alexander P. Hardt: Pyrotechnics. Pyrotechnica Publications, Post Falls, Idaho, 2001, ISBN 0-929388-06-2, S. 74 ff.
- Mary Weeks, Discovery of the elements, Journal of Chemical Education 1956, S. 135.
- Schrötter, Neue Modifikation des Phosphors, Liebigs Annalen der Chemie, Band 68, 1848, S. 247–253
- Anton Schrötter: Ueber einen neuen allotropischen Zustand des Phosphors. In: J. C. Poggendorff (Hrsg.): Annalen der Physik und Chemie, Dritte Reihe. 157 (Pogg. Ann. 81), Nr. 10. Johann Ambrosius Barth, 1850, ISSN 1521-3889, S. 276–298, doi:10.1002/andp.18501571009 (online bei Gallica Bibliothèque nationale de France).
- W. Hittorf, Zur Kenntniss des Phosphors, Annalen der Physik, Band 202, 1865, S. 193–228
- Bridgman, Two new modifications of phosphor, Journal of the American Chemical Society, Band 36, 1914, S. 1344–1363.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 928–931.
- „Phosphorverarmung: Bakterielle Säurebildner – Herrscher über Leben und Tod?“ (Schattenblick vom 15. April 2008).
- “The earth's available reserves of phosphate, which is the primary ingredient in fertilizers, could be exhausted within the next 50 to 130 years”, in: A blooming waste, Website University of Technology, Sydney, 6. November 2006; alternativ: “Depletion of current economically exploitable reserves are estimated at somewhere from 60 to 130 years. Using the median reserves estimates and under reasonable predictions, it appears that phosphate reserves would last for at least 100+ years”; in Arne Haarr, EUREAU (European Union of National Associations of Water Suppliers and Waste Water Services): The Reuse of Phosphorus.
- Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Cornelia Behm, Friedrich Ostendorff, Dorothea Steiner, weiterer Abgeordneter und der Fraktion BÜNDNIS 90/ DIE GRÜNEN.Deutscher Bundestag, 15. Dezember 2012, abgerufen am 27. August 2019.
- Phosphat bei USGS Mineral Resources.
- M. Okrusch, S. Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage. Springer, 2005, ISBN 3-540-23812-3.
- Der letzte Dreck? Phosphor-Recycling aus Klärschlamm. 9. März 2021, abgerufen am 4. November 2021.
- Medienmitteilung der Baudirektion des Kantons Zürich: Klärschlamm in Rohstoff verwandeln: Neues Verfahren für industrielle Produktion geeignet. 3. Juni 2019, abgerufen am 14. Oktober 2019.
- Odenwalds Universum: Bedeutet die Verknappung von Phosphor das Ende der Menschheit? auf: focus.de, 9. Mai 2008.
- Dietmar Kunath: Phosophor. In: Claus Schaefer, Torsten Schröer (Hrsg.): Das große Lexikon der Aquaristik. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9, S. 772.
- A. Matthew u. a.: Evidence for reactive reduced phosphorus species in the early Archean ocean. In: PNAS. 110(25), 2013, S. 10089–10094. PMID 23733935; pdf (freier Volltextzugriff, engl.)
- Astronomers reveal interstellar thread of one of life's building blocks (en). In: phys.org. Abgerufen am 28. September 2020.
- Kometen brachten Phosphor - einen Baustein des Lebens - auf die Erde (de). 20. Januar 2020. Abgerufen am 28. September 2020.
- V. M. Rivilla, M. N. Drozdovskaya, K. Altwegg, P. Caselli, M. T. Beltrán, F. Fontani, F. F. S. van der Tak, R. Cesaroni, A. Vasyunin, M. Rubin, F. Lique, S. Marinakis, L. Testi, the ROSINA team: ALMA and ROSINA detections of phosphorus-bearing molecules: the interstellar thread between star-forming regions and comets. In: Monthly Notices of the Royal Astronomical Society. 11. Februar 2020, S. 1180–1198. arxiv:1911.11647. doi:10.1093/mnras/stz3336.
- Eintrag zu Phosphor. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Januar 2015.
- Soda Springs. (Memento vom 24. Juli 2016 im Internet Archive) auf: monsanto.com
- Federal contract site reveals US reliance on Monsanto and Israeli firm for White Phosphorus supply, 7. Februar 2013.
- Horst Briehl: Chemie der Werkstoffe. Springer-Verlag, 2014, ISBN 978-3-658-06225-5, S. 24 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ralf Steudel: Chemie der Nichtmetalle Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 978-3-11-021128-3, S. 360 (eingeschränkte Vorschau in der Google-Buchsuche).
- Brandi M. Cossairt, Christopher C. Cummins, Ashley R. Head, Dennis L. Lichtenberger, Raphael J. F. Berger, S. A. Hayes, N. W. Mitzel, G. Wu,: On the Molecular and Electronic Structures of AsP 3 and P 4. In: Journal of the American Chemical Society. Band 132, Nr. 24, 23. Juni 2010, ISSN 0002-7863, S. 8459–8465, doi:10.1021/ja102580d (acs.org [abgerufen am 3. Juli 2020]).
- Alfons Klemenc: Anorganische Chemie auf physikalisch-chemischer Grundlage. Springer-Verlag, 2013, ISBN 978-3-7091-7793-8, S. 202 (eingeschränkte Vorschau in der Google-Buchsuche).
- Stefanie Ortanderl, Ulf Ritgen: Chemie für Dummies. Das Lehrbuch. John Wiley & Sons, 2014, ISBN 978-3-527-70924-3, S. 541 (eingeschränkte Vorschau in der Google-Buchsuche).
- Arndt Simon, Horst Borrmann, Jörg Horakh: On the Polymorphism of White Phosphorus. In: Chemische Berichte. Band 130, Nr. 9, September 1997, ISSN 0009-2940, S. 1235–1240, doi:10.1002/cber.19971300911 (wiley.com [abgerufen am 8. Februar 2022]).
- Brandi M. Cossairt, Christopher C. Cummins, Ashley R. Head, Dennis L. Lichtenberger, Raphael J. F. Berger: On the Molecular and Electronic Structures of AsP 3 and P 4. In: Journal of the American Chemical Society. Band 132, Nr. 24, 23. Juni 2010, ISSN 0002-7863, S. 8459–8465, doi:10.1021/ja102580d (acs.org [abgerufen am 8. Februar 2022]).
- Dietrich Wertz: Lumineszenz. diplom.de, 2004, ISBN 3-8324-8284-9, S. 29 (eingeschränkte Vorschau in der Google-Buchsuche).
- retro; bib – Seite aus Handbuch der Drogisten-Praxis: Ungeziefermittel.
- J. Sedlmeyer: Über Phosphorvergiftungen. In: Deutsche Zeitschrift für die gesamte gerichtliche Medizin. Band 19, Nr. 1, Dezember 1932, S. 365–383; (doi:10.1007/BF01750213).
- Merkblatt zur BK Nr. 1109: Erkrankungen durch Phosphor oder seine anorganischen Verbindungen, Bek. des BMA vom 25. Februar 1981, BArbBl Heft 4/1981.
- Wie Kupfersulfatlösung bei der Entgiftung von weißem Phosphor wirkt. auf: www.chemieunterricht.de.
- Broadband electro-optic polarization conversion with atomically thin black phosphorus. Auf: www.science.org.
- Stefan Lange, Peer Schmidt, Tom Nilges: Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus. In: Inorganic Chemistry 46 (10), 2007, S. 4028–4035; doi:10.1021/ic062192q.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. Vol. 1, Academic Press 1963, S. 518–525.
- Grundlagen und Hauptgruppenelemente Band 1: Grundlagen und Hauptgruppenelemente. Walter de Gruyter GmbH & Co KG, 2016, ISBN 3-11-049585-6, S. 852 (eingeschränkte Vorschau in der Google-Buchsuche).
- H. Thurn, H. Krebs: Über Struktur und Eigenschaften der Halbmetalle. XXII. Die Kristallstruktur des Hittorfschen Phosphors. In: Acta Cryst. B25, 1969, S. 125–135.
- H. Thurn: Die Kristallstruktur des Hittorfschen Phosphors. Dissertation. Technische Hochschule Stuttgart, 1967.
- Arno Pfitzner, Michael F. Bräu, Josef Zweck, Gunther Brunklaus, Hellmut Eckert: Phosphorus Nanorods – Two Allotropic Modifications of a Long-Known Element. In: Angew. Chem. Int. Ed. 43, 2004, S. 4228–4231; doi:10.1002/anie.200460244.
- Phosphorverbrauch in Deutschland und Europa. 12. Februar 2021, abgerufen am 4. November 2021.
- E.-C. Koch: Specials Materials in Pyrotechnics: IV. The Chemistry of Phosphorus and its Compounds. In: J. Pyrotech. 21, 2005, S. 39; Abstract.
- E.-C. Koch: Specials Materials in Pyrotechnics: V. Military Applications of Phosphorus and its Compounds. In: Propellants Explosives Pyrotechnics 33, 2008, S. 165; doi:10.1002/prep.200700212.
- Dietmar Kunath: Phosphor. In: Claus Schaefer, Torsten Schröer (Hrsg.): Das große Lexikon der Aquaristik. 2 Bände. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9, 772.
- Emanuel Epstein: The Anomaly of Silicon in Plant Biology. In: Proceedings of the National Academy of Sciences of the United States of America 91, 1994, S. 11; doi:10.1073/pnas.91.1.11.
- Lincoln Taiz, Eduardo Zeiger: Physiologie der Pflanzen. Spektrum, Akad. Verlag, Heidelberg/ Berlin 1998, ISBN 3-8274-0537-8.
- K. Mengel: Ernährung und Stoffwechsel der Pflanze. Gustav Fischer Verlag, Jena 1991, S. 324–334.
- Der Phosphorkreislauf – und wo er zur Sackgasse wird. 10. Februar 2021, abgerufen am 4. November 2021.
- Munitionsreste: Granaten in der Ostsee. (Memento vom 14. März 2008 im Internet Archive) auf: sueddeutsche.de, 9. Januar 2008.
- Munitionsreste in der Ostsee. „Die Behörden zeigen kein Interesse“. auf: sueddeutsche.de, 8. Januar 2008.
- Stefan Nehring: Munitions-Unfälle – und kein Ende. auf: travemuende-aktuell.de, 2015.
- DGUV.de: BGR/GUV-SR 2003 Unterricht in Schulen mit gefährlichen Stoffen (Online-Fassung; PDF-Datei; 9,52 MB), S. 24, abgerufen am 25. April 2011.
- Nils Wiberg, Egon Wiberg, Arnold Frederik Hollemann: Anorganische Chemie. Band 1: Grundlagen und Hauptgruppenelemente. 103. Auflage. De Gruyter, Berlin, Boston 2017, ISBN 978-3-11-051854-2, S. 783 ff.(abgerufen über De Gruyter Online)




