Allicin
Allicin ist das Umsetzungsprodukt der in Knoblauch vorkommenden nicht-proteinogenen Aminosäure Alliin. Da Allicin nicht stabil ist, wandelt es sich zum Teil spontan in Di- und Trisulfide, im Öl auch in Vinyldithiine sowie Ajoen um. Erst diese Verbindungen sind für den typischen Knoblauchgeruch verantwortlich.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
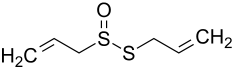 | |||||||||||||||||||
| Strukturformel ohne Stereochemie – Stereozentrum am Schwefelatom der S=O-Gruppe | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Allicin | ||||||||||||||||||
| Andere Namen |
Prop-2-en-1-thiosulfinsäure-S-allylester | ||||||||||||||||||
| Summenformel | C6H10OS2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 162,28 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,11 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Löslichkeit |
mäßig in Wasser, mischbar mit Diethylether und Ethanol[1] | ||||||||||||||||||
| Brechungsindex |
1,561 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
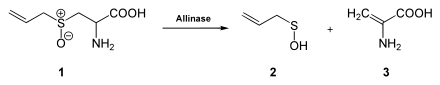
Allicin bildet sich, indem die Zellstruktur von z. B. Knoblauch zerstört wird. Dabei tritt Alliin in Kontakt mit einer Alliinase, so dass schließlich Allicin entsteht:
Chemie
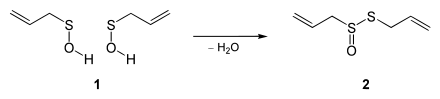
Allicin ist chiral, und kommt in der Natur als Racemat vor.[4] Racemisches Allicin kann durch Oxidation von Diallyldisulfid[5] mit einer Percarbonsäure auch synthetisch hergestellt werden:
- (SCH2CH=CH2)2 + RCO3H → CH2=CHCH2S(O)SCH2CH=CH2 + RCO2H
Allicin kann sich in wässerigem Milieu spontan zu Allylsulfiden bzw. Diallylsulfiden umsetzen. In einer Ölphase (z. B. bei Knoblauchölmazeraten) entstehen Vinyldithiine (70 %), Sulfide (18 %) und Ajoene (12 %).[4][6][7]
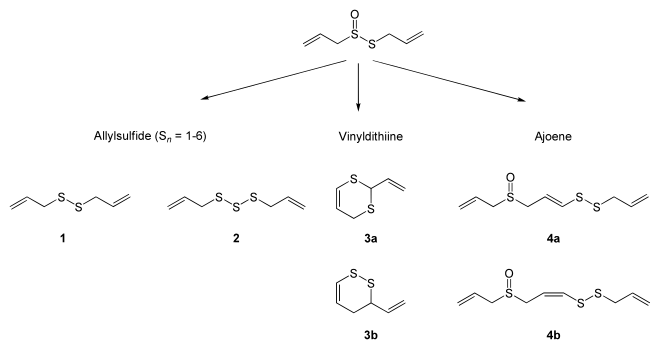
Allicin selbst ist geruchlos, jedoch verursachen v. a. Diallylsulfide und Vinyldithiine den Knoblauch-typischen Geruch.
Biologische Bedeutung
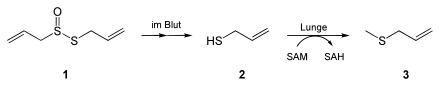
Allicin kann gut resorbiert werden. Im Blut wird es zu Allylmercaptan (Allylthiol) abgebaut. In den Lungen schließlich wird es zu Allylmethylsulfid umgesetzt, dabei wird SAM benötigt.
Es wird vermutet, dass der Großteil des Allylmercaptans zu Allylsulfonsäuren oxidiert wird – analog der Oxidation von Cystein zu Taurin.[7]
Das tränenreizende Allicin ist im Magen antibakteriell: noch in 100.000-facher Verdünnung tötet es sowohl grampositive als auch gramnegative Bakterien ab. Aufgrund einer Lipid-senkenden Wirkung (in vitro und im Tierversuch) wird dem Allicin – und damit dem Knoblauch – eine positive therapeutische Wirkung bei Arteriosklerose zugesprochen. Eine Senkung des LDL-Cholesterins konnte in einer Doppelblind-Studie mit frischem Knoblauch, Knoblauchpulver, Knoblauchextrakt und Placebos an 192 Patienten mit leicht erhöhten Cholesterinwerten nicht nachgewiesen werden. Zu hohe LDL-Cholesterinwerte stehen im Zusammenhang mit der Entstehung von Arteriosklerose.[8]
Pharmakologie
Allicin hat zytotoxische (zelltötende) Eigenschaften,[9] die sich aber beim Verzehr nicht auswirken, da es sehr schnell zu ungiftigen Stoffen weiter abgebaut wird (s. o.). Dabei ist die Basis der Wirkung von Allicin, dass es in der Lage ist, mit Thiolen, die in Proteinen in Resten der Aminosäure Cystein vorkommen, zu reagieren. Dabei gibt es zwei Theorien, die die Wirkung von Allicin erklären: Zum einen ist denkbar, dass Allicin direkt mit Cysteinresten von Enzymen reagiert und diese dadurch zu Mischdisulfiden oxidiert, zum anderen kann die Oxidation am Cystein auch zur Bildung von nicht nativen Disulfidbrücken führen.[10]
Von 2010 bis 2017 wurde Allicin auf vorbeugende[11] und therapeutische Wirkungen auf Tumoren hin untersucht,[12][13] darunter auf Wirkungen bei Brustkrebs[14] und Magenkrebs.[15]
Weblinks
- Wissenschaft.de: Antikörper mit Stinkeffekt – Knoblauchinhaltsstoff Allicin macht Abwehrproteine zu effektiven Waffen gegen Krebszellen
- Wissenschaft.de: Weshalb Knoblauch auf der Zunge brennt – Allicin aktiviert hitzeempfindliche Rezeptoren
Einzelnachweise
- Eintrag zu Allicin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-10.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von S-allyl acrylo-1-sulphinothioate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. Dezember 2017.
- Eric Block: Garlic and Other Alliums: The Lore and the Science. Royal Society of Chemistry, Cambridge 2010, ISBN 978-0-85404-190-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- R. J. W. Cremlyn: An introduction to organosulfur chemistry. Wiley, 1996, ISBN 0-471-95512-4.
- Eric Block: Die Organoschwefelchemie der Gattung Allium und ihre Bedeutung für die organische Chemie des Schwefels. In: Angewandte Chemie. 104, 1992, S. 1158–1203, doi:10.1002/ange.19921040906.
- Theodor Dingermann, Rudolf Hänsel, Ilse Zündorf (Hrsg.): Pharmazeutische Biologie: Molekulare Grundlagen und klinische Anwendungen. 1. Auflage. Springer Verlag, Berlin 2002, ISBN 3-540-42844-5, S. 62–63.
- Christoph Gardener u. a.: Effect of Raw Garlic vs Commercial Garlic Supplements on Plasma Lipid Concentrations in Adults With Moderate Hypercholesterolemia: A Randomized Clinical Trial. In: Archives of Internal Medicine. 167, 2007, S. 346–353. PMID 17325296.
- J. Borlinghaus, F. Albrecht, M. C. Gruhlke, I. D. Nwachukwu, A. J. Slusarenko: Allicin: chemistry and biological properties. In: Molecules. Band 19, Nummer 8, August 2014, S. 12591–12618, doi:10.3390/molecules190812591, PMID 25153873.
- E. D. Wills: Enzyme Inhibition by Allicin, the Active Principle of Garlic. In: Biochem. J. 63, 1956, S. 514–520. PMC 1216205 (freier Volltext).
- G. Schäfer, C. H. Kaschula: The immunomodulation and anti-inflammatory effects of garlic organosulfur compounds in cancer chemoprevention. In: Anti-Cancer Agents in Medicinal Chemistry. Band 14, Nummer 2, Februar 2014, S. 233–240, PMID 24237225, PMC 3915757 (freier Volltext).
- S. Rajput, M. Mandal: Antitumor promoting potential of selected phytochemicals derived from spices: a review. In: European Journal of Cancer Prevention : the official journal of the European Cancer Prevention Organisation. Band 21, Nummer 2, März 2012, S. 205–215, doi:10.1097/CEJ.0b013e32834a7f0c, PMID 21876437.
- S. C. Gupta, J. H. Kim, S. Prasad, B. B. Aggarwal: Regulation of survival, proliferation, invasion, angiogenesis, and metastasis of tumor cells through modulation of inflammatory pathways by nutraceuticals. In: Cancer Metastasis Reviews. Band 29, Nummer 3, September 2010, S. 405–434, doi:10.1007/s10555-010-9235-2, PMID 20737283, PMC 2996866 (freier Volltext).
- A. Tsubura, Y. C. Lai, M. Kuwata, N. Uehara, K. Yoshizawa: Anticancer effects of garlic and garlic-derived compounds for breast cancer control. In: Anti-Cancer Agents in Medicinal Chemistry. Band 11, Nummer 3, März 2011, S. 249–253, PMID 21269259.
- A. Haghi, H. Azimi, R. Rahimi: A Comprehensive Review on Pharmacotherapeutics of Three Phytochemicals, Curcumin, Quercetin, and Allicin, in the Treatment of Gastric Cancer. In: Journal of Gastrointestinal Cancer. Band 48, Nummer 4, Dezember 2017, S. 314–320, doi:10.1007/s12029-017-9997-7, PMID 28828709.
