Gallium
Gallium ist ein selten vorkommendes chemisches Element mit dem Elementsymbol Ga und der Ordnungszahl 31. Im Periodensystem steht es in der 4. Periode und ist das dritte Element der 3. Hauptgruppe, 13. IUPAC-Gruppe, oder Borgruppe. Es ist ein silberweißes, leicht zu verflüssigendes Metall. Gallium kristallisiert nicht in einer der sonst häufig bei Metallen anzutreffenden Kristallstrukturen, sondern in seiner stabilsten Modifikation in einer orthorhombischen Struktur mit Gallium-Dimeren. Daneben sind noch sechs weitere Modifikationen bekannt, die sich bei speziellen Kristallisationsbedingungen oder unter hohem Druck bilden. In seinen chemischen Eigenschaften ähnelt das Metall stark dem Aluminium.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Gallium, Ga, 31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Metalle | ||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 13, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß | ||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-163-8 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.330 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 14 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 69,723(1)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 130 (136) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 187 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d10 4s2 4p1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 5.9993020(12) eV[4] ≈ 578.84 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 20.51514(12) eV[4] ≈ 1979.41 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 30.72576(25) eV[4] ≈ 2964.58 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 63.241(9) eV[4] ≈ 6101.8 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 86.01(12) eV[4] ≈ 8299 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | sieben | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 5,904 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −2,3 · 10−5)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 302,91 K (29,76 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 2673 K[8] (2400 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 11,80 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 256 kJ·mol−1[8] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 5,59 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 2740 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 371[1] J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | etwa 7,14 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 29 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [9] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,53 V (Ga3+ + 3 e− → Ga) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,81 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||
In der Natur kommt Gallium nur in geringem Umfang und meist als Beimischung in Aluminium-, Zink- oder Germaniumerzen vor; Galliumminerale sind sehr selten. Gallium wird auch als Nebenprodukt bei der Produktion von Aluminium oder Zink gewonnen. Der größte Teil des Galliums wird zum III-V-Verbindungshalbleiter Galliumarsenid weiterverarbeitet, der vor allem in der Hochfrequenztechnik, beispielsweise für HF-Transistoren, und in der Optoelektronik, beispielsweise für Leuchtdioden, verwendet wird.
Geschichte

Erstmals wurde ein dem späteren Gallium entsprechendes Element 1871 von Dmitri Mendelejew vorausgesagt. Er prognostizierte mit Hilfe des von ihm entwickelten Periodensystems ein neues, Eka-Aluminium genanntes Element und sagte auch einige Eigenschaften dieses Elementes (Atommasse, spezifisches Gewicht, Schmelzpunktlage und Art der Salze) voraus.[11]
Der französische Chemiker Paul Émile Lecoq de Boisbaudran, der Mendelejews Voraussagen nicht kannte, hatte herausgefunden, dass in der Linienabfolge im Linienspektrum von Elementfamilien bestimmte Gesetze herrschen, und versuchte, diese für die Aluminiumfamilie zu bestätigen. Dabei erkannte er, dass zwischen Aluminium und Indium ein weiteres, noch unbekanntes Element stehen müsse. 1875 gelang es ihm schließlich, im Emissionsspektrum von Zinkblende-Erz, das er in Säure gelöst und mit metallischem Zink versetzt hatte, zwei violette Spektrallinien nachzuweisen, die er dem unbekannten Element zuordnete.[12]
Anschließend konnte Lecoq de Boisbaudran aus einigen hundert Kilogramm Zinkblende eine größere Menge Galliumhydroxid gewinnen. Daraus stellte er durch Lösen in einer Kaliumcarbonatlösung und Elektrolyse erstmals elementares Gallium dar.[12]
Lecoq de Boisbaudran benannte das Element nach Gallien, der lateinischen Bezeichnung seines Heimatlandes Frankreich.[13]
Nachdem die Eigenschaften des neuen Elementes bestimmt waren, erkannte Mendelejew schnell, dass es sich dabei um das von ihm vorausberechnete Eka-Aluminium handeln müsse. Viele Eigenschaften stimmten sehr genau mit den vorausberechneten Werten überein. So wich der theoretisch ermittelte Wert der Dichte von 5,9 nur sehr wenig vom experimentellen von 5,904 ab.[12]
Vorkommen
Gallium ist auf der Erde ein seltenes Element. Mit einem Gehalt von 19 ppm in der kontinentalen Erdkruste ist seine Häufigkeit vergleichbar mit derjenigen von Lithium und Blei. Es kommt nicht elementar, sondern nur gebunden vor, vorwiegend in Aluminium-, Zink- oder Germaniumerzen. Zu den galliumreichsten Erzen zählen Bauxite, Zinkblende-Erze und Germanit.
Die Galliumgehalte sind meist gering; so enthält der in Surinam gefundene Bauxit mit dem höchsten bekannten Gehalt nur 0,008 % Gallium. Die weltweit in Bauxit befindlichen Galliumreserven werden auf 1,6 · 106 Tonnen geschätzt.[14] Höhere Gehalte mit bis zu 1 % Gallium kommen in Germanit vor. Lediglich in der Apex-Mine im US-Bundesstaat Utah kommen so hohe Gehalte in den Erzen vor, dass ein Abbau zur Galliumgewinnung versucht wurde. Dies scheiterte jedoch nach kurzer Zeit aus Rentabilitätsgründen.[15]
Nur wenige Galliumminerale sind bekannt; zu diesen zählen die vorwiegend in Tsumeb in Namibia gefundenen Gallit (CuGaS2), Söhngeit (Ga(OH)3) und Tsumgallit (GaO(OH)).
Gewinnung und Darstellung

Gallium wird als Nebenprodukt bei der Aluminiumherstellung aus Bauxit im Bayer-Verfahren gewonnen. Als Ausgangsprodukt dient das dabei in Natronlauge gelöste Gemisch von Natriumaluminat und Natriumgallat. Durch verschiedene Verfahren kann hieraus Gallium vom Aluminium getrennt werden. Eine Möglichkeit ist die fraktionierte Kristallisation mit Hilfe von Kohlenstoffdioxid, wobei zunächst bevorzugt Aluminiumhydroxid ausfällt, während sich das leichter lösliche Natriumgallat in der Natronlauge anreichert. Erst nach weiteren Prozessschritten wird Galliumhydroxid gefällt, vermischt mit Aluminiumhydroxid. Anschließend wird das Gemisch in Natronlauge gelöst und Gallium durch Elektrolyse gewonnen. Da dieses Verfahren energie- und arbeitsaufwendig ist, wird es nur in Ländern mit geringen Kosten dafür, etwa der Volksrepublik China, angewendet.[14]
Gallium kann auch direkt durch Elektrolyse aus der Natronlauge gewonnen werden. Dazu werden Quecksilberkathoden eingesetzt, wobei sich bei der Elektrolyse ein Galliumamalgam bildet. Auch das Versetzen der Lösung mit Natriumamalgam ist möglich.
Mit Hilfe spezieller Hydroxychinoline als Chelatliganden ist es möglich, Gallium aus der Natronlauge mit Kerosin zu extrahieren und so vom Aluminium zu trennen. Weitere Elemente, die dabei ebenfalls extrahiert werden, können mit verdünnten Säuren abgetrennt werden. Anschließend wird die verbliebene Galliumverbindung in konzentrierter Salz- oder Schwefelsäure gelöst und elektrolytisch zum Metall reduziert.
Für viele technische Anwendungen wird sehr reines Gallium benötigt; für Halbleiter beispielsweise darf es mitunter nur ein Hundertmillionstel an Fremdstoffen enthalten. Mögliche Reinigungsverfahren sind Vakuumdestillation, fraktionierte Kristallisation oder Zonenschmelzen.[14]
Die Menge an produziertem Gallium ist gering. 2008 betrug die Weltprimärproduktion 95 Tonnen. Eine weitere wichtige Quelle ist das Wiederaufbereiten von galliumhaltigen Abfällen, daraus wurden 2008 weitere 135 Tonnen Gallium gewonnen. Hauptproduktionsländer sind die Volksrepublik China, Deutschland, Kasachstan und die Ukraine, für das Galliumrecycling auch die Vereinigten Staaten, Japan und das Vereinigte Königreich.[16]
Im Labormaßstab lässt sich Gallium durch Elektrolyse einer Lösung von Galliumhydroxid in Natronlauge an Platin- oder Wolfram-Elektroden darstellen.[17]
Eigenschaften

Physikalische Eigenschaften
Gallium ist ein silberweißes, weiches (Mohs-Härte: 1,5[18]) Metall. Es hat einen für Metalle ungewöhnlich niedrigen Schmelzpunkt, der bei 29,76 °C liegt.[19] Es ist damit nach Quecksilber und Caesium das Metall mit dem niedrigsten Schmelzpunkt, der auch deutlich unter denjenigen der benachbarten Elemente Aluminium und Indium liegt. Verantwortlich hierfür ist wahrscheinlich die ungewöhnliche Kristallstruktur, die im Gegensatz zu den Strukturen anderer Metalle keine hohe Symmetrie aufweist und daher nicht sehr stabil ist.[20] Da der Siedepunkt mit 2400 °C vergleichsweise hoch liegt, besitzt Gallium einen ungewöhnlich großen Bereich, in dem es flüssig ist. Auf Grund der schwierigen Kristallisation lässt sich flüssiges Gallium leicht unter den Schmelzpunkt abkühlen (Unterkühlung) und kristallisiert bei der Bildung von Kristallisationskeimen schlagartig. Typische Werte der Unterkühlung liegen bei Temperaturunterschieden von 40 bis 70 °C.[21] Schmelzpunkt und Gefrierpunkt werden durch Verminderung der Größe verringert, so weist ein 35 nm großer Partikel Gallium eine Schmelztemperatur von ca. −14,7 °C und eine Gefriertemperatur von ca. −128,3 °C auf.[22] Die physikalischen Eigenschaften verändern sich durch den fest-flüssigen Phasenübergang. So sinkt die elektrische Leitfähigkeit am Phasenübergang von ca. 0,71 · 105 S/cm (Feststoff) auf 0,38· 105 S/cm (Flüssigkeit).[23][24] Weiterhin besitzt Gallium – wie Silicium, einige andere Elemente und Wasser – eine Dichteanomalie; seine Dichte ist im flüssigen Zustand um etwa 3,2 %[14] höher als in fester Form und liegt bei ca. 6,09 g/cm³.[21] Dies ist typisch für Stoffe, die im festen Zustand molekulare Bindungen besitzen.[25] Weitere wichtige Parameter für Flüssigkeiten sind die Oberflächenspannung und die Viskosität. Die Oberflächenspannung wurde von vielen Wissenschaftlern gemessen und man hat sich auf einen Wert von ca. 711 mN/m geeinigt (zum Vergleich liegt die Oberflächenspannung von Wasser bei ca. 72,7 mN/m).[21][26][27] Die Oberflächenspannung sinkt durch Oxidation (Gallium oxidiert an der Luft spontan und schnell) auf etwa die Hälfte des ursprünglichen Wertes (ca. 360 mN/m),[28] ist jedoch schwer zu messen, da sich die Oxidschicht wie ein Feststoff verhält und somit eine Fließgrenze entsteht.[28] Die Viskosität von flüssigem Gallium liegt bei ca. 2,0 mPa·s.[29]
Gallium ist im festen Zustand diamagnetisch, wird jedoch im flüssigen Zustand paramagnetisch (χm = 2,4 · 10−6 bei 40 °C)[30]
Charakteristisch für seine Strukturen ist das Ausbilden von Gallium-Gallium-Bindungen. Es sind verschiedene Modifikationen bekannt, die sich bei unterschiedlichen Kristallisationsbedingungen (vier bekannte Modifikationen, α- bis δ-Gallium, unter Normaldruck) und unter Druck bilden (insgesamt drei weitere Hochdruckmodifikationen, Ga-II, Ga-III, Ga-IV). Die bei Raumtemperatur stabilste Modifikation ist das α-Gallium, das in einer orthorhombischen Schichtstruktur kristallisiert. Dabei bilden jeweils zwei über eine kovalente Bindung aneinander gebundene Atome ein Dimer. Jedes Galliumatom grenzt zusätzlich an sechs weitere Atome anderer Dimere. Zwischen den einzelnen Dimeren herrschen metallische Bindungen. Die Galliumdimere sind so stabil, dass sie auch beim Schmelzen zunächst erhalten bleiben und auch in der Gasphase nachweisbar sind.[31]
Weitere Modifikationen bilden sich bei der Kristallisation von unterkühltem, flüssigem Gallium. Bei −16,3 °C bildet sich β-Gallium, das eine monokline Kristallstruktur besitzt. In der Struktur liegen parallel angeordnete Zickzackketten aus Galliumatomen vor. Tritt die Kristallisation bei einer Temperatur von −19,4 °C ein, bildet sich trigonales δ-Gallium, in dem vergleichbar mit α-Bor verzerrte Ikosaeder aus zwölf Galliumatomen vorliegen. Diese sind über einzelne Galliumatome miteinander verbunden. Bei −35,6 °C entsteht schließlich γ-Gallium. In dieser orthorhombischen Modifikation bilden sich Röhren aus miteinander verbundenen Ga7-Ringen aus, in deren Mitte eine lineare Kette aus weiteren Galliumatomen liegt.[31]
Wird Gallium bei Raumtemperatur unter hohen Druck gesetzt, so bilden sich bei Druckerhöhung nacheinander verschiedene Hochdruckmodifikationen. Ab 30 kbar[31] ist die kubische Gallium-II-Modifikation stabil, bei der jedes Atom von jeweils acht weiteren umgeben ist. Wird der Druck auf 140 kbar erhöht, kristallisiert das Metall nun als tetragonales Gallium-III in einer Struktur, die derjenigen des Indiums entspricht.[32] Wird der Druck weiter auf etwa 1200 kbar erhöht, bildet sich schließlich die kubisch-flächenzentrierte Struktur des Gallium-IV.[32]
| Modifikation | α-Ga[33] | β-Ga[34] | γ-Ga[35] | δ-Ga[36] | Gallium-II[37] | Gallium-III[37] | Gallium-IV[32] |
|---|---|---|---|---|---|---|---|
| Struktur |  | 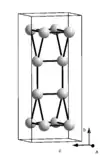 | 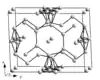 | 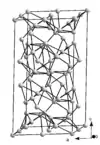 | 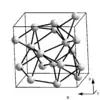 | 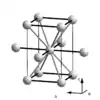 | 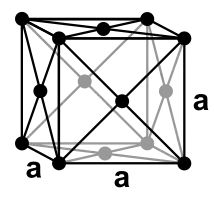 |
| Kristallsystem | orthorhombisch | monoklin | orthorhombisch | trigonal | kubisch | tetragonal | kubisch |
| Koordinationszahl | 1+6 | 8 (2+2+2+2) | 3, 6–9 | 6–10 | 8 | 4+8 | 12 |
| Raumgruppe | Cmce[38] (Nr. 64) | C2/c (Nr. 15) | Cmcm (Nr. 63) | R3m (Nr. 166) | I43d (Nr. 220) | I4/mmm (Nr. 139) | Fm3m (Nr. 225) |
| Gitterparameter | a = 452,0 pm b = 766,3 pm c = 452,6 pm | a = 276,6 pm b = 805,3 pm c = 333,2 pm β = 92° | a = 1060 pm b = 1356 pm c = 519 pm | a = 907,8 pm c = 1702 pm | a = 459,51 pm | a = 280,13 pm c = 445,2 pm | a = 408 pm |
| Atome pro Elementarzelle | 8 | 8 | 40 | 66 | 12 | 2 | 4 |
Chemische Eigenschaften

Die chemischen Eigenschaften von Gallium ähneln denen des Aluminiums. Wie dieses ist Gallium durch die Bildung einer dichten Oxidschicht an der Luft passiviert und reagiert nicht. Erst in reinem Sauerstoff bei hohem Druck verbrennt das Metall mit heller Flamme unter Bildung des Oxides. Ähnlich reagiert es auch nicht mit Wasser, da sich hierbei das unlösliche Galliumhydroxid bildet. Ist dagegen Gallium mit Aluminium legiert und durch die Schmelzpunkterniedrigung bei Raumtemperatur flüssig, so reagiert es sehr heftig mit Wasser. Auch mit Halogenen reagiert Gallium schnell unter Bildung der entsprechenden Salze GaX3.
Gallium ist amphoter und sowohl in Säuren als auch in Basen unter Wasserstoffentwicklung löslich. In Säuren bilden sich analog zu Aluminium Salze mit Ga3+-Ionen, in Basen Gallate der Form [Ga(OH)4]−. In verdünnten Säuren löst es sich dabei langsam, in Königswasser und konzentrierter Natronlauge schnell. Durch Salpetersäure wird Gallium passiviert.
-
- Reaktion von Gallium mit Natronlauge
Die meisten Metalle werden von flüssigem Gallium angegriffen. Es wird meist in Kunststoffbehältern, z. B. aus Polystyrol, aufbewahrt. Als Reaktionsgefäße kommen Behälter aus Glas, Quarz, Graphit, Aluminiumoxid, Wolfram bis 800 °C und Tantal bis 450 °C zum Einsatz.[39]
Isotope
Es sind insgesamt 31 Galliumisotope zwischen 56Ga und 87Ga und weitere elf Kernisomere bekannt. Von diesen sind zwei, 69Ga und 71Ga stabil und kommen auch in der Natur vor. In der natürlichen Isotopenzusammensetzung überwiegt 69Ga mit 60,12 %, 39,88 % sind 71Ga. Von den instabilen Isotopen besitzt 67Ga mit 3,26 Tagen die längste Halbwertszeit, die übrigen Halbwertszeiten reichen von Sekunden bis maximal 14,1 Stunden bei 72Ga.[40]
Zwei Galliumisotope, 67Ga und das mit 67,71 Minuten Halbwertszeit kurzlebige 68Ga werden in der Nuklearmedizin als Tracer für die Positronen-Emissions-Tomographie genutzt. 67Ga wird dabei in einem Cyclotron erzeugt, während bei der Erzeugung von 68Ga kein Cyclotron nötig ist. Stattdessen wird das längerlebige Germaniumisotop 68Ge durch Bestrahlung von 69Ga mit Protonen erzeugt. Dieses zerfällt zu 68Ga, wobei das entstandene 68Ga in einem Gallium-68-Generator extrahiert werden kann. Für Untersuchungen wird das Gallium in der Regel in einem Komplex mit einem stark chelatisierenden Liganden wie 1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure (DOTA) gebunden.[41]
Verwendung

Auf Grund der Seltenheit des Elementes wird Gallium nur in geringem Umfang verwendet. Aus dem größten Teil des produzierten Galliums werden verschiedene Galliumverbindungen hergestellt. Die mit Abstand ökonomisch wichtigsten sind die mit Elementen der 5. Hauptgruppe, vor allem Galliumarsenid, das unter anderem für Solarzellen und Leuchtdioden benötigt wird. Im Jahre 2003 wurden 95 % des produzierten Galliums hierzu verarbeitet. Daneben dient es auch als Material zur Dotierung von Silicium (p-Dotierung).[42]
Der große Temperaturbereich, in dem das Element flüssig ist, und der gleichzeitig niedrige Dampfdruck werden für den Bau von Thermometern (als Bestandteil von Galinstan) ausgenutzt. Galliumthermometer lassen sich bis zu Temperaturen von 1200 °C einsetzen. Flüssiges Gallium kann als Sperrflüssigkeit zur Volumenmessung von Gasen bei höheren Temperaturen sowie als flüssiges Elektrodenmaterial bei der Gewinnung von Reinstmetallen wie Indium verwendet werden.[39]
Gallium besitzt eine hohe Benetzbarkeit und ein gutes Reflexionsvermögen und wird darum als Beschichtung für Spiegel eingesetzt.[39] Zudem wird es in Schmelzlegierungen, für Wärmetauscher in Kernreaktoren und als Ersatz für Quecksilber in Lampen eingesetzt.[18]
Legierungen von Gallium mit anderen Metallen haben verschiedene Einsatzgebiete. Magnetische Werkstoffe entstehen durch Legieren mit Gadolinium, Eisen, Yttrium, Lithium und Magnesium. Die Legierung mit Vanadium in der Zusammensetzung V3Ga ist ein Supraleiter mit der vergleichsweise hohen Sprungtemperatur von 16,8 K. In Kernwaffen wird es mit Plutonium legiert, um Phasenumwandlungen zu verhindern. Viele Galliumlegierungen wie Galinstan sind bei Raumtemperatur flüssig und können das giftige Quecksilber oder die sehr reaktiven Natrium-Kalium-Legierungen ersetzen.[18] Legierungen von Indium oder Gallium mit Gold können eine blaue Farbe aufweisen.[43]
Aufgrund seines niedrigen Schwellenwerts für den Neutrinoeinfang von nur 233,2 keV eignet sich Gallium als Detektormaterial zum Nachweis solarer Neutrinos (vgl. Sonnenneutrinoexperiment GALLEX).
Außerdem spielt Gallium eine Rolle in der medizinischen Diagnostik: Bei der Gallium-68-Dotatate-PET-CT-Ganzkörperuntersuchung wird das Element genutzt, um neuroendokrine Tumoren zu diagnostizieren[44].
Nachweis
Gallium lässt sich mit verschiedenen typischen Farbreaktionen qualitativ nachweisen. Dazu zählen die Reaktion mit Rhodamin B in Benzol, das bei Zusatz von Gallium orangegelb bis rotviolett fluoresziert[45], Morin, das wie bei der Reaktion mit Aluminium eine grüne Fluoreszenz zeigt[46], und Kaliumhexacyanidoferrat(III), mit dem Gallium einen weißen Niederschlag aus Galliumhexacyanidoferrat(III) bildet.[47] Zudem ist ein spektroskopischer Nachweis über die charakteristischen violetten Spektrallinien bei 417,1 und 403,1 nm möglich.[48]
Quantitative Nachweise können über komplexometrische Titrationen, beispielsweise mit Ethylendiamintetraessigsäure oder über die Atomabsorptionsspektrometrie, erfolgen.[48]
Toxikologie und biologische Bedeutung
Für Galliummetall existieren keine toxikologischen Daten; es wirkt jedoch reizend auf Haut, Augen und Atemwege.[10] Die Verbindungen Gallium(III)-nitrat Ga(NO3)3 und Gallium(III)-oxid Ga2O3 besitzen orale LD50-Werte im Grammbereich: 4,360 g/kg für das Nitrat und 10 g/kg für das Oxid.[49] Gallium wird daher als gering toxisch angesehen und spielt, soweit bekannt, als Spurenelement keine Rolle für den Menschen.[50]
Verbindungen
Gallium kommt in Verbindungen fast ausschließlich in der Oxidationsstufe +3 vor. Daneben sind seltene und meist sehr instabile Gallium(I)-Verbindungen bekannt sowie solche, die sowohl ein- als auch dreiwertiges Gallium enthalten (formal Gallium(II)-Verbindungen).
Verbindungen mit Elementen der Stickstoffgruppe
Die technisch wichtigsten Verbindungen des Galliums sind diejenigen mit den Elementen der Stickstoffgruppe. Galliumnitrid, Galliumphosphid, Galliumarsenid und Galliumantimonid sind typische Halbleiter (III-V-Halbleiter) und werden für Transistoren, Dioden und andere Bauteile der Elektronik verwendet. Insbesondere Leuchtdioden verschiedener Farben werden aus Gallium-Stickstoffgruppen-Verbindungen hergestellt. Die von der Bandlücke abhängige Farbe kann dabei durch das unterschiedliche Verhältnis der Anionen oder auch durch das Ersetzen von Gallium durch Aluminium oder Indium eingestellt werden. Galliumarsenid wird darüber hinaus für Solarzellen verwendet. Insbesondere bei Satelliten werden diese eingesetzt, da Galliumarsenid widerstandsfähiger gegen ionisierende Strahlung als Silicium ist.[51]
Halogenide
Galliumhalogenide der Form GaX3 ähneln in vielen Eigenschaften den entsprechenden Aluminiumverbindungen. Mit Ausnahme des Gallium(III)-fluorides kommen sie als Dimer in einer Aluminiumbromidstruktur vor. Als einziges Halogenid hat Gallium(III)-chlorid eine geringe wirtschaftliche Bedeutung. Es wird als Lewis-Säure in Friedel-Crafts-Reaktionen eingesetzt.[52]
Weitere Verbindungen
Gallium(III)-oxid ist wie Aluminiumoxid ein farbloser, hochschmelzender Feststoff. Es kommt in fünf verschiedenen Modifikationen vor, von denen die kubische β-Modifikation am stabilsten ist.
Organische Galliumverbindungen existieren als Gallane GaR3, Gallylene GaR und als höhere Gallane, die Gallium-Gallium-Bindungen enthalten. Sie sind wie viele andere metallorganische Verbindungen instabil gegen Luft und Hydrolyse. Eine der wenigen galliumorganischen Verbindungen mit wirtschaftlicher Bedeutung ist Trimethylgallium, das als Dotierungsreagenz und für die Erzeugung dünner Schichten an Galliumarsenid und Galliumnitrid in der metallorganischen Gasphasenepitaxie eingesetzt wird.[53]
Einen Überblick über Galliumverbindungen gibt die Kategorie:Galliumverbindung.
Literatur
- J. F. Greber: Gallium and Gallium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. 7. Auflage. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a12_163.
- Eintrag zu Gallium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Gallium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu gallium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu gallium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Gallium) entnommen.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-142 – 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Gallium) entnommen.
- Eintrag zu Gallium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. November 2021. (JavaScript erforderlich)
- William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5, S. 206–207.
- Mary Elvira Weeks: Discovery of the Elements. 3. Auflage. Kessinger Publishing, 2003, ISBN 0-7661-3872-0, S. 215–219 (Discovery of the Elements in der Google-Buchsuche).
- Paul Émile Le Coq de Boisbaudran: Sur un nouveau métal, le gallium. In: Annales de chimie et de physique, Ser. 5. Band 10, 1877, S. 100–141 (Digitalisat auf Gallica).
- J. F. Greber: Gallium and Gallium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. 7. Auflage. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a12_163.
- Friedrich-Wilhelm Wellmer, Manfred Dalheimer, Markus Wagner: Economic Evaluations in Exploration. 2. Auflage. Springer 2007, ISBN 978-3-540-73557-1, S. 83–84.
- Gallium (PDF; 85 kB). In: U.S. Geological Survey: Mineral Commodity Summaries. Januar 2009.
- E. Dünges, H. Schmidbaur: Gallium, Indium, Thallium. In: Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 844–846.
- Eintrag zu Gallium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- T. Iida R. L. Guthrie: The Physical Properties of Liquid Metals. Clarendon Press, Oxford, U.K 1988.
- Ulrich Müller: Anorganische Strukturchemie. 6. Auflage. Vieweg+Teubner Verlag, 2008, ISBN 978-3-8348-0626-0, S. 228.
- Stephan Handschuh-Wang, Florian J. Stadler, Xuechang Zhou: Critical Review on the Physical Properties of Gallium-Based Liquid Metals and Selected Pathways for Their Alteration. In: The Journal of Physical Chemistry C. 9. September 2021, ISSN 1932-7447, S. acs.jpcc.1c05859, doi:10.1021/acs.jpcc.1c05859 (acs.org [abgerufen am 18. September 2021]).
- Akihisa Yamaguchi, Yu Mashima, Tomokazu Iyoda: Reversible Size Control of Liquid-Metal Nanoparticles under Ultrasonication. In: Angewandte Chemie International Edition. Band 54, Nr. 43, 19. Oktober 2015, S. 12809–12813, doi:10.1002/anie.201506469 (wiley.com [abgerufen am 18. September 2021]).
- Sebastian Runde, Heiko Ahrens, Frank Lawrenz, Amal Sebastian, Stephan Block: Stable 2D Conductive Ga/Ga(O x H y ) Multilayers with Controlled Nanoscale Thickness Prepared from Gallium Droplets with Oxide Skin. In: Advanced Materials Interfaces. Band 5, Nr. 16, August 2018, S. 1800323, doi:10.1002/admi.201800323 (wiley.com [abgerufen am 18. September 2021]).
- The resistance of liquid metals. In: Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. Band 146, Nr. 857, September 1934, ISSN 0950-1207, S. 465–472, doi:10.1098/rspa.1934.0166 (royalsocietypublishing.org [abgerufen am 18. September 2021]).
- O. Züger, U. Dürig: Atomic structure of the α-Ga(001) surface investigated by scanning tunneling microscopy: Direct evidence for the existence of Ga2 molecules in solid gallium. In: Phys. Rev. B. 46, 1992, S. 7319–7321, doi:10.1103/PhysRevB.46.7319.
- James K. Beattie, Alex M. Djerdjev, Angus Gray-Weale, Nikola Kallay, Johannes Lützenkirchen: pH and the surface tension of water. In: Journal of Colloid and Interface Science. Band 422, Mai 2014, S. 54–57, doi:10.1016/j.jcis.2014.02.003 (elsevier.com [abgerufen am 17. September 2021]).
- B. J. Keene: Review of data for the surface tension of pure metals. In: International Materials Reviews. Band 38, Nr. 4, Januar 1993, S. 157–192, doi:10.1179/imr.1993.38.4.157.
- Stephan Handschuh-Wang, Tiansheng Gan, Tao Wang, Florian J. Stadler, Xuechang Zhou: Surface Tension of the Oxide Skin of Gallium-Based Liquid Metals. In: Langmuir. Band 37, Nr. 30, 3. August 2021, ISSN 0743-7463, S. 9017–9025, doi:10.1021/acs.langmuir.1c00966 (acs.org [abgerufen am 18. September 2021]).
- J. N. Koster: Directional Solidification and Melting of Eutectic GaIn. In: Crystal Research and Technology. Band 34, Nr. 9, 1999, ISSN 1521-4079, S. 1129–1140, doi:10.1002/(SICI)1521-4079(199911)34:9<1129::AID-CRAT1129>3.0.CO;2-P (wiley.com [abgerufen am 18. September 2021]).
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1181.
- Takemura Kenichi, Kobayashi Kazuaki, Arai Masao: High-pressure bct-fcc phase transition in Ga. In: Phys. Rev. B. 58, 1998, S. 2482–2486, doi:10.1103/PhysRevB.58.2482.
- B. D. Sharma, J. Donohue: A refinement of the crystal structure of gallium. In: Zeitschrift für Kristallographie. 117, 1962, S. 293–300.
- L. Bosio, A. Defrain: Structure cristalline du gallium β. In: Acta Cryst. B25, 1969, S. 995, doi:10.1107/S0567740869003360.
- L. Bosio, H. Curien, M. Dupont, A. Rimsky: Structure cristalline de Ga γ. In: Acta Cryst. B28, 1972, S. 1974–1975, doi:10.1107/S0567740872005357.
- L. Bosio, H. Curien, M. Dupont, A. Rimsky: Structure cristalline de Ga δ. In: Acta Cryst. B29, 1973, S. 367–368, doi:10.1107/S0567740873002530.
- Louis Bosio: Crystal structure of Ga(II) and Ga(III). In: J. Chem. Phys. 68, 3, 1978, S. 1221–1223, doi:10.1063/1.435841.
- Die ehemalige Bezeichnung dieser Raumgruppe lautete Ccma.
- Manfred Merkel, Karl-Heinz Thomas: Taschenbuch der Werkstoffe. 7. Auflage. Hanser Verlag, 2008, ISBN 978-3-446-41194-4, S. 322–324.
- G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- Mark A. Green, Michael J. Welch: Gallium radiopharmaceutical chemistry. In: International Journal of Radiation Applications and Instrumentation. Part B. Nuclear Medicine and Biology. 16, 5, 1989, S. 435–448, doi:10.1016/0883-2897(89)90053-6.
- R. R. Moskalyk: Gallium: the backbone of the electronics industry. In: Minerals Engineering. 16, 10, 2003, S. 921–929, doi:10.1016/j.mineng.2003.08.003.
- M. Douma (Kurator): Gold: Colored gold alloys. webexhibits.org, abgerufen am 23. März 2021.
- Somatostatinrezeptoren (Dotatate): UKM - Nuklearmedizin. Abgerufen am 17. Dezember 2019.
- K. Brodersen: Zum empfindlichen Nachweis von Gallium. In: Fresenius' Journal of Analytical Chemistry. 149, 1956, S. 154–155, doi:10.1007/BF00454207.
- Gottfried Beck: Mikrochemischer Nachweis von Gallium mit Morin. In: Mikrochemie. 20, 1936, S. 194–197, doi:10.1007/BF02740180.
- N. S. Poluektoff: Zum Nachweis von Gallium mit Hilfe von Farbreaktionen. In: Mikrochemie. 19, 1936, S. 248–252, doi:10.1007/BF02752838.
- Gallium. In: Lexikon der Chemie. Spektrum Verlag, 2000.
- Bernard Martel, Keith Cassidy: Chemical risk analysis: a practical handbook. Taylor & Francis, 2000, ISBN 1-56032-835-5, S. 376.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1179.
- Eintrag zu Galliumarsenid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- Eintrag zu Gallium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1200–1214.

