Antimon
Antimon [antiˈmoːn] (von lateinisch Antimonium, vermutlich von arabisch „al-ithmîd(un)“ (ithmid / إثمد / iṯmid, Antimonsulfid bzw. Stibnit)) ist ein chemisches Element mit dem Elementsymbol Sb (von lateinisch Stibium ‚(Grau-)Spießglanz‘) und der Ordnungszahl 51. Im Periodensystem steht es in der 5. Periode und der 5. Hauptgruppe, bzw. 15. IUPAC-Gruppe oder Stickstoffgruppe. In der stabilen Modifikation ist es ein silberglänzendes und sprödes Halbmetall.
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Antimon, Sb, 51 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halbmetalle | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 15, 5, p | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig glänzend grau | |||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-146-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.314 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,65 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 121,760(1)[3][4] u | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 145 (133) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 139 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 206[5] pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d10 5s2 5p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 8.608389(12) eV[6] ≈ 830.58 kJ/mol[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 16.626(25) eV[6] ≈ 1604.2 kJ/mol[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 25.3235 eV[6] ≈ 2443.35 kJ/mol[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 43.804(25) eV[6] ≈ 4226.4 kJ/mol[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 55.00(10) eV[6] ≈ 5307 kJ/mol[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | trigonal | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 6,697 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 3,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −6,8 · 10−5)[9] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 903,78 K (630,63 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 1908 K[10] (1635 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 18,19 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 193 kJ/mol[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 19,7 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 2,5 · 106 A·V−1·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 24 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −3, 3, 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,150 V (Sb3+ + 3 e− → Sb) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,05 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,5 mg·m−3 (gemessen als einatembarer Staub)[14] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||
Name, Geschichte
Es wird vermutet, dass der Name auf das spätgriechische anthemon („Blüte“) zurückgeht. Damit sollten die stängelartigen Kristalle von Antimonsulfid (Sb2S3) beschrieben werden, die büschelförmig erschienen und wie eine Blüte aussähen. Im 11. Jahrhundert findet sich der lateinische Begriff für die mineralische Arzneidroge antimonium[15][16] zur innerlichen Therapie von Krankheiten[17] dann bei Constantinus Africanus.
Im 17. Jahrhundert ging der Name Antimon als Bezeichnung auf das Metall über. Die koptische Bezeichnung für das Schminkpuder Antimonsulfid ging über das Griechische in das Lateinische stibium über. Die vom schwedischen Mediziner und Chemiker Jöns Jakob Berzelius („Vater der modernen Chemie“) benutzte Abkürzung Sb wird noch heute als Elementsymbol genutzt.
Eine späte legendäre Volksetymologie, die von Samuel Johnson in seinem Wörterbuch verewigt wurde, besagt, dass der deutsche Mönch Basilius Valentinus die Beobachtung machte, dass Schweine durch die Aufnahme von Antimon schnell fett wurden. Er probierte dies auch an seinen Ordensbrüdern aus, woraufhin diese allerdings starben, sodass der Begriff „antimoine“ (antimönchisch) geprägt wurde, aus dem später „Antimon“ entstanden sei.
Als Typlokalität für gediegenes Antimon gilt die Silbergrube in der schwedischen Gemeinde Sala im Västmanland.[18] Allerdings war metallisches Antimon schon den Chinesen und Babyloniern bekannt. Einige seiner Verbindungen wurden schon in der Bronzezeit als Zuschlag zu Kupfer verwendet, um Bronze herzustellen (Funde von Velem-St. Vid in Ungarn).
Vorkommen

Antimon ist ein selten vorkommendes Element. Da es in der Natur auch gediegen (das heißt in elementarer Form) gefunden werden kann, wird es von der International Mineralogical Association (IMA) unter der System-Nr. 1.CA.05[19] als Mineral anerkannt.
Weltweit konnte gediegenes Antimon bisher (Stand: 2011) an rund 300 Fundorten nachgewiesen werden. So unter anderem in mehreren Regionen von Australien; in den bolivianischen Departements La Paz und Potosí; Minas Gerais in Brasilien; Schwarzwald, Fichtelgebirge, Oberpfälzer Wald, Odenwald und im Harz in Deutschland; Seinäjoki in Finnland; mehreren Regionen von Frankreich; Lombardei, Piemont, Sardinien und Trentino-Südtirol in Italien; einigen Regionen von Kanada; einigen Regionen von Österreich; Ost- und Westsibirien und Ural in Russland; neben Västmanland noch Dalarna, Gästrikland, Närke, Södermanland, Värmland und Västerbotten in Schweden; in einigen Regionen der Slowakei; Böhmen und Mähren in Tschechien sowie in vielen Regionen der USA.[20] Eine der weltweit bedeutendsten Lagerstätten für gediegen Antimon und Antimonerze ist der Murchison greenstone belt in der Murchison Range von Südafrika.[21]
Bisher sind 264 Antimon-Minerale bekannt (Stand: 2010).[22] Industriell genutzt wird überwiegend das Sulfid-Mineral Stibnit Sb2S3 (Grauspießglanz) mit einem Gehalt von maximal 71,7 % Sb. Das Mineral mit dem höchsten Sb-Gehalt in einer chemischen Verbindung ist die natürliche Antimon-Arsen-Legierung Paradocrasit (max. 92 %). Allerdings kommt sie mit nur drei Fundorten,[23] im Gegensatz zum Stibnit (rund 2500 Fundorte),[24] sehr viel seltener vor. Weitere Quellen für Antimon sind die Minerale Valentinit Sb2O3 (Weißspießglanz), Breithauptit NiSb (Antimonnickel, Nickelantimonid), Kermesit Sb2S2O (Rotspießglanz) und Sb2S5 (Goldschwefel).
Gewinnung und Darstellung
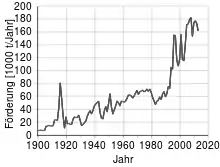
Technisch wird Antimon aus dem Antimonglanz gewonnen. Ein Verfahren beruht auf dem Abrösten und der Reduktion mit Kohlenstoff (Röstreduktionsverfahren):
Eine andere Möglichkeit besteht darin, die Reduktion mit Eisen durchzuführen (Niederschlagsverfahren):
Weltweit wurden zu Beginn des 21. Jahrhunderts zwischen 110.000 und 160.000 Tonnen pro Jahr an Antimon gefördert. Seit 1900 hat sich damit die Fördermenge mehr als verzehnfacht.
87 % der Antimonproduktion findet in China statt (Stand: 2015).[25]
Eigenschaften
| Kristallographische Daten[26] | |
|---|---|
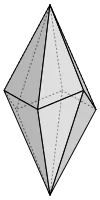 Idealisierte Kristallform eines ditrigonalen Skalenoeders. | |
| Kristallsystem | trigonal – ditrigonal-skalenoedrisch |
| Raumgruppe | R3m (Nr. 166) |
| Gitterparameter (Elementarzelle) | a = 431 pm; c = 1127 pm |
| Zahl (Z) der Formeleinheiten | Z = 6 |
Modifikationen
Antimon kann in drei verschiedenen Modifikationen auftreten, wobei metallisches bzw. graues Antimon die beständigste Modifikation ist.
Unter Normalbedingungen kristallisiert Antimon trigonal in rhomboedrischer Aufstellung in der nach der Hermann-Mauguin-Symbolik beschriebenen Raumgruppe R3m (Nr. 166) mit den Gitterparametern a = 431 pm und c = 1127 pm sowie sechs Formeleinheiten pro Elementarzelle.
Durch Abschrecken von Antimondampf an kalten Flächen entsteht amorphes, schwarzes und sehr reaktives Antimon, welches sich durch Erhitzen wieder in metallisches Antimon umwandelt. Durch elektrolytische Herstellung entsteht explosives Antimon, das beim Ritzen explosionsartig aufglühend und funkensprühend in metallisches Antimon übergeht. Diese Form enthält jedoch immer etwas Chlor und kann nicht als Modifikation betrachtet werden.[27] Gelbes Antimon ist ebenfalls keine eigenständige Modifikation, sondern eine hochpolymere chemische Verbindung mit Wasserstoff.[28]
Physikalische Eigenschaften
Metallisches Antimon ist silberweiß, stark glänzend, blättrig-grobkristallin. Es lässt sich aufgrund seiner Sprödigkeit leicht zerkleinern. Elektrische und thermische Leitfähigkeit sind gering.
Chemische Eigenschaften
Mit naszierendem Wasserstoff reagiert Antimon zum instabilen Antimonhydrid SbH3. Von Luft und Wasser wird Antimon bei Raumtemperatur nicht angegriffen. Oberhalb des Schmelzpunkts verbrennt es in Luft mit bläulich-weißer Flamme zu Antimon(III)-oxid. In heißen konzentrierten Mineralsäuren löst es sich auf. Mit den Halogenen reagiert es schon bei Raumtemperatur heftig zu den entsprechenden Halogeniden.
In Verbindungen liegt Antimon überwiegend in den Oxidationsstufen +3 und +5 vor. In Metallantimoniden wie Kaliumantimonid K3Sb bildet es Sb3−-Ionen.
Isotope
Es existieren zwei stabile Antimon-Isotope: 121Sb und 123Sb.
Verwendung
Legierungen
Der überwiegende Teil des hergestellten Antimons wird zu Legierungen verarbeitet und zeigt dabei folgende Eigenschaften:
- Es dient zur Härtung von Blei- und Zinnlegierungen.
- Im Gegensatz zu den meisten anderen Metallen dehnt es sich beim Abkühlen der Schmelze aus (infolge Umwandlung in eine andere Modifikation): Der Antimongehalt kann so eingestellt werden, dass solche Legierungen beim Abkühlen nicht schrumpfen oder sich sogar etwas ausdehnen; bei in Gießformen hergestellten Teilen presst sich das Metall dadurch beim Erstarren in alle Ecken und Winkel, so dass auch komplizierte Formen und stark gemusterte Oberflächen lunkerfrei hergestellt werden können.
Wichtige Legierungen:
- Blei-Antimon-Legierungen: Hartblei, Letternmetall, Lagermetall, Akkumulatoren-Blei, Bleimantel für Erdkabel
- Zinn-Antimon-Legierungen: Britanniametall, Lagermetall
- Herstellung von Halbleitern, z. B. durch Dotierung von Silicium, zur Herstellung von III-V-Verbindungshalbleitern
- Zinn-Antimon-Kupferlegierungen (Babbitt-Metall) als Lagermetalle
- Zinn-Antimon-Kupfer-Bleilegierungen für Zinngeschirr und andere Gebrauchsartikel aus Zinn
- so genanntes Lötzinn oder Weichlot
- Aluminium-Antimon, Gallium-Antimon, Indium-Antimon für Infrarot- und Hall-Effekt-Geräte
- Schrumpffreie Antimon-Legierungen für Präzisionsguss
Medizin
„Antimon“ (bzw. ein aus Antimonerz gewonnenes Präparat)[29] war bereits im Alten Ägypten (im Papyrus Ebers gegen Augengeschwüre und Augenpusteln), im Alten Rom (zum selben Zweck bei Celsus) und in Rezeptsammlungen des 15. Jahrhunderts (als Bestandteil von Heilpflastern und Salben) bekannt. Es wurde auch von Paracelsus als Bestandteil dermatologischer Präparate abgehandelt, so in de antimonio, dem ersten Traktat seines erstmals 1569 in Straßburg gedruckten Buches liber praeparationum, worin „Antimon“, etwa in Form des Minerallkermes, als wirksam gegen lepra bzw. scabies squamosa, elephantia bzw. inflatio cruris et pedum, alopetia, morphea, vulnera und ulcera beschrieben wird.
Im 16. und 17. Jahrhundert wurde es zu einem (iatrochemischen) „Leitarzneimittel“, war aber – wie auch andere paracelsische Medikamente – umstritten und in Frankreich, wo sich ein hundertjähriger[30] „Antimonstreit“[31] zwischen Befürwortern und Gegnern der medizinischen Verwendung von Antimon und verschiedenen seiner Verbindungen entwickelt hat, zwischen 1615 und 1688 auch verboten.[32][33]
Das von Paracelsus stets mit Antimon bezeichnete Mineral war der natürlich vorkommende Grauspießglanz (Sb2S2), welcher Blei, Kupfer und Arsen enthalten kann. Das heutige metallische Antimon nannte Paracelsus hingegen „Spießglanzkönig, regulus antimonii“.[34]
Brechweinstein wurde lange als brechreizerregendes Mittel verwendet (Antimonpille), heute wird es noch manchmal verwendet, um den Mageninhalt von Vögeln zu untersuchen.[35]
Sowohl Schistosomiasis als auch Trypanosomen[36] wurden beginnend Anfang des 19. Jahrhunderts mit Brechweinstein (Kaliumantimonyltartrat) bekämpft. Brechweinstein wurde hergestellt, indem man für einen Tag Wein in einem Antimonbecher lagerte, und diesen dann austrank. Inzwischen kommen effektivere und verträglichere Medikamente zur Anwendung.[37][38]
Antimonpräparate (dazu gehören die schon länger bekannten Chemotherapeutika wie Fuadin, Neostibosan und Solustibosan[39]) werden meist als weniger toxische pentavalente Formen zur medikamentösen Therapie der Leishmaniose[40] und Schistosomiasis eingesetzt, allerdings in entwickelten Ländern nicht mehr als Mittel der ersten Wahl. Hierbei hemmt Antimon das Enzym Phosphofructokinase, das den geschwindigkeitsbestimmenden Schritt der Glykolyse darstellt.
Weiteres

- Bestandteil von Sprengstoffzündern und bleihaltiger Munition[41]
- Antimontrisulfid
- in Bremsbelägen von Fahrzeugen
- war ca. 1826 im Zündkopf des ersten echten Streichholzes von John Walker enthalten. Seit der Erfindung der Sicherheitsstreichhölzer hat es an Bedeutung verloren und wird heute nur noch selten in Reibflächen verwendet.[42]
- Antimon(V)-sulfid:
- zur Herstellung (Vulkanisieren) von rotem Kautschuk (Beispiel: Labor-Gummischläuche)
- früher als Augenschminken und in der Augenheilkunde („Augenerweiterer“)
- Antimonchromat als gelbes Farbpigment
- Antimonoxide:
- Katalysator zur Herstellung von Polyester und PET (Antimon(III)-oxid)
- als Weißpigment zur Färbung von Polystyrol, Polyethylen und Polypropylen
- Herstellung weißer Glasuren und Fritten
- Läuterung von Bleiglas
- mit Zinn dotiert als transparent-leitfähige Beschichtung („ATO“ Antimon-Tin-Oxide), beispielsweise auf Gläsern, zur Herstellung von Displays oder in elektrisch leitfähigen Pigmenten („Minatec“), für Fußbodenbeläge zur Ableitung elektrostatischer Aufladungen.
- in Pigmenten („Lazerflair“) für die Laser-Markierung von Kunststoffteilen, wegen der starken Absorption von Infrarot-Strahlung üblicher Markierungslaser (Nd:YAG).
- in Tarnanstrichen wegen der starken Infrarot-Absorption.
- als Flammschutzmittel und als Bestandteil von flammfesten und flammhemmenden Farben, Kunststoffen und Textilien für Kabelumhüllungen, Autositzbezüge, Vorhangstoffe, Kinderbekleidung u. Ä.
- Antimonsalze als Bestandteil von Pestiziden, Beizen und Feuerwerksartikeln
- Scheidemittel für Gold: Zur Ausfällung von Silber aus Goldschmelze
Toxizität
Antimon kann bereits bei Ingestion von 200 bis 1200 mg tödlich sein. In der Toxikologie sind drei Antimon-Formen bekannt, von denen das gasförmige Antimonhydrid (Stiban, SbH3) die gefährlichste Form ist, die eine massive Hämolyse, welche ein Nierenversagen bewirken kann, induziert. Nach der Toxizität folgt Brechweinstein mit dreiwertigem („trivalentem“) Antimon, während fünfwertiges Antimon am wenigsten toxisch ist.
Das trivalente Antimon wird innerhalb der ersten zwei Stunden nach der Einnahme zu 95 % in rote Blutkörperchen aufgenommen und damit vorwiegend in stark durchbluteten Organen angereichert. Die Exkretion erfolgt vorwiegend durch Bindung an Glutathion über die Galle mit entsprechend hohem enterohepatischen Kreislauf, und nur ein geringer Teil wird über die Nieren ausgeschieden. Kaliumantimonyltartrat wird zu 90 % innerhalb des ersten Tages nach Aufnahme ausgeschieden, die übrigen 10 % aufgrund einer langsameren Eliminationskinetik über 16 Tage.
Es wird vermutet, dass Antimon ähnlich wie Arsen die Funktion des Pyruvatdehydrogenase-Komplexes hemmt und somit zu einem Mangel des intrazellulären Energieträgers Adenosintriphosphat (ATP) führt. Dabei kommt es zur Bildung von Chelatkomplexen zwischen dem Antimon und Thiol-Gruppen der entsprechenden Enzyme. Im Körper wirkt es in zahlreichen Organen toxisch, so im Verdauungstrakt, in der Leber, in den Nieren, im Herz und im Zentralnervensystem. Die höchste Konzentration erreicht Antimon in der Leber, wo es zu einer Hepatitis bis hin zum Leberversagen kommen kann. Am Herzen kommt es zu EKG-Veränderungen mit Inversion und Verminderung der T-Welle und verlängertem QT-Intervall.
Therapeutisch erfolgt bei einer Antimon-Vergiftung neben unterstützenden Maßnahmen wie Infusionstherapie (sowohl zum Ausgleich des Flüssigkeitsverlustes durch das Erbrechen als auch zum Schutz der Nieren), und engmaschiger Überwachung der Vitalfunktionen und des EKGs die Gabe von Aktivkohle, N-Acetylcystein als Vorläufer des Glutathions zur vermehrten Sekretion und eines Chelatbildners, z. B. Dimercaprol.[43]
Ergebnisse aus Untersuchungen deuten darauf hin, dass Antimonverbindungen Haut und Schleimhäute reizen. Diese Verbindungen lösen sich vermutlich aus Kunststoff und Textilien.
Sicherheitshinweise und Grenzwerte
Von den Antimonverbindungen sind seitens der EU Antimonfluorid als giftig (T) und die Chloride als ätzend (C) eingestuft, außerdem als umweltgefährlich (N); alle anderen Antimonverbindungen als gesundheitsschädlich (Xn) und umweltgefährlich (N).[44] Antimon selbst ist dort nicht aufgeführt, laut Sicherheitsdatenblatt ist es als reizend gekennzeichnet.
Die Internationale Agentur für Krebsforschung (IARC) stuft Antimon(III)-oxid als möglicherweise krebserzeugende Substanz ein.[45]
In der EU gilt für Trinkwasser ein Grenzwert von 5 µg/l. Untersuchungen von in PET-Flaschen abgefüllten Fruchtsäften (für die keine Richtlinien existieren) ergaben Antimonkonzentrationen bis zu 44,7 µg/l in unverdünnten Saftkonzentraten.[46][47]
Antimon wurde 2016 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Antimon waren die Besorgnisse bezüglich Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der möglichen Gefahr durch krebsauslösende Eigenschaften. Die Neubewertung läuft seit 2018 und wird von Deutschland durchgeführt.[48]
Nachweis

Vorproben:
Flammenfärbung: Flamme fahlblau, wenig charakteristische Phosphorsalzperle: Farblos (gestört durch alle Elemente, die eine farbige Perle erzeugen)
Reduktion durch unedle Metalle, zum Beispiel Eisen, Zink oder Zinn.
In nicht zu sauren Lösungen reduzieren unedle Metalle Antimon-Kationen Sb(III), Sb(V) und Sb(III)/(V) zu metallischem Antimon:
- 2 Sb3+ + 3 Fe → 2 Sb + 3 Fe2+
Die auf Antimon zu prüfende Substanz wird in salzsaure Lösung gegeben und mit Eisenpulver versetzt. Es entsteht ein schwarzer, flockiger Niederschlag aus metallischem Antimon in der Lösung oder direkt am Eisen. Auch der Nachweis an einem Eisennagel ist möglich. Dabei ist eine schwarze Ablagerung am Nagel ein Nachweis für Antimon, welches sich hier elementar niedergeschlagen hat.
Die Marshsche Probe gestattet einen eindeutigen Nachweis von Antimon. Wenn die pyrolytisch abgeschiedene Substanz (dunkel glänzender Spiegel) sich nicht in ammoniakalischem Wasserstoffperoxid löst, sind Arsen und Germanium als mögliche Alternativen ausgeschlossen.
Die hochempfindliche Bestimmung winziger Antimonspuren erfolgt durch die Hydridtechnik der Atomspektrometrie. Hierbei wird im Prinzip die Marshsche Probe mit der Atomabsorptionsspektrometrie gekoppelt. Die Matrixeffekte der Probelösung lassen sich dadurch sehr wirksam unterdrücken.
Eine weitere Methode besteht darin, eine wässrige Lösung, in der Antimonionen enthalten sind, mit Rhodamin-B-Lösung zu versetzen. Es bildet sich ein farbiger Komplex, der mit Isopropylether extrahierbar ist. Dieser Nachweis ist allerdings recht unspezifisch, da auch Gold-, Cadmium-, Gallium, Thallium-, Uran- und Wolfram-ionen farbige Komplexe bilden.[49]
Verbindungen
- Antimonwasserstoff, auch Monostiban SbH3 genannt.
Giftiges Gas, das sich aus Antimon und einwirkenden Säuren bildet. - Distiban (Sb2H4)
Halogenverbindungen
- Antimon(V)-fluorid (SbF5) bildet (nach VSEPR) eine quadratische Pyramide aus und hybridisiert dabei zu sp3d
- Antimon(V)-chlorid (SbCl5)
- Antimon(III)-fluorid (SbF3)
- Antimon(III)-chlorid (SbCl3)
- Antimon(III)-bromid (SbBr3)
- Antimon(III)-iodid (SbI3)
Sauerstoffverbindungen
- Antimon(III)-oxid (Antimontrioxid, Sb2O3), das in der Natur vorkommt und das beim Verbrennen von Antimon an der Luft entsteht[50]
- Antimon(III,V)-oxid (Antimontetroxid, Sb2O4), wird ebenfalls in der Natur aufgefunden und entsteht beim Erhitzen von Sb2O3
- Antimon(V)-oxid (Antimonpentaoxid, Sb2O5)
- Es existieren Salze, die sich von der hypothetischen wasserreichen Form der antimonigen Säure HSb(OH)4 ableiten. Die antimonige Säure selbst, das Antimontrihydroxid (H3SbO3/Sb(OH)3), ist nicht isolierbar. Es wirkt aufgrund der Reaktion als schwache Säure (pKS = 11)[51]. Es ist amphoter und kann auch als sehr schwache Base wirken ()[51]
- Antimonsäure (HSb(OH)6)
Schwefelverbindungen
- Antimontrisulfid, auch Antimonglanz genannt (Sb2S3)
Grauschwarze, metallisch glänzende Stängel. Ausgangsstoff zur Herstellung metallischen Antimons. Löslich in starken Säuren. Verwendung für Streichhölzer, Rubingläser und Tarnanstriche (Reflexion von IR-Licht). - Antimonpentasulfid, früher als Goldschwefel bezeichnet (Sb2S5)
Sonstige Verbindungen
- Antimon(V)-chloridfluorid (SbCl4F) (Katalysator für die Herstellung von Polytetrafluorethylen [„Teflon“])
- Aluminiumantimonid (AlSb)
- Galliumantimonid (GaSb)
- Indiumantimonid (InSb)
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 829–860.
- Willem Frans Daems: Stimmi – Stibium – Antimon. Eine substanzhistorische Betrachtung. (= Weleda-Schriftenreihe. 9). Arlesheim/ Schwäbisch Gmünd 1976.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Antimon) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- IUPAC, Standard Atomic Weights Revised 2013.
- Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar: Consistent van der Waals Radii for the Whole Main Group. In: J. Phys. Chem. A. 113, 2009, S. 5806–5812, doi:10.1021/jp8111556.
- Eintrag zu antimony in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu antimony bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Antimon) entnommen.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-142 – 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Antimon) entnommen.
- Eintrag zu Antimony im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Antimon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Oktober 2020. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7440-36-0 bzw. Antimon), abgerufen am 2. November 2015.
- Willem F. Daems: Zu Helmut Gebelein: Alchemie. München: Eugen Diederichs 1991. In: Würzburger medizinhistorische Mitteilungen. Band 11, 1993, S. 405–407, hier: S. 406.
- Vgl. auch Wouter S. van den Berg (Hrsg.): Eene Middelnederlandsche vertaling van het Antidotarium Nicolaï (Ms. 15624–15641, Kon. Bibl. te Brussel) met den latijnschen tekst der eerste gedrukte uitgave van het Antidotarium Nicolaï. Hrsg. von Sophie J. van den Berg, N. V. Boekhandel en Drukkerij E. J. Brill, Leiden 1917, S. 200 f.
- Doris Schwarzmann-Schafhauser: Antimonstreit. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 72.
- Mindat – Sala Silver Mine, Sala, Västmanland, Sweden.
- IMA/CNMNC List of Mineral names – Antimony (englisch, PDF 1,8 MB, S. 14).
- Mindat – Localities for Antimony (englisch).
- Mineral profile of Limpopo region. auf www.geoscience.org.za (englisch).
- Webmineral – Mineral Species sorted by the element Sb (Antimony).
- Mindat – Paradocrasite.
- Mindat – Stibnite.
- ddc.arte.tv
- Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. 9. Auflage. E. Schweizerbart'sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 50.
- William M. Haynes: CRC Handbook of Chemistry and Physics. 96. Auflage. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 4–4 (google.de [abgerufen am 22. März 2016]).
- Lautenschläger u. a.: Taschenbuch der Chemie. 15.5 Antimon und Antimonverbindungen. (Memento vom 4. März 2016 im Internet Archive) Verlag Harri Deutsch, Frankfurt am Main 2001.
- Ulrich Arndt: Der „Magnet der Weisen“ – Alchemistische Transmutation des Antimon. In: Paracelsus. November 2005, S. 12–17. (Online-Version).
- Bouissiou: Une guerre de cent ans, la querelle de l’antimoine. In: Médecine de France. Nr. 24, 1951.
- Friedrich Dobler: Die chemische Fundierung der Heilkunde durch Theophrastus Paracelsus: Experimentelle Überprüfung seiner Antimonpräparate. In: Veröffentlichungen der Internationalen Gesellschaft für Geschichte der Pharmazie, Neue Folge, 10, 1957, S. 76–86.
- Wolf-Dieter Müller-Jahncke, Christoph Friedrich: Geschichte der Arzneimitteltherapie. Deutscher Apothekerverlag, Stuttgart 1996, ISBN 3-7692-2038-2, S. 65–66.
- Doris Schwarzmann-Schafhauser: Antimonstreit. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 72.
- Friedrich Dobler: Die chemische Fundierung der Heilkunde durch Theophrastus Paracelsus: Experimentelle Überprüfung seiner Antimonpräparate. 1957, S. 80 (Antimonium optime tritum).
- Antony W. Diamond, V. C. Fayad, Peter S. McKinley: Commentary: Ipecac: An Improved Emetic for Wild Birds. In: Journal of Field Ornithology. Band 78, Nr. 4, 2007, S. 436–439, doi:10.1111/j.1557-9263.2007.00136.x.
- George C. Low: The history of the use of intravenous injections of tartar emetic (Antimonium tartaratum) in tropical medicine. In: Transactions of the Royal Society of Tropical Medicine and Hygiene. Band 10, Nr. 2, 1916, S. 37, doi:10.1016/S0035-9203(16)90068-3.
- Paul Hagan: Schistosomiasis – a rich vein of research. In: Parasitology. Band 136, Nr. 12, 2009, S. 1611–1619, doi:10.1017/S003118200999093X, PMID 19691867.
- Vishnu Ji Ram, Mahendra Nath: Progress in Chemotherapy of Leishmaniasis. In: Current Medicinal Chemistry. Publishers, Bentham Science, Oktober 1996, Kapitel The Antimonials, S. 304–305 (Google Books).
- Friedrich Dobler: Die chemische Fundierung der Heilkunde durch Theophrastus Paracelsus: Experimentelle Überprüfung seiner Antimonpräparate. 1957, S. 79.
- Rüdiger Dörris: Medizinische Mikrobiologie. Georg Thieme Verlag, ISBN 3-13-125313-4, S. 527.
- Katja Bauer: Giftstoffe auf Schießständen von Elitepolizisten? In: badische-zeitung.de, 4. Juni 2016.
- Alexander P. Hardt: Pyrotechnics, Pyrotechnica Publications, Post Falls Idaho USA 2001, ISBN 0-929388-06-2, S. 74 ff.
- Wendy Macías Konstantopoulos, Michele Burns Ewald, Daniel S. Pratt: Case 22-2012: A 34-Year-Old Man with Intractable Vomiting after Ingestion of an Unknown Substance. In: New England Journal of Medicine. 367, 2012, S. 259–268.
- Eintrag zu Antimonverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. September 2012. (JavaScript erforderlich)
- Bundesamt für Gesundheit Schweiz (BAG): Risikoanalyse: Antimon in Lebensmitteln und Fertiggerichten, die direkt in PET-Schalen zubereitet werden. (PDF) 23. August 2007.
- Claus Hansen, Alexandra Tsirigotaki, Søren Alex Bak, Spiros A. Pergantis, Stefan Stürup, Bente Gammelgaard, Helle Rüsz Hansen: Elevated antimony concentrations in commercial juices. In: Journal of Environmental Monitoring. Band 12, Nr. 4, 2010, S. 822–824, doi:10.1039/B926551A.
- Sophie Borland: Fruit juice cancer warning as scientists find harmful chemical in 16 drinks. Daily Mail, 1. März 2010, abgerufen am 1. März 2010.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Antimony, abgerufen am 20. Mai 2019.
- Eintrag zu Rhodamine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. August 2016.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 970 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 971 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
