Rhenium
Rhenium ist ein chemisches Element mit dem Elementsymbol Re und der Ordnungszahl 75. Im Periodensystem der Elemente steht es in der 7. Nebengruppe (Gruppe 7) oder Mangangruppe. Es ist ein sehr seltenes, silberweiß glänzendes, schweres Übergangsmetall. Legierungen mit Rheniumanteilen finden Verwendung in Flugzeugtriebwerken, als Katalysator beim Herstellen von bleifreiem Benzin und in Thermoelementen.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Rhenium, Re, 75 | ||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 7, 6, d | ||||||||||||||||||||||||||||||||||||||||||
| Aussehen | gräulich weiß | ||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-124-5 | ||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.294 | ||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,001 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 186,207(1)[3] u | ||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 135 (188) pm | ||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 159 pm | ||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f14 5d5 6s2 | ||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 7.83352(11) eV[4] ≈ 755.82 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 16.6(5) eV[4] ≈ 1600 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 27.0(1,6) eV[4] ≈ 2610 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 39.1(1,7) eV[4] ≈ 3770 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 51.9(1,9) eV[4] ≈ 5010 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||||||||||||||||||||
| Dichte | 21,0 g/cm3 (25 °C)[7] | ||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 7–8[1] | ||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 9,6 · 10−5)[8] | ||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 3459 K (3186 °C) | ||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 5903 K[9] (5630 °C) | ||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 8,86 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 707 kJ·mol−1[9] | ||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 33 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 4700 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 137 J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 5,56 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 48 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||
| Chemisch [10] | |||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −3, −2, −1, 0, 1, 2, 3, 4, 5, 6, 7[11] | ||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,276 V (ReO2 + 4 H+ + 4e− → Re + 2 H2O) | ||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,9 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||
Biologische Funktionen des Rheniums sind nicht bekannt, es kommt normalerweise nicht im menschlichen Organismus vor. Ebenso sind keine toxischen Effekte des Metalls bekannt, es gilt als arbeitshygienisch unbedenklich.[13]
Geschichte
Die Existenz des späteren Rheniums wurde erstmals 1871[14] von Dmitri Iwanowitsch Mendelejew als Dwi-Mangan vorhergesagt. Er schloss aus den Gesetzmäßigkeiten des von ihm entworfenen Periodensystems, dass unterhalb des Mangans zwei noch unbekannte Elemente, später als Technetium und Rhenium benannt, stehen müssten.
Entdeckt wurde Rhenium 1925 von Walter Noddack, Ida Tacke und Otto Berg. Sie untersuchten Columbit, um die gesuchten Elemente Eka- und Dwi-Mangan zu finden. Da die gesuchten Elemente in den Proben nur in sehr geringem Maße enthalten waren, mussten sie durch Abtrennen der anderen Bestandteile angereichert werden. Schließlich konnte das spätere Rhenium durch Röntgenspektroskopie nachgewiesen werden.[15] Noddack und Tacke behaupteten auch, sehr geringe Mengen des Eka-Mangans (später Technetium) gefunden zu haben, jedoch konnte dies nicht durch Darstellung des Elements bestätigt werden. Sie nannten die Elemente nach ihren Heimatgegenden Rhenium (lat. Rhenus für Rhein) und Masurium (von Masuren). Letzterer setzte sich jedoch nach der Entdeckung des Technetiums 1937 nicht durch.
1928 konnten Noddack und Tacke erstmals ein Gramm Rhenium aus 660 Kilogramm Molybdänerz extrahieren.[16] Wegen der hohen Kosten begann die Herstellung nennenswerter Mengen erst ab 1950, als ein größerer Bedarf für neuentwickelte Wolfram-Rhenium- und Molybdän-Rhenium-Legierungen bestand.
Vorkommen
Rhenium ist mit einem Anteil von 0,7 ppb[17] in der kontinentalen Erdkruste seltener als Rhodium, Ruthenium und Iridium. Es kommt nicht gediegen, sondern ausschließlich gebunden in einigen Erzen vor. Da Rhenium ähnliche Eigenschaften wie Molybdän besitzt, wird es vor allem in Molybdänerzen wie Molybdänglanz MoS2 gefunden. In diesen kann bis zu 0,2 %[18] Rhenium enthalten sein. Weitere rheniumhaltige Minerale sind Columbit (Fe,Mn)[NbO3], Gadolinit Y2FeBe[O|SiO4]2 und Alvit ZrSiO4. Auch im Mansfelder Kupferschiefer ist in geringen Mengen Rhenium enthalten. Die größten Vorkommen an rheniumhaltigen Erzen liegen in den Vereinigten Staaten, Kanada und Chile.
Bisher wurde ein Rheniummineral, der Rheniit (Rhenium(IV)-sulfid, ReS2), entdeckt. Der Fundort lag in einer Fumarole am Gipfelkrater des Vulkans Kudrjawy auf der Insel Iturup, die zu den Kurilen (Russland) gehört.[19]
Gewinnung und Darstellung

Der Grundstoff für die Gewinnung von Rhenium sind Molybdänerze, insbesondere Molybdänit. Werden diese im Zuge der Molybdängewinnung geröstet, reichert sich Rhenium als flüchtiges Rhenium(VII)-oxid in der Flugasche an. Dieses kann mit ammoniakhaltigem Wasser zu Ammoniumperrhenat (NH4ReO4) umgesetzt werden.
Das Ammoniumperrhenat wird anschließend bei hohen Temperaturen mit Wasserstoff zu elementarem Rhenium reduziert.
Die Hauptproduzenten waren 2006 Chile, Kasachstan und die Vereinigten Staaten, die Gesamtmenge an produziertem Rhenium belief sich auf etwa 45 Tonnen.[20] 2013 betrug die Gesamtmenge des produzierten Rheniums 48,9 Tonnen; Hauptproduzenten waren Chile (25 t), Polen (7,5 t), die Vereinigten Staaten (7,1 t) sowie Usbekistan (5,5 t). Der USGS gibt als Preis für Rhenium 4.720 USD je kg im Jahre 2010 und 3.160 USD je kg für 2013 an.[21]
Eigenschaften
Physikalische Eigenschaften
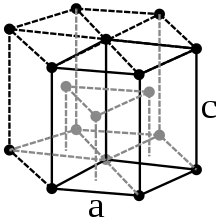
Rhenium ist ein weißglänzendes hartes Schwermetall, das äußerlich Palladium und Platin ähnelt. Es kristallisiert in einer hexagonal-dichtesten Kugelpackung in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 276,1 pm und c = 445,8 pm sowie zwei Formeleinheiten pro Elementarzelle.[22] Die mit 21,03 g/cm3[13] sehr hohe Dichte des Rheniums wird noch von den drei Platinmetallen Osmium, Iridium und Platin übertroffen.
Rhenium hat mit 3186 °C[23] einen der höchsten Schmelzpunkte aller Elemente. Es wird nur noch von dem höchstschmelzenden Metall Wolfram (3422 °C[23]) und Kohlenstoff übertroffen. Auch der Siedepunkt des Rheniums ist mit 5630 °C der zweithöchste aller Elemente nach dem des Wolframs von 5930 °C.[9] Unterhalb von 1,7 K[23] wird Rhenium zum Supraleiter.
Rhenium lässt sich gut durch Schmieden und Verschweißen verarbeiten, da es duktil ist und dies im Gegensatz zu Wolfram oder Molybdän auch nach Rekristallisation bleibt. Beim Schweißen von Rhenium tritt keine Versprödung auf, die zu einer höheren Sprödigkeit und damit schlechteren Materialeigenschaften führen würde.[24]
Chemische Eigenschaften
Obwohl Rhenium mit einem negativen Standardpotential nicht zu den Edelmetallen zählt, ist es bei Raumtemperatur unreaktiv und gegenüber Luft stabil. Erst beim Erhitzen reagiert es ab 400 °C[13] mit Sauerstoff zu Rhenium(VII)-oxid. Auch mit den Nichtmetallen Fluor, Chlor und Schwefel reagiert es beim Erhitzen.
In nichtoxidierenden Säuren, wie Salzsäure oder Flusssäure, ist Rhenium nicht löslich. Dagegen lösen die oxidierenden Schwefel- und Salpetersäure Rhenium leicht auf. Mit Oxidationsschmelzen bilden sich leicht farblose Perrhenate(VII) der Form ReO4− oder grüne Rhenate(VI) des Typs ReO42−.
Rhenium ist als Pulver ein entzündbarer Feststoff. Er kann durch kurzzeitige Einwirkung einer Zündquelle leicht entzündet werden und brennt nach deren Entfernung weiter. Die Entzündungsgefahr ist umso größer, je feiner der Stoff verteilt ist. Das feuchte Pulver wird schon bei Raumtemperatur allmählich unter Bildung von Perrheniumsäure oxidiert.[12]
Isotope
Es sind insgesamt 34 Isotope und weiter 20 Kernisomere des Rheniums bekannt.[26] Von diesen kommen zwei, die Isotope 185Re und 187Re, natürlich vor. 185Re, das mit einem Anteil von 37,40 % an der natürlichen Isotopenverteilung vorkommt, ist das einzige stabile Isotop. Das mit einem Anteil von 62,60 % häufigere 187Re ist schwach radioaktiv. Es zerfällt unter Betazerfall mit einer Halbwertszeit von 4,12 · 1010 Jahren zu 187Os, was zu einer spezifischen Aktivität von 1020 Becquerel/Gramm führt. Rhenium ist damit neben Indium eines der wenigen Elemente, die zwar ein stabiles Isotop haben, in der Natur jedoch am häufigsten in ihrer radioaktiven Form vorkommen. Beide Isotope sind mit Hilfe der Kernspinresonanzspektroskopie nachweisbar. Von den künstlichen Isotopen werden 186Re und 188Re als Tracer verwendet. Als hauptsächlicher Beta-Strahler wird 186Re in der Nuklearmedizin zur Therapie bei der Radiosynoviorthese eingesetzt.[27] 188Re dient als radioaktives Arzneimittel in der Tumortherapie.[28] Die epidermale Radioisotopentherapie nutzt die Eigenschaften des 188Re als Beta-Strahler zur Brachytherapie für die Behandlung des Basalioms und von Plattenepithelkarzinomen der Haut.[29]
Der Zerfall von 187Re zu 187Os wird als Rhenium-Osmium-Methode in der Geologie zur isotopischen Altersbestimmung von Gesteinen oder Mineralen benutzt. Dabei wird zur Korrektur des schon vorher vorhandenen Osmiums die Isochronenmethode verwendet.[30]
Verwendung
Rhenium wird meist nicht elementar verwendet, sondern als Beimischung in einer Vielzahl von Legierungen eingesetzt. Etwa 70 %[31] des Rheniums werden als Zusatz in Nickel-Superlegierungen genutzt. Ein Zusatz von 4 bis 6 % Rhenium bewirkt eine Verbesserung des Kriech- und Ermüdungsverhaltens bei hohen Temperaturen. Diese Legierungen werden als Turbinenschaufeln für Flugzeugtriebwerke eingesetzt.[32]
Weitere 20 % der produzierten Rheniummenge werden für Platin-Rhenium-Katalysatoren verwendet. Diese spielen eine große Rolle bei der Erhöhung der Oktanzahl von bleifreiem Benzin durch Reformieren („Rheniforming“). Der Vorteil des Rheniums liegt darin, dass es im Vergleich mit reinem Platin nicht so schnell durch Kohlenstoffablagerungen auf der Oberfläche des Katalysators („Coking“) deaktiviert wird. Dadurch ist es möglich, die Produktion bei niedrigeren Temperaturen und Drücken durchzuführen und so wirtschaftlicher zu produzieren. Auch andere Kohlenwasserstoffe, wie Benzol, Toluol und Xylol, lassen sich mit Platin-Rhenium-Katalysatoren herstellen.[31]
Thermoelemente für die Temperaturmessung bei hohen Temperaturen (bis 2200 °C[33]) werden aus Platin-Rhenium-Legierungen gefertigt. Auch als Legierung mit anderen Metallen, wie Eisen, Cobalt, Wolfram, Molybdän oder Edelmetallen, verbessert Rhenium die Beständigkeit gegenüber Hitze und chemischen Einflüssen. Die Anwendung ist jedoch durch die Seltenheit und den hohen Preis des Rheniums beschränkt.
In einigen Spezialanwendungen wird ebenfalls Rhenium verwendet, beispielsweise für Glühkathoden in Massenspektrometern oder Kontakte in elektrischen Schaltern.
Nachweis
Es gibt mehrere Möglichkeiten, Rhenium nachzuweisen. Eine Möglichkeit sind spektroskopische Methoden. Rhenium besitzt eine fahlgrüne Flammenfärbung mit charakteristischen Spektrallinien bei 346 und 488,9 nm.[34] Gravimetrisch ist Rhenium über die charakteristisch kristallisierende Perrheniumsäure oder verschiedene Perrhenat-Salze, etwa Tetraphenylarsonium-perrhenat, nachweisbar.[35] Auch moderne analytische Methoden wie Massenspektrometrie oder Kernresonanzspektroskopie sind für den Nachweis des Elements geeignet.
Sicherheitshinweise
Wie viele Metalle ist Rhenium in Pulverform leichtentzündlich und brennbar. Zum Löschen darf wegen des entstehenden Wasserstoffes kein Wasser verwendet werden. Stattdessen sind als Löschmittel Löschpulver oder Metallbrandlöscher zu verwenden.[12] Kompaktes Rhenium ist dagegen nicht brennbar und ungefährlich. Rhenium hat keine bekannte biologische Bedeutung für den menschlichen Organismus. Obwohl über die Toxizität von Rhenium nichts Genaueres bekannt ist und keine Toxizitätswerte existieren, gilt Rhenium arbeitshygienisch als unbedenklich.[13]
Verbindungen
Rhenium bildet eine große Zahl an Verbindungen; wie bei Mangan und Technetium sind Verbindungen in den Oxidationsstufen von −III bis +VII bekannt. Im Gegensatz zu Mangan sind jedoch Verbindungen in den hohen Oxidationsstufen beständiger als in den niedrigeren.
Oxide
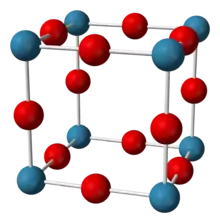
in der Raumgruppe Pm3m (Raumgruppen-Nr. 221), a = 374,8 pm[36]
Es sind insgesamt fünf Oxide des Rheniums bekannt, das gelbe Re2O7, rotes ReO3, Re2O5, braunschwarzes ReO2 und Re2O3. Rhenium(VII)-oxid Re2O7 ist das stabilste Rheniumoxid. Es ist ein Zwischenprodukt bei der Rheniumgewinnung und kann als Ausgangsverbindung für die Synthese anderer Rheniumverbindungen wie Methyltrioxorhenium genutzt werden.[37] In Wasser löst es sich unter Bildung der stabilen Perrheniumsäure HReO4. Rhenium(VI)-oxid ReO3 hat eine charakteristische Kristallstruktur, die als Kristallstrukturtyp (Rheniumtrioxid-Typ) dient.
Halogenide
Es sind insgesamt 13 Verbindungen des Rheniums mit den Halogenen Fluor, Chlor, Brom und Iod bekannt. Dabei reagiert Rhenium bevorzugt zu Hexahalogeniden des Typs ReX6. So entstehen blassgelbes Rhenium(VI)-fluorid ReF6 und grünes Rhenium(VI)-chlorid ReCl6 direkt aus den Elementen bei 125 °C bzw. 600 °C. Reaktion von Rhenium mit Fluor unter leichtem Druck bei 400 °C führt zu hellgelbem Rhenium(VII)-fluorid, neben Osmium(VII)-fluorid und Iod(VII)-fluorid das einzige bekannte Halogenid in der Oxidationsstufe +VII. Rotbraunes Rhenium(V)-chlorid (ReCl5)2 besitzt eine dimere, oktaedrische Struktur. Chlorierung von ReO2 mit Thionylchlorid liefert ein schwarzes, polymeres Chlorid Re2Cl9, das aus Ketten von dimeren Re-Cl-Clustern besteht, die über Chloratome verbrückt sind. Werden höhere Rheniumchloride thermisch bei über 550 °C zersetzt, bildet sich dunkelrotes, trimeres Rhenium(III)-chlorid Re3Cl9. Strukturell bestehen dessen Moleküle aus Dreiecksmetallclustern, wobei die Re-Re-Abstände von 248 pm Doppelbindungscharakter der Metall-Metall-Bindungen beweisen.[38] Die Halogenide sind wasserempfindlich und reagieren mit Wasser zu Halogenoxiden oder Oxiden.
Weitere Rheniumverbindungen
Das schwarze Rhenium(VII)-sulfid Re2S7 entsteht aus Perrhenatlösungen durch Einleiten von Schwefelwasserstoff. Thermische Zersetzung ergibt ebenfalls schwarzes Rhenium(IV)-sulfid ReS2, das auch direkt aus den Elementen zugänglich ist.[38]
Rhenium bildet eine Vielzahl von Komplexen. Es sind sowohl klassische Komplexe mit einzelnen Metallzentren, als auch Metallcluster bekannt. Bei diesen liegen Rhenium-Rhenium-Mehrfachbindungen teilweise auch in Form von Dreifach- oder Vierfachbindungen vor. Eine Vierfachbindung existiert etwa im Re2X82−-Komplexion (X ist dabei ein Halogenatom oder eine Methylgruppe).
Auch metallorganische Verbindungen des Rheniums sind bekannt. Eine wichtige organische Rheniumverbindung ist Methylrheniumtrioxid (MTO), die als Katalysator für Metathesereaktionen, zur Epoxidierung von Olefinen sowie zur Olefinierung von Aldehyden eingesetzt werden kann. MTO und andere Rheniumkatalysatoren für die Metathese sind besonders beständig gegenüber Katalysatorgiften.[39]
Die synthetische Verbindung von Rhenium und Bor (ReB2, Rheniumdiborid) ist entlang einer Kristallachse härter als Diamant.
→ Kategorie:Rheniumverbindung
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1620–1634.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage. Weinheim 1988, ISBN 3-527-26169-9.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Eric Scerri: A tale of seven elements, Oxford University Press, Oxford, 2013
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind (soweit nicht anders angegeben) aus www.webelements.com (Rhenium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu rhenium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu rhenium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind (soweit nicht anders angegeben) aus www.webelements.com (Rhenium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. Weinheim 1988, ISBN 3-527-26169-9, S. 1339.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind (soweit nicht anders angegeben) aus www.webelements.com (Rhenium) entnommen.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Eintrag zu Rhenium-Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 214.
- William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5.
- Ida Tacke: Zur Auffindung der Ekamangane. In: Zeitschrift für angewandte Chemie. 51, 1925, S. 1157–1180, doi:10.1002/ange.19250385102.
- Ida und Walter Noddack: Die Herstellung von einem Gramm Rhenium. In: Zeitschrift für anorganische und allgemeine Chemie. 183, 1, 1929, S. 353–375, doi:10.1002/zaac.19291830126.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Abundance of Elements in the Earth’s Crust and in the Sea, S. 14-17.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage. Weinheim 1988, ISBN 3-527-26169-9.
- M. A. Korzhinsky, S. I. Tkachenko, K. I. Shmulovich, Y. A. Tarant, G. S. Steinberg: Discovery of a pure rhenium mineral at Kudriavy volcano. In: Nature. 369, 1994, S. 51–53, doi:10.1038/369051a0.
- Rhenium bei usgs mineral resources (2007) (PDF; 60 kB).
- MINERAL COMMODITY SUMMARIES 2015. (PDF 2,3 MB, S. 130–131) USGS, abgerufen am 7. Oktober 2015 (englisch).
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. B30, 1974, S. 193–204, doi:10.1107/S0567740874002469.
- Physikalische Eigenschaften des Rheniums bei webelements.com.
- E. Gebhardt, E. Fromm, Fr. Benesovsky: Hochschmelzende Metalle und ihre Legierungen. In: Materialwissenschaft und Werkstofftechnik. 3, 4, 1972, S. 197–203, doi:10.1002/mawe.19720030407.
- Berechnet aus Isotopenverhältnis, relativer Isotopenmasse und Halbwertszeit aus: David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Abundance of Elements in the Earth’s Crust and in the Sea, S. 11-191 – 11-193.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB). (auch Häufigkeiten und Halbwertszeiten).
- Deutsche Gesellschaft für Nuklearmedizin – Leitlinie der Radiosynoviorthese.
- Rhenium-188 – alles im Fluss Rhenium-188 als Radiopharmazeutikum, Forschungs-Neutronenquelle Heinz Maier-Leibnitz (FRM II), Garching, 19. Juli 2007.
- Cesidio Cipriani, Maria Desantis, Gerhard Dahlhoff, Shannon D. Brown, Thomas Wendler: Personalized irradiation therapy for NMSC by rhenium-188 skin cancer therapy: a long-term retrospective study. In: Journal of Dermatological Treatment. 22. Juli 2020, ISSN 0954-6634, S. 1–7, doi:10.1080/09546634.2020.1793890 (tandfonline.com [abgerufen am 26. Oktober 2020]).
- Wissenschaft-Online-Lexika: Eintrag zu Rhenium-Osmium-Methode im Lexikon der Geowissenschaften.
- usgs mineral resources, mineral yearbook 2005 (Rhenium) (PDF; 53 kB).
- Astrid K. Heckl: Auswirkungen von Rhenium und Ruthenium auf die Mikrostruktur und Hochtemperaturfestigkeit von Nickel-Basis Superlegierungen unter Berücksichtigung der Phasenstabilität. Dissertation, Universität Erlangen, 2011 urn:nbn:de:bvb:29-opus-27908.
- Hans Breuer: Allgemeine und anorganische Chemie. (= dtv-Atlas Chemie. Band 1). 9. Auflage. dtv, München 2000, ISBN 3-423-03217-0.
- L. C. Hurd: Qualitative Reactions of Rhenium. In: Ind. Eng. Chem., Anal. Ed. 8, 1936, S. 11–15.
- Rhenium. In: Lexikon der Chemie. Spektrum Akad. Verlag, Heidelberg 2000.
- T.-S. Chang, P. Trucano: Lattice parameter and thermal expansion of ReO3 between 291 and 464 K. In: J. Appl. Cryst. 11, 1978, S. 286–288; doi:10.1107/S0021889878013333.
- Wolfgang A. Herrmann u. a.: Kostengünstige, effiziente und umweltfreundliche Synthese des vielseitigen Katalysators Methyltrioxorhenium (MTO). In: Angew. Chem. 119, 2007, S. 7440–7442, doi:10.1002/ange.200703017.
- Wissenschaft-Online-Lexika: Eintrag zu Rheniumverbindungen im Lexikon der Chemie.
- Eintrag zu Rhenium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. April 2011.
