Americium
Americium () ist ein chemisches Element mit dem Elementsymbol Am und der Ordnungszahl 95. Im Periodensystem steht es in der Gruppe der Actinoide (7. Periode, f-Block) und zählt auch zu den Transuranen. Americium ist neben Europium das einzige nach einem Erdteil benannte Element. Es ist ein leicht verformbares radioaktives Metall silbrig-weißen Aussehens.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Americium, Am, 95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Actinoide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | Ac, 7, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig-weißes Metall | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-144-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.313 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 243,061375[2] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | 184 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 228,5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Rn] 5f7 7s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 5.97381(25) eV[3] ≈ 576.38 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 11.7(4) eV[3] ≈ 1130 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 21.7(4) eV[3] ≈ 2090 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 36.8(4) eV[3] ≈ 3550 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 50.0(1,9) eV[3] ≈ 4820 kJ/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 13,67 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 7,1 · 10−4)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1449 K (1176 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 2880 (2607 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 1,778 · 10−5 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 238,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 14,4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 0,11 J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 147,1[2] A·V−1·m−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 10[2] W·m−1·K−1 bei 300 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +2, +3, +4, +5, +6, (+7) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,070 V (Am3+ + 3 e− → Am)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,3 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gefahren- und Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Radioaktiv | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Von Americium gibt es kein stabiles Isotop. Auf der Erde kommt es ausschließlich in künstlich erzeugter Form vor. Das Element wurde erstmals im Spätherbst 1944 erzeugt, die Entdeckung jedoch zunächst nicht veröffentlicht. Kurioserweise wurde seine Existenz in einer amerikanischen Radiosendung für Kinder durch den Entdecker Glenn T. Seaborg, den Gast der Sendung, der Öffentlichkeit preisgegeben.
Americium wird in Kernreaktoren gebildet, eine Tonne abgebrannten Kernbrennstoffs enthält durchschnittlich etwa 100 g des Elements. Es wird als Quelle ionisierender Strahlung eingesetzt, z. B. in der Fluoreszenzspektroskopie und in Ionisationsrauchmeldern. Das Americiumisotop 241Am wurde wegen seiner gegenüber Plutonium (238Pu) wesentlich längeren Halbwertszeit von 432,2 Jahren zur Befüllung von Radionuklidbatterien (RTG) für Raumsonden vorgeschlagen, welche dann hunderte Jahre lang elektrische Energie zum Betrieb bereitstellen würden.
Geschichte


Americium wurde im Spätherbst 1944 von Glenn T. Seaborg, Ralph A. James, Leon O. Morgan und Albert Ghiorso im 60-Zoll-Cyclotron an der Universität von Kalifornien in Berkeley sowie am metallurgischen Laboratorium der Universität von Chicago (heute: Argonne National Laboratory) erzeugt. Nach Neptunium und Plutonium war Americium das vierte Transuran, das seit dem Jahr 1940 entdeckt wurde; das um eine Ordnungszahl höhere Curium wurde als drittes schon im Sommer 1944 erzeugt. Der Name für das Element wurde in Anlehnung zum Erdteil Amerika gewählt – in Analogie zu Europium, dem Seltene-Erden-Metall, das im Periodensystem genau über Americium steht: The name americium (after the Americas) and the symbol Am are suggested for the element on the basis of its position as the sixth member of the actinide rare-earth series, analogous to europium, Eu, of the lanthanide series.[10][11][12]
Zur Erzeugung des neuen Elements wurden in der Regel die Oxide der Ausgangselemente verwendet. Dazu wurde zunächst Plutoniumnitratlösung (mit dem Isotop 239Pu) auf eine Platinfolie von etwa 0,5 cm2 aufgetragen; die Lösung danach eingedampft und der Rückstand dann zum Oxid (PuO2) geglüht. Nach dem Beschuss im Cyclotron wurde die Beschichtung mittels Salpetersäure gelöst, anschließend wieder mit einer konzentrierten wässrigen Ammoniaklösung als Hydroxid ausgefällt; der Rückstand wurde in Perchlorsäure gelöst. Die weitere Trennung erfolgte mit Ionenaustauschern. In ihren Versuchsreihen wurden der Reihe nach vier verschiedene Isotope erzeugt: 241Am, 242Am, 239Am und 238Am.
Als erstes Isotop isolierten sie 241Am aus einer Plutonium-Probe, die mit Neutronen bestrahlt wurde. Es zerfällt durch Aussendung eines α-Teilchens in 237Np. Die Halbwertszeit dieses α-Zerfalls wurde zunächst auf 510 ± 20 Jahre bestimmt; der heute allgemein akzeptierte Wert ist 432,2 a.[8]
- Die angegebenen Zeiten sind Halbwertszeiten.
Als zweites Isotop wurde 242Am durch erneuten Neutronenbeschuss des zuvor erzeugten 241Am gefunden. Durch nachfolgenden raschen β-Zerfall entsteht dabei 242Cm, das zuvor schon entdeckte Curium. Die Halbwertszeit dieses β-Zerfalls wurde zunächst auf 17 Stunden bestimmt, der heute als gültig ermittelte Wert beträgt 16,02 h.[8]
Erstmals öffentlich bekannt gemacht wurde die Entdeckung des Elements in der amerikanischen Radiosendung Quiz Kids am 11. November 1945 durch Glenn T. Seaborg, noch vor der eigentlichen Bekanntmachung bei einem Symposium der American Chemical Society: Einer der jungen Zuhörer fragte den Gast der Sendung, Seaborg, ob während des Zweiten Weltkrieges im Zuge der Erforschung von Nuklearwaffen neue Elemente entdeckt wurden. Seaborg bejahte die Frage und enthüllte dabei auch gleichzeitig die Entdeckung des nächsthöheren Elements, Curium.[13]
Americium (241Am und 242Am) und seine Produktion wurde später unter dem Namen Element 95 and method of producing said element patentiert, wobei als Erfinder nur Glenn T. Seaborg angegeben wurde.[14]
In elementarer Form wurde es erstmals im Jahr 1951 durch Reduktion von Americium(III)-fluorid mit Barium dargestellt.[15]
Vorkommen
Americiumisotope entstehen im r-Prozess in Supernovae und kommen auf der Erde wegen ihrer im Vergleich zum Alter der Erde zu geringen Halbwertszeit nicht natürlich vor.
Heutzutage wird jedoch Americium als Nebenprodukt in Kernkraftwerken erbrütet; das Americiumisotop 241Am entsteht als Zerfallsprodukt (u. a. in abgebrannten Brennstäben) aus dem Plutoniumisotop 241Pu. Eine Tonne abgebrannten Kernbrennstoffs enthält durchschnittlich etwa 100 g verschiedener Americiumisotope.[16] Es handelt sich dabei hauptsächlich um die α-Strahler 241Am und 243Am, die aufgrund ihrer relativ langen Halbwertszeiten in der Endlagerung unerwünscht sind und deshalb zum Transuranabfall zählen. Eine Verminderung der Langzeitradiotoxizität in nuklearen Endlagern wäre durch Abtrennung langlebiger Isotope aus abgebrannten Kernbrennstoffen möglich. Zur Beseitigung des Americiums wird derzeit die Partitioning & Transmutation-Strategie untersucht.[17][18]
Gewinnung und Darstellung
Gewinnung von Americiumisotopen
Americium fällt in geringen Mengen in Kernreaktoren an. Es steht heute in Mengen von wenigen Kilogramm zur Verfügung. Durch die aufwändige Gewinnung aus abgebrannten Brennstäben hat es einen sehr hohen Preis. Seit der Markteinführung 1962 soll der Preis für Americium(IV)-oxid mit dem Isotop 241Am bei etwa 1500 US-Dollar pro Gramm liegen.[19] Das Americiumisotop 243Am entsteht in geringeren Mengen im Reaktor aus 241Am und ist deshalb mit 160 US-Dollar pro Milligramm 243Am[20] noch wesentlich teurer.
Americium wird über das Plutoniumisotop 239Pu in Kernreaktoren mit hohem 238U-Anteil zwangsläufig erbrütet, da es aus diesem durch Neutroneneinfang und zwei anschließende β-Zerfälle (über 239U und 239Np) entsteht.
- Die angegebenen Zeiten sind Halbwertszeiten.
Danach wird, wenn es nicht zur Kernspaltung kommt, aus dem 239Pu, neben anderen Nukliden, durch stufenweisen Neutroneneinfang (n,γ) und anschließenden β-Zerfall 241Am oder 243Am erbrütet.
Das Plutonium, welches aus abgebrannten Brennstäben von Leistungsreaktoren gewonnen werden kann, besteht zu etwa 12 % aus dem Isotop 241Pu.[19] Deshalb erreichen erst 70 Jahre, nachdem der Brutprozess beendet wurde, die abgebrannten Brennstäbe ihren Maximalgehalt von 241Am; danach nimmt der Gehalt wieder (langsamer als der Anstieg) ab.[21]
Aus dem so entstandenen 241Am kann durch weiteren Neutroneneinfang im Reaktor 242Am entstehen. Bei Leichtwasserreaktoren soll aus dem 241Am zu 79 % 242Am und zu 10 % 242mAm entstehen:[22]
zu 79 %:
zu 10 %:
Für die Erbrütung von 243Am ist ein vierfacher Neutroneneinfang des 239Pu erforderlich:
Darstellung elementaren Americiums
Metallisches Americium kann durch Reduktion aus seinen Verbindungen erhalten werden. Zuerst wurde Americium(III)-fluorid zur Reduktion verwendet. Dieses wird hierzu in wasser- und sauerstofffreier Umgebung in Reaktionsapparaturen aus Tantal und Wolfram mit elementarem Barium zur Reaktion gebracht.[15][23]
Auch die Reduktion von Americium(IV)-oxid mittels Lanthan oder Thorium ergibt metallisches Americium.[24]
Eigenschaften

Im Periodensystem steht das Americium mit der Ordnungszahl 95 in der Reihe der Actinoide, sein Vorgänger ist das Plutonium, das nachfolgende Element ist das Curium. Sein Analogon in der Reihe der Lanthanoiden ist das Europium.
Physikalische Eigenschaften
Americium ist ein radioaktives Metall. Frisch hergestelltes Americium ist ein silberweißes Metall, welches jedoch bei Raumtemperatur langsam matt wird. Es ist leicht verformbar. Sein Schmelzpunkt beträgt 1176 °C[24], der Siedepunkt liegt bei 2607 °C. Die Dichte beträgt 13,67 g·cm−3[24].[25] Es tritt in zwei Modifikationen auf.
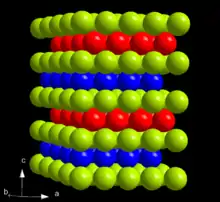
Die bei Standardbedingungen stabile Modifikation α-Am kristallisiert im hexagonalen Kristallsystem in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 346,8 pm und c = 1124 pm sowie vier Formeleinheiten pro Elementarzelle. Die Kristallstruktur besteht aus einer doppelt-hexagonal dichtesten Kugelpackung (d. h.c.p.) mit der Schichtfolge ABAC und ist damit isotyp zur Struktur von α-La.[25][23]
Bei hohem Druck geht α-Am in β-Am über. Die β-Modifikation kristallisiert im kubischen Kristallsystem in der Raumgruppe Fm3m (Nr. 225) mit dem Gitterparameter a = 489 pm[25][23], was einem kubisch flächenzentrierten Gitter (f.c.c.) beziehungsweise einer kubisch dichtesten Kugelpackung mit der Stapelfolge ABC entspricht.
Die Lösungsenthalpie von Americium-Metall in Salzsäure bei Standardbedingungen beträgt −620,6 ± 1,3 kJ·mol−1. Ausgehend von diesem Wert erfolgte die erstmalige Berechnung der Standardbildungsenthalpie (ΔfH0) von Am3+(aq) auf −621,2 ± 2,0 kJ·mol−1 und des Standardpotentials Am3+ / Am0 auf −2,08 ± 0,01 V.[26]
Chemische Eigenschaften
Americium ist ein sehr reaktionsfähiges Element, das schon mit Luftsauerstoff reagiert und sich gut in Säuren löst. Gegenüber Alkalien ist es stabil.
Die stabilste Oxidationsstufe für Americium ist +3, die Am(III)-Verbindungen sind gegen Oxidation und Reduktion sehr stabil. Mit dem Americium liegt der erste Vertreter der Actinoiden vor, der in seinem Verhalten eher den Lanthanoiden ähnelt als den d-Block-Elementen.
Es ist auch in den Oxidationsstufen +2 sowie +4, +5, +6 und +7 zu finden. Je nach Oxidationszahl variiert die Farbe von Americium in wässriger Lösung ebenso wie in festen Verbindungen:
Am3+ (gelbrosa), Am4+ (gelbrot), AmVO2+ (gelb), AmVIO22+ (zitronengelb), AmVIIO65− (dunkelgrün).
Im Gegensatz zum homologen Europium – Americium hat eine zu Europium analoge Elektronenkonfiguration – kann Am3+ in wässriger Lösung nicht zu Am2+ reduziert werden.
Verbindungen mit Americium ab Oxidationszahl +4 aufwärts sind starke Oxidationsmittel, vergleichbar dem Permanganat-Ion (MnO4−) in saurer Lösung.[27]
Die in wässriger Lösung nicht beständigen Am4+-Ionen lassen sich nur noch mit starken Oxidationsmitteln aus Am(III) darstellen. In fester Form sind zwei Verbindungen des Americiums in der Oxidationsstufe +4 bekannt: Americium(IV)-oxid (AmO2) und Americium(IV)-fluorid (AmF4).
Der fünfwertige Oxidationszustand wurde beim Americium erstmals 1951 beobachtet.[28] In wässriger Lösung liegen primär AmO2+-Ionen (sauer) oder AmO3−-Ionen (alkalisch) vor, die jedoch instabil sind und einer raschen Disproportionierung unterliegen:[29][30]
Zunächst ist von einer Disproportionierung zur Oxidationsstufe +6 und +4 auszugehen:
Etwas beständiger als Am(IV) und Am(V) sind die Americium(VI)-Verbindungen. Sie lassen sich aus Am(III) durch Oxidation mit Ammoniumperoxodisulfat in verdünnter Salpetersäure herstellen. Der typische rosafarbene Ton verschwindet in Richtung zu einer starken Gelbfärbung.[31] Zudem kann die Oxidation mit Silber(I)-oxid in Perchlorsäure quantitativ erreicht werden.[32] In Natriumcarbonat- oder Natriumhydrogencarbonat-Lösungen ist eine Oxidation mit Ozon oder Natriumperoxodisulfat gleichfalls möglich.[33]
 Americium(III)
Americium(III)
in 2 M Na2CO3-Lösung Americium(IV)
Americium(IV)
in 2 M Na2CO3-Lösung Americium(IV) und (VI)
Americium(IV) und (VI)
in 2 M Na2CO3-Lösung
Biologische Aspekte
Eine biologische Funktion des Americiums ist nicht bekannt.[34] Vorgeschlagen wurde der Einsatz immobilisierter Bakterienzellen zur Entfernung von Americium und anderen Schwermetallen aus Fließgewässern. So können Enterobakterien der Gattung Citrobacter durch die Phosphataseaktivität in ihrer Zellwand bestimmte Americiumnuklide aus wässriger Lösung ausfällen und als Metall-Phosphat-Komplex binden.[35] Ferner wurden die Faktoren untersucht, die die Biosorption und Bioakkumulation des Americiums durch Bakterien[36][37] und Pilze[38] beeinflussen.
Spaltbarkeit
Das Isotop 242m1Am hat mit rund 5700 barn den höchsten bisher (10/2008) gemessenen thermischen Spaltquerschnitt.[39] Damit geht eine kleine kritische Masse einher, weswegen 242m1Am als Spaltmaterial vorgeschlagen wurde, um beispielsweise Raumschiffe mit Kernenergieantrieb anzutreiben.[40]
Dieses Isotop eignet sich prinzipiell auch zum Bau von Kernwaffen. Die kritische Masse einer reinen 242m1Am-Kugel beträgt etwa 9–14 kg. Die Unsicherheiten der verfügbaren Wirkungsquerschnitte lassen derzeit keine genauere Aussage zu. Mit Reflektor beträgt die kritische Masse noch etwa 3–5 kg.[41] In wässriger Lösung wird sie nochmals stark herabgesetzt. Auf diese Weise ließen sich sehr kompakte Sprengköpfe bauen. Nach öffentlichem Kenntnisstand wurden bisher keine Kernwaffen aus 242m1Am gebaut, was mit der geringen Verfügbarkeit und dem hohen Preis begründet werden kann.
Aus denselben Gründen wird 242m1Am auch nicht als Kernbrennstoff in Kernreaktoren eingesetzt, obwohl es dazu prinzipiell sowohl in thermischen als auch in schnellen Reaktoren geeignet wäre.[42] Auch die beiden anderen häufiger verfügbaren Isotope, 241Am und 243Am können in einem schnellen Reaktor eine Kettenreaktion aufrechterhalten. Die kritischen Massen sind hier jedoch sehr hoch. Sie betragen unreflektiert 57,6–75,6 kg bei 241Am und 209 kg bei 243Am[43], so dass sich durch die Verwendung keine Vorteile gegenüber herkömmlichen Spaltstoffen ergeben.
Entsprechend ist Americium rechtlich nach § 2 Abs. 1 des Atomgesetzes nicht den Kernbrennstoffen zugeordnet. Es existieren jedoch Vorschläge, sehr kompakte Reaktoren mit einem Americium-Inventar von lediglich knapp 20 g zu konstruieren, die in Krankenhäusern als Neutronenquelle für die Neutroneneinfangtherapie verwendet werden können.[44]
Isotope
Von Americium sind 16 Isotope und 11 Kernisomere mit Halbwertszeiten zwischen Bruchteilen von Mikrosekunden und 7370 Jahren bekannt. Es gibt zwei langlebige α-strahlende Isotope 241Am mit 432,2 und 243Am mit 7370 Jahren Halbwertszeit. Außerdem hat das Kernisomer 242m1Am mit 141 Jahren eine lange Halbwertszeit. Die restlichen Kernisomere und Isotope haben mit 0,64 µs bei 245m1Am bis 50,8 Stunden bei 240Am kurze Halbwertszeiten.[8]
241Am ist das am häufigsten erbrütete Americiumisotop und liegt auf der Neptunium-Reihe. Es zerfällt mit einer Halbwertszeit von 432,2 Jahren[8] mit einem α-Zerfall zu 237Np. 241Am gibt nur mit einer Wahrscheinlichkeit von 0,35 % die gesamte Zerfallsenergie mit dem α-Teilchen ab, sondern emittiert meistens noch ein oder mehrere Gammaquanten.[45]
242Am ist kurzlebig und zerfällt mit einer Halbwertszeit von 16,02 h[8] zu 82,7 % durch β-Zerfall zu 242Cm und zu 17,3 % durch Elektroneneinfang zu 242Pu. Das 242Cm zerfällt zu 238Pu und dieses weiter zu 234U, das auf der Uran-Radium-Reihe liegt. Das 242Pu zerfällt über die gleiche Zerfallskette wie 238Pu. Während jedoch 238Pu als Seitenarm beim 234U auf die Zerfallskette kommt, steht 242Pu noch vor dem 238U. 242Pu zerfällt durch α-Zerfall in 238U, den Beginn der natürlichen Uran-Radium-Reihe.
242m1Am zerfällt mit einer Halbwertszeit von 141 Jahren[8] zu 99,541 % durch Innere Konversion zu 242Am und zu 0,459 % durch α-Zerfall zu 238Np. Dieses zerfällt zu 238Pu und dann weiter zu 234U, das auf der Uran-Radium-Reihe liegt.
243Am ist mit einer Halbwertszeit von 7370 Jahren[8] das langlebigste Americiumisotop. Es geht zunächst durch α-Strahlung in 239Np über, das durch β-Zerfall weiter zu 239Pu zerfällt. Das 239Pu zerfällt durch α-Strahlung zu Uran 235U, dem offiziellen Anfang der Uran-Actinium-Reihe.
Die Americiumisotope mit ungerader Neutronenzahl, also gerader Massenzahl, sind gut durch thermische Neutronen spaltbar.
Verwendung
Für die Verwendung von Americium sind vor allem die beiden langlebigsten Isotope 241Am und 243Am von Interesse. In der Regel wird es in Form des Oxids (AmO2) verwendet.

Ionisationsrauchmelder
Die α-Strahlung des 241Am wird in Ionisationsrauchmeldern genutzt.[19] Es wird gegenüber 226Ra bevorzugt, da es vergleichsweise wenig γ-Strahlung emittiert. Dafür muss aber die Aktivität gegenüber Radium ca. das Fünffache betragen. Die Zerfallsreihe von 241Am „endet“ für den Verwendungszeitraum quasi direkt nach dessen α-Zerfall bei 237Np, das eine Halbwertszeit von rund 2,144 Millionen Jahren besitzt.
Radionuklidbatterien
241Am wurde wegen seiner gegenüber 238Pu wesentlich längeren Halbwertszeit zur Befüllung von Radionuklidbatterien (RTG) von Raumsonden vorgeschlagen. Dank seiner Halbwertszeit von 432,2 Jahren könnte ein RTG mit 241Am-Füllung hunderte Jahre lang – anstatt nur einige Jahrzehnte (wie mit einer 238Pu-Füllung) – elektrische Energie zum Betrieb einer Raumsonde bereitstellen.[46] Es soll voraussichtlich in den Radionuklidbatterien zum Einsatz kommen, deren Entwicklung die ESA erwägt und deren Entwicklung in den 2020er-Jahren abgeschlossen werden könnte.[47]
Neutronenquellen
241Am als Oxid mit Beryllium verpresst stellt eine Neutronenquelle dar, die beispielsweise für radiochemische Untersuchungen eingesetzt wird.[2] Hierzu wird der hohe Wirkungsquerschnitt des Berylliums für (α,n)-Kernreaktionen ausgenutzt, wobei das Americium als Produzent der α-Teilchen dient. Die entsprechenden Reaktionsgleichungen lauten:
Derartige Neutronenquellen kommen beispielsweise in der Neutronenradiographie und -tomographie zum Einsatz.
Ionisator

Neben dem häufig verwendeten 210Po als Ionisator zur Beseitigung von unerwünschter elektrostatischer Aufladung kam auch 241Am zum Einsatz. Dazu wurde z. B. die Quelle am Kopf einer Bürste montiert mit der man langsam über die zu behandelnden Oberflächen strich und dadurch eine Wiederverschmutzung durch elektrostatisch angezogene Staubpartikel vermeiden konnte.
Herstellung anderer Elemente
Americium ist Ausgangsmaterial zur Erzeugung höherer Transurane und auch der Transactinoide. Aus 242Am entsteht zu 82,7 % Curium (242Cm) und zu 17,3 % Plutonium (242Pu). Im Kernreaktor wird zwangsläufig in geringen Mengen durch Neutroneneinfang aus 243Am das 244Am erbrütet, das durch β-Zerfall zum Curiumisotop 244Cm zerfällt.
In Teilchenbeschleunigern führt zum Beispiel der Beschuss von 241Am mit Kohlenstoffkernen (12C) beziehungsweise Neonkernen (22Ne) zu den Elementen Einsteinium 247Es beziehungsweise Dubnium 260Db.[2]
Spektrometer
Mit seiner intensiven Gammastrahlungs-Spektrallinie bei 60 keV eignet sich 241Am gut als Strahlenquelle für die Röntgen-Fluoreszenzspektroskopie. Dies wird auch zur Kalibrierung von Gammaspektrometern im niederenergetischen Bereich verwendet, da die benachbarten Linien vergleichsweise schwach sind und so ein einzeln stehender Peak entsteht. Zudem wird der Peak nur vernachlässigbar durch das Compton-Kontinuum höherenergetischer Linien gestört, da diese ebenfalls höchstens mit einer um mindestens drei Größenordnungen geringeren Intensität auftreten.[48]
Sicherheitshinweise und Gefahren
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen, welche eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielt. Eine chemische Gefahr liegt überhaupt nur dann vor, wenn es sich um eine dafür relevante Stoffmenge handelt.
Da von Americium nur radioaktive Isotope existieren, darf es selbst sowie seine Verbindungen nur in geeigneten Laboratorien unter speziellen Vorkehrungen gehandhabt werden. Die meisten gängigen Americiumisotope sind α-Strahler, weshalb eine Inkorporation unbedingt vermieden werden muss. Das breite Spektrum der hieraus resultierenden meist ebenfalls radioaktiven Tochternuklide stellt ein weiteres Risiko dar, das bei der Wahl der Sicherheitsvorkehrungen berücksichtigt werden muss.[49] 241Am gibt beim radioaktiven Zerfall große Mengen relativ weicher Gammastrahlung ab, die sich gut abschirmen lässt.[50]
Nach Untersuchungen des Forschers Arnulf Seidel vom Institut für Strahlenbiologie des Kernforschungszentrums Karlsruhe erzeugt Americium (wie Plutonium), bei Aufnahme in den Körper, mehr Knochentumore als dieselbe Dosis Radium.[51]
Die biologische Halbwertszeit von 241Am beträgt in den Knochen 50 Jahre und in der Leber 20 Jahre. In den Gonaden verbleibt es dagegen offensichtlich dauerhaft.[52]
Verbindungen
→ Kategorie: Americiumverbindung
Oxide
Von Americium existieren Oxide der Oxidationsstufen +3 (Am2O3) und +4 (AmO2).
Americium(III)-oxid (Am2O3) ist ein rotbrauner Feststoff und hat einen Schmelzpunkt von 2205 °C.[53]
Americium(IV)-oxid (AmO2) ist die wichtigste Verbindung dieses Elements. Nahezu alle Anwendungen dieses Elements basieren auf dieser Verbindung. Sie entsteht unter anderem implizit in Kernreaktoren beim Bestrahlen von Urandioxid (UO2) bzw. Plutoniumdioxid (PuO2) mit Neutronen. Es ist ein schwarzer Feststoff und kristallisiert – wie die anderen Actinoiden(IV)-oxide – im kubischen Kristallsystem in der Fluorit-Struktur.
Halogenide
Halogenide sind für die Oxidationsstufen +2, +3 und +4 bekannt.[54] Die stabilste Stufe +3 ist für sämtliche Verbindungen von Fluor bis Iod bekannt und in wässriger Lösung stabil.[55]
| Oxidations- zahl | F | Cl | Br | I |
|---|---|---|---|---|
| +4 | Americium(IV)-fluorid AmF4 schwach rosa |
|||
| +3 | Americium(III)-fluorid AmF3 rosa |
Americium(III)-chlorid AmCl3 rosa |
Americium(III)-bromid AmBr3 hellgelb |
Americium(III)-iodid AmI3 hellgelb |
| +2 | Americium(II)-chlorid AmCl2 schwarz |
Americium(II)-bromid AmBr2 schwarz |
Americium(II)-iodid AmI2 schwarz | |
Americium(III)-fluorid (AmF3) ist schwerlöslich und kann durch die Umsetzung einer wässrigen Americiumlösung mit Fluoridsalzen im schwach Sauren durch Fällung hergestellt werden:
Das tetravalente Americium(IV)-fluorid (AmF4) ist durch die Umsetzung von Americium(III)-fluorid mit molekularem Fluor zugänglich:[56]
In der wässrigen Phase wurde das vierwertige Americium auch beobachtet.[57]
Americium(III)-chlorid (AmCl3) bildet rosafarbene hexagonale Kristalle. Seine Kristallstruktur ist isotyp mit Uran(III)-chlorid. Der Schmelzpunkt der Verbindung liegt bei 715 °C.[54] Das Hexahydrat (AmCl3·6 H2O) weist eine monokline Kristallstruktur auf.[58]
Durch Reduktion mit Na-Amalgam aus Am(III)-Verbindungen sind Am(II)-Salze zugänglich: die schwarzen Halogenide AmCl2, AmBr2 und AmI2. Sie sind sehr sauerstoffempfindlich, und oxidieren in Wasser unter Freisetzung von Wasserstoff zu Am(III)-Verbindungen.
Chalkogenide und Pentelide
Von den Chalkogeniden sind bekannt: das Sulfid (AmS2)[59], zwei Selenide (AmSe2 und Am3Se4)[59][60] und zwei Telluride (Am2Te3 und AmTe2).[61]
Die Pentelide des Americiums (243Am) des Typs AmX sind für die Elemente Phosphor, Arsen,[62] Antimon und Bismut dargestellt worden. Sie kristallisieren im NaCl-Gitter.[60]
Silicide und Boride
Americiummonosilicid (AmSi) und Americium„disilicid“ (AmSix mit: 1,87 < x < 2,0) wurden durch Reduktion von Americium(III)-fluorid mit elementaren Silicium im Vakuum bei 1050 °C (AmSi) und 1150–1200 °C (AmSix) dargestellt. AmSi ist eine schwarze Masse, isomorph mit LaSi. AmSix ist eine hellsilbrige Verbindung mit einem tetragonalen Kristallgitter.[63]
Boride der Zusammensetzungen AmB4 und AmB6 sind gleichfalls bekannt.[64]
Metallorganische Verbindungen
Analog zu Uranocen, einer Organometallverbindung in der Uran von zwei Cyclooctatetraen-Liganden komplexiert ist, wurden die entsprechenden Komplexe von Thorium, Protactinium, Neptunium, Plutonium und auch des Americiums, (η8-C8H8)2Am, dargestellt.[65]
Literatur
- Wolfgang H. Runde, Wallace W. Schulz: Americium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1265–1395 (doi:10.1007/1-4020-3598-5_8).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane: Teil A 1 I, S. 30–34; Teil A 1 II, S. 18, 315–326, 343–344; Teil A 2, S. 42–44, 164–175, 185–188; Teil B 1, S. 57–67.
Weblinks
- Eintrag zu Americium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Rachel Sheremeta Pepling: Americium. Chemical & Engineering News, 2003.
Einzelnachweise
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Americium) entnommen.
- Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3, S. 18–23.
- Eintrag zu americium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu americium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Americium) entnommen.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Americium) entnommen.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties, in: Nuclear Physics A, 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieses Element entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- G. T. Seaborg, R. A. James, L. O. Morgan: The New Element Americium (Atomic Number 95), NNES PPR (National Nuclear Energy Series, Plutonium Project Record), Vol. 14 B The Transuranium Elements: Research Papers, Paper No. 22.1, McGraw-Hill Book Co., Inc., New York, 1949 (Abstract; Maschinoskript (Januar 1948)).
- K. Street, Jr., A. Ghiorso, G. T. Seaborg: The Isotopes of Americium, in: Physical Review, 1950, 79 (3), S. 530–531 (doi:10.1103/PhysRev.79.530; Maschinoskript (11. April 1950)).
- Übersetzung: Der Name Americium (nach den beiden Amerikas) und das Symbol Am werden für das Element vorgeschlagen – basierend auf seiner Position als sechstes Mitglied der Actinoid-Seltenerdmetalle-Serie, in Analogie zum Europium, Eu, aus der Lanthanoiden-Serie.
- Rachel Sheremeta Pepling: Americium. Chemical & Engineering News, 2003.
- Patent US3156523: Element 95 and method of producing said element. Angemeldet am 23. August 1946, veröffentlicht am 10. November 1964, Erfinder: Glenn T. Seaborg.
- Edgar F. Westrum, Jr., LeRoy Eyring: The Preparation and Some Properties of Americium Metal, in: J. Am. Chem. Soc., 1951, 73 (7), S. 3396–3398 (doi:10.1021/ja01151a116).
- Klaus Hoffmann: Kann man Gold machen? Gauner, Gaukler und Gelehrte. Aus der Geschichte der chemischen Elemente, Urania-Verlag; Leipzig, Jena, Berlin 1979, DNB 800228367, S. 233.
- L. H. Baetsle: Application of Partitioning/Transmutation of Radioactive Materials in Radioactive Waste Management (Memento vom 26. April 2005 im Internet Archive) (PDF; 2,4 MB), September 2001.
- Gabriele Fioni, Michel Cribier, Frédéric Marie: Can the minor actinide, americium-241, be transmuted by thermal neutrons?.
- Smoke Detectors and Americium. (Memento vom 12. November 2010 im Internet Archive)
- Informationen zum Element Americium bei www.speclab.com (engl.); Zugriff: 8. Oktober 2008.
- BREDL Southern Anti-Plutonium Campaign (Memento vom 29. April 2015 im Internet Archive).
- Akihiro Sasahara, Tetsuo Matsumura, Giorgos Nicolaou, Dimitri Papaioannou: Neutron and Gamma Ray Source Evaluation of LWR High Burn-up UO2 and MOX Spent Fuels, in: Journal of Nuclear Science and Technology, 2004, 41 (4), S. 448–456 (doi:10.1080/18811248.2004.9715507).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil B 1, S. 57–67.
- W. Z. Wade, T. Wolf: Preparation and Some Properties of Americium Metal, in: J. Inorg. Nucl. Chem., 1967, 29 (10), S. 2577–2587 (doi:10.1016/0022-1902(67)80183-0).
- D. B. McWhan, B. B. Cunningham, J. C. Wallmann: Crystal Structure, Thermal Expansion and Melting Point of Americium Metal, in: J. Inorg. Nucl. Chem., 1962, 24 (9), S. 1025–1038 (doi:10.1016/0022-1902(62)80246-2).
- J. U. Mondal, D. L. Raschella, R. G. Haire, J. R. Peterson: The Enthalpy of Solution of 243Am Metal and the Standard Enthalpy of Formation of Am3+(aq), in: Thermochim. Acta, 1987, 116, S. 235–240 (doi:10.1016/0040-6031(87)88183-2).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1956.
- L. B. Werner, I. Perlman: The Pentavalent State of Americium, in: J. Am. Chem. Soc., 1951, 73 (1), S. 495–496 (doi:10.1021/ja01145a540).
- G. R. Hall, T. L. Markin: The Self-reduction of Americium(V) and (VI) and the Disproportionation of Americium(V) in Aqueous Solution, in: J. Inorg. Nucl. Chem., 1957, 4 (5–6), S. 296–303 (doi:10.1016/0022-1902(57)80011-6).
- James S. Coleman: The Kinetics of the Disproportionation of Americium(V), in: Inorg. Chem., 1963, 2 (1), S. 53–57 (doi:10.1021/ic50005a016).
- L. B. Asprey, S. E. Stephanou, R. A. Penneman: A New Valence State of Americium, Am(VI), in: J. Am. Chem. Soc., 1950, 72 (3), S. 1425–1426 (doi:10.1021/ja01159a528).
- L. B. Asprey, S. E. Stephanou, R. A. Penneman: Hexavalent Americium, in: J. Am. Chem. Soc., 1951, 73 (12), S. 5715–5717 (doi:10.1021/ja01156a065).
- J. S. Coleman, T. K. Keenan, L. H. Jones, W. T. Carnall, R. A. Penneman: Preparation and Properties of Americium(VI) in Aqueous Carbonate Solutions, in: Inorg. Chem., 1963, 2 (1), S. 58–61 (doi:10.1021/ic50005a017).
- The Biochemical Periodic Tables – Americium.
- L. E. Macaskie, B. C. Jeong, M. R. Tolley: Enzymically Accelerated Biomineralization of Heavy Metals: Application to the Removal of Americium and Plutonium from Aqueous Flows, in: FEMS Microbiol. Rev., 1994, 14 (4), S. 351–367 (PMID 7917422).
- E. A. Wurtz, T. H. Sibley, W. R. Schell: Interactions of Escherichia coli and Marine Bacteria with 241Am in Laboratory Cultures, in: Health Phys., 1986, 50 (1), S. 79–88 (PMID 3511007).
- A. J. Francis, J. B. Fillow, C. J. Dodge, M. Dunn, K. Mantione, B. A. Strietelmeier, M. E. Pansoy-Hjelvik, H. W. Papenguth: Role of Bacteria as Biocolloids in the Transport of Actinides from a Deep Underground Radioactive Waste Repository, in: Radiochimica Acta, 1998, 82, S. 347–354 (Abstract und PDF-Download).
- N. Liu, Y. Yang, S. Luo, T. Zhang, J. Jin, J. Liao, X. Hua: Biosorption of 241Am by Rhizopus arrihizus: Preliminary Investigation and Evaluation, in: Appl. Radiat. Isot., 2002, 57 (2), S. 139–143 (PMID 12150270).
- G. Pfennig, H. Klewe-Nebenius, W. Seelmann-Eggebert (Hrsg.): Karlsruher Nuklidkarte, 7. Auflage 2006.
- Science daily: Extremely Efficient Nuclear Fuel Could Take Man To Mars In Just Two Weeks, 3. Januar 2001.
- H. Dias, N. Tancock, A. Clayton: Critical Mass Calculations for 241Am, 242mAm and 243Am, in: Nippon Genshiryoku Kenkyujo JAERI, Conf, 2003, S. 618–623 (Abstract; PDF).
- Y. Ronen, M. Aboudy, D. Regev: A novel method for energy production using 242mAm as a nuclear fuel, in: Nuclear Technology, 2000, 129 (3), S. 407–417 (Abstract).
- Institut de Radioprotection et de Sûreté Nucléaire: Evaluation of nuclear criticality safety data and limits for actinides in transport, S. 16 (PDF (Memento vom 22. August 2011 auf WebCite)).
- Y. Ronen, M. Aboudy, D. Regev: Homogeneous 242mAm-Fueled Reactor for Neutron Capture Therapy, in: Nuclear Science and Engineering, 2001, 138 (3), S. 295–304 (Abstract).
- α-Zerfall von 241Am mit Entstehung von Gammastrahlen (Memento vom 24. Juni 2008 im Internet Archive).
- Nuklide für RTGs (PDF; 297 kB) letzte Seite.
- Stephen Clark: Space agencies tackle waning plutonium stockpiles, in: Spaceflight Now, 9. Juli 2010.
- Nuclear Data Viewer 2.4, NNDC, abgefragt am 11. September 2008; Sucheingabe.
- Lenntech: Americium (Am).
- Public Health Statement for Americium Abschnitt 1.5.
- Franz Frisch: Klipp und klar, 100 x Energie, Bibliographisches Institut AG, Mannheim 1977, ISBN 3-411-01704-X, S. 184.
- Division of Environmental Health, Office of Radiation Protection, Fact Sheet #23 (November 2002): Americium-241 (Memento vom 18. Februar 2011 auf WebCite).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1972.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1969.
- L. B. Asprey, T. K. Keenan, F. H. Kruse: Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium, in: Inorg. Chem., 1965, 4 (7), S. 985–986 (doi:10.1021/ic50029a013).
- L. B. Asprey: New Compounds of Quadrivalent Americium, AmF4, KAmF5, in: J. Am. Chem. Soc., 1954, 76 (7), S. 2019–2020 (doi:10.1021/ja01636a094).
- L. B. Asprey, R. A. Penneman: First Observation of Aqueous Tetravalent Americium, in: J. Am. Chem. Soc., 1961, 83 (9), S. 2200–2200 (doi:10.1021/ja01470a040).
- John H. Burns, Joseph Richard Peterson: The Crystal Structures of Americium Trichloride Hexahydrate and Berkelium Trichloride Hexahydrate, in: Inorg. Chem., 1971, 10 (1), S. 147–151 (doi:10.1021/ic50095a029).
- D. Damien, J. Jove: Americium Disulfide and Diselenide, in: Inorg. Nucl. Chem. Lett., 1971, 7 (7), S. 685–688 (doi:10.1016/0020-1650(71)80055-7).
- J. W. Roddy: Americium Metallides: AmAs, AmSb, AmBi, Am3Se4, and AmSe2, in: J. Inorg. Nucl. Chem., 1974, 36 (11), S. 2531–2533 (doi:10.1016/0022-1902(74)80466-5).
- D. Damien: Americium Tritelluride and Ditelluride, in: Inorg. Nucl. Chem. Lett., 1972, 8 (5), S. 501–504 (doi:10.1016/0020-1650(72)80262-9).
- J. P. Charvillat, D. Damien: Americium Monoarsenide, in: Inorg. Nucl. Chem. Lett., 1973, 9 (5), S. 559–563 (doi:10.1016/0020-1650(73)80191-6).
- F. Weigel, F. D. Wittmann, R. Marquart: Americium Monosilicide and “Disilicide”, in: Journal of the Less Common Metals, 1977, 56 (1), S. 47–53 (doi:10.1016/0022-5088(77)90217-X).
- Harry A. Eick, R. N. R. Mulford: Americium and Neptunium Borides, in: J. Inorg. Nucl. Chem., 1969, 31 (2), S. 371–375 (doi:10.1016/0022-1902(69)80480-X).
- Christoph Elschenbroich: Organometallchemie, 6. Auflage, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 589.