Schwefelsäure
Schwefelsäure ist eine chemische Verbindung des Schwefels mit der Summenformel H2SO4. Die 100%ige Schwefelsäure ist eine farblose, ölige, sehr viskose und hygroskopische Flüssigkeit, die in der Technik häufig als Monohydrat bezeichnet wird. Schwefelsäure ist eine der stärksten Säuren und wirkt stark ätzend. Diese Mineralsäure bildet zwei Reihen von Salzen, die Hydrogensulfate und die Sulfate, bei denen im Vergleich zur freien Säure ein beziehungsweise zwei Protonen durch Kationen ersetzt sind.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
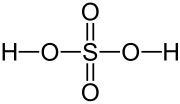 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Schwefelsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | H2SO4 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose, viskose Flüssigkeit[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 98,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[3] | ||||||||||||||||||
| Dichte |
1,84 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG/Schweiz: 0,1 mg·m−3 (gemessen als einatembarer Staub/Aerosolanteil)[3][7] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Schwefelsäure ist eine der technisch wichtigsten Chemikalien überhaupt und zählt zu den meistproduzierten chemischen Grundstoffen. 1993 wurden weltweit etwa 135 Millionen Tonnen[9] Schwefelsäure produziert, im Jahr 2012 waren es 230 Millionen Tonnen[10]. Sie wird vor allem in der Düngemittelproduktion und zur Herstellung anderer Mineralsäuren, etwa der Salz- oder Phosphorsäure, verwendet. Es werden meist wässrige Lösungen verschiedener Konzentrationen eingesetzt.
Das Anhydrid der Schwefelsäure ist das Schwefeltrioxid (SO3). Die Lösung von Schwefeltrioxid in der Schwefelsäure über das stöchiometrische Mengenverhältnis hinaus wird als rauchende Schwefelsäure oder Oleum bezeichnet. Verwandte Säuren sind die Schweflige Säure (H2SO3), die sich vom Schwefeldioxid ableitet und die Thioschwefelsäure (H2S2O3), bei der ein Sauerstoffatom durch Schwefel ersetzt ist.
Geschichte

Schwefelsäure ist unter dem veralteten Namen Vitriolöl schon seit langer Zeit bekannt. Erste Hinweise finden sich in den Texten des historisch umstrittenen Alchemisten Dschābir ibn Hayyān aus dem 8. Jahrhundert. Danach werden mögliche Herstellungsverfahren auch in den alchimistischen Schriften des Albertus Magnus (1200–1280) und Basilius Valentinus (um 1600) erwähnt. Diese Verfahren beschreiben, wie aus natürlich vorkommenden Sulfaten – etwa Chalkanthit oder Alaun – Vitriolöl gewonnen werden kann. Der Name Vitriolöl leitet sich von der veralteten Bezeichnung Vitriol für diese Minerale ab. Die erste Quelle für größere Mengen Schwefelsäure war Eisenvitriol. Ab dem 16. Jahrhundert wurde in Böhmen, Sachsen und am Harz nach dem Vitriolverfahren Schwefelsäure hergestellt.[11] Nach dem ersten Produktionsort Nordhausen wurde das Produkt Nordhäuser Vitriol genannt.[12] Erste wissenschaftliche Untersuchungen mit Schwefelsäure führte Johann Rudolph Glauber durch. Er ließ die Säure auf Kochsalz einwirken und erhielt dabei die Salzsäure und das nach ihm benannte Glaubersalz Natriumsulfat.[13]
Die Verfahren, bei denen Sulfate eingesetzt wurden, waren allerdings sehr aufwendig und teuer. Um größere Mengen zu bekommen, wurde im 18. Jahrhundert ein Verfahren entwickelt, bei dem Schwefel und Salpeter in Glasgefäßen verbrannt wurden. Da die Glasgefäße sehr zerbrechlich waren, wurde 1746 durch John Roebuck die Reaktion erstmals in Bleibehältern durchgeführt. 1778 wurde in Winterthur mit dem Laboratorium die erste chemische Fabrik der Schweiz gegründet, die als Hauptprodukt Vitriolöl herstellte.[14] Nachdem 1793 Nicolas Clément-Désormes und Charles-Bernard Desormes entdeckt hatten, dass durch den Einsatz von Luft die Salpetermenge deutlich gesenkt werden konnte, konnte das Bleikammerverfahren großtechnisch eingesetzt werden. Dies war insbesondere für das 1789[15] von Nicolas Leblanc erfundene und 1791 erstmals von ihm angewendete Leblanc-Verfahren zur Sodaproduktion wichtig. Das Verfahren wurde mehrmals, etwa durch die Entwicklung von Methoden zur Absorption der nitrosen Gase durch Joseph Louis Gay-Lussac, verbessert.[16] Es konnte damit eine kontinuierliche Produktionsführung erreicht werden.
Der größte Nachteil dieses Verfahrens lag darin, dass nur eine Säurekonzentration von maximal 78 % erreichbar war und konzentriertere Lösungen sowie Oleum weiterhin über die aufwändige Destillation von Eisenvitriol hergestellt werden mussten. Eine einfache Produktion höherkonzentrierter Schwefelsäure gelang erst nach Entwicklung des Kontaktverfahrens ab 1870 durch Rudolph Messel in England.[17]
Vorkommen
Freie, nicht in Oxonium- und Sulfationen dissoziierte Schwefelsäure kommt in der Natur nur sehr selten vor. In der Atmosphäre bildet sie sich aus Schwefeldioxid, das bei der Verbrennung von schwefelhaltigen Substanzen oder bei Vulkanausbrüchen entsteht. Das Schwefeldioxid wird durch Hydroxyl-Radikale und Sauerstoff zu Schwefeltrioxid oxidiert. Mit Wasser bildet sich schließlich die freie Schwefelsäure. Weitere Oxidationsmittel, die eine Bildung von Schwefeltrioxid ermöglichen, sind Ozon oder Wasserstoffperoxid. Im sauren Regen gelangt sie dann in Form von verdünnter Säure auf die Erde.
Eine geringe Menge freier Schwefelsäure kommt auch in manchen vulkanischen Quellen, den sogenannten Solfataren vor.
Im Gegensatz zur freien Säure sind ihre Salze, vor allem die Sulfate, in der Natur sehr viel häufiger. Es existieren viele verschiedene Sulfat-Minerale. Zu den bekanntesten und wichtigsten zählen Gips (CaSO4 · 2 H2O), Baryt (BaSO4), Chalkanthit (CuSO4 · 5 H2O) oder Glaubersalz (Na2SO4 · 10 H2O).
Außerhalb der Erde findet sich Schwefelsäure in der oberen Atmosphäre der Venus. Diese entsteht durch photochemische Reaktionen aus Schwefeldioxid und Wasser. Es bilden sich Tröpfchen, die 80–85 % Schwefelsäure enthalten. In tieferen Schichten zersetzt sich die Säure auf Grund der hohen Temperaturen in Schwefeldioxid, Sauerstoff und Wasser, die wieder aufsteigen und Schwefelsäure bilden können.[18]
Gewinnung und Herstellung
Grundstoff für die Schwefelsäureherstellung ist häufig elementarer Schwefel, der in großen Mengen (2007: 66 Millionen Tonnen[19]) bei der Entschwefelung von Erdgas und Rohöl anfällt und nach dem Claus-Prozess aufgearbeitet oder nach dem Frasch-Verfahren abgebaut wird. Der Schwefel wird verbrannt, um Schwefeldioxid als Ausgangsstoff für die eigentliche Darstellung zu gewinnen.
Eine weitere Quelle, bei der in großen Mengen Schwefeldioxid anfällt, ist die Verhüttung schwefelhaltiger Erze. Beispiele hierfür sind die Kupfer-, Zink- oder Bleigewinnung aus den entsprechenden Sulfiden. Das Schwefeldioxid bildet sich beim Rösten mit Luftsauerstoff.
Im Jahr 1999 wurden in Europa noch drei Millionen Tonnen Pyrit zur Schwefelsäuregewinnung geröstet. In Asien liegt der Anteil von Pyrit jedoch höher.[20]

Für rohstoffarme Staaten, die weder über Schwefel noch über sulfidische Erze verfügen, kommt die Herstellung von Gipsschwefelsäure nach dem Müller-Kühne-Verfahren in Frage. Hierbei wird aus Gips und Kohle im Drehrohrofen Schwefeldioxid gewonnen. Der energieaufwendige Prozess kann rentabler gestaltet werden, wenn durch Zusatz von Sand und Ton als Nebenprodukt Zement anfällt. In der DDR wurde das Verfahren in großem Maßstab durchgeführt.[21]
Für die weitere Produktion muss aus dem Schwefeldioxid Schwefeltrioxid gewonnen werden. Die direkte Reaktion von Schwefel und Sauerstoff zu Schwefeltrioxid findet nur in zu geringem Maße statt, da das Gleichgewicht in der Reaktion von Schwefeldioxid zu Schwefeltrioxid nur bei niedrigen Temperaturen auf der Seite des Schwefeltrioxids liegt. Bei diesen Temperaturen ist jedoch die Reaktionsgeschwindigkeit zu gering. Daher muss mit Hilfe geeigneter Katalysatoren die Reaktionsführung so gesteuert werden, dass eine ausreichend schnelle Reaktion bei nicht zu hohen Temperaturen gewährleistet ist.
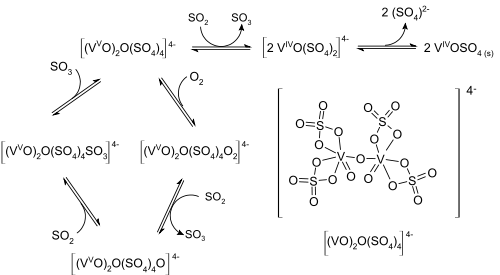
Beim ausschließlich noch angewendeten Kontaktverfahren wird Vanadiumpentoxid als sauerstoffübertragender Katalysator verwendet. Es bildet sich eine Salzschmelze aus Vanadium(V)-oxid und als Co-Katalysatoren zugesetzten Alkalimetallsulfaten. In dieser bilden sich der als eigentlicher Katalysator wirkende reaktive Komplex mit der Zusammensetzung [(VO)2O(SO4)4]4−. An diese lagern sich ohne Änderung der Oxidationszahl des Vanadiums Sauerstoff und Schwefeldioxid an und reagieren zu Schwefeltrioxid.[22]
Die Temperatur während der Reaktion muss zwischen 420 und 620 °C liegen, da bei tieferen Temperaturen der Katalysator durch Bildung von Vanadium(IV)-Verbindungen inaktiv wird und er sich bei höheren Temperaturen zersetzt.[22] Die Umsetzung wird in sogenannten Hordenkontaktöfen durchgeführt, bei denen der Katalysator in insgesamt vier Schichten (den „Horden“) übereinander angeordnet wird und das durchströmende Gas zwischen den Horden auf die passende Temperatur gekühlt wird.
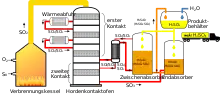
Im sogenannten Doppelkontaktverfahren wird vor der letzten Horde das vorhandene Schwefeltrioxid mit konzentrierter Schwefelsäure ausgewaschen. Dies ermöglicht eine Erhöhung der Ausbeute auf mindestens 99,8 % (Erste Allgemeine Verwaltungsvorschrift zum Bundes-Immissionsschutzgesetz, Technische Anleitung zur Reinhaltung der Luft 2002).
Nach Bildung des Schwefeltrioxids wird dieses zu Schwefelsäure umgesetzt. Dazu muss zunächst verbliebenes Schwefeldioxid mit Ammoniak oder Natriumthiosulfat entfernt werden. Da die direkte Reaktion von Schwefeltrioxid mit Wasser zu langsam ist, wird das Gas in konzentrierte Schwefelsäure geleitet. Dabei bildet sich schnell Dischwefelsäure H2S2O7. Wird diese mit Wasser verdünnt, zerfällt sie zu zwei Molekülen Schwefelsäure.
Bei diesem Verfahren entsteht keine reine Schwefelsäure, sondern konzentrierte Säure mit 98 % Säuregehalt. Um reine Schwefelsäure zu erzeugen, muss die Menge Schwefeltrioxid in die konzentrierte Säure eingeleitet werden, die der Stoffmenge des überschüssigen Wassers der konzentrierten Säure entspricht.
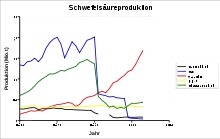
In den letzten Jahrzehnten ist die Schwefelsäureproduktion vor allem in China stark gestiegen, während in europäischen Ländern wie Deutschland die Produktion zurückgegangen ist. Seit Anfang 2000 ist China auf zusätzliche Mengen aus Europa angewiesen.[23] Die in der Graphik zu sehenden starken Umbrüche in den Jahren 1990 und 1991 sind auf die Auflösung der Sowjetunion und eine Änderung der Statistik in den Vereinigten Staaten zurückzuführen.[24]
Von erheblicher wirtschaftlicher Bedeutung bei der großindustriellen Herstellung der Schwefelsäure ist, dass die drei Einzelschritte exotherm sind (für Werte siehe bei Kontaktverfahren nach). Die freiwerdende Wärmemenge wird zur Erzeugung von Hochdruckdampf für die Stromerzeugung und für industrielle Heizzwecke verwendet.[25]
Eigenschaften
Physikalische Eigenschaften
Wasserfreie Schwefelsäure ist eine zähflüssige (durch H-Brücken vernetzte), farblose Flüssigkeit mit hoher Dichte (1,8269 g/cm³), die unterhalb von 10,371 °C erstarrt. Der Schmelzpunkt wird durch geringe Mengen von Wasser stark erniedrigt und liegt zum Beispiel für eine 98%ige Schwefelsäure bei 3,0 °C. Die häufige leicht braune Färbung von technischer Schwefelsäure beruht auf organischen Verunreinigungen, die durch Dehydratisierung verkohlt werden. Oberhalb des Siedepunktes von 279,6 °C von wasserfreier Schwefelsäure bilden sich Schwefelsäuredämpfe, die überschüssiges Schwefeltrioxid enthalten, wobei das Wasser in der siedenden Schwefelsäure verbleibt. Die wasserfreie Schwefelsäure geht so zu einer 98,33%igen Schwefelsäure mit einem konstanten Siedepunkt von 338 °C über. Bei dieser Temperatur hat auch der Dampf einen Säuregehalt von 98,33 % und entspricht damit einem azeotropen Wasser-Schwefelsäure-Gemisch. Eine Säure gleicher Zusammensetzung und gleichen Siedepunktes wird erhalten, wenn man verdünnte Säure destilliert. 100%ige Schwefelsäure lässt sich daher nicht durch Destillieren verdünnter Schwefelsäure, sondern nur durch Auflösen einer bestimmten Menge Schwefeltrioxid in konzentrierter Schwefelsäure gewinnen. Beim weiteren Erhitzen über 338 °C hinaus zersetzt sich Schwefelsäure in Wasser und Schwefeltrioxid („Abrauchen der Schwefelsäure“) und ist bei 450 °C nahezu vollständig dissoziiert.[27]
Als Feststoff kristallisiert Schwefelsäure im monoklinen Kristallsystem in der Raumgruppe C2/c (Raumgruppen-Nr. 15). Die Gitterparameter sind a = 814 pm, b = 470 pm, c = 854 pm und β = 111°.[28] Die Struktur ist eine gewellte Schichtstruktur, in der jedes Dihydrogensulfat-Tetraeder über Wasserstoffbrücken mit vier weiteren Tetraedern verbunden ist. Neben der kristallinen reinen Schwefelsäure sind mehrere Schwefelsäure-Hydrate bekannt. Ein Beispiel ist das Dihydrat H2SO4 · 2 H2O, das ebenfalls monoklin mit der Raumgruppe C2/c (Nr. 15) kristallisiert.[29] Insgesamt sind sechs verschiedene Hydrate mit einem, zwei, drei, vier, sechs und acht Äquivalenten Wasser bekannt, bei denen die Säure vollständig in Oxonium- und Sulfationen gespalten sind. Die Oxoniumionen sind je nach Hydrat mit einer unterschiedlich großen Anzahl Wassermolekülen assoziiert. Der Schmelzpunkt dieser Hydrate sinkt mit zunehmender Anzahl der Wassermoleküle. So schmilzt das Monohydrat bei 8,59 °C, während das Octahydrat schon bei −62 °C schmilzt.[25]
Zwischen den einzelnen Molekülen wirken starke Wasserstoffbrücken, die die hohe Viskosität von 24,6 mPa·s bei 25 °C[30] bedingen. Im Vergleich dazu besitzt Wasser mit 0,89 mPa·s bei 25 °C[17] eine deutlich niedrigere Viskosität.
Ähnlich wie reines Wasser leitet reine Schwefelsäure in geringem Maße elektrischen Strom. Die spezifische Leitfähigkeit beträgt 1,044 · 10−2 S/cm.[30] Der Grund hierfür liegt in der geringen Dissoziation der Säure durch Autoprotolyse. Verdünnte Säure leitet dagegen aufgrund der enthaltenen Oxoniumionen elektrischen Strom gut.
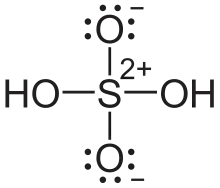

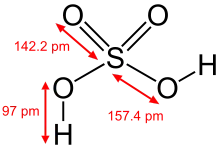
In der Gasphase liegen einzelne Schwefelsäure-Moleküle vor. Diese sind tetraedrisch aufgebaut mit Bindungswinkeln von 101,3° zwischen den OH-Gruppen und 123,3° zwischen den Sauerstoffatomen. Die Bindungslängen der Schwefel-Sauerstoff-Bindungen sind mit 157,4 pm (zu OH-Gruppen) beziehungsweise 142,2 pm (zu den Sauerstoffatomen) unterschiedlich. Die Molekülstruktur im Festkörper entspricht derjenigen in der Gasphase.[26]
Die Bindungen im Schwefelsäuremolekül können durch verschiedene mesomere Grenzstrukturen beschrieben werden. Zum Beispiel die Struktur, bei der zwischen Schwefel und Sauerstoff Doppelbindungen angenommen werden oder bei der nur Einfachbindungen und gleichzeitig eine Ladungstrennung vorliegen. In theoretischen Berechnungen hat sich gezeigt, dass die 3d-Orbitale nur sehr wenig zur Bindung beitragen. Daher wird die reale Bindungssituation im Schwefelsäuremolekül am genauesten durch diejenige Struktur beschrieben, bei der nur Einfachbindungen gezeichnet werden. Die verkürzte S–O-Bindung kann durch zusätzliche elektrostatische Wechselwirkungen zwischen den geladenen Atomen erklärt werden.[31]
Chemische Eigenschaften
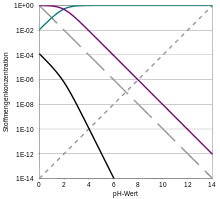
Als sehr starke Säure gibt Schwefelsäure leicht Protonen ab. Mit einem pKs-Wert von −3,0[4] (dies gilt jedoch nur für verdünnte Lösungen) oder genauer einem H0-Wert von −11,9[25] zählt Schwefelsäure in der ersten Protolysestufe zu den starken Säuren.
Sie wird üblicherweise nicht zu den Supersäuren gezählt, jedoch wird sie als Ausgangspunkt für die Definition der Supersäure gewählt: Alle Säuren, die stärker als reine Schwefelsäure sind und diese somit protonieren können, werden als Supersäuren bezeichnet.
Die zweite Protolysestufe von Hydrogensulfat zu Sulfat hat einen pKs-Wert von 1,9.[4] Das Hydrogensulfat-Ion ist daher eine nur mittelstarke Säure.
Aus diesem Grund liegt in verdünnter Schwefelsäure (Konzentration etwa 1 mol/l) zum größten Teil Hydrogensulfat vor. Das H2SO4-Molekül ist nahezu vollständig dissoziiert, während die Reaktion zum Sulfat nur in geringem Maße (etwa 1,3 % bei 1 mol/l[25]) stattfindet. Erst bei höheren Verdünnungen werden größere Mengen Sulfat gebildet.

Schwefelsäure besitzt eine hohe Affinität zu Wasser. Werden Säure und Wasser gemischt, entstehen unter starker Wärmeentwicklung verschiedene Hydrate der Form H2SO4 · n H2O (n = 1–4, 6, 8). Die starke Wasseraffinität der Schwefelsäure äußert sich ebenfalls darin, dass sie in der Lage ist, aus organischen Stoffen Hydroxygruppen und Protonen abzuspalten. Durch diesen Entzug bleibt Kohlenstoff zurück, der organische Stoff wird schwarz und verkohlt. Dieser Effekt tritt vor allem bei Stoffen auf, die viele Hydroxygruppen enthalten. Beispiele sind viele Kohlenhydrate wie Glucose oder Polysaccharide. Weiterhin kann die große Wasseraffinität für Kondensationsreaktionen verwendet werden. Hierbei wird das Wasser ohne Verkohlung einer organischen Verbindung entzogen. Ein Beispiel hierfür ist die Synthese des 2-Pyron.
Ein weiteres Indiz der starken Hygroskopizität ist, dass sich die Säure in geringem Maß selbst entwässert:
Konzentrierte Schwefelsäure wirkt oxidierend und ist in der Lage, beim Erhitzen edlere Metalle wie Kupfer, Quecksilber oder Silber zu lösen. Die Schwefelsäure wird dabei zu Schwefeldioxid reduziert. Hingegen wird sogar reines, unedles Eisen durch Passivierung von konzentrierter Schwefelsäure nicht angegriffen.
Verdünnte Schwefelsäure wirkt dagegen nur in geringem Maße oxidativ, da die Reaktion zu Schwefeldioxid durch das Lösemittel Wasser gehemmt wird. Es werden nur solche Metalle oxidiert bzw. gelöst, die als unedle Elemente durch die Reaktion von Protonen zu Wasserstoff oxidiert werden können.
Verwendung
Schwefelsäure wird in sehr großen Mengen und in vielen Bereichen eingesetzt. Ihre Produktionsmenge gilt – neben der von Chlor – als Maßstab für die industrielle Entwicklung und den Leistungsstand eines Landes. In chemischen Laboratorien zählt Schwefelsäure zu den am häufigsten benutzten Chemikalien. Neben Salzsäure und Salpetersäure ist sie eine viel verwendete starke Säure. Sie wird unter anderem zur Einstellung des pH-Wertes, als Katalysator, etwa für Veresterungen und zum Abrauchen bei Aufschlüssen genutzt. Die stark wasserziehende Wirkung der Schwefelsäure wird zur Trocknung von organischen Substanzen und Gasen in Exsikkatoren und Waschflaschen genutzt.
Je nach Konzentration wird sie unterschiedlich bezeichnet. Zwischen 10 % und 20 % heißt sie verdünnte Schwefelsäure oder Dünnsäure. Akkumulatorsäure oder Akkusäure hat eine Säurekonzentration von 33,5 %. Diese Säuren bleiben auch unter 0 °C flüssig.
Schwefelsäure mit einem Gehalt von bis etwa 70 % heißt Kammersäure, bis zu 80 % Gloversäure. Konzentrierte Schwefelsäure besitzt einen Gehalt von mindestens 98,3 % (Azeotrop).[32] Dünnsäure fällt in großen Mengen als Abfallprodukt in der Titanoxid- oder Farbstoffproduktion an.[33]
Sulfate
Der größte Teil wird in der Produktion von Sulfaten bei der Herstellung von Düngemitteln verbraucht. Mit Hilfe von Schwefelsäure werden vor allem Phosphat- und Ammoniumsulfatdünger gewonnen. Letzterer wird durch Reaktion von halbkonzentrierter Schwefelsäure mit Ammoniak dargestellt.
Bei der Produktion von Phosphatdüngern wird Schwefelsäure zum Aufschluss des Rohphosphates benötigt. Bei der Reaktion entsteht Superphosphat Ca(H2PO4)2/CaSO4

Neben Ammoniumsulfat werden auch andere Sulfate durch Umsetzung entsprechender Salze mit Schwefelsäure hergestellt. Ein Beispiel ist das aus Aluminiumhydroxid gewonnene Aluminiumsulfat, das in großen Mengen in der Papierindustrie und als Flockungsmittel in der Wasserreinigung verwendet wird.
Oleum
Schwefelsäure kann Schwefeltrioxid in beliebigen Mengen lösen. Das Gemisch bezeichnet man als Oleum (CAS-Nummer 8014-95-7) oder rauchende Schwefelsäure, da das enthaltene Schwefeltrioxid leicht aus der Lösung entweicht und mit der Luftfeuchtigkeit Nebel („Rauch“) aus verdünnter Schwefelsäure bildet. Die Konzentration des Oleum wird in Gewichts-% des in 100 %iger Schwefelsäure gelösten SO3 angegeben.[16] Mit Oleum werden in der organischen Chemie bei der Sulfonierung von Aromaten, Alkenen und Aliphaten oder bei der Sulfatierung von Hydroxyverbindungen Sulfonsäuregruppen eingefügt. Damit werden beispielsweise Tenside für die Waschmittelindustrie und Vorprodukte für die Farbstoff- und Pigmentproduktion (Buchstabensäuren) hergestellt.
Nitriersäure
Eine weitere funktionelle Gruppe, die mit Hilfe von Schwefelsäure eingeführt werden kann, ist die Nitrogruppe. Dies geschieht mit Hilfe der sogenannten Nitriersäure, einer Mischung aus Schwefel- und Salpetersäure. Verwendet wird dies vor allem zur Herstellung von Sprengstoffen, wie Trinitrotoluol oder Nitroglycerin. Auch daher zählt die EU Schwefelsäure in Gemischen mit einem Gehalt von mehr als 15 % seit 1. Februar 2021 zu den beschränkten Ausgangsstoffen für Explosivstoffe mit der Folge, dass die Verwendung, der Besitz, die Verbringung und die Abgabe durch und an Personen verboten ist, die nicht zu beruflichen oder gewerblichen Zwecken handeln; die berufliche oder gewerbliche Zweckbestimmung ist bei Verkauf zu überprüfen und verdächtige Transaktionen sind meldepflichtig.[34]
Sonstiges
Da zahlreiche Erze in Schwefelsäure löslich sind, kann sie als Aufschlussmittel eingesetzt werden. Beispiele sind das nasse Verfahren zur Zinkherstellung aus Zinkoxid und das Sulfatverfahren zur Gewinnung des Weißpigmentes Titandioxid. Mit Hilfe von Schwefelsäure können nicht nur oxidische Erze, sondern auch solche mit anderen Anionen wie Fluorid oder Phosphat aufgeschlossen werden. Bei der Reaktion entstehen dabei die entsprechenden Säuren. Dieses Verfahren ist für die Produktion von einigen technisch wichtigen Säuren relevant. Beispiele sind Flusssäure aus Fluorit, Phosphorsäure aus Apatit und Salzsäure aus Halit.
Als Batteriesäure ist Schwefelsäure ein wichtiger Bestandteil des Bleiakkumulators, wie er in Automobilen als Starterbatterie eingesetzt wird. Ebenso wie im Bleiakkumulator dient verdünnte Schwefelsäure auch in elektrolytischen Prozessen als Elektrolyt. Die Vorteile gegenüber anderen Elektrolyten liegen in der hohen Leitfähigkeit und gleichzeitig niedrigen Neigung zur Reduktion.
Biologische Bedeutung
Die in der Luft aus Schwefeldioxid entstandene Schwefelsäure ist neben der aus Stickoxiden gebildeten Salpetersäure ein Bestandteil des sauren Regens. Durch den sauren Regen kann es vor allem in schwach gepufferten Böden und Gewässern zu einem Absinken des pH-Wertes kommen. Eine Auswirkung eines niedrigeren pH-Wertes ist eine Änderung der Löslichkeit einiger Metallionen. So ist das für Pflanzen schädliche Aluminium bei niedrigerem pH-Wert besser in Wasser löslich. Ebenso können biologisch wichtige Ionen, wie Kalium oder Magnesium leichter ausgewaschen werden. Aus diesen Gründen gilt Schwefelsäure als eine mögliche Ursache des Waldsterbens in den 1980er Jahren.[35] Durch technische Maßnahmen wie die Rauchgasentschwefelung bei Kohlekraftwerken und die Einführung schwefelarmer Kraftstoffe wird in Deutschland so wenig Schwefeldioxid freigesetzt, dass das Regenwasser deutlich weniger Schwefelsäure enthält.[36]
Schwefelsäure wirkt auf Fische und andere Gewässerlebewesen auf Grund ihrer Acidität toxisch. So beträgt in weichem Wasser ohne Pufferkapazität die mittlere letale Konzentration (der LC50-Wert) für Fische 100–330 mg/l, also ähnlich wie bei anderen Mineralsäuren.[9]
In den Abraumhalden von Erzbergwerken und Braunkohletagebauen entsteht Schwefelsäure durch eine Kombination aus abiotischer und mikrobieller Oxidation freiliegender sulfidhaltiger Mineralien. Durch Regenwasser wird sie ausgewaschen und sammelt sich als saures Grubenwasser in Restseen, in denen wegen des niedrigen pH-Werts und hoher Schwermetallgehalte kaum Lebewesen zu finden sind.
Sicherheitshinweise
Schwefelsäure wirkt auf Haut und Schleimhäute stark reizend und ätzend. Sie ist in der Lage, lebendes Gewebe zu zerstören (Verätzung). Die Wirkmechanismen von konzentrierter und verdünnter Schwefelsäure sind deutlich zu unterscheiden. Bei verdünnter Schwefelsäure wirkt die erhöhte Protonenkonzentration ätzend, d. h. die Wirkung ist derjenigen anderer verdünnter Säuren ähnlich. Die Wirkung besteht bei Hautkontakt, abhängig von der Konzentration, vorwiegend in lokalen Reizungen.[3] Sie ist damit deutlich ungefährlicher als konzentrierte Schwefelsäure. Diese wirkt auf Grund ihrer stark wasserziehenden Wirkung verkohlend und schädigt schon in kleinen Mengen Haut und Augen stark. Es bilden sich nur langsam heilende, schmerzhafte Wunden.[3] Schwefelsäure kann auch über Dämpfe aus der Luft aufgenommen werden, der MAK-Wert beträgt 0,1 mg/m³[3], der LC50-Wert beträgt bei Ratten über vier Stunden inhalativ aufgenommen 510 mg/m³.[8]
Da bei der Reaktion von konzentrierter Schwefelsäure mit Wasser viel Wärme entsteht, darf sie nur durch Eingießen in Wasser und nicht durch Hinzufügen von Wasser zur Säure verdünnt werden. Wird Wasser zu Schwefelsäure hinzugegeben, kann diese spritzen und so umstehende Personen verätzen. Seit 2021 darf Schwefelsäure in einer Konzentration über 15 Gewichtsprozent nicht mehr an Privatpersonen abgegeben werden.
Nachweis
Konzentrierte Schwefelsäure wird durch die Reaktion mit organischen Substanzen nachgewiesen. Wird etwa ein Holzspan in konzentrierte Schwefelsäure getaucht, wird er langsam schwarz. Es ist möglich, durch unterschiedliche Reaktionen verdünnte und konzentrierte Schwefelsäure zu unterscheiden. Dabei wird die unterschiedliche Reaktivität der beiden Säuren mit unedlen Metallen, wie Zink oder Eisen, ausgenutzt. Während sich bei verdünnter Säure schon bei Raumtemperatur Wasserstoff bildet, reagiert die konzentrierte Säure, die fast keine freien Oxoniumionen enthält, erst beim Erwärmen unter Bildung von Schwefeldioxid und Schwefel.[37]
Da in wässriger Lösung die Schwefelsäure dissoziiert ist, lässt sie sich darin nicht direkt nachweisen. Stattdessen kann die Protonenkonzentration und damit der saure pH-Wert über geeignete Indikatoren oder mit dem pH-Meter bestimmt werden. Das Sulfation lässt sich beispielsweise durch Fällung als schwerlösliches Bariumsulfat bestimmen.[37]
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage, Wiley-VCH, Weinheim, 1988, ISBN 3-527-26169-9.
- Ralf Steudel, David Scheschkewitz: Chemistry of the Non-Metals. Walter de Gruyter, Berlin/Boston, 2020, ISBN 978-3-11-057805-8.
- Eintrag zu Schwefelsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- Hermann Müller: Sulfuric Acid and Sulfur Trioxide. In: Ullmann’s Encyclopedia of Industrial Chemistry, 4. Auflage, Wiley-VCH, 1984, doi:10.1002/14356007.a25_635
- Fritz Ullmann: Enzyclopädie der Technischen Chemie. Ausgabe 1922
- Verzeichnis der weltweit installierten Anlagen
Weblinks
Einzelnachweise
- Eintrag zu E 513: Sulphuric acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu SULFURIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. August 2020.
- Eintrag zu Schwefelsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- R. Williams: pKa Data. In: chem.wisc.edu (PDF; 645 kB).
- Organic Chemistry Michigan State University
- Eintrag zu Sulphuric acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7664-93-9 bzw. Schwefelsäure), abgerufen am 2. November 2015.
- Datenblatt 96%ige Schwefelsäure (PDF) bei Carl Roth, abgerufen am 23. April 2010.
- Eintrag zu Schwefelsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- Global Sulfuric Acid Production Surpassed 230.7 Million Tonnes in 2012 – Merchant Research & Consulting, Ltd. In: mcgroup.co.uk. Abgerufen am 7. November 2021.
- Schwefelsäure in: Meyers Großes Konversations-Lexikon. Leipzig 1905–1909, Band 18, S. 160–163.
- Claus Priesner: Johann Christian Bernhardt und die Vitriolsäure, in: Chemie in unserer Zeit, 1982, 16, 5, S. 149–159; doi:10.1002/ciuz.19820160504.
- Walter Jansen: Zum Gedenken: Johann Rudolph Glauber, in: Chemikon, 2004, 11, 3, S. 155; doi:10.1002/ckon.200490022.
- Barbara Winter-Werner: Die Wiege der Schweizer Chemie war in Winterthur. Platform Chemistry, Akademie der Naturwissenschaften Schweiz. 12/2009, S. 8–9.
- William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5.
- Hermann Müller: Sulfuric Acid and Sulfur Trioxide, in: Ullmann’s Encyclopedia of Industrial Chemistry, 4. Auflage, 1984, doi:10.1002/14356007.a25_635.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, 1988, ISBN 3-527-26169-9.
- V. A. Krasnopolsky, V. A. Parshev: Chemical composition of the atmosphere of Venus, in: Nature, 1981, 292, S. 610–613; doi:10.1038/292610a0.
- U.S. Geological Survey, Mineral Commodity Summaries: Sulfur, January 2008 (PDF; 85 kB)
- E. R. Riegel und J. A. Kent: Riegel's Handbook of Industrial Chemistry. Springer 2003. ISBN 0-306-47411-5, S. 503.
- Hans Kühne: Entwicklung des Gips-Schwefelsäure-Verfahrens nach Müller-Kühne. In: Chemie Ingenieur Technik – CIT. Band 21, Nr. 11-12, Juni 1949, S. 227–229, doi:10.1002/cite.330211105.
- O.B. Lapina, B.S. Bal'zhinimaev, S. Boghosian, K.M. Eriksen, R. Fehrmann: Progress on the mechanistic understanding of SO2 oxidation catalysts, in: Catalysis Today, 1999, 51, S. 469–479, doi:10.1016/S0920-5861(99)00034-6.
- Zusätzlicher Bedarf in China
- Industrial Commodity Statistics Yearbook der United Nations Statistics Division (Memento vom 7. April 2013 im Internet Archive)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Robert L. Kuczkowski, R. D. Suenram, und Frank J. Lovas: Microwave Spectrum, Structure, and Dipole Moment of Sulfuric Acid, in: J. Am. Chem. Soc., 1981, 103, S. 2561–2566; doi:10.1021/ja00400a013.
- A. F. Holleman: Lehrbuch der anorganischen Chemie. Walter de Gruyter GmbH & Co KG, 2019, ISBN 978-3-11-083817-6, S. 511 (eingeschränkte Vorschau in der Google-Buchsuche).
- C. Pascard-Billy: Structure Précise de l'Acide Sulfurique, in: Acta Cryst., 1965, 18, S. 827–829; doi:10.1107/S0365110X65002037.
- Inger Taesler, Ivar Olovsson: Hydrogen Bond Studies. XXXVII. The Crystal Structure of Sulfuric Acid Dihydrate (H3O+)2SO42−, in: J. Chem. Phys., 1969, 51, S. 4213; doi:10.1063/1.1671781.
- Th. M. Klapötke, I. C. Tornieporth-Oetting: Nichtmetallchemie, Wiley-VCH, Weinheim, 1994, ISBN 3-527-29052-4.
- Thorsten Stefan and Rudolf Janoschek: How relevant are S=O and P=O Double Bonds for the Description of the Acid Molecules H2SO3, H2SO4, and H3PO4, respectively? in: J. Mol. Model., 2000, 6, S. 282–288 doi:10.1007/PL00010730
- Hans Breuer: Allgemeine und anorganische Chemie. dtv-Atlas Chemie. Bd. 1. dtv, München 2000 (9. Aufl.), ISBN 3-423-03217-0.
- Dünnsäure. (Memento vom 21. Januar 2012 im Internet Archive) In: Umweltlexikon-online.de
- Art. 5 der Verordnung (EU) 2019/1148 des Europäischen Parlaments und des Rates vom 20. Juni 2019 über die Vermarktung und Verwendung von Ausgangsstoffen für Explosivstoffe mit Anhang I, Inkrafttreten Art. 23, Prüfungs- und Meldepflichten der Wirtschaftsteilnehmer und Online-Marktplätze Art. 8 und 9. In Deutschland sind Verstöße gegen das Besitz-, Verwendungs- und Anwendungsverbot nach § 13 Ausgangsstoffgesetz strafbar.
- Saurer Regen. (Memento vom 11. Juni 2012 im Internet Archive) In: Umweltlexikon-online.de, Stand 8. Mai 2001.
- Boden – Einträge aus der Atmosphäre. (Memento vom 9. Oktober 2010 im Internet Archive) In: Umweltbundesamt, Stand 2. April 2008.
- Jander, Blasius: Einführung in das anorganisch-chemische Praktikum, 14. Aufl., S. Hirzel Verlag, Leipzig 1995, ISBN 3-7776-0672-3.

