Diallyldisulfid
Diallyldisulfid (DADS), eine chemische Verbindung aus der Gruppe der organischen Disulfide, ist eine übelriechende gelbliche Flüssigkeit, die in Wasser unlöslich ist. Es entsteht bei der Zersetzung von Allicin, welches beim Anschneiden von Knoblauch und anderen Pflanzen der Familie der Lauchgewächse (Alliaceae) freigesetzt wird. Dem Diallyldisulfid sind viele der gesundheitsfördernden Wirkungen des Knoblauchs zuzuschreiben, aber auch die allergieauslösende Wirkung. Stark verdünnt wird es als Aromastoff in der Lebensmittelindustrie verwendet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Diallyldisulfid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C6H10S2 | |||||||||||||||
| Kurzbeschreibung |
gelbliche klare Flüssigkeit mit intensivem Knoblauchgeruch[2][3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 146,28 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,0 g·cm−3[4] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Im Jahr 1844 fand Theodor Wertheim die Anwesenheit der von ihm benannten Allylgruppe und von Schwefel in Knoblauchöl, das er durch Wasserdampfdestillation direkt aus Knoblauch erhielt. Aber erst 1892 konnte Friedrich Wilhelm Semmler das Diallyldisulfid als eine der Komponenten des Öls identifizieren. Die Vorstufe Allicin wurde 1944 von Chester J. Cavallito und John Hays Bailey als übelriechende, leichtzersetzliche gelbe Flüssigkeit entdeckt.[7] 1947 fanden Arthur Stoll und Ewald Seebeck, dass DADS und Allicin durch das Enzym Alliinase in situ aus Cysteinderivaten produziert werden.[8]
Vorkommen
Diallyldisulfid entsteht durch Zersetzung aus Allicin, welches bei der Verletzung von Zellen der Lauchgewächse (besonders Knoblauch, Zwiebel und Porree) aus Alliin, mithilfe des Enzyms Alliinase, freigesetzt wird. Der höchste Gehalt an DADS konnte bei der Wasserdampfdestillation von Knoblauchknollen festgestellt werden; hier macht DADS etwa ein Viertel der schwefelhaltigen Fraktion aus, die etwa zwei Gewichtsprozent in der Pflanze einnimmt. Aber auch die Blätter des Knoblauchs sind eine Quelle für die Substanz; deren Öl, das etwa 0,06 Prozent des ungetrockneten Pflanzenmaterials ausmacht, enthält etwa ein Drittel Diallyldisulfid.[9][10]
Gewinnung und Darstellung
Diallyldisulfid kann großtechnisch aus Natriumdisulfid und Allylchlorid oder -bromid bei Temperaturen zwischen 40 und 60 °C unter Inertgas dargestellt werden, wobei das Natriumdisulfid in situ aus Natriumsulfid und Schwefel erzeugt wird. Die Reaktion verläuft exotherm und eine Ausbeute von 88 Prozent des theoretisch Möglichen wurde erreicht.[11]
In kleineren Mengen kann die Synthese an der Luft auch katalytisch mithilfe TBAB aus denselben Ausgangsmaterialien erfolgen; die Ausbeute beträgt hier bis zu 82 Prozent.[12]
Sowohl bei der Synthese als auch bei der Extraktion aus Pflanzenmaterial ist das Hauptproblem für die Reindarstellung die Verunreinigung mit Diallylpolysulfiden. Da das Gemisch schwer zu trennen ist, ist im Handel üblicherweise nur 80%iges Diallyldisulfid zu bekommen. Dieses kann durch Destillation bei Unterdruck aufgereinigt werden, bei sorgfältiger Arbeit erhält man eine klare (nicht gelbliche) Flüssigkeit mit charakteristischem Knoblauchgeruch.
Die Reduktion von Allicin zu Diallyldisulfid findet besonders schnell im Reinzustand oberhalb 37 °C statt. In wässrigen Lösungen bei einem pH-Wert zwischen 1,2 und 7,5 waren nach fünf Stunden bei dieser Temperatur erst 10 Prozent des Allicin umgesetzt. Im Blut sind bereits nach fünf Minuten nur noch Spuren von Allicin nachweisbar.[13]
Eigenschaften
Physikalische Eigenschaften
DADS riecht intensiv nach Knoblauch mit einer metallischen Note. Die klare gelbliche Flüssigkeit kocht bei 138–139 °C (gilt für die 80-prozentige Rohsubstanz), hat ihren Flammpunkt bei 50 °C, eine Dichte von etwa 1,0 g/ml und weist einen Dampfdruck von 1 mm Hg bei 20 °C auf. Die gute Fettlöslichkeit und die Unlöslichkeit in Wasser erklärt sich durch die fehlende Polarität des Moleküls.[2][4]
Chemische Reaktionen
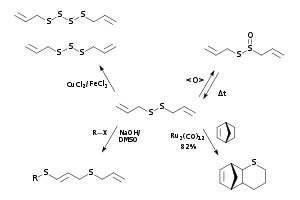
Siehe Abbildung rechts:
- Diallyldisulfid kann zu Allicin oxidiert werden, aus dem es durch Dissoziation entsteht.
- Katalytische Reaktion zu Diallylpolysulfiden.
- Addition an Alkylhalogenide führt zu 1-Alkylthio-3-allylthio-1-propenen und 1,3-di(alkylthio)propenen.[14]
- DADS ist möglicher Teilnehmer an Rutheniumkomplex-katalysierten Cyclisierungsreaktionen, die zu schwefelhaltigen Hetero-Polycyclen führen.[15]
Verwendung
DADS kann als Ausgangspunkt zur Synthese höherer Diallylpolysulfide verwendet werden; es wird dazu mit Eisenchlorid/Kupferchlorid katalysiert. Ebenso dient es als Ausgangsprodukt zur Neusynthese von Allicin; da dieses unstabil ist, wird es kurz vor der Verwendung (zum Beispiel für die Ajoensynthese) erzeugt. Die Nahrungsmittelindustrie benutzt DADS zur Verbesserung des Geschmacks von Fleisch, Gemüse und Früchten.[2][16]
Biologische Bedeutung
Der Wirkungsbereich von Diallyldisulfid in biologischen Systemen umfasst mehrere Gebiete, wobei in geringster Konzentration zunächst ein spezieller Ionenkanal aktiviert wird, was beim Menschen für den charakteristischen Geruch und Geschmack des Stoffes sorgt. Innerhalb der Zellen sind Eingriffe in das Entgiftungssystem die hauptsächlichen Reaktionen. Außerdem gibt es Hinweise auf spezifische Wirkungsmechanismen innerhalb von Krebszellen.
Bei Verzehr entsteht im Magen teilweise Schwefelwasserstoff. Gleichzeitig wird Diallyldisulfid in der Leber zu anderen biologisch wirksamen Substanzen verstoffwechselt, unter anderem zu Allylmethylsulfoxid (AMSO), Allylmethylsulfon (AMSO(2)) und Allylmethylsulfid (AMS), und es wird zu Allicin zurückoxidiert. Das Abbauprodukt AMS ist dasjenige, das für den späteren Gehalt von Aceton im Atem, und damit einen Teil des Mundgeruchs sorgt. Teilweise (bis 3 Stunden nach Verzehr) ist es aber auch DADS selbst, das im Atem wahrnehmbar ist.[17][18][19][20]
Geruch und Geschmack
Die Ursache für das unangenehme Geruchsempfinden und die geschmackliche Schärfe, die von vielen Lebewesen bei der Anwesenheit von DADS wahrgenommen werden, ist TRPA1. Dieser Ionenkanal ist entwicklungsbiologisch bedeutsam und bereits bei Pilzen zu finden. Die Lauchgewächse haben offensichtlich bereits früh auf die Wirkung des Diallyldisulfid auf TRPA1 selektiert, um sich vor Invasivfeinden wie Pilzen und später Fraßfeinden wie Tieren zu schützen.[21][22]
Umgekehrt lässt sich der Knoblauchgeschmack und -geruch von Nahrungsmittelzubereitungen durch das Hinzufügen spezieller Nahrungsmittel wie Kiwi, Spinat, Petersilie, Basilikum, Speisepilze und insbesondere Kuhmilch, rohe Hühnereier, gekochter Reis und Serum-Albumin vom Rind neutralisieren. Die Reaktion betrifft dabei das Diallyldisulfid und ist im Fall von Spinat und Spargel enzymatisch.[23]
Entgiftung und Vergiftung
Aus den Eingriffen in das Zellentgiftungssystem leiten sich viele der Wirkungen von Diallyldisulfid, insbesondere die antimikrobielle, die mutationshemmende, die krebsverhindernde und -hemmende Wirkung, und der Schutz vor Herz-Kreislauf-Erkrankungen ab.
Der Hauptangriffspunkt von Diallyldisulfid ist der ‚Phase II‘ genannte Teil des Entgiftungsmechanismus der Zelle.
Besonders erwähnenswert ist dabei die Rolle bei der Entgiftung mithilfe des GSH/GST-Systems: DADS erhöht signifikant die Produktion des Enzyms Glutathion-S-Transferase (GST) in Zellen. Dieses vermittelt normalerweise die Bindung von Glutathion (GSH) an elektrophile Giftstoffe in der Zelle. Knoblauch unterstützt daher einerseits zum Beispiel die Entgiftungsfunktion von Leberzellen in vitro und schützt Nervenzellen vor oxidativem Stress in vitro. Gleichzeitig reagiert DADS direkt und dosisabhängig mit GSH (zu Allylglutathionsulfid), was in Zellen, die größeren Mengen DADS ausgesetzt sind, dazu führt, dass nun genau umgekehrt vermehrt reaktive Sauerstoffspezies entstehen, die ultimativ den Zelltod zur Folge haben (sogenannter oxidativer Stress). Hohe Dosen DADS können also zum Beispiel bei Mäuse-Nervenzellen in vitro die Schutzwirkung zunichtemachen und das Gegenteil bewirken.[18][24][25][26][27][28][29][30]
Dass der Entgiftungseffekt auch präventiv wirkt und im Darm Entzündungssymptome verhindern kann, wurde an einer Studie sichtbar, bei der Ratten nach längerer Einnahme von DADS mit Endotoxin behandelt wurden und danach vor der Schädigung der Darmzellen durch das Gift geschützt waren. Diese Studie machte auch deutlich, dass gewisse Nebenwirkungen von Knoblauchöl in hoher Dosierung nicht dem Diallyldisulfid zuzuschreiben sind.[31]
Durch Unterstützung der Entgiftungsaktivität in der Leber bietet sich Diallyldisulfid theoretisch als Leberschutz während der Chemotherapie an. Als Polysulfid ist es Substrat für Cyanidionen und daher theoretisch direkt und indirekt für die Cyanidentgiftung geeignet.[32][33] Untersuchungen am Menschen gibt es dazu nicht.
Antimikrobielle Wirkung
Die bei der Zerstörung von Pflanzenzellen freiwerdenden organischen Schwefelverbindungen haben durch ihre antimikrobiellen, sowie insektenabweisenden und larviziden Eigenschaften für die Lauchgewächse einen großen Nutzen. Der Mensch macht sich diese Eigenschaften seit Jahrtausenden zu eigen.[34]
DADS ist das wirksame Prinzip von Knoblauchöl bei der Hemmung des Wachstums von Schimmelpilzen, grampositiven und -negativen Bakterienstämmen. Gegen den Magengeschwür-Keim Helicobacter pylori scheinen allerdings das Allicin und die höherwertigen Polysulfide im Knoblauch noch wirksamer.[35][36] In einem Diabetes-Modell bei Mäusen konnte nach systemischer Infektion mit MRSA durch mehrfache Diallyldisulfidgabe mehrere Infektionsmarker (CRP, TNF, IL-6) normalisiert werden.[37] Im Rattenmodell von Pneumocystis jirovecii-Infektionen kann DADS Cotrimoxazol bei gleicher Effizienz ersetzen.[38] Beim Hefepilz Candida schließlich führt DADS zu oxidativem Stress und Zelltod durch Erzeugung von Glutathionmangel, Block der Elektronentransportkette und der mitochondrialen ATP-Synthase. Die antifungalen Wirkungen waren in einer retrospektiven Beobachtungsstudie die mutmaßliche Ursache für signifikant verringertes Risiko von beatmeten Intensivpatienten, an Pilzinfektionen der unteren Atemwege zu erkranken.[27][39]
Aufgrund der antimikrobiellen Wirkungen ist Diallyldisulfid zusammen mit Tobramycin Bestandteil einer Zubereitungen für die präoperative selektive Darm-Dekontamination. In einer klinischen Studie konnte deren Nutzen zur Verhinderung von Endotoxämie bei Herzklappen-Operationen nachgewiesen werden.[40]
Schutz vor Darmkrebs
Knoblauch kann im Labormodell die Entstehung von Darmkrebs verhindern.[41] In verschiedenen Studien wurde die Vermutung erhärtet, dass Diallyldisulfid einer der Knoblauchbestandteile ist, die eine Rolle bei der Krebsverhinderung und -hemmung spielen können, und zwar durch Eingriff auf mehreren Ebenen des Zellstoffwechsels. Diese Wirkungen sind meist dosisabhängig und diese Dosisabhängigkeit erklärt, warum in vivo beim Verzehr von Knoblauch vor allem Darmkrebszellen betroffen sind. Durch Injektion der Substanz dagegen können auch Leukämiezellen erreicht werden, wie im Mausmodell gezeigt werden konnte.[42][43]
Die Wirkungsweise von DADS auf Krebszellen unterscheidet sich von der auf normale Zellen: Krebszellen sind wesentlich empfindlicher auf die Substanz und leiten schneller den Zelltod ein.[44] DADS führt außerdem dosisabhängig zu einer plötzlichen starken Anhäufung reaktiver Sauerstoffspezies und damit, und durch Aktivierung weiterer Enzyme, zum Start des Apoptose-Programms von Krebszellen. Dieser Effekt kann allerdings, wie an einer Zelllinie demonstriert werden konnte, durch eine erhöhte Glutathion-Menge und Produktion von Glutathionperoxidase in den Zellen verhindert werden.[45][46] Durch Acetylierung von Histonen in Krebszellen kann DADS zudem dosisabhängig das Tumorwachstum und die -ausbreitung verhindern. Dies konnte sowohl an Darmkrebs- als auch an Leukämiezellen bei Ratten in vivo gezeigt werden.[47][48][49] Schließlich konnte gezeigt werden, dass die Substanz direkt in den Zellzyklus von menschlichen Darmkrebszellen eingreift.[50] Krebs wird unter anderem durch die Anhäufung reaktiver Sauerstoffspezies in der Zelle verursacht, wenn die üblichen Entgiftungsmechanismen der Zelle nicht mehr ausreichen. Diallyldisulfid beeinflusst den Teil des Zellstoffwechsels, der für die Entgiftung der Zelle sorgt und hilft, in geringer Menge, bei der Entgiftung, und damit bei der Verhinderung von Krebs (s. Entgiftung und Vergiftung).
Schutz vor Herz-Kreislauf-Erkrankungen
Es gibt Hinweise darauf, dass Knoblauch die Entstehung von Herz-/Kreislauferkrankungen verhindern kann. Eine mögliche Ursache für manche dieser Krankheiten, wie zum Beispiel Arteriosklerose oder Koronare Herzkrankheit, ist oxidativer Stress, welcher von Diallyldisulfid durch Hilfe bei der Entgiftung der Zelle verringert wird. DADS ist daher für die genannten Wirkungen des Knoblauchs mitverantwortlich. Dies ist aber nicht der einzige Wirkmechanismus der Substanz.[8]
Diallyldisulfid verringerte in einer klinischen Studie die Surrogatmarker atherosklerotische Plaques und CRP.[51] Die Literatur zum Thema Diallyldisulfid und Blutfettwerte allgemein ist allerdings widersprüchlich.
Durch Aktivierung des TRP-Ionenkanals TRPA1 führt DADS zu einer kurzfristigen Erniedrigung des Blutdrucks.[21]
Sonstige Wirkungen
DADS aktiviert das Transportprotein Ferritin im Eisen-Stoffwechsel, wie in vivo an Ratten gezeigt werden konnte.[52]
In einem anderen Tierversuch erhöhte sich bei Ratten, die eine stark proteinhaltige Diät bekamen, durch Zufütterung von Knoblauchpulver der Testosteronspiegel. Gleichzeitig sank der Plasmagehalt an Corticosteron. Eine signifikante Erhöhung von Luteinisierendem Hormon durch Diallyldisulfid stellt wahrscheinlich die Ursache dar.[53]
Sicherheitshinweise
DADS ist hautreizend und allergieauslösend, insbesondere ist es die Ursache für Knoblauch- und Zwiebelallergie bei Köchen, bei denen sie zumeist an den Fingerspitzen auftritt. Schutzhandschuhe können dies nicht verhindern.[54]
Für Diallyldisulfid gibt es bei Ratten einen oralen LD50-Wert von 260 mg/kg bzw. den Wert von 3.600 mg/kg bei dermaler Aufnahme. In hohen Dosen von 5 g/kg auf die Haut von Katzen gebracht, wirkte es tödlich durch hämolytische Anämie. Im Zusammenhang damit gibt es Berichte über Vergiftungen bei Haustieren und Ratten durch große Mengen Knoblauch.[2][55]
Nachweis
Bereits Spuren von DADS in der Luft oder im Blut können problemlos gaschromatografisch nachgewiesen werden.[56][57]
Weblinks
- Organosulfur Compounds From Garlic (Memento vom 12. Februar 2008 im Internet Archive)
- Spiegel Online: Knoblauch soll Campylobacter besiegen
Einzelnachweise
- Eintrag zu DIALLYLDISULPHIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- Datenblatt Allyldisulfide bei The Good Scents Company.
- Eintrag zu Diallyldisulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Datenblatt Allyl disulfide bei Sigma-Aldrich, abgerufen am 24. März 2011 (PDF).
- Nishimura, H.; Mizutani, J.: Photochemistry and radiation chemistry of sulfur-containing amino acids. New reaction of the 1-propenylthiyl radicals in J. Org. Chem. 40 (1975), 1567–1575, doi:10.1021/jo00899a011.
- Higuchi, O.; Tateshita, K.; Nishimura, H.: in J. Agric. Food Chem. 51 (2003), 7208-7214.
- Chester J. Cavallito, John Hays Bailey: Allicin, the Antibacterial Principle of Allium sativum. I. Isolation, Physical Properties and Antibacterial Action. In: Journal of the American Chemical Society. 66, 1944, S. 1950, doi:10.1021/ja01239a048.
- Arthur Stoll, Ewald Seebeck: Chemical Investigations on Alliin, the Specific Principle of Garlic. In: Advanced Enzymology. 11, 1951, S. 377–400. doi:10.1002/9780470122563.ch8.
- L. D. Lawson et al.: Identification and HPLC Quantitation of the Sulfides and Dialk(en)yl Thiosulfinates in Commercial Garlic Products. In: Planta Med 57/- 1991, S. 363–370. doi:10.1055/s-2006-960119
- A. E. Edrois und H. M. Fadel: Investigation of the volatile aroma components of garlic leaves essential oil. Possibility of utilization to enrich garlic bulb oil. European Food Research and Technology. 214/2 2002, S. 105–107. doi:10.1007/s00217-001-0429-2
- Patent WO2006016881: Process for Producing Diallyl Disulfide. Veröffentlicht am 16. Februar 2006, Erfinder: John R. Maloney, Kevin J. Theriot, Sharon Booth D. McGee, James E. Torres, Woodrow R. Wilson Jr..
- Yuan Xin-ke et al.: Synthesis, characterization and bioactivity evaluation of diallyl disulfide. J. of Central South University of Technology. 13/5 2006, S. 515–518. doi:10.1007/s11771-006-0079-4
- F. Freeman und Y. Kodera: Garlic Chemistry: Stability of S-2-Propenyl-2-Propene-1-sulfinothioate (Allicin) in Blood, Solvents, and Simulated Physiological Fluids. J Agric Food Chem. 43 1995, S. 2332–2338, doi:10.1021/jf00057a004.
- Amosova S. V. et al.: Synthesis of 1-alkylthio-3-allylthio-1-propenes by the reaction of diallyl disulfide with allyl halides in the alkali-metal hydroxide-DMSO superbasic system. J. Org. Chem. USSR (Engl. Transl.) 22/5 1986, S. 957–963, doi:10.1002/chin.198636161 (Abstract).
- Kondo T. et al.: Ruthenium Complex-Catalyzed Novel Addition-Cyclization Reaction of Allylic Disulfides with 2-Norbornenes. Nippon Kagakkai Koen Yokoshu. 76/2 1999, S. 922 ff. Abstract
- Patent US5231114: Polysulfides compounds and lipid peroxidation inhibitor containing the polysulfide compounds as active ingredient. Veröffentlicht am 27. Juli 1993, Erfinder: Shoji Awazu, Toshiharu Horie, Yukihiro Kodera, Shinji Nagae, Hiromichi Matsuura, Yoichi Itakura.
- E. Germain et al.: In vivo metabolism of diallyl disulphide in the rat: identification of two new metabolites. Xenobiotica. 32/12 2002, S. 1127–1138. PMID 12593760
- E. Germain et al.: Hepatic metabolism of diallyl disulphide in rat and man. Xenobiotica. 33/12 2003, S. 1185–1199. PMID 14742141
- D. L. Lawson und Z. J. Wang: Allicin and allicin-derived garlic compounds increase breath acetone through allyl methyl sulfide: use in measuring allicin bioavailability. J Agric Food Chem. 53/6 2005, S. 1974–1983. PMID 15769123.
- Atta ur Raman: Studies in Natural Products Chemistry. Bioactive Natural Products, Part D. Elsevier Science, 2000. ISBN 0-444-50606-3, S. 466 ff.
- D. M. Bautista et al.: Pungent products from garlic activate the sensory ion channel TRPA1. Proc Natl Acad Sci U S A. 102/34 2005, S. 12248–12252, doi:10.1073/pnas.0505356102 (freier Volltext).
- A. G. Hile et al.: Aversion of European starlings (Sturnus vulgaris) to garlic oil treated granules: Garlic oil as an avian repellent. J Agric Food Chem. 52/8 2004, S. 2192–2196. PMID 15080619
- O. Negishi et al.: Effects of food materials on removal of Allium-specific volatile sulfur compounds. J Agric Food Chem. 50/13 2002, S. 3856–3861. PMID 12059171
- C. W. Tsai et al.: Garlic organosulfur compounds upregulate the expression of the pi class of glutathione S-transferase in rat primary hepatocytes. J Nutr. 135/11 2005, S. 2560–2565. PMID 16251611
- C. C. Wu et al.: Differential effects of garlic oil and its three major organosulfur components on the hepatic detoxification system in rats. J Agric Food Chem. 50/2 2002, S. 378–383. PMID 11782211
- T. Fukao et al.: The effects of allyl sulfides on the induction of phase II detoxification enzymes and liver injury by carbon tetrachloride. Food Chem Toxicol. 42/5 2004, S. 743–749. PMID 15046820.
- K. M. Lemar et al.: Diallyl disulphide depletes glutathione in Candida albicans: oxidative stress-mediated cell death studied by two-photon microscopy. Yeast. 24/8 2007, S. 695–706. PMID 17534841.
- Y. Hu et al.: Glutathione- and thioredoxin-related enzymes are modulated by sulfur-containing chemopreventive agents. Biol Chem. 388/10 2007, S. 1069–1081. PMID 17937621.
- S. H. Koh et al.: Protective effect of diallyl disulfide on oxidative stress-injured neuronally differentiated PC12 cells. Brain Res Mol Brain Res. 133/2 2005, S. 176–186. PMID 15710234
- Kim J. G. et al.: Differential effects of diallyl disulfide on neuronal cells depend on its concentration. In: Toxicology. 211/1-2 2005, S. 86–96. PMID 15863251
- Y. H. Chiang et al.: Effects of garlic oil and two of its major organosulfur compounds, diallyl disulfide and diallyl trisulfide, on intestinal damage in rats injected with endotoxin. In: Toxicol Appl Pharmacol. 213/1 2006, S. 46–54. PMID 16274720
- M. Iciek et al.: Selective effects of diallyl disulfide, a sulfane sulfur precursor, in the liver and Ehrlich ascites tumor cells. In: Eur. J. Pharmacol. 569/1-2 2007, S. 1–7. PMID 17560567.
- M. Iciek et al.: Allyl disulfide as donor and cyanide as acceptor of sulfane sulfur in the mouse tissues. In: Pharmacol Rep. 57/2 2005, S. 212–218. PMID 15886420
- S. V Amonkar und A. Banerji: Isolation and characterization of larvicidal principle of garlic. Science. 174/16 1971, S. 1343–1344. PMID 5135721
- Avato P et al.: Allylsulfide constituents of garlic volatile oil as antimicrobial agents. Phytomedicine. 7/3 2000, S. 239–243. PMID 11185736
- E. A. O'Gara et al.: Activities of garlic oil, garlic powder, and their diallyl constituents against Helicobacter pylori. Appl Environ Microbiol. 66/5 2000, S. 2269–2273. PMID 10788416
- S. M. Tsao et al.: Two diallyl sulphides derived from garlic inhibit meticillin-resistant Staphylococcus aureus infection in diabetic mice. J Med Microbiol. 56/6 2007, S. 803–808. PMID 17510266
- Lu Z. M. et al.: [The experimental study of garlicin in treating Pneumocystis carinii pneumonia in rats]. Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. (Chinese journal of parasitology & parasitic diseases). 22/6 2004, S. 357–360. PMID 15830863
- J. Guan et al.: [Preventive effect and clinical significance of garlicin injection on mechanical ventilator-associated low respiratory tract deep-seated fungal infection]. Zhongguo Zhong Xi Yi Jie He Za Zhi (Chin. Zeitschr. für Alternativmedizin). 24/6 2004, S. 505–507. PMID 15250201
- J. Yu et al.: Effects of preoperatively selected gut decontamination on cardiopulmonary bypass-induced endotoxemia. Chin. J. Traumatol. 10/3 2007, S. 131–137. PMID 17535634
- World Cancer Research Fund/American Institute for Cancer Research: Food, Nutrition,Physical Activity,and the Prevention of Cancer. 2. Auflage, 2007 (ISBN 0-9722522-2-3) S. 93–94
- John A. Milner: Preclinical Perspectives on Garlic and Cancer. J. Nutr. 136/- 2006, S. 827S-831S. Online-Version
- J. S. Yang et al.: Diallyl disulfide inhibits WEHI-3 leukemia cells in vivo. Anticancer Res. 26/1A 2006, S. 219–225. PMID 16475702
- Z. Huang et al.: Bcl-2 small interfering RNA sensitizes cisplatin-resistant human lung adenocarcinoma A549/DDP cell to cisplatin and diallyl disulfide. Acta Biochim Biophys Sin (Shanghai). 39/11 2007, S. 835–843. PMID 17989874
- A. Das et al.: Garlic compounds generate reactive oxygen species leading to activation of stress kinases and cysteine proteases for apoptosis in human glioblastoma T98G and U87MG cells. Cancer 110/5 2007, S. 1083–1095. PMID 17647244.
- G. Filomeni et al.: Glutathione-related systems and modulation of extracellular signal-regulated kinases are involved in the resistance of AGS adenocarcinoma gastric cells to diallyl disulfide-induced apoptosis. Cancer Res. 65/24 2005, S. 11735–11742, PMID 16357186.
- M. C. Myzak und R. H. Dashwood: Histone deacetylases as targets for dietary cancer preventive agents: lessons learned with butyrate, diallyl disulfide, and sulforaphane. Curr Drug Targets. 7/4 2006, S. 443–452. PMID 16611031
- N. Druesne-Pecollo et al.: In vivo treatment by diallyl disulfide increases histone acetylation in rat colonocytes. 354/1 2007, S. 140–147. PMID 17210128
- Jie Zhao et al.: Diallyl disulfide suppresses growth of HL-60 cell through increasing histone acetylation and p21WAF1 expression in vivo and in vitro. In: Acta Pharmacologica Sinica 27/11 2006, S. 1459–1466. doi:10.1111/j.1745-7254.2006.00433.x
- H. J. Jo et al.: Diallyl disulfide induces reversible G2/M phase arrest on a p53-independent mechanism in human colon cancer HCT-116 cells. Oncol. Rep. 19/1 2008, S. 275–280. PMID 18097607
- W. L. Cheng et al.: Clinical study on effect of Garlicin in stabilizing the carotid artery atherosclerotic plaque in patients with primary hypertension and coronary artery disease. Chin J Integr Med. 12/3 2006, S. 166–170. PMID 17005074.
- M. Thomas et al.: Diallyl Disulfide Increases Rat H-Ferritin, L-Ferritin and Transferrin Receptor Genes In Vitro in Hepatic Cells and In Vivo in Liver. J. Nutr. 132/- 2002, S. 3638–3641. Online-Version
- Y. Oi et al.: Garlic supplementation increases testicular testosterone and decreases plasma corticosterone in rats fed a high protein diet. J Nutr. 131/8 2001, S. 2150–2156. PMID 11481410
- M. Moyle et al.: Use of gloves in protection from diallyl disulphide allergy. In: Australasian Journal of Dermatology. 45/4 2004, S. 223–225. PMID 15527433.
- EPA Unterlagen
- Unterlagen des U.S. Department of Labor Occupational Safety & Health
- X. Sun et al.: Simultaneous determination of diallyl trisulfide and diallyl disulfide in rat blood by gas chromatography with electron-capture detection. Pharmazie 61/12 2006, S. 985. PMID 17283653.

