Zink
Zink ist ein chemisches Element mit dem Elementsymbol Zn und der Ordnungszahl 30. Zink wird zu den Übergangsmetallen gezählt, nimmt aber darin eine Sonderstellung ein, da es wegen der abgeschlossenen d-Schale in seinen Eigenschaften eher den Erdalkalimetallen ähnelt. Nach der veralteten Zählung wird die Zinkgruppe als 2. Nebengruppe bezeichnet (analog zu den Erdalkalimetallen als 2. Hauptgruppe), nach der aktuellen IUPAC-Nomenklatur bildet Zink mit Cadmium, Quecksilber und dem ausschließlich in der Forschung relevanten Copernicium die Gruppe 12. Es ist ein bläulich-weißes sprödes Metall und wird unter anderem zum Verzinken von Eisen und Stahlteilen sowie für Regenrinnen verwendet. Zink ist für alle Lebewesen essentiell und ist Bestandteil wichtiger Enzyme. Der Name Zink kommt von Zinke, Zind („Zahn, Zacke“), da Zink zackenförmig erstarrt.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Zink, Zn, 30 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 12, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | bläulich blassgrau | ||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-175-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.341 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code |
A12CB | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,012 %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 65,38(2)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 135 (142) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d10 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 9.394197(6) eV[4] ≈ 906.4 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 17.96439(25) eV[4] ≈ 1733.3 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 39.72330(12) eV[4] ≈ 3832.71 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 59.573(19) eV[4] ≈ 5747.9 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 82.6(9) eV[4] ≈ 7970 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 7,14 g/cm3 (25 °C)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 2,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −1,6 · 10−5)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 692,68 K (419,53 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 1180 K[9] (907 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 9,16 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 115 kJ/mol[9] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 7,4[10] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 3700 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 388[1] J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 16,7 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 120 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [11] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,7926 V (Zn2+ + 2 e− → Zn) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,65 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte
Bereits im Altertum war Zink als Legierungsbestandteil von Messing in Gebrauch. Als eigenständiges Metall wurde Zink jedoch erst im 14. Jahrhundert[14] in Indien und Messing ab dem 17. Jahrhundert entdeckt und verarbeitet.[15] In dem 1679 erbauten Messinghof in Kassel wurde Galmei verhüttet. Im Jahre 1743 wurde in Bristol eine erste Zinkhütte in Betrieb genommen. Weitere entstanden im 19. Jahrhundert in Oberschlesien, z. B. Georg von Giesche bzw. deren Nachfolgefirma, im Aachen-Lütticher Raum sowie in Obersachsen und in Westfalen. Im Ruhrgebiet entstanden die ersten Hütten 1845 in Mülheim an der Ruhr und 1847 in Borbeck (heute Essen). Im Nordharz stellte die Zinkhütte Harlingerode in Harlingerode (heute Bad Harzburg) in der Mitte des 20. Jahrhunderts der größte Industriebetrieb zur Zinkverhüttung in Westdeutschland.
Vorkommen
Zink ist auf der Erde mit einem Gehalt von 0,0076 % (oder 76 ppm[7]) an der Erdkruste ein relativ häufiges Element. Wenn man die Elemente nach Häufigkeit ordnet, steht es damit an 24. Stelle.[7] Es ist häufiger als Kupfer oder Blei. Zink kommt zwar nur selten gediegen vor, ist jedoch als Mineral meist anerkannt.[16] Bisher sind rund 30 registrierte Fundorte für gediegen Zink bekannt.[17]
Überwiegend findet sich Zink gebunden in Erzen. Die häufigsten und für die Zinkgewinnung wichtigsten Erze sind dabei Zinksulfiderze. Diese kommen natürlich entweder als Sphalerit oder Wurtzit vor und enthalten etwa 65 % Zink. Ein weiteres Zinkerz ist Galmei, womit sowohl Smithsonit (auch Zinkspat) ZnCO3 (ca. 52 % Zink) als auch Willemit Zn2[SiO4][18] bezeichnet werden.[19] Daneben existieren noch seltenere Zinkmineralien wie unter anderem Zinkit (auch Rotzinkerz) ZnO (ca. 73 % Zink), Hemimorphit Zn4(OH)2[Si2O7] (54 % Zink), Adamin Zn2(AsO4)(OH) (ca. 45 % Zink), Minrecordit CaZn[CO3]2 (ca. 29 % Zink) und Franklinit (Zn,Fe,Mn)(Fe2Mn2)O4 (16 % Zink). Insgesamt sind zurzeit (Stand: 2010) über 300 Zink-Minerale bekannt.[20]
Große Lagerstätten existieren in Nordamerika (Vereinigte Staaten, Kanada), Australien, der Volksrepublik China und Kasachstan. Auch in Deutschland gab es Zinkerzlagerstätten, beispielsweise in Brilon, im Raum Eschweiler-Stolberg im Rheinland, am Rammelsberg im Harz, Freiberg oder bei Ramsbeck im Sauerland. Oberirdisch kann man in diesen Gebieten seltene Pflanzen finden, die auf zinkhaltigen Böden besonders gut wachsen, wie das gelbe Galmeiveilchen, das nach dem alten Namen für das Zinkerz Smithsonit (Galmei) benannt ist.
Staaten mit der größten Förderung


Zinkerze werden hauptsächlich in der Volksrepublik China, Australien, Peru, Indien, den Vereinigten Staaten, Mexiko und Kanada gefördert. In Europa sind noch einige Zinkminen in Irland, Polen, Finnland, Bulgarien und Schweden aktiv. Die Gesamtproduktion an Zink belief sich 2015 auf 13,4 Millionen Tonnen, weitere 14 Millionen Tonnen wurden aus Recycling gewonnen.[21] Die bedeutendste Firma für die Gewinnung von Zink ist die schweizerische Nyrstar.
| Rang | Land | Förderung | Reserven |
|---|---|---|---|
| 1 | 5.100 | 41.000 | |
| 2 | 1.400 | 28.000 | |
| 3 | 1.000 | 64.000 | |
| 4 | 730 | 9.700 | |
| 5 | 680 | 20.000 | |
| 6 | 360 | 13.000 | |
| 7 | 340 | 5.400 | |
| 8 | 260 | 3.800 |
Gewinnung und Darstellung
Zink wird überwiegend aus Zinksulfid-Erzen gewonnen. Um diese zu verwenden, müssen sie zunächst in Zinkoxid umgewandelt werden. Das geschieht durch Rösten an der Luft. Dabei entstehen neben dem Zinkoxid große Mengen Schwefeldioxid, die zu Schwefelsäure weiterverarbeitet werden können.
Wird Smithsonit als Rohstoff verwendet, kann dies durch Brennen unter Abspaltung von Kohlenstoffdioxid erfolgen.
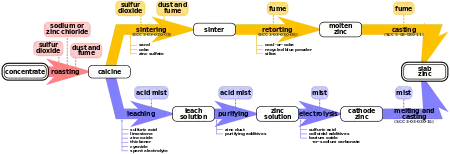
Die Weiterverarbeitung kann durch zwei mögliche Verfahren geschehen, das nasse und das trockene Verfahren. Über das trockene Verfahren werden heute nur noch etwa 10 % der weltweite produzierten Zinkmenge gewonnen.[23] Dabei wird das Zinkoxid mit feingemahlener Kohle vermengt und in einem Gebläseschachtofen (Imperial-Smelting-Ofen) auf 1100–1300 °C[24] erhitzt. Dabei bildet sich zunächst Kohlenstoffmonoxid. Dieses reduziert dann das Zinkoxid zu metallischem Zink. Aus dem entstandenen Kohlenstoffdioxid bildet sich nach dem Boudouard-Gleichgewicht wiederum Kohlenstoffmonoxid.
-
- Reduktion des Zinks
-
- Boudouard-Gleichgewicht
Da im Ofen Temperaturen oberhalb des Siedepunktes von Zink herrschen, entweicht das Zink als Dampf am oberen Ende des Ofens. Dort wird nun Blei eingesprüht und das Zink so auskondensiert.
Das dabei entstandene Rohzink enthält große Mengen Verunreinigungen, insbesondere Blei, Eisen und Cadmium. Durch fraktionierte Destillation kann das Rohzink weiter gereinigt werden. In einer ersten Stufe wird das Rohprodukt so erhitzt, dass nur Zink und Cadmium verdampfen, während Eisen und Blei zurückbleiben. Cadmium und Zink können durch Kondensation voneinander getrennt werden. Dabei kondensiert Zink bei höheren Temperaturen und bildet so 99,99 % reines Feinzink. Cadmium ist leichter flüchtig und wird an einer anderen Stelle als Cadmiumstaub gesammelt. Als Nebenprodukt der Destillation entsteht feinpulvriges Zink, der sogenannte Zinkstaub.[25]
Das nasse Verfahren wird angewendet, wenn dafür billiger elektrischer Strom bereitsteht. Für das Verfahren wird das rohe Zinkoxid in verdünnter Schwefelsäure gelöst. Verunreinigungen von edleren Metallen wie Cadmium werden durch Zinkpulver ausgefällt. Anschließend wird die Lösung unter Verwendung von Bleianoden und Aluminiumkathoden elektrolysiert. Wie beim trockenen Verfahren, entsteht an der Kathode 99,99 % reines Elektrolysezink.
Eigenschaften
Physikalische Eigenschaften
Zink ist ein bläulich weißes, unedles Metall, welches bei Zimmertemperatur und oberhalb 200 °C ziemlich spröde ist. Zwischen 100 und 200 °C ist es jedoch recht duktil und lässt sich leicht verformen. Sein Bruch ist silberweiß. Zink kristallisiert in einer hexagonal-dichtesten Kugelpackung. Diese ist allerdings senkrecht zu den Kugelschichten gestreckt, die Abstände zwischen den Zinkatomen unterscheiden sich leicht (in einer Schicht 264,4 pm, zwischen den Schichten 291,2 pm[24]).
Chemische Eigenschaften
An der Luft bildet Zink eine witterungsbeständige Schutzschicht aus Zinkoxid und -carbonat (Zn5(OH)6(CO3)2). Daher verwendet man es trotz seines unedlen Charakters als Korrosionsschutz (Verzinken von Eisen). Zink löst sich in Säuren unter Bildung von Zink(II)-Salzen und in Laugen unter Bildung von Zinkaten, [Zn(OH)4]2−, auf. Eine Ausnahme ist Zink mit sehr hoher Reinheit (99,999 %), welches nicht mit Säuren reagiert. Zink liegt in seinen Verbindungen fast ausnahmslos in der Oxidationsstufe +II vor.
Chemisch zählt Zink zu den unedlen Metallen (Redoxpotential −0,763 Volt). Das kann beispielsweise dafür ausgenutzt werden, edlere Metalle aus ihren Salzen durch Reduktion elementar abzuscheiden, wie hier am Beispiel der Umsetzung eines Kupfersalzes gezeigt wird:
In Pulverform ist Zink ein selbstentzündlicher (pyrophorer) Feststoff. Er kann sich bei Raumtemperatur an der Luft ohne Energiezufuhr erhitzen und schließlich entzünden. Die Zündbereitschaft hängt unter anderem sehr stark von der Korngröße und dem Verteilungsgrad ab. Bei Kontakt mit Wasser bildet Zinkpulver entzündliche Gase, die sich spontan entzünden können.[13]
Isotope
Von Zink sind 31 Isotope von 54Zn bis 85Zn und weitere elf Kernisomere bekannt.[26] Davon sind fünf, die Isotope 64Zn, 66Zn, 67Zn, 68Zn und 70Zn stabil und natürlich. Es gibt keine radioaktiven natürlichen Isotope. Das häufigste Isotop ist 64Zn mit 48,63 % Anteil am natürlichen Isotopenverhältnis. Danach folgen 66Zn mit 27,90 %, 68Zn mit 18,75 %, 67Zn mit 4,10 % und als seltenstes natürliches Isotop 70Zn mit einem Anteil von 0,62 %.[26] Das stabilste künstliche Isotop ist der Beta- und Gammastrahler (K/β+-Zerfall) 65Zn mit einer Halbwertszeit von 244 Tagen. Dieses und das Kernisomer 69m dienen als Tracer. Als einziges natürliches Isotop kann 67Zn durch die NMR-Spektroskopie nachgewiesen werden.
Verwendung

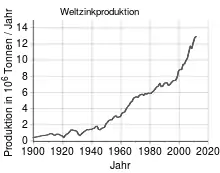
Im Jahr 2018 wurden über 13,5 Millionen Tonnen Zink produziert.[27] Davon wurden 47 %[27] für den Korrosionsschutz von Eisen- und Stahlprodukten durch Verzinken genutzt. Nach Verbrauchsmengen bedeutendstes Einsatzgebiet sind dessen Legierungen, vorzugsweise solche mit Kupfer, wie Messing, oder mit Aluminium, entweder als AlZn-Legierung oder mit deutlich höheren Zinkgehalten als AlZn, das für im Sandguss und Kokillenguss hergestellte Teile verwendet wird. Auch in den genormten Magnesiumlegierungen ist Zink mit bis zu 5 % enthalten. Ungleich bedeutender sind die genormten Feinzink-Gusslegierungen, die überwiegend im Druckgießverfahren, aber auch in Sand und Kokille vergossen werden. Auch zu Walzmaterial wie Zinkblechen werden Zinklegierungen verarbeitet.
Korrosionsschutz
Zink wird seit langem als Korrosionsschutz (Rostschutz) für Stahl- und Eisenteile verwendet, indem man sie verzinkt, d. h. mit einem metallischen Überzug aus Zink überzieht. Das Zink schützt aktiv und passiv gegen Korrosion, d. h., es bildet einerseits eine Barriere und schützt andererseits auch freiliegende benachbarte Eisenflächen sowie Schichtfehler vor Korrosion, indem es wie eine Opferanode wirkt.
Die Verzinkung kann auf verschiedene Weisen erfolgen. Methoden sind das Feuerverzinken, die galvanische Verzinkung, mechanische Beschichtungen, Spritzverzinken und Zinklamellenüberzüge. Sie unterscheiden sich in der Art des Aufbringens der Zinkschicht, der Dicke und damit der Haltbarkeit.

Die älteste Verzinkungsmethode ist das diskontinuierliche Feuerverzinken (Stückverzinken). Dabei werden vorbehandelte und vorgefertigte Bauteile aus Stahl (z. B. Balkongeländer) in ein Bad mit flüssigem Zink getaucht. In den 1930er Jahren kam als Verfahrensvariante das kontinuierliche Feuerverzinken (Bandverzinken) erstmals zur Anwendung, bei dem Bänder aus Stahl im Durchlaufverfahren als Halbzeug verzinkt und danach erst weiterverarbeitet werden. Durch Stückverzinken entstehen Zinkschichten, die in der Regel zwischen 50 und 150 µm liegen und abhängig von den atmosphärischen Bedingungen für Jahrzehnte vor Korrosion schützen. Bandverzinkte Bleche weisen sehr dünne Zinkschichtdicken zwischen 7 und 25 µm auf und erreichen deshalb nur deutlich kürzere Schutzzeiträume. Die Schutzdauer von feuerverzinktem Stahl kann durch eine zusätzliche Beschichtung (Duplex-System) weiter gesteigert werden.[28]
Beim galvanischen Verfahren wird die Zinkschicht elektrolytisch aufgebracht. Dazu wird das Werkstück gemeinsam mit einem Stück reinem Zink in eine saure oder basische Lösung eines Zinksalzes getaucht. Danach wird Gleichspannung angelegt, wobei das Werkstück die Kathode, das Stück Zink die Anode bildet. Am Werkstück wird durch Reduktion von Zinkionen Zink gebildet. Gleichzeitig wird das reine Zink der Anode oxidiert, die Anode löst sich dabei auf. Es entsteht eine dichte Zinkschicht, die in der Praxis 2,5 bis zu 25 µm[28] beträgt und somit deutlich geringer ist als beim diskontinuierlichen Feuerverzinken. Die Zinkschicht könnte theoretisch beim galvanischen Verfahren auch auf die Dicke einer feuerverzinkten Schicht gebracht werden. Allerdings wäre das nicht mehr wirtschaftlich aufgrund der Dauer (ca. 0,5 µm in einer Minute) und der Energiekosten.
Beim Spritzverzinken wird das Zink geschmolzen und dann mit Hilfe von Druckluft auf das Werkstück aufgesprüht. Die thermische Belastung ist dabei geringer als beim Feuerverzinken. Das kann für empfindliche Werkstoffe wichtig sein. Wird das Zink mechanisch auf das Werkstück aufgetragen, spricht man vom Plattieren. Ein Verfahren, das für Verzinken von Kleinteilen, etwa Schrauben, angewendet wird, ist das Sherardisieren. Dabei entsteht die Zinkschicht durch Diffusion von Zink in das Eisen des Werkstücks.[29] Eine weitere mögliche Auftragungsart von Zinkschichten sind Zinksprays.
Zink wird als Opferanode zum Schutz größerer Stahlteile genutzt. Dabei wird das zu schützende Objekt leitend mit dem Zink verbunden. Es entsteht eine galvanische Zelle mit Zink als Anode und dem Objekt als Kathode. Da nun das unedle Zink bevorzugt oxidiert wird und sich dabei langsam auflöst, bleibt das Stahlteil unverändert. Solange Zink vorhanden ist, ist somit das Stahlstück vor Korrosion geschützt.
Aufgaben des Korrosionsschutzes haben auch die Weiß- und Farbpigmente auf Basis von Zinkverbindungen. Zinkverbindungen sind auch Bestandteil der Phosphatierungsmittel (Phosphatierung), die Verfahren wie das Bondern von Blechen erst ermöglichen.
Zink in Batterien

Metallisches Zink gehört zu den wichtigsten Materialien für negative Elektroden (Anoden) in nicht wiederaufladbaren Batterien und wird in großtechnischem Maßstab eingesetzt. Beispiele sind Alkali-Mangan-Batterien, Zink-Kohle-Batterien, Zink-Luft-Batterien, Silberoxid-Zink-Batterien und Quecksilberoxid-Zink-Batterien. Zink wurde auch als Anode in vielen historischen galvanischen Elementen verwendet. Dazu zählen unter anderen die Voltasche Säule, das Daniell-Element und das Bunsen-Element. In geringem Umfang wird Zink auch für negative Elektroden in Akkumulatoren (wiederaufladbaren Batterien) verwendet.
Der Grund für die vielfältige Verwendung von Zink in Batterien liegt in der Kombination von physikalischen und elektrochemischen Eigenschaften mit guter Umweltverträglichkeit und relativ niedrigen Kosten. Zink ist ein gutes Reduktionsmittel mit hoher theoretischer Kapazität (0,82 Ah/g). Aufgrund des niedrigen Standardpotenzials von etwa −0,76 V beziehungsweise in alkalischem Medium −1,25 V lassen sich relativ hohe Zellspannungen realisieren. Ferner hat Zink eine gute elektrische Leitfähigkeit und ist in wässrigen Elektrolytlösungen ausreichend stabil.
Um die Korrosion von Zink in der Batterie zu reduzieren und zur Verbesserung der elektrochemischen Eigenschaften wurde früher amalgamiertes Zink mit einem Quecksilbergehalt von bis zu 9 Prozent eingesetzt. Aus Umweltschutzgründen wurde diese Praxis zumindest in Industrieländern nahezu vollständig eingestellt. Im Jahr 2006 wird amalgamiertes Zinkpulver nur noch in Zink-Luft- und Silberoxid-Zink-Knopfzellen verwendet.
Die Anode in Zink-Kohle-Batterien hat die Form eines Zinkbechers. Die Becher werden durch mehrstufiges Tiefziehen aus Zinkblech oder durch schlagartige Verformung (englisch impact extrusion) von runden oder sechseckigen Scheiben aus dickem Zinkblech (sogenannten Kalotten) hergestellt. Zur Verbesserung der Formbarkeit und zur Hemmung der Korrosion enthält das dafür verwendete Zink geringe Mengen an Cadmium, Blei und/oder Mangan. In Alkali-Mangan-Batterien wird Zinkpulver als aktives Material in der Anode verwendet. Es wird meist durch Verdüsung von geschmolzenem Zink im Luftstrahl hergestellt. Zur Hemmung der Korrosion werden dem Zink geringe Mengen anderer Metalle beigemischt, z. B. Blei, Bismut, Indium, Aluminium und Calcium.
Zinkblech im Bauwesen

Wichtige Zinkprodukte sind auch Halbzeuge, meist in Form von Blechen aus legiertem Zink / Titanzink. Titanzinkblech wird als Werkstoff im Bauwesen verwendet. Heute kommt fast ausschließlich Titanzink zum Einsatz, das korrosionsfester, weniger spröde und dadurch mechanisch deutlich belastbarer ist als unlegiertes Zink bzw. das bis in die 1960er Jahre übliche Zinkblech, das im sogenannten Paketwalzverfahren hergestellt wurde. Gewalztes, massives Titanzinkblech wird hauptsächlich zur Dacheindeckung, als Fassadenbekleidung, für die Dachentwässerung (Regenrinnen, Fallrohre), für Abdeckungen z. B. von Gesimsen oder Außenfensterbänken oder für Anschlüsse und Dachkehlen eingesetzt. Es hält bis zu 100 Jahre und muss in dieser Zeit weder gewartet noch repariert werden, wenn es fachgerecht verarbeitet wurde. Die Verarbeitung erfolgt durch das Klempnerhandwerk.
Zinkblech sollte nicht verwechselt werden mit feuerverzinktem Stahlblech, das fälschlicherweise auch des Öfteren Zinkblech oder Weißblech genannt wird.
Legiertes Zinkblech wird in Coils oder in Tafeln geliefert. Für die Dachdeckung werden oft Metallbahnen (Schare) verwendet, die zwischen 40 und 60 Zentimeter breit sind und bis zu 16 Meter lang sein können. Die Materialdicke ist unterschiedlich, meist beträgt sie 0,7 Millimeter. Die Verbindung der einzelnen Blechteile erfolgt bei kleinteiligen Elementen meist durch Löten, bei Dachdeckungen meist durch doppeltes Falzen (Doppelstehfalzdeckung). Aufgrund der Wärmeausdehnung von legiertem Zink von 22·10−6/K müssen die Verbindungen und Anschlüsse der Zinkprofile Materialbewegungen zulassen.
Moderne Architekten verwirklichen mit Titanzink extravagante Ideen. Daniel Libeskind hat z. B. das Jüdische Museum Berlin oder die Libeskind-Villa in Datteln mit einer Fassade aus Bauzink ausgestattet. Zaha Haddid wählte den Werkstoff für das Transport Museum in Glasgow, das die Verformungseigenschaften des Werkstoffes eindrucksvoll zeigt.
Zinkdruckguss

Zinkdruckguss ist die gebräuchliche Bezeichnung für im Druckgießverfahren hergestellte Teile aus Feinzink-Gusslegierungen. Diese Legierungen erbringen weitaus bessere Werte der Gussteile, als es beim Vergießen von reinem Zink möglich ist. Die Legierungen sind genormt. Viel verwendet wird die Legierung GD ZnAl4Cu1 (Z 410). Zinkdruckguss ermöglicht – wie jedes Druckgießverfahren – die Fertigung großer Stückzahlen. Die Gussteile zeichnen sich durch hohe Maßhaltigkeit aus, besitzen sehr gute mechanische Werte und sind für eine Oberflächenbehandlung wie Vernickeln oder Verchromen gut geeignet. Das Spektrum der Anwendungen umfasst Automobil-Zubehörteile und solche im Maschinen- und Apparatebau, ferner Beschläge aller Art, Teile für die Sanitärindustrie, für Feingeräte- und Elektrotechnik, für Metallspielwaren und viele Gebrauchsgegenstände im Haushalt.
Münzprägung
Da Zink als Münzmetall vergleichsweise wenig kostet, wurde es in Notzeiten, zuletzt in den beiden Weltkriegen, in Form von Zinklegierungen zur Münzprägung verwendet, teilte sich diese Verwendung als sog. „Kriegsmetall“ aber mit Münzen aus einer Aluminiumlegierung. Seit 1982 besteht auch der US-Cent (Penny) im Kern aus Zink.
Analytik
Analysenreines Zinkpulver dient als Urtitersubstanz nach Arzneibuch zur Einstellung von EDTA-Maßlösungen.
Organische Chemie
In der Organischen Synthese dient Zink verschiedenen Zwecken. So fungiert es als Reduktionsmittel und kann als solches in unterschiedlicher Weise aktiviert sein.[30] Ein Beispiel ist die Clemmensen-Reduktion von Carbonylverbindungen mit amalgamiertem Zink. Des Weiteren lassen sich Allylalkohole zu Alkenen reduzieren[31], Acyloine zu Ketonen.[32] Die Reduktion der aromatischen Nitrogruppe kann in Abhängigkeit von den Reaktionsbedingungen zu unterschiedlichen Produkten führen: Arylamin, Arylhydroxylamin[33], Azoaren[34], N,N’-Diarylhydrazin.
Im metallorganischen Bereich bieten Zinkorganyle gegenüber Grignard-Verbindungen Selektivitätsvorteile, da sie in der Regel weniger reaktiv sind und mehr funktionelle Gruppen tolerieren – ein Umstand, von dem die Reformatzki-Reaktion[35] Gebrauch macht. Die Organyle lassen sich auf direkte Weise oder durch Transmetallierung herstellen. In Gegenwart asymmetrisch komplexierender Auxiliare, von denen mitunter katalytische Mengen ausreichen, ist eine stereoselektive Addition möglich. Der Effekt der Chiralitätsverstärkung wurde beobachtet.[30]
Nicht zuletzt ist die Halogeneliminierung[36][37] und Dehalogenierung[38] möglich. Die Simmons-Smith-Reaktion[39] zählt zu den selteneren Präparationsmethoden. Die Zeitschrift Organic Syntheses verzeichnet eine Reihe von Synthesen, in denen elementares Zink als Reagenz dient.[40]
Herstellung von Wasserstoff
Zink wird im sogenannten Solzinc-Verfahren zur Herstellung von Wasserstoff genutzt. Dafür wird in einem ersten Schritt Zinkoxid thermisch durch Sonnenenergie in Zink und Sauerstoff aufgespalten, und in einem zweiten Schritt wird das so gewonnene Zink mit Wasser zu Zinkoxid und Wasserstoff umgesetzt.
Biologische Bedeutung
Zink ist ein Spurenelement für Menschen,[41] Tiere,[42] Pflanzen[43] und Mikroorganismen.[44]
Wirkung im Körper
Zink zählt zu den unentbehrlichen (essentiellen) Spurenelementen für den Stoffwechsel. Es ist Bestandteil einer Vielzahl von Enzymen, beispielsweise der RNA-Polymerase und der Carboanhydrase. Zink erfüllt im Körper viele verschiedene Funktionen. So nimmt es Schlüsselrollen im Zucker-, Fett- und Eiweißstoffwechsel ein und ist beteiligt am Aufbau der Erbsubstanz und beim Zellwachstum. Sowohl das Immunsystem als auch viele Hormone benötigen Zink für ihre Funktion.[45] Zink dämpft überschießende (d. h. unangemessene, den Körper schädigende) Abwehrreaktionen des Immunsystems.[46] Zink ist ebenfalls Bestandteil von Zinkfingerproteinen, die wichtige Transkriptionsfaktoren sind. Im Blut ist Zink überwiegend an Albumin gebunden.[47]
Empfohlene Tagesdosis
Die empfohlene Tagesmenge für Zink lag 1996 laut Weltgesundheitsorganisation für erwachsene Männer bei 15 mg, für Frauen bei 12 mg, für präpubertäre Kinder bei 10 mg und für Säuglinge bei 5 mg.[48] Weil der Körper weniger Zink aufnehmen kann als vermutet – nur 30 Prozent können absorbiert werden –, empfiehlt die Deutsche Gesellschaft für Ernährung eine Aufnahme von Zink für erwachsene Männer auf 14 mg pro Tag, für erwachsene Frauen auf 8 mg pro Tag (mittlere Phytatzufuhr, damit moderate Zinkabsorption).[49][50] Phytat in Lebensmitteln hemmt die Zinkaufnahme im Körper.[50] Bei Schwangeren ist der Bedarf erhöht: Im ersten Trimester liegt er bei 9 mg Zink pro Tag, ab dem 4. Monat bei 11 mg Zink pro Tag. Dieser gipfelt bei stillenden Müttern auf einen täglichen Wert von 13 mg Zink.[50] In den Großbritannien sollen täglich durch Nahrung 7 mg Zink für Frauen und 9,5 mg Zink für Männer aufgenommen werden, die Zinkaufnahme soll aber nicht 25 mg pro Tag überschreiten.[51]
Der empfohlene Tolerable Upper Intake Level (zulässige obere Aufnahmemenge, UL) der Europäischen Behörde für Lebensmittelsicherheit liegt bei 25 mg Zink pro Tag,[52] das Standing Committee on the Scientific Evaluation of Dietary Reference Intakes of the Food and Nutrition Board, Institute of Medicine, National Academy of Sciences, betrachtet für Erwachsene 40 mg/Tag als UL.[53][54] Das Bundesinstitut für Risikobewertung sieht eine Höchstmenge an Zink in Nahrungsergänzungsmittel (NEM) bei 6,5 mg und empfiehlt bei NEM mit über 3,5 mg Zink auf die tägliche Einnahme weiterer zinkhaltiger NEM zu verzichten.[55] Daneben betrachtet es 25 mg/Tag ebenfalls als UL.[55]
Eine Zufuhr von mehr als 100 mg pro Tag ist nicht empfehlenswert, ab 200 mg können Symptome wie Übelkeit, Erbrechen, Durchfall oder auch Kopfschmerzen, Lethargie oder Reizbarkeit auftreten.[51][56] Beim Menschen führt die Aufnahme von Zink ab etwa 2 g zu akuten Vergiftungserscheinungen.[57] Eine anhaltende erhöhte Zinkzufuhr (50–150 mg/Tag) kann u. a. zu Kupfermangel[51] und Störungen in der Blutbildung führen.[58]
Zinkpräparate sollten nur bei Zinkmangel (siehe unten) und erhöhtem Zinkbedarf (z. B. nach Operationen, Traumata oder Verbrennungen) eingenommen werden.[59][60]
Wird Zink in hoher Dosis aufgenommen, indem z. B. beim Brennschneiden verzinkter Stähle Zinkdämpfe eingeatmet werden, so entsteht das sogenannte „Zinkfieber“. Dabei entwickelt der Vergiftete grippeähnliche Symptome mit zum Teil starken Fieberanfällen. Die Symptome klingen im Allgemeinen nach 1–2 Tagen wieder ab.
Zufuhr
Es wird geschätzt, dass weltweit zwei Milliarden Menschen an Zinkmangel leiden und dass dieser Mangel mitverantwortlich für den Tod von einer Million Kindern pro Jahr ist.[47]
In den USA nehmen die meisten Säuglinge, Kinder, und Erwachsenen genügend Zink zu sich. Vereinzelt gibt es Hinweise, dass bei älteren Menschen die Zufuhr geringer ausfällt.[61]
Laut Nationaler Verzehrstudie II liegt der Median der Zinkzufuhr in Deutschland in allen Altersgruppen über dem Referenzwert. 32% der Männer und 21% der Frauen liegen unter der empfohlenen täglichen Zufuhr.[62]
Mangel
Wenn die Zink-Zufuhr unter dem Referenzwert liegt, ist dies nicht mit einem Mangel gleichzusetzen, sie erhöht jedoch die Wahrscheinlichkeit für eine Unterversorgung.[63]
Zinkmangel führt zu einer Unterfunktion der Keimdrüsen, Wachstumsstörungen und Blutarmut. Ein niedriger Zinkspiegel äußert sich oft auch durch eine verringerte Abwehrfunktion, Haarausfall, trockene Haut und brüchige Nägel.[64] Zinkmangel kann zu Unfruchtbarkeit beim Mann führen.[65] „Bei einem Mangel an Zink kommt es [..] zu einer reduzierten Geruchs- und Geschmacksempfindung.“[66] Zinkmangel wird häufig durch einen hohen Kupferspiegel verursacht (z. B. bei reichlichem Trinkwassergenuss aus häuslichen Kupferrohrnetzen), da Zink und Kupfer Antagonisten sind.[67] Selbiges gilt für Eisen, z. B. durch eine sehr eisenreiche Ernährung oder die Einnahme von eisenhaltigen Medikamenten.[68] Die Aufnahme von Zink (wie auch anderen Metallionen) aus dem Darm wird ebenfalls durch phytinsäurehaltige Nahrungsmittel vermindert.[69]
Bei Haushunden treten zink-reaktive Dermatosen auf.
Zink in Pflanzen
Die Arten Calluna, Erica und Vaccinium können auf Zink-reichen Böden wachsen, da eine Aufnahme überschüssiger Zinkionen durch Mykorrhiza gemindert wird.[70] Zinkmangel in Böden gehören zu den häufigsten Spurenelementmangeln in landwirtschaftlich genutzten Pflanzen und kommt gehäuft in Böden mit hohem pH-Wert vor.[71] Landwirtschaftlich genutzte Zinkmangelböden kommen hälftig in der Türkei und Indien vor, zu einem Drittel in China, sowie in weiten Teilen Westaustraliens.[43] Pflanzen mit Zinkmangel sind empfänglicher für Pflanzenkrankheiten. Zink kommt in Böden vor allem als Witterungsprodukt von Steinen vor, aber auch menschengemacht wie durch Erzeugung fossiler Energie, Bergbauabraum, Phosphatdünger, Pestizide wie Zinkphosphid, Kalkstein, Gülle, Sedimente der Kanalisation sowie Korrosion verzinkter Metalle. Überschüssiges Zink ist für Pflanzen toxisch, wobei das seltener vorkommt.[43]
Zinkgehalt in Lebensmitteln

Folgende Nahrungsmittel sind gute Zinkquellen:
- Rote Fleischsorten
- Käse
- Haferkleie und Haferflocken
- Sonnenblumenkerne
- Kürbiskerne
- Weizenkeime (Weizen)
- Walnüsse und Pekannüsse
- Pilze und Hefen
- Linsen
- Meeresfrüchte und Schalentiere
Daneben gibt es Nahrungsmittel, die viel Zink enthalten, bei denen die Bioverfügbarkeit von Zink jedoch geringer ist, da Phytat die Aufnahme verringert. Durch Zubereitungsmethoden wie Einweichen, Keimung oder Sauerteiggärung kann Phytat abgebaut und die Bioverfügbarkeit erhöht werden. Daher gibt die Deutsche Gesellschaft für Ernährung bei Ernährungsformen mit hohem Phytatgehalt einen erhöhten Zinkbedarf an. Vollkornprodukte und Hülsenfrüchte enthalten zwar viel Phytat allerdings ist auch ihr Zinkgehalt hoch, so dass ihr Konsum nicht zu Zinkmangel führt.[72]
Tabelle für Lebensmittel mit[73][74]
sehr viel Zink pro 100 g viel Zink pro 100 g durchschnittlich viel Zink pro 100 g wenig Zink pro 100 g Austern 7,0–160,0 mg Paranüsse 4,0 mg Hirse 3,4 mg Huhn 1,0 mg Leber (Kalb, Schwein, Rind) bis zu 6,3 mg (Schwein) Lamm 2,3–6,0 mg Knäckebrot 3,1 mg Fisch 0,4–1,1 mg Sojamehl 5,7 mg Linsen (getrocknet) 3,7 mg Nudeln (ungekocht) 3,1 mg Gemüse 0,2–1,0 mg Emmentaler 30 % o. 45 % F.i.Tr. 4,6 mg Sojabohnen (getrocknet) 0,7–4,2 mg Walnuss 2,7 mg Joghurt 0,3–0,5 mg Haferflocken 4,0–4,5 mg Mais 2,5–3,5 mg Vollkornkekse 2,7 mg Kartoffel 0,4–0,6 mg Butterkäse, Tilsiter, Gouda, Edamer 3,5–4,0 mg Erdnüsse (geröstet) 3,0–3,5 mg Camembert 2,7 mg Vollmilch 0,4 mg Rindfleisch 3,0–4,4 mg Weizenmischbrot 3,5 mg Bohnen (weiß) 2,6 mg Obst 0,1–0,5 mg
Zink als Heilmittel
Zinkhaltige Salben werden bei der Wundheilung und Hautausschlägen (Ekzeme) angewendet.[75] Beispiele für pharmazeutisch genutzte Zinksalze sind Zinkacetat, Zinkacexamat, Zinkchlorid, Zinkgluconat, Zinkoxid, Zinkstearat, Zinksulfat, Zinkundecylenat.[76]
Zink wirkt auf den Stoffwechsel der Darmzellen dahingehend, dass weniger Kupfer resorbiert wird. Zinksalze (z. B. Zinksulfat, Zinkacetat) eignen sich daher als Arzneistoffe in der Behandlung des Morbus Wilson, einer Erkrankung, bei der der Kupferstoffwechsel in der Leber gestört ist und es dadurch zu einer vermehrten Ansammlung von Kupfer in der Leber, dem Auge, dem Zentralnervensystem und anderen Organen kommt.
Eine oft zitierte Metastudie des indischen Institute of Medical Education and Research, die belegen sollte, dass Zink bei Erkältungskrankheiten eine mildernde und die Krankheitsdauer verkürzende Wirkung habe, wies so schwerwiegende Mängel auf, dass sie durch die Cochrane Collaboration zurückgezogen wurde.[77] Eine Metastudie aus dem Jahr 2021 enthält Hinweise darauf, dass Zink Atemwegsinfektions-Symptomen vorbeugen und die Krankheitsdauer verkürzen könne. Allerdings gebe es große Unsicherheiten im Hinblick auf die Wirksamkeit verschiedener Formulierungen und Dosierungen und auch unterscheiden sich die vorliegenden Studien in Qualität, Umfang und Design deutlich.[78] Ältere Untersuchungen konnten eine positive Wirkung allerdings nicht nachweisen.[79][80]
2004 gaben die World Health Organization (WHO) und die United Nations Children’s Fund (UNICEF) eine Stellungnahme zur Behandlung akuter Diarrhöe (Durchfall) ab, in der sie die gemeinsame Behandlung mit Zink und oraler Rehydrationslösung (ORS) empfahlen.[81] Auch eine Meta-Analyse der Cochrane Collaboration stellte eine positive Wirkung von Zink bei der Behandlung von Diarrhöe bei Kindern fest, eingeschränkt auf Kinder über sechs Jahren und aus Regionen mit potenzieller Zink-Unterversorgung.[82]
Nachweis
Ein einfacher Zinknachweis beruht auf dem Erhitzen einer Probe mit wenigen Tropfen einer verdünnten Lösung eines Cobaltsalzes auf einer Magnesiarinne im Bunsenbrenner. Ist Zink zugegen, ist nach kurzer Zeit das so genannte Rinmans Grün zu erkennen.
Die quantitative Bestimmung kann mittels Komplexometrie mit einer EDTA-Maßlösung erfolgen. Zur Spurenbestimmung kommen die verschiedenen Methoden der Polarographie in Frage. Im Ultraspurenbereich setzt man die Graphitrohr-AAS ein. Zink ist ein relativ leicht flüchtiges Element, weshalb Matrixmodifizierer wie Palladium- und Magnesiumnitrat von Bedeutung sind, weil sie die mögliche Pyrolysetemperatur heraufsetzen. Alternativ bieten sich die Inversvoltammetrie oder die ICP-MS als äußerst empfindliche instrumentelle Methoden an.
Verbindungen
Oxide
Zinkoxid bildet farblose, hexagonale Kristalle. Es wird als Pigment, in Farben, Kautschuk, Fotokopierpapier und Chemikalien verwendet. Weitere Verwendungen finden sich in Bodenbelägen, Gläsern, Emails, Geweben, Kunststoffen, Schmiermitteln, bei der Herstellung von Kunstseide und in Arzneimitteln.[83]
Halogenide
Zinkchlorid ist weiß und stark hygroskopisch. Es wird in Flussmitteln zum Löten und Schweißen, zum Brandschutz, als Holzschutzmittel, als Ätzmittel, zur Herstellung von Pergamentpapier, Kunstseide, Aktivkohle, Kaltwasserleimen, Zement und Golfbällen, als Elektrolyt in Trockenbatterien, als Korrosionsinhibitor bei der Wasseraufbereitung, als Mittel bei der Vulkanisation von Kautschuk und für viele andere Zwecke verwendet.
Zinkfluorid hat eine Rutil-Kristallstruktur in der Raumgruppe P42/mnm (Raumgruppen-Nr. 136).[84] Es wird zur Fluorierung organischer Verbindungen, zur Herstellung von Leuchtstoffen, zum Konservieren von Holz, für galvanische Bäder, zum Verzinken von Stahl, zur Herstellung von Keramik, in Medikamenten sowie in Glasuren und Emails für Porzellan verwendet.[83]
Weitere anorganische Verbindungen


Zinksulfid kommt in der Natur als Sphalerit (Zinkblende) und als Wurtzit vor. Es wird als Pigment für Farben, Öltücher, Linoleum, Leder und Zahngummi, in weißem und opakem Glas, Kunststoffen, Fungiziden, als Halbleiter, Fotoleiter für Solarzellen, als Leuchtstoff in Fernseh- und Röntgenbildschirmen sowie in Leuchtzifferblättern von Uhren verwendet.
Zinksulfat wird als Reagens in der analytischen Chemie, zum Bleichen von Papier, bei der Herstellung von Kunstseide, als Brandschutzmittel, in Düngemitteln und als Nahrungsergänzungsmittel benutzt.
Zinkcarbonat wird als feuerfester Füllstoff für Kautschuk- und Kunststoffzusammensetzungen, als Futtermittelzusatz, als Pigment, in Kosmetika und bei der Herstellung von Zinksalzen, Porzellan, Keramik und Kautschuk eingesetzt.
Zinkcyanid ist giftig und umweltschädlich. Es wird zum Plattieren, zur Herstellung von Insektiziden, zum Galvanisieren, zum Entfernen von Ammoniak aus dem Produktionsgas, zur Goldgewinnung, als chemisches Reagens, in der Medizin und in der chemischen Analyse verwendet.[83]
Organische Verbindungen
Zinkacetat ist ein farbloser Feststoff und wird in der Holzkonservierung, als Beizmittel beim Färben, als Lebensmittelzusatz, als Futtermittelzusatz, als Bestandteil von Klebstoffen, als Glasur für Porzellan und als Reagens für die Prüfung auf Albumin, Tannin und Phosphat verwendet.[83]
Zinkstearat ist das Zinksalz der Stearinsäure und gehört zu den Metallseifen. Es besteht aus einem Zink-Ion und zwei langkettigen Stearat-Ionen.
Literatur
- L. Engelskirchen: Zink : das achte Metall. (= Forschungsbeiträge zu Handwerk und Technik. 16). LWL-Freilichtmuseum Hagen, Essen 2006, ISBN 3-89861-653-3
- W. Hommel: Zur Geschichte des Zinks. In: Chemiker-Zeitung, 36 (95), 1912, S. 905–906
- David van Reybrouck: Zink. (Aus dem Niederländischen von Waltraud Hüsmert), Suhrkamp, Berlin 2017, ISBN 978-3-518-75176-3
- Heinrich Vahrenkamp: Zink, ein langweiliges Element? In: Chemie in unserer Zeit, 22 (3), 1988, S. 73–84 (doi:10.1002/ciuz.19880220302)
- Sabina Grund: Zink – Werkstoff und lebenswichtiges Spurenelement. In: Praxis der Naturwissenschaften – Chemie in der Schule, 53 (7), 2004, S. 2–8
- M. Adelhelm: Schulversuche mit elementarem Zink. In: Praxis der Naturwissenschaften – Chemie in der Schule, 53 (7), 2004, S. 29–31
- Anonymus: Zink in der Therapie von chronischen Lebererkrankungen. In: Naturheilkunde. 3/2006, S. 18–23
- Sabina C. Grund, Marianne Schönnenbeck: Nachhaltig bauen und konstruieren mit Zink. In: UmweltMagazin, 36 (10/11), 2006, S. 64–66
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Zink) entnommen
- IUPAC, Standard Atomic Weights Revised 2013
- Eintrag zu zinc in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu zinc bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Zink) entnommen
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1545
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Magnetic Susceptibility of the Elements and Inorganic Compounds, S. 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086
- G. G. Graf: Zinc. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a28 509
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Zink) entnommen
- Eintrag zu Zinc im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Zink, Pulver oder Staub, nicht stabilisiert in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016. (JavaScript erforderlich)
- Initiative Zink: Die Bedeutung von Zink in der Geschichte
- Frühe Herstellung von Messing in Indien. In: NZZ online. 7. September 2005
- Mineralienatlas:Zink (Wiki)
- MinDat - Localities for Zinc (englisch)
- Stefan Weiß: Das große Lapis Mineralienverzeichnis. 4. Auflage. Christian Weise Verlag, München 2002, ISBN 3-921656-17-6.
- Galmei (Memento vom 13. März 2016 im Internet Archive) Eintrag auf der Webseite des Museum Zinkhütter Hof (besucht am 30. April 2016)
- Webmineral - Mineral Species containing Zinc (Zn)
- USGS 2016 Minerals Yearbook. (PDF; 276 kB) Abgerufen am 21. November 2017.
- USGS: World Mine Production, Reserves, and Reserve Base (PDF; 90 kB)
- Zinkerzeugung. Initiative Zink, abgerufen am 21. November 2013.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Eintrag zu Zink. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. Juni 2014.
- G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext)
- International Lead and Zinc Study Group.
- Informationen des Institut Feuerverzinken.
- Leitfaden zum Korrusionsschutz
- F. Sempf: Skript „Organozinkverbindungen“. (Memento vom 11. Juni 2007 im Internet Archive) (PDF; 174 kB)
- I. Elphimoff-Felkin, P. Sarda: Reductive Cleavage of Allylic Alcohols, Ethers, or Acetates to Olefins: 3-Methylcyclohexene In: Organic Syntheses. 56, 1977, S. 101, doi:10.15227/orgsyn.056.0101; Coll. Vol. 6, 1988, S. 769 (PDF).
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 776
- Oliver Kamm: β-Phenylhydroxylamine In: Organic Syntheses. 4, 1925, S. 57, doi:10.15227/orgsyn.004.0057; Coll. Vol. 1, 1941, S. 445 (PDF).
- H. E. Bigelow, D. B. Robinson: Azobenzene In: Organic Syntheses. 22, 1942, S. 28, doi:10.15227/orgsyn.022.0028; Coll. Vol. 3, 1955, S. 103 (PDF).
- Reformatzky-Reaktion: Skizze. Portal für Organische Chemie
- J. C. Sauer: 1,1-Dichloro-2,2-Difluoroethylene In: Organic Syntheses. 36, 1956, S. 19, doi:10.15227/orgsyn.036.0019; Coll. Vol. 4, 1963, S. 268 (PDF).
- Louis F. Fieser: Cholesterol, Δ5-Cholesten-3-One, and Δ4-Cholesten-3-One In: Organic Syntheses. 35, 1955, S. 43, doi:10.15227/orgsyn.035.0043; Coll. Vol. 4, 1963, S. 195 (PDF).
- S. Gronowitz, T. Raznikiewicz: 3-Bromothiophene In: Organic Syntheses. 44, 1964, S. 9, doi:10.15227/orgsyn.044.0009; Coll. Vol. 5, 1973, S. 149 (PDF).
- Simmons-Smith-Reaktion. Portal für Organische Chemie
- Organic Syntheses: Gesamtübersicht zu Zink. (Memento vom 10. Oktober 2012 im Webarchiv archive.today)
- Wolfgang Maret: Chapter 12. Zinc and Human Disease. In: Astrid Sigel, Helmut Sigel, Roland K. O. Sigel (Hrsg.): Interrelations between Essential Metal Ions and Human Diseases (= Metal Ions in Life Sciences), Band 13. Springer, 2013, ISBN 978-94-007-7499-5, S. 389–414, doi:10.1007/978-94-007-7500-8_12. PMID 24470098
- Prasad A. S.: Zinc in Human Health: Effect of Zinc on Immune Cells. In: Mol. Med.. 14, Nr. 5–6, 2008, S. 353–7. doi:10.2119/2008-00033.Prasad. PMID 18385818. PMC 2277319 (freier Volltext).
- M. R. Broadley, P. J. White, J. P. Hammond, I. Zelko, A. Lux: Zinc in plants. In: New Phytologist. 173, Nr. 4, 2007, S. 677–702. doi:10.1111/j.1469-8137.2007.01996.x. PMID 17286818.
- Zinc’s role in microorganisms is particularly reviewed in: Sugarman B: Zinc and infection. In: Reviews of Infectious Diseases. 5, Nr. 1, 1983, S. 137–47. doi:10.1093/clinids/5.1.137. PMID 6338570.
- rhw-redaktion (Hrsg.): Ökotrophologie. Band 2, Verlag Neuer Merkur, 2005, ISBN 3-937346-03-1, S. 202
- Ming-Jie Liu u. a.: ZIP8 Regulates Host Defense through Zinc-Mediated Inhibition of NF-kB. In: Cell Reports. 21. Februar 2013, Abgerufen am 2. November 2013 (PDF, 2,6 MB)
- Hans Konrad Biesalski, Stephan Bischoff, Christoph Puchstein: Ernährungsmedizin. 4., vollständig überarbeitete und erweiterte Auflage. Georg Thieme, Stuttgart 2010, ISBN 978-3-13-100294-5.
- WHO: Zinc in Drinking-water – Background document for development of WHO Guidelines for Drinking-water Quality (PDF; 152 kB)
- Zink - Empfohlene Zufuhr. In: Deutsche Gesellschaft für Ernährung. Abgerufen am 28. Januar 2021.
- Mehr Zink bei Erkältungen? In: Klartext Nahrungsergänzung. Verbraucherzentrale, 15. Oktober 2020, abgerufen am 28. Januar 2021.
- Hayley Willacy: Zinc Deficiency, Excess and Supplementation. Zinc problems. In: Patient UK. 26. April 2019, abgerufen am 28. Januar 2021 (englisch).
- Overview on Tolerable Upper Intake Levels as derived by the Scientific Committee on Food (SCF) and the EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). (PDF) In: EFSA. 4. September 2018, abgerufen am 28. Januar 2021 (englisch).
- Panel on Micronutrients, Subcommittees on Upper Reference Levels of Nutrients and of Interpretation and Use of Dietary Reference Intakes, and the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. 2001
- Europäische Behörde für Lebensmittelsicherheit: Wissenschaftliches Gutachten: Nahrungsergänzungsmitteln für Ernährungszwecke zugesetztes Chrompicolinat, Zinkpicolinat und Zinkpicolinatdihydrat. 2009, ( Volltext als PDF-Datei (Memento vom 10. August 2013 im Internet Archive))
- Anke Weißenborn et al.: Höchstmengen für Vitamine und Mineralstoffe in Nahrungsergänzungsmitteln. In: Journal of Consumer Protection and Food Safety. Band 13, Nr. 1, 1. März 2018, S. 25–39, doi:10.1007/s00003-017-1140-y.
- EUFIC: Zink – ein Super-Nährstoff? (Memento vom 24. November 2010 im Internet Archive) In: Food today. 05/2008
- rhw-redaktion (Hrsg.): Ökotrophologie. Band 2, Verlag Neuer Merkur, 2005, ISBN 3-937346-03-1, S. 204
- Präparate mit Zink plus Vitamin C. (Memento vom 4. November 2013 im Internet Archive) Ökotest. In: Ratgeber Essen, Trinken und Genießen. Ausgabe 8/2008, Abgerufen am 2. November 2013
- Colin Tidy: Zinc Supplements. Patient.co.uk. 22. März 2010, Abgerufen am 2. November 2013
- Burgerstein Zinktabletten 15 mg. In: Arzneimittel-Kompendium der Schweiz. 7. September 2009, Abgerufen am 2. November 2013
- https://ods.od.nih.gov/factsheets/Zinc-HealthProfessional/#en1
- https://www.mri.bund.de/fileadmin/MRI/Institute/EV/NVSII_Abschlussbericht_Teil_2.pdf
- https://www.dge.de/fileadmin/public/doc/ws/faq/FAQs-Zink.pdf
- Ivonne Silvester: Psyche-Physe-Fit. BoD – Books on Demand, ISBN 978-3-8311-2209-7, S. 199–200
- A. H. Colagar, E. T. Marzony, M. J. Chaichi: Zinc levels in seminal plasma are associated with sperm quality in fertile and infertile men. In: Nutr Res. 29(2), Feb 2009, S. 82–88
- Julika Krug: Effekt von Zink auf die Olfaktion und Motorik von Patienten mit Morbus Parkinson. Dissertation. Marburg 2006.
- Rainer Elschenbroich: Zinkmangel durch Kupfer-Wasserleitungen? (PDF; 87 kB), 2009
- Zink – Wirkung und Anwendung. (Memento vom 29. Mai 2012 im Webarchiv archive.today) bei aktivapo.de
- Österreichische Apothekerkammer: Zink: ein wichtiges Spurenelement
- Geoffrey Michael Gadd: Metals, minerals and microbes: geomicrobiology and bioremediation Archiviert vom Original am 25. Oktober 2014. In: Microbiology. 156, Nr. 3, März 2010, S. 609–643. doi:10.1099/mic.0.037143-0. PMID 20019082.
- Brian J. Alloway: Zinc in Soils and Crop Nutrition, International Fertilizer Industry Association, and International Zinc Association. 2008. Archiviert vom Original am 19. Februar 2013.
- https://www.dge.de/fileadmin/public/doc/ws/faq/FAQs-Zink.pdf
- Tabelle - Nährwert und Zinkgehalt. Abgerufen am 18. Mai 2010.
- Empfehlung der Deutschen Gesellschaft für Ernährung (DGE). Abgerufen am 18. Mai 2010.
- Zink: Hilfe für die Haut. auf: medizinauskunft.de, 16. Mai 2006, abgerufen am 27. Mai 2013
- Bioverfügbarkeit von Zinkpräparaten. In: deutsche-apotheker-zeitung.de. 17. September 2020, abgerufen am 25. Oktober 2021.
- Meenu Singh, Rashmi R Das: Zinc for the common cold. In: Cochrane Database of Systematic Reviews. doi:10.1002/14651858.CD001364.pub5
- J. Hunter, S. Arentz, J. Goldenberg nd andere: Zinc for the prevention or treatment of acute viral respiratory tract infections in adults: a rapid systematic review and meta-analysis of randomised controlled trials. In: BMJ Open. Nr. 11, 2021, doi:10.1136/bmjopen-2020-047474.
- T. J. Caruso, C. G. Prober, J. M. Gwaltney: Treatment of naturally acquired common colds with zinc: a structured review. In: Clin. Infect. Dis. 45, Nr. 5, September 2007, S. 569–574. doi:10.1086/520031. PMID 17682990
- I. Marshall: Zinc for the common cold. In: Cochrane Database Syst Rev. Nr. 2, 2000, S. CD001364. doi:10.1002/14651858.CD001364. PMID 10796643
- WHO/UNICEF JOINT STATEMENT: CLINICAL MANAGEMENT OF ACUTE DIARRHOEA. Archiviert vom Original am 27. Juli 2007; abgerufen am 24. Januar 2017.
- Marzia Lazzerini, Humphrey Wanzira: Oral zinc for treating diarrhoea in children. In: Cochrane Database of Systematic Reviews. Nr. 12, 20. Dezember 2016, doi:10.1002/14651858.CD005436.pub5View (Art. No.: CD005436).
- National Pollutant Inventory: Zinc and compounds
- Norman N. Greenwood, A. Earnshaw: Chemistry of the Elements. 2. Auflage, Butterworth-Heinemann, Oxford 1997, ISBN 0-7506-3365-4


