Fluor
Fluor [ˈfluːoːɐ̯] ist ein chemisches Element mit dem Symbol F und der Ordnungszahl 9. Im Periodensystem steht es in der 7. Hauptgruppe und gehört damit zur 17. IUPAC-Gruppe, den Halogenen, von denen es das leichteste ist. Es liegt unter Normalbedingungen in Form des zweiatomigen Moleküls F2 gasförmig vor und ist das reaktivste aller Elemente[15]. Es reagiert mit allen Elementen mit Ausnahme der Edelgase Helium und Neon. Fluor ist farblos und erscheint stark verdichtet blassgelb. Es ist das elektronegativste aller Elemente und hat in Verbindungen mit anderen Elementen stets die Oxidationsstufe −1.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Fluor, F, 9 | ||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halogene | ||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 17, 2, p | ||||||||||||||||||||||||||||||||||||
| Aussehen | blasses, gelbliches Gas | ||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-954-8 | ||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.029.049 | ||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,028 %[1] | ||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||
| Atommasse | 18,998403163(6)[3] u | ||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 50 (42) pm | ||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 71 pm | ||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 147 pm | ||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [He] 2s2 2p5 | ||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 17.42282(5) eV[4] ≈ 1681.05 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 34.97081(12) eV[4] ≈ 3374.17 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 62.70798(25) eV[4] ≈ 6050.4 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 87.175(17) eV[4] ≈ 8411.11 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 114.249(6) eV[4] ≈ 11023.3 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||
| 6. Ionisierungsenergie | 157.16311(25) eV[4] ≈ 15163.9 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||
| 7. Ionisierungsenergie | 185.1868(6) eV[4] ≈ 17867.8 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig (F2) | ||||||||||||||||||||||||||||||||||||
| Dichte | 1,6965 kg/m3[7] bei 273 K | ||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch | ||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 53,53 K (−219,62 °C) | ||||||||||||||||||||||||||||||||||||
| Siedepunkt | 85,15 K[8] (−188 °C) | ||||||||||||||||||||||||||||||||||||
| Molares Volumen | (fest) 11,20 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 6,32 kJ/mol[8] | ||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 0,2552 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,0279 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Chemisch [9] | |||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −1 | ||||||||||||||||||||||||||||||||||||
| Normalpotential | 2,87 V (F + e− → F−) | ||||||||||||||||||||||||||||||||||||
| Elektronegativität | 3,98[10] (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 0,15 mg·m−3[14] | ||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||
Der Name des Elementes ist von lateinisch fluores für Flussspat abgeleitet, dem natürlich vorkommenden Mineral Fluorit, das in der Metallurgie als Flussmittel zur Herabsetzung des Schmelzpunktes von Erzen verwendet wird.
Elementares Fluor ist stark ätzend und sehr giftig; sein durchdringender Geruch kann schon in geringeren Konzentrationen bemerkt werden. Dessen Salze – Fluoride und diverse Fluorokomplexsalze wie Natriummonofluorophosphat – sind in höherer Konzentration ebenfalls giftig. Schon in Spuren beeinflussen Fluor und Fluoride die Bildung von Knochen und Zähnen, insbesondere des Zahnschmelzes. Sie werden daher zur Prophylaxe von Zahnkaries in Zahnpasten eingesetzt sowie als Fluoridierung dem Trinkwasser oder dem Speisesalz zugesetzt.
Geschichte
Das erste beschriebene Fluorsalz war das natürlich vorkommende Calciumfluorid (Flussspat). Es wurde 1530 von Georgius Agricola beschrieben und 1556 von ihm als Hilfsmittel zum Schmelzen von Erzen erwähnt.[16] Es macht Erzschmelzen und Schlacken dünnflüssiger, lässt sie fließen (Flussmittel).
Carl Wilhelm Scheele beschäftigte sich ab 1771 erstmals eingehender mit Flussspat und seinen Eigenschaften, sowie der daraus bei Säurebehandlung gebildeten Flusssäure. Er erforschte die Reaktionen bei Einwirkung von Flusssäure auf Glas unter Bildung von Siliciumtetrafluorid und Fluorkieselsäure. Eine weitere Eigenschaft, die er an Flussspat entdeckte, war die Fluoreszenz, die nach dem Mineral benannt ist.[16]

In einem Leserbrief an das Philosophical Magazine, der lediglich mit dem Kürzel „E.B.“ signiert ist, beklagte 1808 der Schreiber das seiner Meinung nach inkonsequente Vorgehen bei der Namensgebung für neue Elemente. In einem Nachtrag schlug er für den in der Flusssäure (engl.: fluoric acid) gebundenen Grundstoff den Namen Fluor vor.[17] André-Marie Ampère äußerte in einem Brief vom 25. August 1812 an Humphry Davy den Gedanken, dass wie in der Salzsäure auch in der Flusssäure das Radikal (engl.: fluorine. gelegentlich auch fluorin. in Analogie zu chlorine für Chlor) an Wasserstoff gebunden sei.[18] Danach versuchten viele Chemiker das Element zu isolieren, was wegen seiner Reaktivität und Giftigkeit aber schwierig war. Am 26. Juni 1886 gelang es Henri Moissan erstmals, elementares Fluor herzustellen und zu charakterisieren. Er erhielt es durch Elektrolyse einer Lösung von Kaliumhydrogendifluorid in flüssigem Fluorwasserstoff bei tiefen Temperaturen in einer speziell entwickelten Apparatur (teilweise aus Flussspat). Für diese Leistung erhielt Moissan 1906 den Nobelpreis für Chemie.[19]
Aufschwung nahm die Fluorherstellung im Zweiten Weltkrieg, zum einen durch die Entwicklung der Atomwaffen in den USA (Manhattan-Projekt), da die Isotopenanreicherung von 235Uran über gasförmiges Uranhexafluorid (UF6) erfolgt, das mit Hilfe von elementarem Fluor hergestellt wird.[20][21] Zum anderen betrieb die I.G. Farben in Gottow damals eine Fluorelektrolyse-Zelle, deren Produkt angeblich nur zur Herstellung eines neuen Brandmittels (Chlortrifluorid) für Brandbomben dienen sollte.[22] Ob es in Deutschland damals möglich gewesen wäre, mit Hilfe dieser Fluorproduktion 235Uran anzureichern, ist kontrovers diskutiert worden.[23][24]
In Knochen kann Fluor selbst dann noch angereichert werden, wenn sie als Fossilien tausende Jahre in Erdreich eingebettet sind. Dieser Umstand wurde vor allem zwischen 1950 und 1970 in Form der Fluor-Datierung für die Altersbestimmung von Knochenfunden genutzt.[25]
Vorkommen

In der Erdkruste ist Fluor mit 525 ppm ein relativ häufiges Element.[26] Es kommt aufgrund seiner Reaktivität in der Natur nur äußerst selten elementar, sondern fast ausschließlich gebunden als Fluorid in Form einiger Minerale vor. Eine Ausnahme bildet Stinkspat (eine uranhaltige Fluorit-Varietät) u. a. aus Wölsendorf, sowie Villiaumit, in denen geringe Mengen elementares Fluor durch Radiolyse entstanden sind, was bei mechanischen Bearbeitungen einen starken Geruch durch freigesetztes Fluor verursacht.[27][28] Meerwasser enthält wenig gelöste Fluoride, da bei Anwesenheit von Calcium die Löslichkeit durch Bildung von schwerlöslichem Calciumfluorid eingeschränkt wird. Die häufigsten Fluorminerale sind der Fluorit CaF2 und der Fluorapatit Ca5(PO4)3F. Der größte Teil des Fluorits ist in Fluorapatit gebunden, jedoch enthält dieser nur einen geringen Massenanteil Fluor von ca. 3,8 %. Daher wird Fluorapatit nicht wegen seines Fluorgehaltes, sondern vor allem als Phosphatquelle abgebaut. Die Hauptquelle für die Gewinnung von Fluor und Fluorverbindungen ist der Fluorit. Größere Fluoritvorkommen existieren in Mexiko, China, Südafrika, Spanien und Russland. Auch in Deutschland findet sich Fluorit, beispielsweise im eingangs erwähnten Wölsendorf.
Ein weiteres natürlich vorkommendes Fluormineral ist Kryolith Na3AlF6. Die ursprünglich bedeutenden Kryolithvorkommen bei Ivigtut auf Grönland sind ausgebeutet. Das in der Aluminiumproduktion benötigte Kryolith wird heute chemisch hergestellt.
Fluorid-Ionen kommen daneben auch in einigen seltenen Mineralen vor, in denen sie die Hydroxidgruppen ersetzen. Beispiele sind Asbest sowie der Schmuckstein Topas Al2SiO4(OH, F)2, Sellait MgF2 und Bastnäsit (La,Ce)(CO3)F. Eine Übersicht gibt die Kategorie:Fluormineral.
Einige wenige Organismen können Fluoride in fluororganische Verbindungen einbauen. Der südafrikanische Busch Gifblaar und weitere Pflanzenarten der Gattung Dichapetalum können Fluoressigsäure synthetisieren und in ihren Blättern speichern. Dies dient zur Abwehr von Fressfeinden, für die Fluoressigsäure tödlich wirkt. Die Giftwirkung wird durch Unterbrechung des Citratzyklus ausgelöst.[29]
Gewinnung und Darstellung

Das Ausgangsmaterial für die Gewinnung elementaren Fluors und anderer Fluorverbindungen ist überwiegend Fluorit (CaF2). Aus diesem wird durch Reaktion mit konzentrierter Schwefelsäure Fluorwasserstoff gewonnen.
- Reaktion von Calciumfluorid mit Schwefelsäure.
Eine weitere Quelle für Flusssäure ist die Phosphatgewinnung, bei der Flusssäure als Abfallprodukt bei der Verarbeitung von Fluorapatit entsteht.
Der größte Teil der produzierten Flusssäure wird zur Herstellung fluorierter Verbindungen eingesetzt. Wo dazu die Reaktivität der Flusssäure nicht ausreicht, gelangt elementares Fluor zum Einsatz, das aus einem kleineren Teil der HF-Produktion gewonnen wird.
Da Fluor eines der stärksten Oxidationsmittel ist, kann es auf chemischem Weg nur sehr umständlich und nicht wirtschaftlich gewonnen werden. Stattdessen wird ein elektrochemisches Verfahren eingesetzt. Die Bruttoreaktion verläuft gemäß:
Das Verfahren wird nach Henri Moissan benannt. Dabei wird kein reiner Fluorwasserstoff zur Elektrolyse verwendet, sondern eine Mischung von Kaliumfluorid und Fluorwasserstoff im Verhältnis von 1:2 bis 1:2,2.[30] Der Hauptgrund für die Verwendung dieser Mischung liegt darin, dass die Leitfähigkeit der Schmelze im Vergleich zu reinem Fluorwasserstoff, der wie reines Wasser Strom nur sehr wenig leitet, stark erhöht ist. Für die Elektrolyse ist es wichtig, dass die Schmelze komplett wasserfrei ist, da sonst während der Elektrolyse Sauerstoff anstatt Fluor entstehen würde.
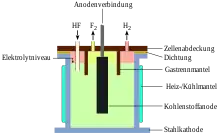
Technisch wird das sogenannte Mitteltemperatur-Verfahren mit Temperaturen von 70 bis 130 °C und einer Kaliumfluorid-Fluorwasserstoff-Mischung von 1:2 angewendet. Bei höheren Fluorwasserstoffgehalten würde ein größerer Dampfdruck entstehen, so dass bei tiefen Temperaturen und aufwändiger Kühlung gearbeitet werden müsste. Bei niedrigeren Gehalten (etwa 1:1) sind die Schmelztemperaturen höher (1:1-Verhältnis: 225 °C), was den Umgang erheblich erschwert und die Korrosion fördert. Die Elektrolyse findet mit Graphit-Elektroden in Zellen aus Stahl oder Monel statt, die zusätzliche Eisenbleche zur Trennung von Anoden- und Kathodenraum enthalten, um eine Durchmischung der entstehenden Gase zu verhindern. An die Elektroden wird eine Spannung von etwa 8–12 Volt angelegt. Der bei der Elektrolyse verbrauchte Fluorwasserstoff wird kontinuierlich ersetzt.
Das Rohfluor, das die Elektrolysezelle verlässt, ist mit Fluorwasserstoff verunreinigt, enthält aber auch Sauerstoff, Tetrafluormethan (CF4) und andere Perfluorcarbone, die durch Reaktion von Fluor und dem Elektrodenmaterial entstehen. Diese Verunreinigungen können durch Ausfrieren und Adsorption von Fluorwasserstoff an Natriumfluorid entfernt werden.
Im Labor kann Fluor durch Zersetzung von Mangantetrafluorid (MnF4) dargestellt werden. Hierzu wird zunächst K2MnF6 mit SbF5 versetzt, wobei das instabile blauviolette MnF4 freigesetzt wird. Dieses Mangantetrafluorid zerfällt bei Temperaturen über 150 °C in F2 und MnF3.[31]
Eigenschaften
Physikalische Eigenschaften
Fluor ist bei Raumtemperatur ein blassgelbes, stechend riechendes Gas. Die Farbe ist von der Schichtdicke abhängig, unterhalb von einem Meter Dicke erscheint das Gas farblos, erst darüber ist es gelb. Unterhalb von −188 °C ist Fluor flüssig und von „kanariengelber“ Farbe.[32] Der Schmelzpunkt des Fluor liegt bei −219,52 °C.[33] Von festem Fluor sind zwei Modifikationen bekannt. Zwischen −227,6 °C und dem Schmelzpunkt liegt Fluor in einer kubischen Kristallstruktur mit Gitterparameter a = 667 pm vor (β-Fluor).[34] Unterhalb von −227,6 °C ist die monokline α-Modifikation mit den Gitterparametern a = 550 pm, b = 328 pm, c = 728 pm und β = 102,17° stabil.[35] Fluor ist mit einer Dichte von 1,6959 kg/m³ bei 0 °C und 1013 hPa[7] schwerer als Luft. Der kritische Punkt liegt bei einem Druck von 52,2 bar und einer Temperatur von 144,2 K (−129 °C).[36]
Moleküleigenschaften
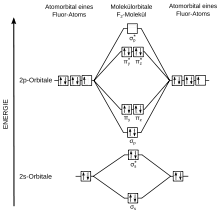
Fluor liegt im elementaren Zustand wie die anderen Halogene in Form zweiatomiger Moleküle vor. Die Bindungslänge im Fluormolekül ist mit 144 pm kürzer als die Einfachbindungen in anderen Elementen (beispielsweise Kohlenstoff-Kohlenstoff-Bindung: 154 pm). Trotz dieser kurzen Bindung ist die Dissoziationsenergie der Fluor-Fluor-Bindung im Vergleich zu anderen Bindungen mit 158 kJ/mol gering und entspricht etwa der des Iodmoleküls mit einer Bindungslänge von 266 pm. Die Gründe für die geringe Dissoziationsenergie liegen vor allem darin, dass sich die freien Elektronenpaare der Fluoratome stark nähern und es zu Abstoßungen kommt. Diese schwache Bindung bewirkt die hohe Reaktivität des Fluors.
Durch die Molekülorbitaltheorie lässt sich die Bindung im Fluormolekül ebenfalls erklären. Dabei werden die s- und p-Atomorbitale der einzelnen Atome zu bindenden und antibindenden Molekülorbitalen zusammengesetzt. Die 1s- und 2s-Orbitale der Fluoratome werden jeweils zu σs und σs*- bindenden und antibindenden Molekülorbitalen. Da diese Orbitale vollständig mit Elektronen gefüllt sind, tragen sie nichts zur Bindung bei. Aus den 2p-Orbitalen werden insgesamt sechs Molekülorbitale mit unterschiedlicher Energie. Dies sind die bindenden σp-, πy- und πz- sowie die entsprechenden antibindenden σp*-, πy*- und πz*-Molekülorbitale. Die π-Orbitale besitzen dabei gleiche Energie. Werden Elektronen in die Molekülorbitale verteilt, kommt es dazu, dass sowohl sämtliche bindenden als auch die antibindenden π*-Orbitale vollständig besetzt sind. Dadurch ergibt sich eine Bindungsordnung von (6–4)/2 = 1 und ein diamagnetisches Verhalten, das auch beobachtet wird.
Chemische Eigenschaften
Fluor gehört zu den stärksten bei Raumtemperatur beständigen Oxidationsmitteln. Es ist das elektronegativste Element und reagiert mit allen Elementen außer Helium und Neon. Die Reaktionen verlaufen meist heftig. So reagiert Fluor im Gegensatz zu allen anderen Halogenen ohne Lichtaktivierung selbst als Feststoff bei −200 °C explosiv mit Wasserstoff unter Bildung von Fluorwasserstoff. Fluor ist das einzige Element, das mit den Edelgasen Krypton, Xenon und Radon direkt reagiert. So bildet sich bei 400 °C aus Xenon und Fluor Xenon(II)-fluorid.
Auch viele andere Stoffe reagieren lebhaft mit Fluor, darunter viele Wasserstoffverbindungen wie beispielsweise Wasser, Ammoniak, Monosilan, Propan oder organische Lösungsmittel. Mit Wasser reagiert Fluor bei verschiedenen Bedingungen unterschiedlich. Werden geringe Mengen Fluor in kaltes Wasser geleitet, bilden sich Wasserstoffperoxid und Flusssäure.[37]
Bei der Reaktion eines Fluor-Überschusses mit geringen Wassermengen, Eis oder Hydroxiden entstehen dagegen als Hauptprodukte Sauerstoff und Sauerstoffdifluorid.[37]
Mit festen Materialien reagiert Fluor dagegen wegen der kleineren Angriffsfläche langsamer und kontrollierter. Bei vielen Metallen führt die Reaktion mit elementarem Fluor zur Bildung einer Passivierungsschicht auf der Metalloberfläche, die das Metall vor dem weiteren Angriff des Gases schützt. Da die Schicht bei hohen Temperaturen oder Fluordrücken nicht dicht ist, kann es dabei zu einer Weiterreaktion von Fluor und Metall kommen, die zur Aufschmelzung des Materials führt. Da beim Aufschmelzen ständig frisches Metall freigelegt wird, das dann wieder zur Reaktion mit Fluor bereitsteht, kann es letztlich sogar zu einem unkontrollierten Reaktionsverlauf kommen (so genanntes Fluorfeuer).
Auch Kunststoffe reagieren bei Raumtemperatur zumeist sehr kontrolliert mit elementarem Fluor. Wie bei den Metallen, führt auch beim Kunststoff die Reaktion mit Fluor zur Bildung einer fluorierten Oberflächenschicht.
Glas ist bei Raumtemperatur gegen Fluorwasserstoff-freies Fluor inert. Bei höherer Temperatur wird jedoch eine mehr oder weniger schnelle Reaktion beobachtet. Verantwortlich hierfür sind Fluoratome, die durch die thermische Dissoziation des molekularen Fluors gebildet werden und dadurch besonders reaktionsfreudig sind. Produkt der Reaktion ist gasförmiges Siliciumtetrafluorid. Spuren von Fluorwasserstoff führen dagegen auch ohne Erhitzen zu einer schnellen Reaktion.
Isotope
Fluor ist eines von 22 Reinelementen. Natürlich vorkommendes Fluor besteht zu 100 % aus dem Isotop 19F. Daneben sind weitere 16 künstliche Isotope von 14F bis 31F sowie das Isomer 18mF bekannt.[38] Außer dem Isotop 18F, das eine Halbwertszeit von 109,77 Minuten besitzt, zerfallen alle anderen künstlichen Isotope innerhalb von Zeptosekunden (10−21s) bis etwas über einer Minute.
18F wird in der Krebsdiagnostik in Form von Fluordesoxyglucose, Fluorethylcholin, Fluorethyltyrosin bzw. 18F-Fluorid als Radionuklid in der Positronen-Emissions-Tomographie (PET) eingesetzt.
Siehe auch: Liste der Fluor-Isotope
Verwendung
Aufgrund der hohen Reaktivität und des schwierigen Umgangs mit Fluor kann elementares Fluor nur eingeschränkt verwendet werden. Es wird überwiegend zu fluorierten Verbindungen weiterverarbeitet, die auf andere Weise nicht hergestellt werden können. Der größte Teil des produzierten Fluors wird für die Herstellung von Uranhexafluorid benötigt, was infolge seiner Leichtflüchtigkeit die Anreicherung von 235U mit Gaszentrifugen oder durch das Gasdiffusionsverfahren ermöglicht. Dieses Isotop ist für die Kernspaltung wichtig. Ein zweites wichtiges Produkt, das nur mit Hilfe von elementarem Fluor hergestellt werden kann, ist Schwefelhexafluorid. Dieses dient als gasförmiger Isolator beispielsweise in Hochspannungsschaltern und gasisolierten Rohrleitern.
Fluor dient zudem zur Oberflächenfluorierung von Kunststoffen. Dies wird unter anderem bei Kraftstofftanks in Automobilen eingesetzt, wobei sich eine fluorierte Barriereschicht ausbildet, die unter anderem eine niedrigere Benzindurchlässigkeit bewirkt. Diese Anwendung der Fluorierung steht in Konkurrenz zur Koextrusionstechnologien und dem Metalltank. Eine zweite Wirkung der Fluorierung ist, dass die Oberflächenenergie vieler Kunststoffe erhöht werden kann. Dies findet vor allem Anwendungen, wo Farben, Lacke oder Klebstoffe auf ansonsten hydrophobe Kunststoffoberflächen (Polyolefine) aufgebracht werden sollen. Die Vorteile der Fluorierung von Kunststoffoberflächen liegen in der Behandelbarkeit von Körpern mit ausgeprägten 3D-Strukturen und Hohlräumen. Zudem lassen sich Kleinteile als Schüttgut behandeln und der Effekt bleibt über eine lange Zeit erhalten. Die Fluorierung wird eingesetzt, wenn weiter verbreitete und kostengünstigere Methoden, wie z. B. die Beflammung, nicht einsetzbar sind. Weiter mögliche Effekte, die durch Fluorierung von Kunststoffoberflächen erreicht werden können, sind: verbesserte Faser-Matrix-Haftung, verringerte Reibung und verbesserte Selektivitäten in der Membrantechnik.[39]
Werden Fluor und Graphit zusammen erhitzt, entsteht Graphitfluorid, das als Trockenschmiermittel und Elektrodenmaterial eingesetzt werden kann.
Nachweis
Für Fluoridionen existieren mehrere Nachweise. Bei der sogenannten Kriechprobe wird in einem Reagenzglas aus Glas eine fluoridhaltige Substanz mit konzentrierter Schwefelsäure versetzt.
- Fluorid-Ionen reagieren mit Schwefelsäure zu Sulfat-Ionen und Fluorwasserstoff.
Es steigen Fluorwasserstoffdämpfe auf, die das Glas anätzen. Gleichzeitig ist die Schwefelsäure aufgrund der Veränderung der Oberfläche nicht mehr in der Lage, das Glas zu benetzen.[40]
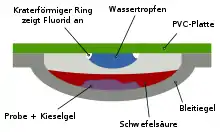
Eine zweite Nachweismöglichkeit ist die sogenannte Wassertropfenprobe. Dabei wird die fluoridhaltige Substanz mit Kieselsäure und Schwefelsäure zusammengebracht. Es entsteht gasförmiges Siliciumtetrafluorid. Über das Gefäß mit der Probe wird ein Wassertropfen gehalten. Durch Reaktion von Siliciumtetrafluorid mit dem Wasser bildet sich Siliciumdioxid, das als charakteristischer weißer Rand um den Tropfen kristallisiert.[40]
- Bildung des Siliciumtetrafluorids.
- Reaktion im Wassertropfen
Siehe auch: Nachweise für Fluorid
In der modernen Analytik, insbesondere für organische Fluorverbindungen spielt die NMR-Spektroskopie eine große Rolle. Fluor besitzt den Vorteil, zu 100 % aus einem Isotop (Reinelement) zu bestehen, das durch NMR-Spektroskopie nachweisbar ist.
Biologische Bedeutung
Es ist umstritten, ob Fluor ein für den menschlichen Organismus essentielles Spurenelement ist.[41] Laut einem im Jahr 2013 veröffentlichten Gutachten der Europäischen Behörde für Lebensmittelsicherheit (EFSA) ist Fluorid kein essentieller Nährstoff, da es weder Wachstumsprozessen noch der Zahnentwicklung dient und Zeichen eines Fluoridmangels nicht identifiziert werden konnten.[42]
Im Körper sind etwa 5 g Fluoride (bei 70 kg Körpergewicht) enthalten.[43] Es ist sehr ungleichmäßig verteilt, der weitaus größte Teil ist in den Knochen und Zähnen enthalten.
Fluorid kann vor Zahnkaries schützen und den Zahnschmelz härten. Durch den Einbau von Fluorid- anstatt von Hydroxid-Ionen in den Hydroxylapatit der Zähne entsteht Fluorapatit. Fluorid wirkt durch die geringe Löslichkeit des Fluorapatits remineralisierend, indem der durch Säuren aufgelöste Apatit in Anwesenheit von Fluorid wieder ausgefällt wird. Außerdem wirkt Fluorid hemmend auf bestimmte Enzyme und bewirkt eine Unterbrechung der Glykolyse in kariesverursachenden Bakterien, was deren Wachstum hemmt.[44]
Die Aufnahme von Fluorid auf natürlichen Wegen erfolgt in der Regel mit dem Trinkwasser oder der Nahrung. Nehmen Kinder während der Zahnentwicklung zu viel Fluorid auf, kann sich eine Dentalfluorose bilden. Diese bewirkt punktförmige bis fleckig-braune Verfärbungen (mottled teeth oder mottled enamel) auf der Zahnoberfläche, zudem ist der Zahn fragiler und weniger widerstandsfähig. Die maximal empfohlenen Höchstmengen an Fluorid, die ein Mensch täglich zu sich nehmen sollte, betragen für Säuglinge bis sechs Monate 0,7 mg, von 7–17 Monaten 0,9 mg bei Kindern bis drei Jahren 1,3 mg. Kinder von vier bis acht Jahren sollten nicht mehr als 2,2 mg Fluorid pro Tag aufnehmen. Wenn danach die Zahnentwicklung abgeschlossen ist, verträgt der Mensch höhere Dosen bis zu 10 mg Fluorid pro Tag.[45]
In Deutschland ist die Trinkwasserfluoridierung nicht zulässig, in der Schweiz wurde sie bis 2003 in Basel durchgeführt. Bis zum Jahr 2000 durfte darum in Basel auch kein fluoridhaltiges Salz verkauft werden.[46]
Da Fluorid ähnlich Selen in größeren Mengen toxisch wirkt, existiert nur ein kleiner Bereich, in dem Fluorid im Körper vorkommen darf, ohne toxisch zu wirken.
Toxikologie
Fluor und viele Fluorverbindungen sind für den Menschen und andere Lebewesen sehr giftig, die letale Dosis (LD50, eine Stunde) liegt bei elementarem Fluor bei 150–185 ppm.[7] Elementares Fluor wirkt auf Lunge, Haut und besonders auf die Augen stark verbrennend und verätzend. Schon bei einem fünfminütigen Kontakt mit 25 ppm Fluor kommt es zu einer erheblichen Reizung der Augen. Gleichzeitig entsteht durch Reaktion mit Wasser (Luftfeuchtigkeit, Hautoberfläche) der ebenfalls giftige Fluorwasserstoff.[7] Eine akute Fluorvergiftung äußert sich je nachdem, über welchen Weg, in welcher Verbindung und Dosis das Fluor in den Körper gelangt ist, mit unterschiedlichen Beschwerden. Eine gastrointestinal entstandene akute Vergiftung mit Fluoriden führt zu Schleimhautverätzungen, Übelkeit, anfänglich schleimigem, später blutigem Erbrechen, unstillbarem Durst, heftigen Leibschmerzen und blutigem Durchfall. Teilweise versterben Betroffene. Bei Aufnahme von Fluorwasserstoff und staubförmigen Fluoriden mit der Atemluft folgen Tränenfluss, Niesen, Husten, Atemnot, Lungenödem bis hin zum Tod unter Krämpfen. Eine über die Haut entstandene Vergiftung mit Fluorwasserstoff (auch in sauren Lösungen von Fluoriden) hat tiefgreifende Nekrosen und schlecht heilende Ulzera zur Folge.
Als schwach dissoziiertes Molekül wird Fluorwasserstoff leicht durch die Haut aufgenommen. Es kommt zu schmerzhaften Entzündungen, später zu hartnäckigen, schlecht abheilenden Geschwüren.[47] Außerdem bildet HF starke Wasserstoffbrückenbindungen aus und ist so in der Lage, die Tertiärstruktur von Proteinen zu verändern.[48] Mit Aluminium-Ionen bildet Fluorid Fluoridoaluminat-Komplexe, die eine Phosphat-analoge Struktur haben und so zur Deregulierung von G-Proteinen beitragen.[49] Resultat ist ein Eingriff in die rezeptorgekoppelte Signalübertragung und – via signalabhängige Phosphorylierung/Dephosphorylierung – in die Aktivität vieler Enzyme. Bekanntestes Beispiel für eine Enzym-Hemmung durch Fluorid ist die Enolase, ein Enzym der Glykolysekette. Diese Hemmung macht man sich bei der Blutzuckermessung zu Nutze: Das im Entnahmeröhrchen vorgelegte Natriumfluorid hemmt den in-vitro Abbau der Glucose nach der Blutentnahme, sodass der später gemessene Wert dem tatsächlichen in-vivo Wert möglichst nahekommt.[50]
Die hochtoxischen Fluoracetate und Fluoracetamid werden nach der Resorption zu Fluorcitrat metabolisiert. Diese Verbindung führt zur Blockade des für den Citratzyklus wichtigen Enzyms Aconitase. Dies bewirkt eine Anreicherung von Citrat im Blut, was wiederum die Körperzellen von der Energiezufuhr abschneidet.[51] Perfluorierte Alkane, die als Blutersatzstoffe in der Erprobung sind, und die handelsüblichen Fluorcarbone, wie PTFE (Teflon), PVDF oder PFA gelten als ungiftig.
Das schwerlösliche Calciumfluorid, das sich bei der Reaktion mit Calcium – etwa in den Knochen – bildet, wurde früher für inert und daher harmlos gehalten. Zumindest die Stäube von Calciumfluorid haben sich jedoch sowohl im Tierversuch, als auch beim Menschen, als toxisch erwiesen.[52][53][54][55][56] Ob in vivo bei akuter Fluoridvergiftung tatsächlich schwerlösliches Calciumfluorid gebildet wird, wie so oft vermutet, konnte im Rahmen gezielter Untersuchungen nicht bewiesen werden.[57]
Die Aufnahme von mehr als 20 mg Fluorid pro Tag führt zu einer chronischen Fluorvergiftung, die auch Fluorose genannt wird. Symptome sind Husten, Auswurf, Atemnot, eine Dentalfluorose mit Veränderung von Struktur und Farbe des Zahnschmelzes, eine Fluorosteopathie und teilweise eine Fluorokachexie. Die Fluorosteopathie führt durch Vermehrung des Knochengewebes zu Elastizitätsverlust und erhöhten Knochenbrüchigkeit (Osteosklerose) bis hin zum völligen Versteifen von Gelenken oder gar der Wirbelsäule.[47] Da gleichzeitig mit Hilfe hoher Fluoriddosen das Knochenwachstum stimuliert werden kann, verwendet man Fluoride zur Behandlung verschiedener Formen der Osteoporose.[47]
Frühere Studien untersuchten einen möglichen Zusammenhang von Fluoridaufnahme durch Trinkwasser und dem Auftreten von Osteosarkomen, einer Krebsart.[58][59] Die aufgenommene Fluoridmenge wurde geschätzt anhand der bevorzugten Trinkwasserquelle. Eine statistische Analyse hierzu fand eine positive Korrelation von Fluoridaufnahme und Krebsrate, allerdings nur bei Männern, nicht bei Frauen.[59] Ein unabhängiger Kommentar zu dieser Analyse bemerkt, dass der Zusammenhang lediglich bei der ersten Gruppe der untersuchten Personen feststellbar war, bei einer späteren zweiten Gruppe hingegen nicht mehr. Die Autoren kommen darin zu der Einschätzung, dass daraus kein erhöhtes Krebsrisiko abgeleitet werden kann.[60] Die Internationale Agentur für Krebsforschung war in ihrer Bewertung 1982 zu dem Ergebnis gekommen, dass es keine Anzeichen einer krebserzeugenden Wirkung von anorganischen Fluoriden im Zusammenhang mit der Trinkwasserfluoridierung gibt.[61] Mittlerweile wird ein Zusammenhang bestritten.[62]
Schäden, die durch die Arbeit mit Fluoriden entstehen, wie Skelettfluorose, Lungenschäden, Reizung des Magen-Darm-Trakts oder Verätzungen sind als Berufskrankheiten anerkannt. Im Berufskrankheiten-System sind sie unter Bk Nr. 13 08 erfasst.[63]
Sicherheitshinweise
Auf Grund seiner hohen Reaktivität muss Fluor in speziellen Behältnissen aufbewahrt werden. Die Werkstoffe müssen dabei so beschaffen sein, dass sie durch den Kontakt mit Fluor eine Passivierungsschicht ausbilden und so eine Weiterreaktion verhindern. Beispiele für geeignete Werkstoffe sind Stahl oder die Nickel-Kupfer-Legierung Monel. Nicht geeignet sind beispielsweise Glas, das durch entstandenen Fluorwasserstoff angegriffen wird, oder Aluminium. Brennbare Stoffe wie Fett dürfen ebenfalls nicht in Kontakt mit Fluor kommen, da sie unter heftiger Reaktion verbrennen.[7]
Fluor brennt zwar selbst nicht, wirkt aber brandfördernd. Brände bei Anwesenheit von Fluor können nicht mit Löschmitteln gelöscht werden, es muss zunächst der weitere Zutritt von Fluor verhindert werden.[7]
Verbindungen
Als elektronegativstes aller Elemente kommt Fluor in Verbindungen fast ausschließlich in der Oxidationsstufe −I vor. Es sind von allen Elementen außer Helium und Neon Fluorverbindungen bekannt.
Fluorwasserstoff
Fluorwasserstoff ist ein stark ätzendes, giftiges Gas. Die wässrige Lösung des Fluorwasserstoffs wird Flusssäure genannt. Während wasserfreier, flüssiger Fluorwasserstoff zu den stärksten Säuren, den so genannten Supersäuren zählt, ist Flusssäure nur mittelstark. Fluorwasserstoff ist eine der wenigen Substanzen, die direkt mit Glas reagieren. Dementsprechend ist die Verwendung als Ätzlösung in der Glasindustrie eine Anwendung von Flusssäure. Darüber hinaus ist Fluorwasserstoff das Ausgangsmaterial für die Herstellung von Fluor und vielen anderen Fluorverbindungen.
Fluoride

Fluoride sind die Salze des Fluorwasserstoffs. Sie sind die wichtigsten und verbreitetsten Fluorsalze. In der Natur kommt vor allem das schwerlösliche Calciumfluorid CaF2 in Form des Minerals Fluorit vor. Technisch spielen auch andere Fluoride eine Rolle. Beispiele sind das unter Verwendung erwähnte Uranhexafluorid oder Natriumfluorid, das unter anderem als Holzschutzmittel verwendet wird und vor etwa 100 Jahren als Rattengift und Insektizid vermarktet wurde.[64]
Ein in der organischen Chemie häufig verwendetes Fluorid ist das Tetrabutylammoniumfluorid (TBAF). Da TBAF in organischen Lösungsmitteln löslich ist und das Fluoridion nicht durch Kationen beeinflusst wird (sogenanntes „nacktes Fluorid“) wird es als Fluoridquelle in organischen Reaktionen benutzt. Eine weitere wichtige Reaktion des Tetrabutylammoniumfluorids ist die Abspaltung von Silylethern, die als Schutzgruppe für Alkohole verwendet werden.[65]
Organische Fluorverbindungen
Es existiert eine Reihe von organischen Fluorverbindungen. Eine der bekanntesten fluorhaltigen Stoffgruppen sind die Fluorchlorkohlenwasserstoffe (FCKW). Die niedermolekularen FCKW mit einem oder zwei Kohlenstoffatomen sind gasförmige Stoffe und dienten früher als Kältemittel in Kühlschränken und Treibgas für Spraydosen. Da diese Stoffe den Ozonabbau verstärken und somit die Ozonschicht schädigen, ist ihre Herstellung und Verwendung mit dem Montreal-Protokoll stark eingeschränkt worden. Dagegen sind Fluorkohlenwasserstoffe für die Ozonschicht ungefährlich. Eine weitere umweltschädliche Auswirkung fluorhaltiger organischer Verbindungen ist ihre Absorptionsfähigkeit für Infrarotstrahlung. Daher wirken sie als Treibhausgase.[66]
Eine aus dem Alltag bekannte organische Fluorverbindung ist Polytetrafluorethen (PTFE), die unter dem Handelsnamen Teflon® als Beschichtung von Bratpfannen verwendet wird. Perfluorierte Tenside, die unter anderem bei der Herstellung von PTFE verwendet werden, und andere perfluorierte Verbindungen verfügen über eine äußerst stabile Kohlenstoff-Fluor-Bindung. Diese Bindung verleiht den Stoffen eine hohe chemische und thermische Beständigkeit, was aber auch dazu führt, dass die Substanzen in der Umwelt persistent sind und kaum abgebaut werden.[67]
Siehe auch Kategorie:Organofluorverbindung
Weitere Fluorverbindungen
Mit den anderen Halogenen bildet Fluor eine Reihe von Interhalogenverbindungen. Ein wichtiges Beispiel hierfür ist Chlortrifluorid, ein giftiges Gas, das vor allem als Fluorierungsmittel eingesetzt wird.
Fluor ist elektronegativer als Sauerstoff, weshalb die Verbindungen zwischen Fluor und Sauerstoff nicht wie die anderen Halogen-Sauerstoffverbindungen als Halogenoxide, sondern als Sauerstofffluoride bezeichnet werden.
Im Gegensatz zu den schwereren Halogenen existiert nur eine Fluorsauerstoffsäure, die Hypofluorige Säure HOF. Der Grund hierfür liegt darin, dass Fluor keine Drei-Zentren-vier-Elektronen-Bindungen ausbildet.
Fluor bildet auch mit den Edelgasen Krypton, Xenon, und Argon einige Verbindungen wie Xenon(II)-fluorid. Kryptondifluorid, die einzige bekannte Kryptonverbindung, ist das stärkste bekannte Oxidationsmittel. Weitere Edelgasverbindungen des Fluor enthalten oft auch noch Atome anderer Elemente, wie beispielsweise das Argonhydrogenfluorid (HArF), die einzige bekannte Argonverbindung.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 430–433.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. Weinheim 1988, ISBN 3-527-26169-9, S. 1018–1022.
- Michael Binnewies, Manfred Jäckel, Helge Willner, Geoff Rayner-Canham: Allgemeine und Anorganische Chemie. Spektrum Akademischer Verlag, Heidelberg 2004, ISBN 3-8274-0208-5, S. 552, 556–557, 575.
- Ralf Steudel: Chemie der Nichtmetalle. de Gruyter, Berlin 1998, ISBN 3-11-012322-3.
Weblinks
- Woher kommt das Fluor in der Zahnpasta? aus der Fernseh-Sendereihe alpha-Centauri (ca. 15 Minuten). Erstmals ausgestrahlt am 26. Nov. 2003.
- chemie-master.de – Foto von flüssigem Fluor
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Fluor) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu fluorine in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu fluorine bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Fluor) entnommen.
- Eintrag zu Fluor in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. August 2016. (JavaScript erforderlich)
- Yiming Zhang et al.: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Fluor) entnommen.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Molecular Structure and Spectroscopy, S. 9-98.
- W. Herzog, M. Messerschmidt: NMR-Spektroskopie für Anwender. VCH, Weinheim 1995, ISBN 3-527-28690-X.
- H. Friebolin: Basic one- and two-dimensional NMR spectroscopy. 3. Auflage. Wiley-VCH, Weinheim 1998.
- Eintrag zu Fluorine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7782-41-4), abgerufen am 25. November 2019.
- Fluorine, the most reactive chemical element (Encyclopædia Britannica).
- P. Meiers: Fluoride History – 1. Entdeckung des Fluors. April 2007.
- E. B.: On chemical nomenclature. By a correspondent. In: The Philosophical Magazine. 30, Feb.-Mai 1808, S. 320–322.
- Lettres d'Ampère a Davy sur le Fluor in: Annales de Chimie et de Physique [6] 4 (1885) S. 5–9; Brief auf S. 9
- Alain Tressaud: Henri Moissan: Chemie-Nobelpreisträger 1906. In: Angew. Chem. 118, 2006, S. 6946–6950, doi:10.1002/ange.200601600.
- C. Voegtlin, H. C. Hodge: Pharmacology and toxicology of Uranium Compounds. With a section on the pharmacology and toxicology of fluorine and hydrogen fluoride. In: National Nuclear Energy Series. McGraw Hill Book Company, 1949.
- H. Goldwhite: The Manhattan Project. In: R. E. Banks, D. W. A. Sharp, J. C. Tatlow (Hrsg.): Fluorine – the first hundred years. Elsevier, Lausanne/ New York 1986, S. 109 ff.
- E. Karr: Elemental fluorine. I. G. Farbenindustrie Leverkusen. In: FIAT final report. 838, 15. Juni 1946.
- Rainer Karlsch: Hitlers Bombe. Deutsche Verlags-Anstalt, München 2005.
- Joseph M. Scalia: In geheimer Mission nach Japan: U 234. 3. Auflage. Ullstein, 2006 (Hinweis: Mit U 234 ist das U-Boot U 234 gemeint, kein Uranisotop).
- Kenneth Page Oakley: Fluorine and the Relative Dating of Bones. In: The Advancement of Science. Band 4, Nr. 16, 1948, S. 336–337.
- Hans Wedepohl: The composition of the continental crust. In: Geochimica et Cosmochimica Acta. 59, Nr. 7, 1995, S. 1217–1232.
- Jörn Schmedt auf der Günne, Martin Mangstl, Florian Kraus: Elementares Fluor F2 in der Natur – In-situ-Nachweis und Quantifizierung durch NMR-Spektroskopie. In: Angewandte Chemie. 2012, S. 7968–7971, doi:10.1002/ange.201203515.
- V. R. Celinski, M. Ditter, F. Kraus, F. Fujara, J. Schmedt auf der Günne, Chem. Eur. J. 2016, 22, 18388–18393, http://onlinelibrary.wiley.com/doi/10.1002/chem.201603402/full
- Klaus Roth: Das Sinnloseste: der Zitronensäurezyklus. In: Chemie in unserer Zeit. 39, 2005, S. 348–354.
- Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner: Industrielle Anorganische Chemie. 4. Auflage. Wiley, 2013, ISBN 978-3-527-64958-7. (eingeschränkte Vorschau in der Google-Buchsuche)
- Erwin Riedel: Anorganische Chemie. Walter de Gruyter, Berlin 2004.
- J.Burdon et al.: Is fluorine gas really yellow? In: Journal of Fluorine Chemistry. Band 34, Nr. 3-4, 1. Januar 1987, S. 471–474, doi:10.1016/S0022-1139(00)85188-X.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 214.
- Truman H. Jordan et al.: Single‐Crystal X‐Ray Diffraction Study of β‐Fluorine. In: The Journal of Chemical Physics. Band 41, Nr. 3, August 1964, S. 760–764, doi:10.1063/1.1725957.
- L. Pauling, I. Keaveny, A. B. Robinson: The Crystal Structure of α-Fluorine. In: Journal of solid state chemistry. 2, 1970, S. 225–221.
- Eintrag zu Fluor. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- George Hamilton Cady: Reaction of Fluorine with Water and with Hydroxides. In: Journal of the American Chemical Society. 57, 1935, S. 246–249, doi:10.1021/ja01305a006.
- G. Audi et al.: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- A. Tressaud et al.: Modification of surface properties of carbon-based and polymeric materials through fluorination routes: From fundamental research to industrial applications. In: Journal of Fluorine Chemistry. 128, 2007, S. 378–391, doi:10.1016/j.jfluchem.2006.12.015.
- Gerhart Jander, E. Blasius: Einführung in das anorganisch-chemische Praktikum. 15. Auflage. S. Hirzel Verlag, Stuttgart 2005, ISBN 3-7776-1364-9.
- WHO: Fluoride in Drinking-water. Background document for development of WHO Guidelines for Drinking-water Quality WHO/SDE/WSH/03.04/96, World Health Organization 2004 (pdf)
- Nutrition, and Allergies (NDA) EFSA Panel on Dietetic Products: Scientific Opinion on Dietary Reference Values for fluoride. In: EFSA Journal. Band 11, Nr. 8, 1. August 2013, S. n/a–n/a, doi:10.2903/j.efsa.2013.3332 (wiley.com [abgerufen am 6. März 2018]).
- W. Kaim, B. Schwederski: Bioanorganische Chemie. 4. Auflage. Teubner, 2005, ISBN 3-519-33505-0.
- L. Stösser, R. Heinrich-Weltzien: Kariesprävention mit Fluoriden. In: Oralprophylaxe und Kinderzahnheilkunde. 29, 2007.
- Cem Ekmekcioglu, Wolfgang Marktl: Essentielle Spurenelemente: Klinik und Ernährungsmedizin. Springer, 2006, ISBN 3-211-20859-3, S. 142–143 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gesundheitsdepartement Basel-Stadt: Umstellung von der Trinkwasser- zur Salzfluoridierung in Basel. Medienmitteilung vom 24. Juni 2003, abgerufen am 5. Dezember 2012.
- W. Forth et al.: Allgemeine und spezielle Pharmakologie und Toxikologie. 8. Auflage. Urban & Fischer, München 2001, ISBN 3-437-42520-X.
- S. L. Edwards et al.: The crystal structure of fluoride-inhibited cytochrome c peroxidase. In: Journal of Biological Chemistry. Band 259, Nr. 21, 1984, S. 12984–12988 (PDF).
- A. Lubkowska et al.: Interactions between fluorine and aluminium. In: Fluoride. Band 35, Nr. 2, 2002, S. 73–77 (PDF).
- Raymond Gambino, David E. Bruns: Stabilization of glucose in blood samples: out with the old, in with the new. In: Clinical Chemistry and Laboratory Medicine. Band 51, Nr. 10, 1. Oktober 2013, ISSN 1437-4331, S. 1883–1885, doi:10.1515/cclm-2013-0341 (degruyter.com [abgerufen am 11. Februar 2021]).
- A. T. Proudfoot et al.: Sodium Fluoroacetate Poisoning. In: Toxicological Reviews. Band 25, Nr. 4, 2006, S. 213–219, PMID 17288493.
- K. G. Schmidt: Welche Stäube in der keramischen und Glas-Industrie sind gesundheitsschädlich? In: Ber. dtsch. Keram. Ges. 31, 1954, S. 355.
- E. J. King et al.: Tissue reactions produced by calcium fluoride in the lungs of rats. In: British Journal of Industrial Medicine. Band 15, Nr. 3, 1958, S. 168–171, PMID 13596534.
- J. Hilfenhaus et al.: Hämolyse von Säugererythrozyten durch Flußspat. In: Arch. Hyg. Nr. 153, 1969, S. 109.
- Elliott Leyton: Dying Hard. The Ravages of Industrial Carnage. McClelland and Stewart, Toronto 1975, ISBN 0-7710-5304-5 (Nachdruck 1990; berichtet über Schicksale von Flußspatarbeitern).
- R. Rennie: The dirt. Industrial disease and conflict at St. Lawrence, Newfoundland. Fernwood Publishing, 2008, ISBN 978-1-55266-259-5.
- K. Müller: Zur Therapie der Flußsäure-Verätzung anhand eines neuen Tierexperimentellen Modells unter besonderer Berücksichtigung allgemeiner und methodischer Probleme. Inaug. Diss., Gießen 1976.
- P. Meiers: Does Water Fluoridation have Negative Side Effects? A Critique of the York Review, Objective 4, Sections 9.1–9.6. In: Journal of Orthomolecular Medicine. Band 16, Nr. 2, 2001, S. 73–82 (PDF).
- E. B. Bassin et al.: Age-specific fluoride exposure in drinking water and osteosarcoma (United States). In: Cancer Causes & Control. Band 17, 2006, S. 421–428, doi:10.1007/s10552-005-0500-6.
- C. W. Douglass, K. Joshipura: Caution needed in fluoride and osteosarcoma study. In: Cancer Causes & Control. Band 17, 2006, S. 481–482 ().
- Some Aromatic Amines, Anthraquinones and Nitroso Compounds, and Inorganic Fluorides Used in Drinking-water and Dental Preparations. Summary of Data Reported and Evaluation. In: IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Band 27, 1982 (PDF).
- Brock A. Lindsey et al.: Osteosarcoma Overview. In: Rheumatology and Therapy. Band 4, Nr. 1, 8. Dezember 2016, S. 25–43, doi:10.1007/s40744-016-0050-2, PMID 27933467, PMC 5443719 (freier Volltext).
- Helmut Valentin, Gerhard Lehnert, Heinrich Petry: Arbeitsmedizin I. Arbeitsphysiologie und Arbeitshygiene. Grundlagen für Prävention und Begutachtung. 3. Auflage. Georg Thieme Verlag, Stuttgart 1985, ISBN 3-13-572003-9.
- James E. House, Kathleen A. House: Descriptive Inorganic Chemistry. 3. Auflage. Academic Press, 2015, ISBN 978-0-12-802979-4, S. 397.
- Eintrag zu Tetrabutylammonium-Salze. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- [https://de.wikipedia.org/w/index.php?title=Wikipedia:Defekte_Weblinks&dwl=http://www.lfu.bayern.de/umweltwissen/doc/uw_22_fckw.pdf Seite nicht mehr abrufbar], Suche in Webarchiven: [http://timetravel.mementoweb.org/list/2010/http://www.lfu.bayern.de/umweltwissen/doc/uw_22_fckw.pdf FCKW und FCKW-Ersatzstoffe]. Bayerisches Landesamt für Umweltschutz, Mai 2004 (PDF; 358 kB).
- Perfluorierte Verbindungen. Allergie – Umwelt – Gesundheit.



