Sulfoxide
Sulfoxide sind eine Klasse chemischer Verbindungen mit organisch gebundenem Schwefel und der allgemeinen Struktur R1-S(=O)-R2, dabei sind R1 und R2 organische Reste. Die Oxidationsstufe des Schwefels liegt zwischen denen in Sulfiden R1-S-R2 und in Sulfonen R1-S(=O)2-R2.
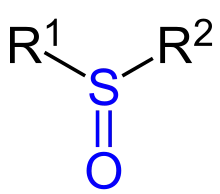
Chiralität
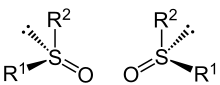
Sulfoxide mit unterschiedlichen Resten R1 und R2 sind chiral, es existieren zwei enantiomere (spiegelbildliche) Formen. Die elektrostatische Abstoßungskraft zwischen dem nichtbindenden Elektronenpaar und den Bindungselektronen führt dazu, dass Sulfoxide nicht planar, sondern pyramidal aufgebaut sind. Daraus ergibt sich deren Chiralität bei ungleichen Substituenten (R1 ≠ R2).[1]
Herstellung
Zur Synthese der Sulfoxide werden die entsprechenden Thioether (Sulfide) oxidiert. Es gibt auch Verfahren zur gezielten Herstellung enantiomerenreiner Sulfoxide.[2]
Vorkommen
Als Inhaltsstoff verschiedener Laucharten (Zwiebeln, Knoblauch) ist das natürliche Sulfoxid Cycloalliin bekannt.
 Knoblauch
Knoblauch Isoalliin – Naturstoff, vorkommend in Laucharten
Isoalliin – Naturstoff, vorkommend in Laucharten Cycloalliin
Cycloalliin
Eigenschaften und Verwendung
Sulfoxide sind schwer flüchtige und polare Verbindungen, ihr einfachster Vertreter ist das als Lösungsmittel benutzte Dimethylsulfoxid. Einige Sulfoxide (Esomeprazol, Omeprazol, Lansoprazol (Takeda), Rabeprazol (Eisai) und Pantoprazol) besitzen als Arzneistoff aus der Gruppe der Protonenpumpenhemmer praktische Bedeutung in der Behandlung von Magen- und Zwölffingerdarmgeschwüren sowie bei Refluxösophagitis.
Dimethylsulfoxid wirkt in der Kornblum-Oxidation als Oxidationsmittel.[3] Dibenzylsulfoxid wird als Bestandteil von Sparbeizen unlegierter und niedrig legierter Stähle verwendet.[4]
Reaktivität
Die Oxidation von Sulfoxiden mit Wasserstoffperoxid oder Kaliumpermanganat liefert Sulfone.
Bindungssituation
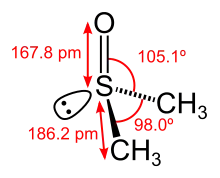
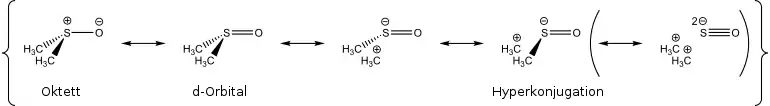
In Lehrbüchern und wissenschaftlichen Artikeln wird die S,O-Bindung auf unterschiedliche Weise dargestellt. Die Schreibweise als S=O-Doppelbindung ist am häufigsten anzutreffen. Gerade in älteren Veröffentlichungen wird die Bindung oft als Pfeil dargestellt (koordinative Bindung). Neuere Lehrbücher bevorzugen z. T. eine Darstellung als Einfachbindung mit Formalladung, welche die Oktettregel erfüllt. Quantenchemische Untersuchungen unterstützen letzteres. Am Sauerstoff finden sich zwei besetzte p-Orbitale, die im Sinne von Hyperkonjugation mit σ*S,C und d-Orbitalen am Schwefel wechselwirken. Diese hyperkonjugativen Wechselwirkungen lassen sich als Bond-no bond-Resonanzformeln darstellen. Eine dadurch erhöhte Bindungsordnung darf jedoch nicht als partielle Doppelbindung angesehen werden, sondern wegen der beiden p-Orbitale am Sauerstoff eher als partielle Dreifachbindung. Diese Sichtweise deckt sich mit theoretischen und experimentellen Untersuchungen der magnetischen Anisotropie.[5]
Siehe auch
Einzelnachweise
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 235–236, ISBN 978-3-906390-29-1.
- Graham E. O'Mahony, Padraig Kelly, Simon E. Lawrence und Anita R. Maguire: Synthesis of enantioenriched sulfoxides, ARCHIVOC 2011, 1–110.
- László Kürti und Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 250–251, ISBN 978-0-12-429785-2.
- Lexikon der Chemie - Spektrum der Wissenschaft: Sparbeizen, abgerufen am 25. Dezember 2016.
- Sebastian Jung, Joachim Podlech: Stereoelectronic Effects: The γ-Gauche Effect in Sulfoxides. In: The Journal of Physical Chemistry A. Band 122, Nr. 26, 5. Juli 2018, S. 5764–5772, doi:10.1021/acs.jpca.8b03729.