Alkalimetalle
Als Alkalimetalle werden die chemischen Elemente Lithium, Natrium, Kalium, Rubidium, Caesium und Francium aus der 1. Hauptgruppe des Periodensystems bezeichnet. Sie sind silbrig glänzende, reaktive Metalle, die in ihrer Valenzschale ein einzelnes Elektron besitzen, das sie als starke Reduktionsmittel leicht abgeben können. Obwohl Wasserstoff in vielen Darstellungen des Periodensystems auch in der ersten Hauptgruppe steht – ganz oben und meist mit einer Lücke abgetrennt, oder in anderer Farbe dargestellt – kann Wasserstoff keinesfalls zu den Alkalimetallen gezählt werden. Als typisches Nichtmetall ist Wasserstoff unter Standardbedingungen gasförmig und nicht fest, hat eine viel größere Ionisierungsenergie und zeigt keine typischen metallische Eigenschaften.[1]
|
Lage im Periodensystem
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 1 |
| Hauptgruppe | 1 |
| Periode | |
| 2 | 3 Li |
| 3 | 11 Na |
| 4 | 19 K |
| 5 | 37 Rb |
| 6 | 55 Cs |
| 7 | 87 Fr |
Etymologie
Der Name der Alkalimetalle leitet sich von dem arabischen Wort القلية / al-qalya für „Pottasche“ ab, die alte Bezeichnung für aus Pflanzenaschen gewonnenes Kaliumcarbonat. Humphry Davy stellte im Jahre 1807 erstmals das Element Kalium durch eine Schmelzflusselektrolyse aus Kaliumhydroxid dar. Letzteres gewann er aus Kaliumcarbonat. In einigen Sprachen spiegelt sich dies im Namen wider. So heißt Kalium beispielsweise im Englischen und Französischen potassium und im Italienischen potassio.
Eigenschaften

Alkalimetalle sind metallisch glänzende, silbrig-weiße weiche Leichtmetalle. Caesium hat bei geringster Verunreinigung einen Goldton. Sie sind mit dem Messer schneidbar. Alkalimetalle haben eine geringe Dichte. Sie reagieren mit vielen Stoffen, so beispielsweise mit Wasser, Luft oder Halogenen teilweise äußerst heftig unter starker Wärmeentwicklung. Insbesondere die schwereren Alkalimetalle können sich an der Luft selbst entzünden. Daher werden sie unter Schutzflüssigkeiten, wie Paraffin oder Petroleum (Lithium, Natrium und Kalium), bzw. unter Luftabschluss in Ampullen (Rubidium und Caesium) aufbewahrt.
Als Elemente der ersten Gruppe des Periodensystems besitzen sie nur ein schwach gebundenes s-Elektron, das sie leicht abgeben. Ihre ersten Ionisierungsenergien und ihre Elektronegativitäten sind entsprechend klein. In Verbindungen kommen sie alle fast ausschließlich als einwertige Kationen vor, wenngleich sogar Verbindungen bekannt sind, in denen diese Metalle anionisch vorliegen (z. B. Natride, komplexiert mit sogenannten Kryptanden).
Alkalimetalle und ihre Salze besitzen eine spezifische Flammenfärbung:[2]
- Lithium und seine Salze färben die Flamme rot (671 nm).
- Natrium und seine Salze färben die Flamme gelb (589 nm).
- Kalium und seine Salze färben die Flamme violett (768 und 404 nm).
- Rubidium und seine Salze färben die Flamme rot (780 und 421 nm).
- Caesium und seine Salze färben die Flamme blauviolett (458 nm).
Aufgrund dieser Flammenfärbung werden Alkalimetallverbindungen für Feuerwerke benutzt.
In der Atomphysik werden Alkalimetalle eingesetzt, da sie sich aufgrund ihrer besonders einfachen elektronischen Struktur besonders leicht mit Lasern kühlen lassen.
Physikalische Eigenschaften
Alle Alkalimetalle kristallisieren in der kubisch-raumzentrierten Struktur. Lediglich Lithium und Natrium kristallisieren in der hexagonal-dichtesten Packung, wenn tiefe Temperaturen vorherrschen.
Der Radius der Elementatome sowie der Kationen nimmt mit steigender Massenzahl zu. Viele andere Eigenschaften der Alkalimetalle zeigen einen Trend innerhalb der Gruppe von oben nach unten:
- Abnahme der Härte, Ionisierungsenergie, Elektronegativität, Schmelz- und Siedepunkte,
- Zunahme der Reaktivität, Basizität und Dichte.
| Element | Lithium | Natrium | Kalium | Rubidium | Cäsium | Francium |
|---|---|---|---|---|---|---|
| Schmelzpunkt (1013 hPa)[3] | 453,69 K (180,54 °C) |
370,87 K (97,72 °C) |
336,53 K (63,38 °C) |
312,46 K (39,31 °C) |
301,59 K (28,44 °C) |
298 K (25 °C) |
| Siedepunkt (1013 hPa)[3] | 1603 K (1330 °C) |
1163 K (890 °C) |
1047 K (774 °C) |
961,2 K (688 °C) |
963,2 K (690 °C) |
950 K (677 °C) |
| Kritischer Punkt[3] |
|
|
|
|
|
|
| Dichte (20 °C, 1013 hPa)[3] | 0,534 g/cm3 | 0,968 g/cm3 | 0,856 g/cm3 | 1,532 g/cm3 | 1,90 g/cm3 | 2,48 g/cm3 |
| Mohshärte | 0,6 | 0,5 | 0,4 | 0,3 | 0,2 | |
| Elektrische Leitfähigkeit | 10,6 · 106 S/m | 21 · 106 S/m | 14,3 · 106 S/m | 7,52 · 106 S/m | 4,76 · 106 S/m | |
| Atommasse | 6,94 u | 22,990 u | 39,098 u | 85,468 u | 132,905 u | 223,020 u |
| Elektronegativität | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
| Struktur | 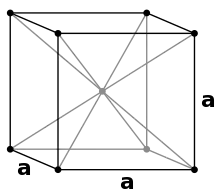 |
 |
 |
 |
 |
 |
| Kristallsystem | kubisch raumzentriert | kubisch raumzentriert | kubisch raumzentriert | kubisch raumzentriert | kubisch raumzentriert | kubisch raumzentriert |
Reaktionen und Verbindungen
Die Alkalimetalle reagieren mit Wasserstoff unter Bildung salzartiger Alkalimetallhydride:
Die thermische Beständigkeit der Hydride nimmt vom Lithiumhydrid zum Caesiumhydrid ab. Alkalihydride werden als Reduktions- oder Trocknungsmittel eingesetzt.
Mit Sauerstoff reagieren die Metalle unter Bildung fester, weißer Alkalimetalloxide (Lithiumoxid, Natriumoxid), Alkalimetallperoxide (Natriumperoxid, Kaliumperoxid) und Alkalimetallhyperoxide (Kaliumhyperoxid, Rubidiumhyperoxid, Caesiumhyperoxid):
Die Reaktion mit Wasser zu Alkalimetallhydroxiden erfolgt unter Freisetzung von Wasserstoff:
Vom Lithium zum Caesium steigt die Reaktivität stark an. Während eine annähernd kubische Probe von Lithium relativ träge reagiert, entzündet sich schon bei Natrium aufgrund der Hitzeentwicklung der entstehende Wasserstoff unter Anwesenheit von Luftsauerstoff. Ab dem Kalium erfolgt bei fortschreitender Reaktion auch Verdampfung und Entflammung des Metalls, nicht zuletzt auch wegen des mit der Ordnungszahl abnehmenden Siedepunkts (siehe oben). Aber auch unter Luftabschluss können schon weniger als 0,5 g Natrium explosiv mit Wasser reagieren, was eigentlich durch die an der Kontaktfläche der Edukte entstehenden Reaktionsprodukte, Wasserstoff und Alkalimetalhydroxid, gehemmt werden sollte. Hochgeschwindigkeitsaufnahmen eines Experiments, bei dem Tropfen einer unter Standardbedingungen flüssigen Legierung aus Kalium und Natrium unter einer Inertgas-Atmosphäre mit Wasser in Kontakt gebracht wurden, legen eine initial erfolgende Coulomb-Explosion („negative Oberflächenspannung“) bzw. die damit einhergehende starke Oberflächenvergrößerung der mit Ausnahme von Lithium nach kurzer Zeit schmelzflüssigen unlegierten Alkalimetallproben als Ursache für den ungehemmten Ablauf, die hohe Geschwindigkeit und damit die Heftigkeit dieser Reaktionen nahe.[4] Die Alkalimetallhydroxide sind farblose Feststoffe, die sich in Wasser unter starker Erwärmung leicht lösen und dabei stark basisch reagieren. Die Hydroxide und ihre Lösungen wirken stark ätzend.
Die Reaktivität der Alkalimetalle nimmt mit steigender Ordnungszahl zu, weil mit steigender Zahl von Elektronenschalen das Außenelektron immer mehr von der Anziehungskraft des positiv geladenen Atomkerns abgeschirmt wird und daher leichter abgespalten werden kann. Die Zunahme der Reaktivität lässt sich an der Reaktion der verschiedenen Metalle mit Wasser gut erkennen: Lithium und Natrium reagieren mit Wasser zwar heftig unter Wasserstoffentwicklung, aber ohne dass es zur Entzündung des Wasserstoffs kommt. Kalium und Rubidium reagieren unter spontaner Entzündung des Wasserstoffs, Caesium reagiert explosionsartig. Besonders gut reagieren die Alkalimetalle mit Nichtmetallen, denen nur wenige Elektronen fehlen, um Edelgaskonfiguration zu erreichen.[5]
Mit Halogenen reagieren die Alkalimetalle zu den salzartigen Alkalimetallhalogeniden:
Die Reaktivität steigt vom Lithium zum Caesium und sinkt vom Fluor zum Iod. So reagiert Natrium mit Iod kaum und mit Brom sehr langsam, während die Reaktion von Kalium mit Brom und Iod explosionsartig erfolgt.
Alkalimetalle können Halogenkohlenwasserstoffen unter Explosionserscheinungen das Halogen unter Bildung von Kohlenstoff und dem entsprechenden Alkalimetallhalogenid entziehen:
Alkalimetalle lösen sich in flüssigem Ammoniak unter Bildung von intensiv blau gefärbten Lösungen. Diese Lösungen, die positiv geladene Alkalimetall-Kationen und solvatisierte Elektronen enthalten, wirken als sehr starke Reduktionsmittel und werden z. B für die Birch-Reduktion eingesetzt. Wird diesen Lösungen ein geeigneter Komplexbildner ( e Kryptand oder Kronenether) zugesetzt, können sich entsprechende Salze mit Alkalimetall-Anionen, die sogenannten Alkalide, bilden.
Wasserstoff
| Gruppe | 1 |
| Hauptgruppe | 1 |
| Periode | |
| 1 | 1 H |
Wasserstoff, das erste Element der 1. Hauptgruppe, ist unter Normalbedingungen ein Nichtmetall und wird deshalb nicht zu den Alkalimetallen gezählt. Wasserstoff hat z. B wie andere typische Nichtmetalle eine deutlich höhere erste Ionisierungsenergie als die Alkalimetalle, die ihr Elektron leicht abgeben, und zeigt dementsprechend andere chemische Eigenschaften. Anders als die Alkalimetalle teilt Wasserstoff sein Elektron mit Nichtmetallen wie Chlor oder Sauerstoff und bildet mit ihnen über kovalente Bindungen Molekularverbindungen. Im Gegensatz zu den Alkalimetallen kann Wasserstoff ein Elektron von Metallen aufnehmen und bildet mit ihnen salzartige Hydride. Die wichtigste charakteristische Eigenschaft des Wasserstoffatoms ist die Fähigkeit, das einzige Elektron an das Molekül Wasser unter Bildung des Kations Hydroniumkations zu verlieren. Dieses Kation spielt bei allen chemischen Reaktionen in wässrigen Lösungen eine wichtige Rolle. Die genannten Besonderheiten des Elements Wasserstoff, haben dazu geführt, dass man in Lehrbüchern auch die Auffassung findet „Wasserstoff gehört im Periodensystem zu keiner bestimmten Gruppe“[6]
Jedoch gibt es auch chemische Eigenschaften und chemisches Verhalten, in denen Wasserstoff den Alkalimetallen ähnlich ist. Wasserstoff ist wie die Alkalimetalle ein starkes Reduktionsmittel und tritt wie die Alkalimetalle stets einwertig auf. Wasserstoff wandelt sich unter extrem hohem Druck in eine metallische Hochdruckmodifikation um, den metallischen Wasserstoff.[7] Umgekehrt haben auch einige Alkalimetalle unter bestimmten Bedingungen Eigenschaften wie Wasserstoff, z. B. besteht Lithium als Gas zu 1 % aus zweiatomigen Molekülen.
Literatur
- A. G. Sharpe et al.: Inorganic Chemistry, second edition – ISBN 0-13-039913-2 – Kapitel 10 Group 1: the alkali metals.
- Handbuch der experimentellen Chemie Sekundarbereich II, Band 2, Alkali- und Erdalkalimetalle, Halogene, Aulis Verlag Deubner & Co. KG, Köln.
Weblinks
- Pink-Panther-Reaktion Reaktion von Natrium mit Wasser auf Video
- Die Alkalimetalle Beschreibung der Alkalimetalle mit vielen Abbildungen
- High speed camera reveals why sodium explodes! Video zur Ursache der heftigen Reaktion von Alkalimetallen mit Wasser unter Luftabschluss auf dem YouTube-Kanal (Thunderf00t) des Hauptautors des Nature-chemistry-Artikels (englisch)
Einzelnachweise
- Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten: Chemie. Die zentrale Wissenschaft. Pearson Studium, 2007, ISBN 978-3-8273-7191-1, S. 992–998.
- Duden Learnattack GmbH: Flammenfärbung
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006 (doi:10.1002/14356007.a17_485).
- P. E. Mason, F. Uhlig, V. Vaněk, T. Buttersack, S. Bauerecker, P. Jungwirth: Coulomb explosion during the early stages of the reaction of alkali metals with water. In: Nature chemistry. Band 7, Nummer 3, März 2015, S. 250–254, doi:10.1038/nchem.2161, PMID 25698335
- Duden Learnattack GmbH: Alkalimetalle
- Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten: Chemie. Die zentrale Wissenschaft. Pearson Studium, 2007, ISBN 978-3-8273-7191-1, S. 318, 333.
- Hoher Druck macht Wasserstoff metallisch. Mitteilung der Max Planck Gesellschaft vom 17. November 2011, abgerufen am 22. Februar 2021.
