Chrom
Chrom (altgriechisch χρῶμα chrṓma, deutsch ‚Farbe‘) ist ein chemisches Element mit dem Elementsymbol Cr und der Ordnungszahl 24. Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der 6. Nebengruppe (6. IUPAC-Gruppe) oder Chromgruppe. Die Verbindungen von Chrom haben viele verschiedene Farben und werden oft als Pigmente in Farben und Lacken verwendet.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Chrom, Cr, 24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 6, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig metallisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-157-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.324 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,019 %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 51,9961(6)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 140 (166) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d5 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.76651(4) eV[4] ≈ 652.87 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 16.486305(15) eV[4] ≈ 1590.69 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 30.959(25) eV[4] ≈ 2987.1 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 49.16(5) eV[4] ≈ 4743 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 69.46(4) eV[4] ≈ 6702 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch raumzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 7,14 g/cm3 (20 °C)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 8,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | antiferromagnetisch, paramagnetisch (χm = 3,1 · 10−4)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 2180 K (1907 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 2755 K[9] (2482 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 7,23 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 347 kJ/mol[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 16,93[10] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 5940 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 449[1] J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,5 eV[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 7,87 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 94 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 6, 3, 2, 1[13] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | • −0,744 V (Cr3+ + 3 e− → Cr)[14]
• −0,913 V (Cr2+ + 2 e− → Cr)[14] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,66 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte
.jpg.webp)
1763 berichtete Michail Wassiljewitsch Lomonossow von seiner Reise nach Sankt Petersburg, dass der dort als Professor für Chemie arbeitende Johann Gottlob Lehmann ein „rotes Bleierz“ in Beresowsk entdeckt hätte und untersuche.[16][17]
Johann Gottlob Lehmann beschrieb 1766 ein orangerotes Mineral aus dem Ural als „Rotbleierz“, das in Salzsäure eine grüne Lösung bildet.[16] Da er es für eine eisenhaltige Bleiverbindung hielt, die mit Calciumsulfat auskristallisierte, blieb Chrom weiterhin unentdeckt.[18][19]
1770 fand Peter Simon Pallas an gleicher Stelle ein rotes Bleimineral, das von François Sulpice Beudant anfangs als Crocoise, später als Krokoit (vgl. griech. κρόκος krókos „Safran“) bezeichnet wurde.[18] Die Verwendung von Rotbleierz als Farbpigment nahm schnell zu. Ein aus Krokoit gewonnenes strahlendes Gelb, das Chromgelb, wurde als Postgelb zur Modefarbe.[20]
Erst 1797 entdeckte Louis-Nicolas Vauquelin im Rotbleierz eine unbekannte metallische Substanz, die er in Form einer Säure (der Chromsäure) mit Molybdänsäure verglich.[18] Er erhielt zuerst Chrom(III)-oxid Cr2O3 aus dem Mineral und Salzsäure. 1798 gelang ihm die Herstellung von verunreinigtem elementarem Chrom durch Reduktion von Chrom(III)-oxid mit Holzkohle.[21] Zu etwa der gleichen Zeit beschäftigte sich auch Martin Heinrich Klaproth mit dem Mineral und entdeckte ebenfalls das neue Element, jedoch veröffentlichte Vauquelin seine Untersuchungen früher.[18] René-Just Haüy, ein Freund Vauquelins, schlug vor, das neu entdeckte Metall Chrom (von griech. χρῶμα chrṓma „Farbe“) aufgrund der Vielfarbigkeit seiner Salze in unterschiedlichen Oxidationsstufen zu nennen. Anfangs gefiel Vauquelin die vorgeschlagene Bezeichnung nicht, weil das entdeckte Metall eine unscheinbare graue Färbung hatte und diesen Namen nicht rechtfertigte,[17][20] jedoch überzeugten ihn seine Freunde von diesem Namen.[22] Spuren des neuen Elementes konnte Vauquelin auch in Edelsteinen wie Rubin und Smaragd nachweisen.[18]
Im 19. Jahrhundert wurden Chromverbindungen überwiegend als Farbpigmente und in der Chromgerberei verwandt. Ende des 20. Jahrhunderts werden Chrom und Chromverbindungen hauptsächlich zur Herstellung von korrosions- und hitzebeständigen Legierungen eingesetzt (Verchromen, Chromstahl).[21]
Vorkommen
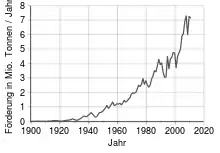
Chrom ist von der International Mineralogical Association (IMA) als Mineral anerkannt (System-Nr. nach Strunz: 1.AE.05 bzw. ehemals I/A.06-10), tritt allerdings in der Natur nur sehr selten in gediegener Form auf. Bisher sind lediglich zehn Fundorte bekannt.[23] Größtenteils wird Chrom daher nur in gebundener Form vor allem als Mineral Chromit (Chromeisenstein) FeCr2O4 mit einem Chromanteil von etwa 46 % im Tagebau oder in geringer Tiefe abgebaut. Einige andere Minerale, beispielsweise Ferchromid (~ 87 %) oder Grimaldiit (~ 61 %), enthalten zwar mehr Chrom, kommen jedoch gegenüber dem Chromit sehr viel seltener vor. Insgesamt sind zurzeit (Stand: 2010) rund 100 chromhaltige Minerale bekannt.[24]
Die Türkei war im Zweiten Weltkrieg der wichtigste Lieferant von Chrom für das Dritte Reich.[25]
Im Jahr 2000 wurden ungefähr 15 Millionen Tonnen marktfähiges Chromiterz gefördert. Hieraus ließen sich 4 Millionen Tonnen Ferrochrom mit einem Marktwert von 2,5 Milliarden Dollar gewinnen. Metallisches Chrom kommt in Lagerstätten sehr selten vor. In der Udatschnaja-Mine in Russland wird eine diamantenhaltige Kimberlit-„Pipe“ ausgebeutet. In der reduzierenden Matrix bildeten sich Diamanten und metallisches Chrom.
| Rang | Land | Förderung | Reserven |
|---|---|---|---|
| 1 | Südafrika | 16.000 | 200.000 |
| 2 | Türkei | 6.500 | 26.000 |
| 3 | Kasachstan | 4.600 | 230.000 |
| 4 | Indien | 3.500 | 100.000 |
Gewinnung und Darstellung

Das geförderte Chromiterz wird vom tauben Gestein befreit. Im zweiten Schritt folgt ein oxidierender Aufschluss bei ca. 1200 °C zum Chromat:
Das Natriumchromat wird mit heißem Wasser extrahiert und mit Schwefelsäure ins Dichromat überführt:
Das Natriumdichromat kristallisiert beim Abkühlen als Dihydrat aus der Lösung. Durch eine nachfolgende Reduktion mit Kohle erhält man Chrom(III)-oxid:
Im Anschluss folgt die aluminothermische Reduktion des Chrom(III)-oxids zu Chrom:

Chrom kann nicht durch Reduktion mit Kohle aus den oxidischen Erzen gewonnen werden, da hierbei Chromcarbid entsteht. Reineres Chrom wird durch elektrolytische Abscheidung des Cr3+-Ions aus schwefelsaurer Lösung dargestellt. Entsprechende Lösungen werden durch Auflösen von Chrom(III)-oxid oder Ferrochrom in Schwefelsäure hergestellt. Ferrochrom als Ausgangsstoff erfordert allerdings eine vorherige Abtrennung des Eisens.
Extrem reines Chrom wird durch weitere Reinigungsschritte nach dem Van-Arkel-de-Boer-Verfahren erzeugt.
Ferrochrom wird durch Reduktion von Chromit im Lichtbogenofen bei 2800 °C erzeugt.
Eigenschaften
| Oxidationszustände von Chrom[7] | |
|---|---|
| −2 | Na2[Cr(CO)5] |
| −1 | Na2[Cr2(CO)10] |
| 0 | Cr(C6H6)2 |
| +1 | K3[Cr(CN)5NO] |
| +2 | CrCl2, CrO |
| +3 | CrCl3, Cr2O3 |
| +4 | CrF4, CrO2, K2CrF6 |
| +5 | CrF5, K3CrO8 |
| +6 | CrF6, CrO3, K2CrO4 |

Chrom ist ein silberweißes, korrosions- und anlaufbeständiges hartes Metall, das im Urzustand zäh, form- und schmiedbar ist. Es ist antiferromagnetisch mit einer Néel-Temperatur von 311 K[27] (etwa 38 °C). Chrom löst sich in Salzsäure und Schwefelsäure nach einiger Zeit unter Wasserstoffentwicklung auf, wenn die schützende Oxidschicht abgelöst wurde. Häufige Oxidationsstufen des Chroms sind +2, +3 und +6, wobei +3 die beständigste ist.
Cr(II) ist mit d4-Konfiguration instabil. Bei dieser Konfiguration tritt der Jahn-Teller-Effekt auf. Dadurch sind Cr(II)-Komplexe oft verzerrt oktaedrisch oder quadratisch koordiniert. Cr2+-Lösungen sind nur dann stabil, wenn sie aus reinstem Chrom (z. B. Elektrolytchrom) gewonnen werden. Cr(II)-Verbindungen sind starke Reduktionsmittel.[28]
Cr(III) bzw. Cr3+ ist die stabilste Form. Dies wird durch die Kristallfeldtheorie erklärt, nach der bei einer d3-Konfiguration alle t2g-Orbitale (Oktaederfeldaufspaltung) mit einem einzelnen, ungepaarten Elektron besetzt sind. Diese Konfiguration ist energetisch besonders günstig und daher stabil.[29]
Cr(VI) als Chromat (CrO42−) bzw. Dichromat (Cr2O72−) wird als starkes Oxidationsmittel eingesetzt. Es ist giftig und karzinogen. In wässrigen Lösungen liegt zwischen den beiden Ionen ein chemisches Gleichgewicht vor, das pH-abhängig ist. Säuert man eine verdünnte gelbe Chromat-Lösung an, gibt man also H3O+-Ionen dazu, so verschiebt sich nach dem Prinzip von Le Chatelier das Gleichgewicht in Richtung des Dichromates, die Lösung färbt sich orange.
Nachweise
_chloride_green_hexahydrate.jpg.webp)
-peroxide_analysis.jpg.webp)
Chrom(III)-salze ergeben im Kationentrenngang bei der Nachweisreaktion mit dem „alkalischen Bad“ (NaOH in konz. Wasserstoffperoxidlösung) gelbe Chromatlösungen, die im Sauren zu orangem Dichromat reagieren:
- (Achtung: Chromate und Dichromate sind krebserregend, siehe unten.)
Ein charakteristischer Nachweis für Chrom ist die Bildung von blauem Chrom(VI)-peroxid, CrO(O2)2 (Oft auch als CrO5 beschrieben). Hierzu wird verdünnte Salpetersäure mit Wasserstoffperoxid vermischt und mit Diethylether überschichtet. Dann bringt man die zu prüfende Lösung vorsichtig unter die Etherschicht, ohne die Flüssigkeiten zu mischen. Bei Anwesenheit von Chrom bildet sich an der Grenzfläche ein blauer Ring aus Chrom(VI)-peroxid. (Der Ether dient als Stabilisator, da sich das Chromperoxid sonst nach kurzer Zeit unter Sauerstoffentwicklung wieder zersetzt.)
- Reaktion:
- Zersetzung:
Auch bei den Vorproben tritt beim Schmelzen der Salzperle mit Phosphorsalz NaNH4HPO4 oder Borax (Dinatriumtetraborat) Na2B4O7 eine charakteristische Färbung mit Schwermetallsalzen auf (mit Cr3+ grün). Bei der Oxidationsschmelze mit Soda und Salpeter hingegen wird Chrom(III) zu Chromat oxidiert (Gelbfärbung). Quantitativ kann Chrom(VI) mittels Iodometrie erfasst werden, wobei die grüne Farbe des entstehenden Chrom(III)-aquakomplexes die visuelle Erkennung des Äquivalenzpunktes erschwert. Spuren von Chromverbindungen können durch Methoden der Atomspektrometrie bestimmt werden. Dabei sind als Nachweisgrenze 2 µg/l für die Flammen-AAS und 0,02 µg/l für die Graphitrohr-AAS angegeben worden.[30] In der Polarografie ergibt Dichromat in 1 M Kaliumchloridlösung mehrere Stufen bei −0,28, −0,96, −1,50 und −1,70 V (gegen SCE). Dreiwertiges Chrom (als Hexaminkomplex) ergibt in einem 1 M Ammoniak-Ammoniumchlorid-Puffer eine Stufe bei −1,42 V.[31]
Sicherheitshinweise und biologische Bedeutung
Die Rolle von Chrom(III) (Cr3+-Ionen) im menschlichen Körper wird zurzeit kontrovers diskutiert. Es gibt Hinweise darauf, dass Chrom(III) eine Bedeutung im Kohlenhydrat- und Fettstoffwechsel von Säugetieren haben könnte. Diesen Hinweisen wird zurzeit nachgegangen. Frühere Hinweise, dass das beliebte Nahrungsergänzungsmittel Chrom(III)-picolinat einen günstigen Einfluss auf den Körperaufbau hat, konnten in späteren Studien nicht bestätigt werden. In einer Studie mit Hamsterzellen konnte gezeigt werden, dass Chrom(III)-picolinat mutagen ist und Krebs auslösen kann.
Die aktuell zur Verfügung stehenden Daten weisen darauf hin, dass es extrem unwahrscheinlich ist, eine Chromunterversorgung zu erleiden. Einen toxischen Effekt lösen auch höhere Dosen Chrom(III) nur schwer aus, da das Löslichkeitsprodukt von Chrom(III)-hydroxid extrem niedrig ist (6,7 · 10−31). Es wird deshalb im menschlichen Darm vermutlich nur sehr schwer aufgenommen. In den USA wurde die empfohlene Aufnahmemenge Chrom(III) bei 50–200 µg/Tag auf 35 µg/Tag bei erwachsenen Männern und auf 25 µg/Tag bei erwachsenen Frauen heruntergesetzt.
Im Jahr 2014 entfernte die Europäische Behörde für Lebensmittelsicherheit Chrom aus der Liste der essentiellen Mineralien. Die Behörde kam zu dem Ergebnis, dass die Einnahme von Chrom keinen nutzbringenden Einfluss auf die menschliche Gesundheit hat.[32][33]
Chrom(VI)-Verbindungen sind äußerst giftig. Sie sind mutagen und schädigen die DNA. Sie gelangen über die Atemwege in den Körper und schädigen das Lungengewebe. Menschen, die chronisch solchen Verbindungen ausgesetzt sind, haben ein erhöhtes Risiko für Lungenkrebs. Die giftige Wirkung steigt dabei mit der Unlöslichkeit des Salzes.[34] Seit 1998 dürfen in Deutschland Verfahren zur Behandlung von Bedarfsgegenständen aus Leder, das bei bestimmungsgemäßem Gebrauch wie bei Uhrenarmbändern nicht nur vorübergehend den menschlichen Körper berührt, nicht mehr eingesetzt werden, sofern im Erzeugnis Chrom(VI) nachweisbar ist[35]. Für die Europäische Union schränken seit 2004 die RoHS-Richtlinien die Verwendung von Cr(VI)-Verbindungen in Elektro- und Elektronikgeräten zunehmend ein. Seit Mai 2015 dürfen in der EU Ledererzeugnisse, die mit der Haut in Berührung kommen, nicht mehr in Verkehr gebracht werden, wenn der Gehalt an Chrom(VI)-Verbindungen 3 mg/kg übersteigt.[36] Bereits vorher war die Verwendung und das Inverkehrbringen von Zement oder Zementgemischen verboten, in denen nach Verfestigung mehr als 2 mg lösliche Chrom-VI-Verbindungen je kg sind und bei denen eine Gefahr von Hautkontakten besteht.[37]
Verwendung
Chrom und Chromverbindungen werden für die verschiedensten Anwendungen eingesetzt, in denen seine Beständigkeit genutzt wird:
- Legierungselement: Verwendung in der Metallurgie in korrosions- und hitzebeständigen nichtrostenden Stählen sowie NE-Legierungen
- Hartverchromung: galvanisches Aufbringen einer bis zu 1 mm dicken Verschleißschutzschicht direkt auf Stahl, Gusseisen, Kupfer. Auch Aluminium kann nach dem Aufbringen einer Zwischenschicht verchromt werden (hartverchromte Aluminiumzylinder im Motorenbau). Seit dem 21. September 2017 ist für die Verwendung von Chrom (VI) eine Autorisierung der EU notwendig, wenn weiterhin mit Chrom(VI)-Elektrolyten verchromt werden soll[38].

- Dekorverchromung: galvanisches Aufbringen einer < 1 μm dicken Cr-Schicht als Dekor mit einer korrosionsschützenden Zwischenschicht aus Nickel oder Nickel-Kupfer. Sehr oft werden auch Kunststoffteile verchromt. Ein Ersatz für die Dekorverchromung ist das Achrolyte-Verfahren.
- Passivierung von galvanischen Zinkschichten (Chromatierung)
- Katalysator: um chemische Reaktionen zu ermöglichen oder zu beschleunigen
- Chromgerbung: das wichtigste Verfahren zur Herstellung von Leder
Verbindungen
-oxide_pigment.jpg.webp)
Chromoxidgrün: Chrom(III)-oxid Cr2O3, wird als Emaillefarbe und zum Glasfärben (grüne Flaschen) verwendet (auch Kölner Brückengrün). Dieses ist nicht mit dem giftigen Chromgrün zu verwechseln.
- Chromgelb
- Blei(II)-chromat PbCrO4, diente früher als brillant gelbes Farbpigment („Postgelb“). Auf Grund seiner Toxizität wird es heute fast vollständig durch organische Farbpigmente ersetzt. In der Analytik wird es zur iodometrischen Bestimmung von Blei genutzt.
Das Chromgelb, das als Künstlerfarbe Anwendung findet, ist je nach Herstellung ein Bleisulfat/Bleichromat (etwa 2 PbSO4 · PbCrO4). Das Pigment wurde 1809 von Louis-Nicolas Vauquelin entdeckt und seit 1820 kommerziell in Deutschland hergestellt. Chromgelb hat ein hohes Deckvermögen, seine Lichtstabilität hängt von dem Gelbton ab. Chromgelb wird kaum in der Ölmalerei verwendet. Vincent van Gogh allerdings verwendete Chromgelb u. a. in den berühmten Sonnenblumenbildern, die in Öl auf Leinwand ausgeführt sind. Diese leiden jedoch heute teilweise unter einer Verfärbung der Gelbtöne.[39][40]
Der Kunsttechnologe Christoph Krekel von der Kunstakademie Stuttgart zu der Verwendung des Pigments Chromgelb: „Die Maler haben sich auf das Chromgelb gestürzt, weil es ein sehr brillantes Gelb ist – es hat eine große Farbintensität, das heißt, man konnte mit Hilfe dieses neuen gelben Farbtons eine sehr viel leuchtstärkere Malerei herstellen“.
Chromgelb ist auch eine wichtige Farbe bei der Fälschungsanalyse „alter“ Gemälde.
- Chromdioxid
- Chrom(IV)-oxid CrO2, ist ein schwarzes ferromagnetisches Pulver zur Herstellung von Magnetbändern mit einem besseren Signal-Rausch-Verhältnis als konventionelle Eisenoxid-Magnetbänder, da Chromdioxid eine höhere Koerzitivität besitzt.
- Chromsäure
- mit der hypothetischen Struktur H2CrO4 existiert nur in verdünnter wässriger Lösung. Sie ist sehr giftig. Als Anion existiert sie in einigen Chromaten und Dichromaten.
Das Anhydrid der Chromsäure, das sehr giftige Chrom(VI)-oxid CrO3, wird als Chromtrioxid bezeichnet.
Das orangefarbene, sehr giftige Kaliumdichromat K2Cr2O7 ist ein kräftiges Oxidationsmittel: In schwefelsaurer Lösung werden primäre Alkohole leicht in die betreffenden Aldehyde umgewandelt, was man zum halbquantitativen Nachweis von Alkohol in der Atemluft nutzen kann. Im Laborbetrieb wurde es in Form von Chromschwefelsäure zur Reinigung von Glasgeräten verwendet. Beim Kontakt mit Chloridionen wird jedoch das flüchtige, krebserregende Chromylchlorid CrO2Cl2 gebildet (Abzug!). Kaliumdichromat wird außerdem als Titrationsmittel verwendet sowie als Fixiermittel in industriellen Färbebädern. Kaliumdichromat und das ebenfalls sehr giftige Ammoniumdichromat (NH4)2Cr2O7 sind die lichtempfindliche Substanz in Chromgelatineschichten der frühen Fotografie (siehe Edeldruckverfahren).
- Chromit
- (Chromeisenstein; siehe oben) FeCr2O4 wird zur Herstellung von Formen für das Brennen von Ziegelsteinen verwendet.
Weitere Chromverbindungen sind Chrom(III)-chlorid, Chrom(III)-iodid, Chrom(III)-fluorid, Chrom(III)-sulfat, Kaliumchrom(III)-sulfat, Chrom(III)-nitrat, Chrom(III)-hydroxid, Chrom(II)-chlorid, Chrom(IV)-fluorid, Chrom(V)-fluorid sowie unterschiedliche Chromate.
Komplexverbindungen
Es ist eine Vielzahl von Komplexverbindungen des Chroms bekannt, insbesondere vom Chrom(III). Hierbei nehmen die Amminkomplexe eine bedeutende Stellung ein. Zwischen dem Hexaamminchrom(III)-ion [Cr(NH3)6]3+ und dem reinen Aquakomplex [Cr(H2O)6]3+ gibt es mehrere Übergänge vom Aquapentaamminchrom(III)- bis zum Tetraaquadiamminchrom(III)-ion. Daneben existieren eine Reihe von gemischten Amminkomplexen mit organischen Liganden, wie z. B. Ethylendiamin. Komplexe vom Typ [CrX6]3− existieren mit den Liganden Fluoride, Chloride, Thiocyanate und Cyanide. Auch hier gibt es mehrere gemischte Formen. Ein Beispiel ist das Reinecke-Salz NH4[Cr(SCN)4(NH3)2], das in der analytischen Chemie zum Fällen von Kationen eine Rolle spielt. Gemischte Aquachlorokomplexe treten in Chrom(III)-chloridlösungen auf und haben den Begriff Hydratationsisomerie geprägt. Aquasulfatokomplexe können sich in Chrom(III)-sulfatlösungen bilden. Mehrkernige Komplexe bilden sich bevorzugt über Oxo- bzw. Hydroxobrücken, z. B. [(NH3)5Cr(OH)Cr(NH3)5]5+. Komplexe mit anderen Oxidationsstufen des Chroms sind zum Teil unbeständig. Verbindungen von Chrom(II) sind starke Reduktionsmittel. Hier sind beispielsweise Amminkomplexe, wie das [Cr(NH3)6]2+, Komplexe mit Hydrazin, Ethylendiamin, Bipyridine und dem Thiocyanation bekannt. Peroxokomplexe werden von Chrom in höheren Oxidationsstufen gebildet, wie das Kaliumperoxochromat, das durch Reaktion von Kaliumdichromatlösung mit Wasserstoffperoxid entsteht.[41]
Literatur
- A. Pollack: Zwanzig Jahre Verchromung. In: Chemiker-Zeitung. 67, 1943, S. 279–280.
- R. Schliebs: Die technische Chemie des Chroms. In: Chemie in unserer Zeit. 14, 1980, S. 13–17, doi:10.1002/ciuz.19800140103.
- J. B. Vincent: Recent advances in the nutritional biochemistry of trivalent chromium. In: Proceedings of the Nutrition Society. 63, 2004, S. 41–47.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3.
- Nikolai P. Lyakišev, Mikhail I. Gasik: Metallurgy of chromium. Allerton Press, New York 1998, ISBN 0-89864-083-0.
Weblinks
- Mineralienatlas:Chrom (Wiki)
- Axel Ludwig: Chrom(III) und Chrom(VI) in einer mit Gerbereischlamm belasteten Ackerfläche bei Weinheim Heidelberg, 1996, mit weiteren Infos zu Chrom PDF, 697 KiB)
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Chromium) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu chromium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu chromium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Chromium) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. 1988, ISBN 3-527-26169-9, S. 1291.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- J. H. Downing, P. D. Deeley, R. Fichte: Chromium and Chromium Alloys. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a07_043.
- Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, 2005, ISBN 3-11-017485-5, S. 361.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Chromium) entnommen.
- P. P. Samuel, R. Neufeld, K. C. Mondal u. a.: Cr(I)Cl as well as Cr+ are stabilised between two cyclic alkyl amino carbenes†. In: Chemical Sciences. The Royal Society of Chemistry, London 2015, doi:10.1039/c5sc00646e.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1566.
- Eintrag zu Chrom, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. April 2020. (JavaScript erforderlich)
- Per Enghag: Encyclopedia of the Elements: Technical Data – History – Processing … John Wiley & Sons, 2008, ISBN 978-3-527-61234-5, S. 576 (eingeschränkte Vorschau in der Google-Buchsuche).
- Helmut Schröcke, Karl-Ludwig Weiner: Mineralogie: Ein Lehrbuch auf systematischer Grundlage. Walter de Gruyter, 1981, ISBN 3-11-083686-6, S. 599 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hermann Moser: Chemische Abhandlung über das Chrom. Gerold, 1824, S. 1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gmelins Handbuch: Chrom. Springer, 1962, S. 51 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jacques Guertin, James A. Jacobs, Cynthia P. Avakian: Chromium(VI) Handbook. CRC Press, 2004, ISBN 0-203-48796-6, S. 7 (eingeschränkte Vorschau in der Google-Buchsuche).
- Markus Miller: Der große Strategie- und Edelmetall-Guide: Das FORT KNOX für Privatanleger. FinanzBuch Verlag, 2012, ISBN 978-3-86248-267-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- Sergej J. Venetzkij, Hans J. Eckstein, Emil Eckstein: Erzählungen über Metalle. Dt. V. Grundstoffind., 1994, ISBN 3-342-00324-3, S. 30 (eingeschränkte Vorschau in der Google-Buchsuche).
- mindat – Localities for Chromium (englisch).
- Webmineral – Mineral Species sorted by the element Cr (Chromium ) (englisch).
- Jean Ziegler: Die Schweiz, das Gold und die Toten. 1. Auflage. C. Bertelsmann Verlag, München 1997, S. 46.
- United States Geological Survey: World Mine Production and Reserves
- Eric G. R. Fawcett: Spin-density-wave antiferromagnetism in chromium. In: Reviews of Modern Physics. Band 60, 1976, S. 209, doi:10.1103/RevModPhys.60.209, bibcode:1988RvMP...60..209F.
- E. Riedel, C. Janiak: Anorganische Chemie. 8. Auflage. de Gruyter, 2011, ISBN 978-3-11-022566-2, S. 814.
- E. Riedel, C. Janiak: Anorganische Chemie. 8. Auflage. de Gruyter, 2011, ISBN 978-3-11-022566-2, S. 812.
- K. Cammann (Hrsg.): Instrumentelle Analytische Chemie. Spektrum Akademischer Verlag, Heidelberg/ Berlin 2001, S. 4–47.
- J. Heyrovský, J. Kůta: Grundlagen der Polarographie. Akademie-Verlag, Berlin 1965, S. 509.
- J. B. Vincent: Is the Pharmacological Mode of Action of Chromium(III) as a Second Messenger? In: Biol. Trace Elem. Res. 2015, doi:10.1007/s12011-015-0231-9.
- European Food Safety Authority: Scientific Opinion on Dietary Reference Values for chromium. In: EFSA Journal. 12 (10), 2014, S. 3845–3870, doi:10.2903/j.efsa.2014.3845.
- Emanuel Rubin, David Strayer: Environmental and Nutrional Pathology. In: Raphael Rubin, David Strayer: Rubin’s Pathology. Philadelphia 2008, S. 268.
- Anlage 4 (zu § 5) Bedarfsgegenständeverordnung
- Verordnung (EU) Nr. 301/2014 der Kommission vom 25. März 2014 zur Änderung von Anhang XVII der Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) hinsichtlich Chrom (VI)-Verbindungen, abgerufen am 25. Februar 2017.
- für Zement und Leder je Eintrag 47 in Anhang XVII zu Artikel 67 der Verordnung (EG) Nr. 1907/2006, konsolidierte Fassung vom 1. Januar 2020
- Stéphane Itasse: Chrom(VI)-Ersatz fällt in einigen Fällen schwer. Maschinenmarkt. 11. Februar 2017. Abgerufen am 2017.07.15.
- UV-Licht lässt Van-Gogh-Gemälde verblassen. In: Spiegel Online. 15. Februar 2011.
- Letizia Monico, Geert Van der Snickt, Koen Janssens, Wout De Nolf, Costanza Miliani, Joris Dik, Marie Radepont, Ella Hendriks, Muriel Geldof, Marine Cotte: Degradation Process of Lead Chromate in Paintings by Vincent van Gogh Studied by Means of Synchrotron X-ray Spectromicroscopy and Related Methods. 2. Original Paint Layer Samples. In: Analytical Chemistry. 83 (4), 2011, S. 1224–1231, doi:10.1021/ac1025122.
- F. Albert Cotton, Geoffrey Wilkinson: Anorganische Chemie. Verlag Chemie, Weinheim 1967, S. 768–779.
-oxid.jpg.webp)

