Dimethylether
Dimethylether ist der einfachste Ether und ein Dialkylether. Er enthält zwei Methylgruppen als organische Reste. Dimethylether ist polar und findet in flüssiger Form als Lösemittel Verwendung.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
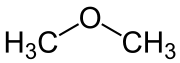 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethylether | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C2H6O | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit etherischem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 46,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−24,8 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
wenig in Wasser (70 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Treibhauspotential |
1 (bezogen auf 100 Jahre)[6] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−184,1 kJ/mol[7] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Dimethylether ist ein (bei Normalbedingungen) farbloses, hochentzündliches, narkotisch wirkendes Gas. Die Verbindung siedet bei −24 °C. Die molare Verdampfungsenthalpie beträgt am Siedepunkt 21,51 kJ/mol.[8] Unter Druck sind bis zu 34 % in Wasser löslich.
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,11475, B = 894,669 und C = −30,604 im Temperaturbereich von 194,93 bis 248,24 K.[9] Die kritischen Größen betragen für die kritische Temperatur 126,9 °C, für den kritischen Druck 53,7 bar und für die kritische Dichte 0,271 g·cm−3.[2]
Sicherheitstechnische Kenngrößen
Dimethylether bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von −42 °C.[2] Der Explosionsbereich liegt zwischen 2,8 Vol.-% als untere Explosionsgrenze (UEG) und 24,4 Vol.-% als obere Explosionsgrenze (OEG).[2][10] Der maximale Explosionsdruck beträgt 9,8 bar.[2][10] Die Grenzspaltweite wurde mit 0,84 mm (50 °C) bestimmt.[2][10] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB.[10] Die Zündtemperatur beträgt 240 °C.[2][10] Der Stoff fällt somit in die Temperaturklasse T3.
Herstellung
Er kann zum Beispiel durch säurenkatalysierte Kondensation aus 2 Molekülen Methanol (unter Abspaltung von Wasser) gewonnen werden:
Dimethylether entsteht als Nebenprodukt der Methanolsynthese und wird üblicherweise direkt aus Synthesegas hergestellt. Als Quelle für das Synthesegas sind insbesondere Kohle, Erd- und Biogas sowie Syngas aus der Biomassevergasung von hohem Interesse.
Bei der Synthese handelt es sich um einen zweistufigen Prozess, bei dem mit Hilfe von entsprechenden Katalysatoren (in der Regel CuO/ZnO/Al2O3) bei Temperaturen von 270 °C und einem Druck von 5 bis 10 MPa zuerst Methanol hergestellt wird, das in einem zweiten Schritt in Anwesenheit eines Säurekatalysators (In der Regel Aluminium) innerhalb desselben Prozesses dehydratisiert wird. Abgeschiedener Dimethylether enthält noch geringe Mengen Methanol und Wasser.[11]
Verwendung
Hochreiner Dimethylether findet breite Anwendung als Treibgas z. B. in Haarspray und Lackspray.[12] Technischer Dimethylether ist eine Alternative zu Flüssiggas mit ausgezeichneten Brenneigenschaften. Ein azeotropes Gemisch von Dimethylether und Ammoniak ergibt das Kältemittel R723.
Ein großer Anteil des produzierten Dimethylethers wird mit Schwefeltrioxid (SO3) zu Dimethylsulfat (C2H6O4S) umgesetzt, das als Basis für eine Reihe von chemischen Prozessen und Produkten benötigt wird.
Bis in die 1980er Jahre war dies die Hauptverwendung von Dimethylether, 1998 wurden von den in Mitteleuropa produzierten 50.000 t etwa 15.000 t zu Dimethylsulfat umgesetzt.[11]
Dimethylether ist zudem ein Zwischenprodukt zur Herstellung von Alkenen wie Ethen (Ethylen) und Propen (Propylen) aus Methanol oder Erdgas in der so genannten Methanol-to-Olefins-Technologie, die als Alternative zu den derzeit verwendeten Verfahren aus Erdöl („steam cracking“) entwickelt wurde.[13]
DME als Kraftstoff
Aufgrund einer Cetanzahl von 55 bis 60 lässt sich Dimethylether im Dieselmotor als Ersatz für Dieselkraftstoff verwenden. Dabei sind leichte Modifikationen am Motor erforderlich, die hauptsächlich die Einspritzpumpe betreffen, sowie der Einbau eines Drucktanks, ähnlich wie bei Autogas. Dimethylether verbrennt im Dieselmotor sehr sauber ohne Rußbildung. Der Heizwert liegt bei 28,4 MJ/kg.
Gemäß der Biokraftstoffrichtlinie 2003-30-EG gilt Dimethylether als Biokraftstoff, sofern er „aus Biomasse hergestellt wird und für die Verwendung als Biokraftstoff bestimmt ist“ und soll langfristig Flüssiggas ablösen.[14] Als Rohstoffbasis zur Herstellung des Synthesegases soll Schwarzlauge aus der Papier- und Zellstoffindustrie dienen.[15] Eine erste Fabrik für die Herstellung von biologisch hergestelltem Dimethylether wurde 2012 in Piteå in Schweden errichtet.[16]
Unglück
Bei der Explosion eines mit Dimethylether gefüllten Kesselwagens auf dem Gelände der BASF in Ludwigshafen am Rhein starben am 28. Juli 1948 insgesamt 207 Menschen und es gab 3818 Verletzte. 3122 Gebäude wurden in Mitleidenschaft gezogen.
Einzelnachweise
- Eintrag zu DIMETHYL ETHER in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- Eintrag zu Dimethylether in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. März 2018. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- Eintrag zu Dimethyl ether im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 115-10-6 bzw. Dimethylether), abgerufen am 2. November 2015.
- P. Forster, P., V. Ramaswamy u. a.: Changes in Atmospheric Constituents and in Radiative Forcing. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge und New York 2007, S. 213, (PDF)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- R. M. Kennedy, M. Sagenkahn, J. G. Aston: The heat capacity and entropy, heats of fusion and vaporization, and the vapor pressure of dimethyl ether. The density of gaseous dimethyl ether. In: J. Am. Chem. Soc. 63, 1941, S. 2267–2272, doi:10.1021/ja01853a068.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Manfred Müller, Ute Hübsch: Dimethyl Ether. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012, doi:10.1002/14356007.a08_541.
- Grillo-Werke AG | DIMETHYLETHER. (grillo.de [abgerufen am 8. November 2018]).
- Tao Ren, Martin K. Patel, Kornelis Blok: Steam cracking and methane to olefins: Energy use, CO2 emissions and production costs. In: Energy. 33, 2008.
- Richtlinie 2003/30/EG des Europäischen Parlaments und des Rates vom 8. Mai 2003 zur Förderung der Verwendung von Biokraftstoffen oder anderen erneuerbaren Kraftstoffen im Verkehrssektor
- Peter Fairly: Taking Pulp to the Pump. In: Technology Review. 12. Dezember 2008.
- Elisabeth Kempemo: Perfectly clean BioDME flowing steadily. In: ChemrecNews. Mai 2012, abgerufen am 10. September 2012.

