Quecksilber
Quecksilber (altgriechisch ὑδράργυρος Hydrargyros, deutsch ‚flüssiges Silber‘, davon abgeleitet lateinisch hydrargyrum (Hg), so benannt von Dioskurides; lateinisch Argentum vivum ‚lebendiges Silber‘, und mercurius; englisch mercury und quicksilver) ist ein chemisches Element mit dem Symbol Hg und der Ordnungszahl 80. Obwohl es eine abgeschlossene d-Schale besitzt, wird es häufig zu den Übergangsmetallen gezählt. Im Periodensystem steht es in der 2. Nebengruppe, bzw. der 12. IUPAC-Gruppe, die auch Zinkgruppe genannt wird. Es ist das einzige Metall und neben Brom das einzige Element, das bei Standardbedingungen flüssig ist. Aufgrund seiner hohen Oberflächenspannung benetzt Quecksilber seine inerte Unterlage nicht, sondern bildet wegen seiner starken Kohäsion linsenförmige Tropfen. Es ist wie jedes andere Metall elektrisch leitfähig.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Quecksilber, Hg, 80 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 12, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-106-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.278 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code |
D08AK05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,4 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 200,592(3)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 150 (171) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 132 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 155 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f14 5d10 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 10.437504(6) eV[4] ≈ 1007.07 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 18.75687(4) eV[4] ≈ 1809.76 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 34.49(5) eV[4] ≈ 3325 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 48.55(15) eV[4] ≈ 4684 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 61.20(20) eV[4] ≈ 5905 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | flüssig | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | trigonal bei T ≤ −38,9 °C[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 13,5459 g/cm3[8] bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | entfällt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −2,8 · 10−5)[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 234,32 K (−38,83 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 630,2 K[10] (357 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | (fest) 14,09 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 58,2 kJ·mol−1[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 2,37[11] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | 0,163[8] Pa bei 293 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 1407 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 140 J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,49 eV[12] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1,04 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 8,3 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [13] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 1, 2, 4[14] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,8535 V (Hg2+ + 2 e− → Hg) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,00 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,005 ml·m−3 bzw. 0,05 mg·m−3[16] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Etymologie

Quecksilber bedeutet ursprünglich „keckes Silber“, d. h. schnelles – vgl. englisch quick – bzw. bewegtes oder lebendiges Silber (von althochdeutsch quëcsilabar, quëchsilper, mittelhochdeutsch quëcsilber, këcsilber zu germanisch kwikw ,[quick]lebendig‘)[17] als Übersetzung von gleichbedeutend (mittel)lateinisch argentum vivum ‚lebendiges Silber‘, z. B. bei Plinius.[17][18]
Schwefelalkohole werden als Mercaptane („Quecksilber-Fänger“) bezeichnet, weil sie mit Quecksilber unter Bildung von Quecksilbersulfiden reagieren können.
Geschichte
Quecksilber ist mindestens seit der Antike bekannt. So wird es schon in den Werken von Aristoteles, Theophrastos von Eresos, Plinius dem Älteren und anderen Schriftstellern der Antike erwähnt. Vom Altertum bis ins 20. Jahrhundert[19] wurde es als Heilmittel verwendet (aufgrund seiner Toxizität, die zuerst von dem Arzt und Empiriker Herakleides von Tarent berichtet[20] wurde, jedoch mit entsprechend negativen Folgen).
Quecksilber wurde in der Antike durch Verreiben von Zinnober mit Essig oder durch Erhitzen von Zinnober über ein Sublimationsverfahren gewonnen. Vitruv war bereits die Legierung des Quecksilbers mit Gold bekannt. Diese wurde zum Feuervergolden von Gegenständen benutzt, wobei das Quecksilber verdampfte. Im 5. Jahrhundert n. Chr. kannte man als Quecksilberverbindung das Sublimat (Quecksilber(II)-chlorid), genannt auch Mercurius sublimatus („destilliertes“ Quecksilber[21] bzw. Hydrargyrum bichloratum corrosivum[22]). Paracelsus war der erste Arzt, der Präzipitate (etwa Mercurius praecipitatus, weißes Quecksilberpräzipitat[23] ) und basische Quecksilbersalze herstellte und als Heilmittel verwendete. Ab dem 16. Jahrhundert wurde Quecksilber wirtschaftlich bedeutungsvoll, weil es zur Gewinnung von Silber aus Silbererzen über Amalgambildung benötigt wurde.
Bereits in Altertum und Mittelalter wurde Quecksilber medizinisch verwendet.[24][25]
Im ausgehenden 19. Jahrhundert hielt man Quecksilber für ein geeignetes Medikament gegen Frauenleiden, weswegen es zum Teil in toxischen Mengen verabreicht wurde.
Vom Ende des 15. bis zum Anfang des 20. Jahrhunderts waren Quecksilberpräparate wie die graue Quecksilbersalbe oder das Asurol[26][27] weit verbreitete Mittel zur Behandlung der Syphilis (zuletzt auch in Kombination mit Arsenverbindungen wie Arsphenamin; siehe auch Biometallorganische Chemie).[28][29] Zu einer Quecksilberkur[30] wurde das Quecksilber in der Regel auf die Haut aufgetragen, injiziert[31] oder gelegentlich sogar inhaliert, wobei es in vielen Fällen zu Vergiftungserscheinungen kam. Syphilis galt als Volksseuche und Anspielungen auf die Symptome der Syphilis sowie der damit einhergehenden Quecksilbervergiftung finden sich in vielen literarischen Werken der damaligen Zeit.
Metallisches Quecksilber diente im gleichen Zeitraum zur Behandlung von Darmverschlüssen. Der Patient nahm dazu oral mehrere Kilogramm metallisches Quecksilber auf, um das Hindernis im Darm zu überwinden. Wenn er die Behandlung überlebte, verließ das Metall seinen Körper auf natürlichem Wege ohne weitere Vergiftungserscheinungen.[32]
Quecksilber(I)-chlorid wurde in der Vergangenheit sowohl äußerlich, etwa gegen Hornhautflecken oder Feigwarzen, als auch vielfach innerlich und bis in die 1990er Jahre als Spermizid in Form von Vaginal-Zäpfchen zur Empfängnisverhütung angewandt. Früher hatten fast alle Merfen-Präparate, auch Lutschtabletten, als Wirkstoff die etwa 1951 als wirksam entdeckte organische Quecksilberverbindung Phenylmercuriborat, während diese heute alle quecksilberfrei sind. Ebenfalls antiseptisch wirkte Merbromin im nur bis 2003 zugelassenen Mercurochrom.
Am Quecksilber wurde vom niederländischen Physiker Heike Kamerlingh Onnes im Jahre 1911 das erste Mal das Phänomen der Supraleitung entdeckt.[33] Unterhalb von 4,183 Kelvin (−268,967 °C) verschwindet dabei der elektrische Widerstand vollständig. Die Nähe zum Siedepunkt von Helium trug dabei zwar zur Entdeckung bei, ist jedoch rein zufällig.
In der griechischen Antike symbolisierte das Quecksilber sowohl den Gott Hermes als auch den zugehörigen Planeten. Dies wurde später von den Römern und den Alchemisten für den gleichgesetzten Gott Mercurius übernommen. Daher ist im Lateinischen Mercurius und im Englischen mercury sowohl die Bezeichnung für das Quecksilber als auch für den Planeten und den Gott. Als alternative Bezeichnung für das Metall wird im Englischen aber auch quicksilver verwendet.
Quecksilber wurde (als Mercurius philosophorum[34][35]) in der Alchemie verwendet, um Metalle zu veredeln. So sollte durch Quecksilberzusatz aus Kupfer Silber entstehen. Angestrebt wurde auch eine Verfestigung des Quecksilbers, die fixatio mercurii, beispielsweise (beschrieben im 15. Jahrhundert durch Hans Kluge) durch physikalisch-chemische Behandlung einer Mischung von Quecksilber mit Kupfervitriol, der weitere Zusätze wie Weinstein, Salpeter und Glaspulver beigefügt wurden.[36]
Für die mittelalterlichen Alchemisten waren Quecksilber, Schwefel und Salz die drei grundlegenden Elemente. Das Einhorn symbolisierte das Quecksilber.
Vorkommen
.jpg.webp)
Quecksilbervorkommen gibt es unter anderem in Serbien, Italien, China, Algerien, Russland und Spanien. Meist findet man es als Mineral in Form von Zinnober (HgS) in Gebieten mit ehemaliger vulkanischer Aktivität. Seltener kommt Quecksilber auch gediegen vor. In der Nähe des spanischen Ortes Almadén befinden sich die größten Zinnober-Vorkommen der Erde. Die Förderung wurde im Jahr 2003 beendet und die Mine von Almadén zu einem Besucherbergwerk umgewandelt.[37] Weit seltenere Quecksilberminerale sind Montroydit (HgO), Paraschachnerit, Schachnerit, Eugenit, Luanheit und Moschellandsbergit (alle AgHg). Ein anderes Mineral ist Belendorffit (CuHg). Quecksilber ist zudem ein akzessorischer Bestandteil von Braun- und Steinkohle.
Große Mengen Quecksilber sind zudem in der gefrorenen Biomasse der Permafrostböden der nördlichen Hemisphäre gebunden. In diesen ist etwa doppelt so viel Quecksilber gespeichert wie in allen anderen Böden, der Atmosphäre sowie den Ozeanen zusammen. Bei einem verstärkten Abtauen des Permafrostes, wie es durch die menschengemachte globale Erwärmung erwartet wird, würden biologische Abbauprozesse einsetzen, durch die das Quecksilber möglicherweise in die Umwelt abgegeben wird, wo es unter anderem den arktischen Ökosystemen, Wasserlebewesen in den Ozeanen und der menschlichen Gesundheit schaden könnte.[38]
Quecksilber wird traditionell in Metalltonnen (englisch „flask“) von 76-pound (34,473 kg) gehandelt und an der Rohstoffbörse in der Einheit „FL“ = flask notiert.
Bedingt durch die lange atmosphärische Lebensdauer von elementarem Quecksilber von mehreren Monaten bis zu einem Jahr führen Emissionen in die Luft zu einer über die gesamte Erdatmosphäre relativ konstanten Median-Luftkonzentration von 1,2 bis 1,8 ng/m3 in der nördlichen Hemisphäre und rund 1,0 ng/m3 in der südlichen Hemisphäre.[39]
Quecksilber als Mineral
Auch wenn Quecksilber unter Normalbedingungen flüssig ist, wird es traditionell zu den Mineralen gezählt,[40] da es ähnlich wie Eis bei entsprechenden Temperaturen als natürlich vorkommender, durch geologische Prozesse entstandener Feststoff mit definierter Zusammensetzung vorkommen kann (Bsp. Permafrostböden). Dies entspricht auch den allgemeinen Bedingungen der International Mineralogical Association(IMA) für die Anerkennung von eigenständigen Mineralarten.[41]
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Quecksilber unter der System-Nummer 1.AA.05 (Elemente – Metalle und intermetallische Verbindungen – Quecksilber-Amalgam-Familie)[42] beziehungsweise in der veralteten 8. Auflage unter I/A.02 (Quecksilber-Amalgam-Reihe) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.01.07 (namenlose Gruppe innerhalb der Unterabteilung Elemente: Metallische Elemente außer der Platingruppe).[43]
Gewinnung und Darstellung
Reines Quecksilber wird gewonnen, indem man das Quecksilbererz Zinnober (HgS) mit Sauerstoff reagieren lässt (Röstverfahren). Die Reaktionsprodukte sind elementares Quecksilber und Schwefeldioxid:[44]
Weltweit wurde in den letzten fünf Jahrhunderten rund eine Million Tonnen metallisches Quecksilber aus Zinnober und anderen Erzen gewonnen. Etwa die Hälfte davon entfiel auf die Zeit vor 1925 (Stand: 2000).[45]
Eigenschaften

Quecksilber ist ein silberweißes, flüssiges Schwermetall. Es wird manchmal noch zu den Edelmetallen gezählt, ist jedoch viel reaktiver als die klassischen Edelmetalle (zum Beispiel Platin, Gold), die in derselben Periode stehen. Es bildet mit sehr vielen Metallen Legierungen, die sogenannten Amalgame. Quecksilber leitet Strom im Vergleich zu anderen Metallen schlecht. Es ist außer den Edelgasen das einzige Element, das bei Raumtemperatur in der Gasphase einatomig vorliegt.[46]
Quecksilber ist mit einer Dichte von 13,5 g/cm3 (hochrein 13,545808 g/cm3 bei 293,15 K und 0 Pa[47]) etwa 13,5-mal so dicht wie Wasser, so dass nach dem Archimedischen Prinzip seine Tragfähigkeit auch 13,5-mal so hoch ist; somit schwimmt auch ein Eisenwürfel (Dichte 7,9 g/cm3) in Quecksilber. Kürzlich durchgeführte Monte-Carlo-Simulationen zeigen, dass auch die Dichte des Quecksilbers relativistischen Effekten unterliegt. Nicht-relativistische Berechnungen würden eine Dichte von 16,1 g/cm3 erwarten lassen.[48]
Leitfähigkeit
Die Metallbindung in Quecksilber kommt durch delokalisierte Elektronen zustande. Diese Elektronen nehmen bestimmte, diskrete Energieniveaus in Bändern ein, die durch die Verbreiterung atomarer Zustände durch Wechselwirkung entstehen. In flüssigen Metallen wie Quecksilber existiert keine periodische Struktur. Daher ist der Quasiimpuls keine gute Quantenzahl und die elektronische Bandkonfiguration nicht in der Brillouin-Zone darstellbar, wie sonst für feste Metalle üblich. Durch das Pauli-Prinzip füllen die Elektronen dennoch nach und nach die Energiezustände auf, nur das Leitungsband bleibt unvollständig besetzt. Die Elektronen in diesem Band sind delokalisiert und bilden das Elektronengas. Auch klassisch lässt sich die elektrische Leitfähigkeit durch diese Elektronen erklären.[49]
Aggregatzustände
Quecksilber ist bei Raumtemperatur flüssig. Ursache dafür sind die Eigenschaften der Bindungen zwischen den Quecksilberatomen. Zunächst hat Quecksilber eine sehr spezielle Elektronenkonfiguration. Als Element der 12. Gruppe des Periodensystems besitzen Quecksilberatome komplett gefüllte s- und d-Atomorbitale, was eine sehr stabile und energetisch günstige Konstellation bedeutet. Das Leitungsband ist dadurch leer. Bei den leichteren Homologen Zink und Cadmium, die in derselben Gruppe des PSE wie Quecksilber stehen, jedoch bei Raumtemperatur fest sind, ist der energetische Unterschied zwischen dem Valenzband zum Leitungsband so gering, dass Elektronen problemlos vom Valenz- ins Leitungsband springen können, wodurch eine Metallbindung zustande kommt.
Die Besonderheit bei Quecksilber liegt in dem mit 14 Elektronen vollständig gefüllten 4f-Orbital. Aufgrund der Lanthanoidenkontraktion und des relativistischen Effekts kommt es zu einem Massezuwachs und einer weniger effizienten Abschirmung der Kernladung. Erst kürzlich konnte mittels Monte-Carlo-Simulation nachgewiesen werden, dass die Schmelzpunktanomalie des Quecksilbers tatsächlich relativistischen Effekten geschuldet ist. Ohne relativistische Effekte wäre ein Schmelzpunkt zu erwarten, der um 105 K höher liegen würde als der experimentell beobachtete.[48]
Besetzte Orbitale werden dadurch näher an den Kern herangezogen, ebenso das Valenzband des Quecksilbers. Unbesetzte Orbitale wie das Leitungsband werden jedoch nicht Richtung Kern verlagert, was zu einer besonders großen Energiedifferenz zwischen Valenz- und Leitungsband führt, die bei Zink und Cadmium deutlich geringer ist. So können kaum Elektronen das Valenzband verlassen und das Leitungsband erreichen, wodurch die Metallbindung außergewöhnlich schwach ausfällt. Dies erklärt zugleich auch die Flüchtigkeit und die für Metalle untypisch schlechte Leitfähigkeit des Quecksilbers.
Der für Quecksilber angegebene Schmelzpunkt von -38,836 °C basierte auf der IPTS-68 (The International Practical Temperature Scale of 1968). Nachdem die ITS-90-Werte die IPTS-68 ablösten, mussten die Schmelz- und Siedepunkte angepasst werden. Nach der ITS-90 liegt der Tripelpunkt von Quecksilber bei -38,8344 °C (einer der Fixpunkte für die Definition der ITS-90[50]), wenn der Druck etwa 10-3 Pa beträgt. Mit der Korrektur für den Normaldruck beträgt der Schmelzpunkt bei 0,101325 MPa also -38,8290 °C.[51]
Bei steigendem Druck tritt eine Schmelzpunkterhöhung auf.[52] Die Druckabhängigkeit des Schmelzpunkts wurde anhand kleiner Proben mit 4,8 + 0,2 mK bar-1 ermittelt.[53] Weitere wichtige Größen beim Übergang zwischen den Aggregatzuständen sind die Siedetemperatur unter Normbedingung von 356,6183 °C, der Tripelpunkt bei −38,8344 °C[54] und 0,000165 Pa, sowie der kritische Punkt bei 1764 ± 1 K und 167 ± 3 MPa.[47] Verunreinigungen verändern jedoch alle Phasenumwandlungstemperaturen.
Isotope
Von Quecksilber sind insgesamt 34 Isotope und 9 Kernisomere mit Massenzahlen von 175 bis 208 bekannt. Sieben dieser Isotope sind stabil (mit den Massenzahlen 196, 198, 199, 200, 201, 202 und 204). Von den radioaktiven Isotopen weist nur 194Hg mit 444 Jahren (nach neueren Angaben 520 Jahren)[55] eine relativ lange Halbwertszeit auf. Die anderen Isotope und Kernisomere haben nur Halbwertszeiten zwischen 1,1 Millisekunden und 46,612 Tagen.
Siehe auch: Liste der Quecksilber-Isotope
Verwendung
Thermometer
Die thermische Ausdehnung des Quecksilbers ist, verglichen mit anderen Flüssigkeiten, knapp eine Größenordnung niedriger, zeigt aber im Bereich zwischen 0 °C und 180 °C nur etwa 2 Prozent Linearitätsfehler:
Außerdem benetzt Quecksilber Glas nicht und ist visuell gut zu erfassen. Daher eignet es sich zum Einsatz in Flüssigkeitsthermometern und Kontaktthermometern. Als Außenthermometer in sehr kalten Regionen kann es aber auf Grund seines Schmelzpunktes (−38,83 °C) nur bedingt verwendet werden.
Bedingt durch seine starke Toxizität ist der Einsatz heutzutage auf den wissenschaftlichen Bereich beschränkt; Quecksilber kann teilweise – je nach Temperaturbereich – durch gefärbte Füllungen aus Alkohol, Petroleum, Propylencarbonat, Pentan, Toluol, Kreosot, Isosamylbenzoat, hydriertem Mineralöl oder Galinstan sowie durch elektronische Thermometer ersetzt werden.
Das erste brauchbare Quecksilberthermometer wurde um 1720 von Daniel Gabriel Fahrenheit entwickelt. In einem Thermometer befinden sich im Schnitt 150 mg Quecksilber. In einem Fieberthermometer kann die Menge bis zu 1 g betragen. Dies entspricht in etwa einem Kügelchen von 5,2 mm Durchmesser.
Seit dem 3. April 2009 ist das Inverkehrbringen von neuen quecksilberhaltigen Fieberthermometern, Barometern und Blutdruckmessgeräten innerhalb der EU verboten; ausgenommen hiervon sind Messgeräte für den wissenschaftlichen oder medizinischen Gebrauch sowie Alt- und Gebrauchtgeräte.[56]
Manometer/Barometer

Die klassische Bauform eines Manometers („Druckdifferenzmessers“) ist ein U-Rohr, dessen Enden mit den beiden Druckatmosphären über Leitungen verbunden sind. Bis in die heutige Zeit ist Quecksilber als Manometerflüssigkeit weit verbreitet. Die Vorteile von Quecksilber sind: hohe Dichte, das Nichtbenetzen von Glas und der vernachlässigbare Dampfdruck. Quecksilber ist zwar farblos doch undurchsichtig.
Die einfachste und älteste Bauform des Barometers ist ein stabiles einseitig geschlossenes Glasrohr von etwa 4–6 mm Innendurchmesser, das mit dem geschlossenen Ende nach unten gehalten randvoll mit Quecksilber gefüllt, dann mit dem Daumen verschlossen, umgekehrt aufgerichtet und samt dem Daumen unter den Quecksilberspiegel in einen breiten, halbvollen Becher getaucht wird, bevor der Daumen die nun untenliegende Öffnung wieder freigibt.
Die Quecksilbersäule im Rohr sinkt nur soweit ab, bis die Kraft des Luftdrucks außerhalb des Rohrs und die Gewichtskraft des Quecksilbers im Rohr sich im Gleichgewicht befinden. Bei Normaldruck (1 Atmosphäre) sind dies 760 mm „Quecksilbersäule“. Die alte Angabe in der Maßeinheit Torr für den Luftdruck entspricht der Höhe der Quecksilbersäule in Millimetern, 1 mm Quecksilbersäule entsprechen 133,21 Pascal.
Schalter

Durch seine elektrische Leitfähigkeit und die sehr hohe Oberflächenspannung (0,476 N/m bei 20 °C) ist Quecksilber ideal für die Anwendung als Kontaktwerkstoff in den früher verwendeten Quecksilberschaltern. Wegen der Problematik bei der Entsorgung von Elektronikschrott ist seit dem Jahr 2005 in der EU („RoHS“-Richtlinie) der Einsatz von Quecksilber in Schaltern für die meisten Anwendungsgebiete untersagt. In Spezialanwendungen werden auch heute noch mit Quecksilber benetzte Kontakte verwendet, um besonders geringe Kontaktwiderstände zu erzielen oder das Prellen der Kontakte zu vermeiden (z. B. Hg-Relais).
Quecksilber-Neigungsschalter funktionieren dank Schwerkraft ähnlich der Libelle einer Wasserwaage; ein beweglicher Quecksilbertropfen in einem gebogenen oder geraden Glasrohr öffnet und schließt neigungsabhängig den elektrischen Kontakt zwischen zwei ins Glas eingeschmolzenen Metallstiften. Solche Neigungsschalter finden sich teilweise in alten Treppenlicht-Zeitschaltern, in Thermostaten von Heißwasserspeichern, in Druckschaltern von Hauswasserpumpen und als Rumpelsicherung in Waschmaschinen. In den früher verwendeten Turbowechselrichtern wurde ein Quecksilberstrahl als kreisender „Schaltfinger“ benutzt.
Frühe Wanderschriftanlagen basierten auf Federkontakten, darunter durchgezogenem Lochstreifen und einem Quecksilberbad.
Quecksilberdampflampen


Quecksilber wird in Entladungsgefäßen (Quecksilberdampflampen) von Gasentladungslampen (Leuchtstofflampen, „Energiesparlampen“, Kaltkathodenröhren, Quecksilberdampf-Hochdruck- und -höchstdrucklampen, Höhensonne, Quarzlampe, sog. „Schwarzlichtlampe“) eingesetzt.
Amalgam
Quecksilber bildet mit vielen anderen Metallen spontan Legierungen, die Amalgame genannt werden. Amalgame werden z. B. als Zahnfüllmittel eingesetzt. Ein Gemisch aus Quecksilber und Pulver von Metallen wie Silber ist eine Zeitlang teigig in eine gebohrte Öffnung des Zahns hineindrückbar und härtet bald unter Amalgambildung aus. Während Zahnmaterial durch bakteriell-chemischen Angriff mit den Jahren schwindet, hat Amalgam die Tendenz, sich durch hohen Kaudruck als Metall tendenziell plastisch auszudehnen und den Nebeneffekt, Bakterien im Wachstum zu hemmen. Wird – eventuell versehentlich, typisch von Schokoladeverpackung – beim Kauen ein Stück Alufolie fest auf eine Amalgamfüllung gepresst, bildet sich ein galvanisches Element aus und fließt entsprechend elektrischer Gleichstrom, der als unangenehmer metallischer Reiz im Zahnnerv empfunden wird.
Im März 2017 wurde im Europäischen Parlament die Verordnung (EU) 2017/852 beschlossen, die die Verwendung von Amalgam deutlich einschränkt. Ab Juli 2018 dürfen Jugendliche unter 15 Jahren sowie schwangere und stillende Frauen keine Zahnfüllungen aus Amalgam mehr erhalten. Grundsätzlich müssen ab dann auch vordosierte Mischungen verwendet werden, um den Quecksilberanteil optimal zu halten. Weiter sind dann Amalgamabscheider im Ordinationsabwasserstrang vorgeschrieben. Eine Studie soll bis 2020 klären, ob um 2030 Amalgam völlig aus der Zahnmedizin verbannt werden soll. Einschränkungen wurden auch für die Industrielle Verwendung von Quecksilber verordnet.[57][58]
Da Quecksilber durch Aluminiumamalgambildung die schützende Oxidhaut des Aluminiums zerstört, ist das Mitführen von quecksilberhaltigen Geräten (z. B. Fieberthermometer) in Flugzeugen zwar nicht verboten, aber gemäß der IATA Dangerous Goods Regulations beschränkt (1 Stück / Passagier und zwingend in Schutzhülle – DGR 2.3). Quecksilber ist der Gefahrgutklasse 8 – Ätzende Materialien zugeordnet. Eine ätzende Wirkung besteht in Verbindung mit fast allen Metallen, u. a. Zink, Magnesium und Aluminium, die im Flugzeugbau verwendet werden. Flüssiges Quecksilber wirkt auf Aluminium und -legierungen versprödend durch liquid metal embrittlement.
Desinfektions- und Beizmittel
In dem Wunddesinfektionsmittel Mercurochrom war der wirksame Bestandteil ein organisches Quecksilbersalz. Die heute erhältliche Mercuchrom-Jod-Lösung ist eine Povidon-Jod-Lösung. In Merfen, einem weiteren Desinfektionsmittel, war früher Phenylquecksilberborat enthalten. HgCl2 (Sublimat) wurde früher als Desinfektionsmittel in Krankenhäusern verwendet. Thiomersal ist eine organische Quecksilberverbindung, die in sehr geringen Konzentrationen als Bakterizid zur Konservierung von Impfstoffen verwendet wird.
Die konventionelle Landwirtschaft verwendet Quecksilberverbindungen als Beizmittel für Saatgut. Seit 1984 ist dies in Deutschland verboten. Im Irak kam es 1971–1972 zu Massenvergiftungen infolge des Verzehrs von Saatgut.
Quecksilber(II)-chlorid wurde früher sowohl als Desinfektions- und Beizmittel als auch zur Holzkonservierung und Leichenkonservierung verwendet.
Elektrolyse
Quecksilber spielte mengenmäßig eine große Rolle bei der Herstellung von Natronlauge und Chlor durch Chlor-Alkali-Elektrolyse nach dem Amalgamverfahren. Während der Elektrolyse wird das reduzierte Natriummetall als Amalgam, einer Natrium-Quecksilber-Legierung, in eine separate Zelle, den Zersetzer, überführt, um die Bildung des explosiven Chlorknallgases und des unerwünschten Natriummonooxochlorates (Natriumhypochlorit) in der Elektrolysezelle zu verhindern. Derzeit wird ein großer Teil der deutschen und europäischen mit dem Amalgamverfahren arbeitenden Einrichtungen auf alternative, quecksilberfreie Prozesse (Membranverfahren) umgestellt, um die Quecksilberemissionen zu senken.
Goldwäsche
Bei einem Verfahren zur Goldgewinnung wird Quecksilber verwendet, um den feinen Goldstaub zu lösen, wodurch Goldamalgam entsteht (siehe Amalgamation). Da Quecksilber schon bei niedrigen Temperaturen flüssig wird, bildet es Legierungen, die besonders leicht schmelzen. Beim Waschen und bei anschließendem Glühen zur Rückgewinnung reinen Goldes gelangt das Quecksilber in die Umgebung. Dies ist der Hauptgrund für die hohe Umweltverschmutzung bei dieser Art der Goldgewinnung (siehe dazu Umweltemissionen, weiter unten). Alternativen zum Amalgamverfahren sollen gefördert werden.[59] Auch das Gold für die vom 17. bis 19. Jahrhundert geprägten deutschen Flussgolddukaten wurde durch Amalgamation herausgelöst bzw. gereinigt, um es zu erschmelzen.
Früher wurde unter anderem im Harz auf diese Weise auch Silber gewonnen.
Kunst
Im Grabmal des ersten chinesischen Kaisers Qin Shihuangdi soll es Flüsse aus Quecksilber gegeben haben. In der Umgebung hat man wissenschaftlich den Boden untersucht und dabei einen unnatürlich hohen Quecksilbergehalt festgestellt. Dieser allein ist aber noch kein Beleg für die Richtigkeit der Legende.[60]
Unterhalb der Tempelpyramide des Quetzalcoatl in Teotihuacán haben mexikanische Archäologen flüssiges Quecksilber gefunden. Die Forscher vermuten, dass es sich dabei um die rituelle Darstellung des Unterweltflusses der Maya – vergleichbar mit dem altgriechischen Styx – handelt.[61]
Der amerikanische Künstler Alexander Calder baute 1937 einen Quecksilber-Springbrunnen zum Gedenken an die Todesopfer des Quecksilberabbaus. Um das Jahr 1000 gab es in den Palästen der Kalifen von Córdoba (Medina az-Zahra), Kairo und Bagdad mit Quecksilber gefüllte Becken, die für das Spiel mit Lichtwirkungen genutzt wurden, außerdem in großen Porphyrmuscheln angelegte Quecksilberteiche (für Kairo sind 50 Ellen im Quadrat, also ca. 26 m × 26 m überliefert).
Im Kunsthandwerk war die Feuervergoldung lange gebräuchlich (bei Vergoldung Bronze im 18. Jahrhundert als Ormolu, bis zum Verbot in Frankreich um 1830 wegen Gesundheitsgefahren für die Handwerker).[62] Hier wurde wie bei der Goldgewinnung die leichte Amalgambildung und thermische Trennung von Gold und Quecksilber ausgenutzt. Mit dieser Methode ist auch ein Vergolden von Kupferblechen möglich, was zum Beispiel bei den Kuppeln der Isaakskathedrale in Sankt Petersburg im 19. Jahrhundert angewendet wurde.
Sonstige Anwendungen

- Verwendung findet das Metall in Quecksilberoxid-Zink-Knopfzellen. Mittlerweile gibt es jedoch nur noch einen Produzenten in Taiwan; der Import in die EU ist nicht mehr zulässig.
- Früher wurde es auch in manchen Röhren der Elektronik wie Quecksilberdampfgleichrichtern, Ignitrons, Excitrons, und Thyratrons verwendet.
- In der Astronomie wird Quecksilber zum Bau relativ preisgünstiger Teleskope mit großer Spiegelfläche verwendet (siehe Flüssiger Spiegel): Quecksilber wird in einen tellerförmigen, luftgelagerten Spiegelträger gefüllt, der dann in Rotation versetzt wird. Durch die Drehung verteilt sich das Quecksilber auf der gesamten Spiegelträgerfläche in dünner Schicht und bildet einen nahezu perfekten parabolischen Spiegel. Ein Nachteil dieser Teleskope ist, dass sie nur senkrecht nach oben schauen können (Zenit), da nur dann bedingt durch die Schwerkraft ein geeigneter Rotationsparaboloid entsteht. Ohne Rotation des Spiegels wurden Quecksilberspiegel in der Metrologie als Ebenheitsnormal eingesetzt.[63]
- Die Eigenschaft von Quecksilber, sich wie eine nichtbenetzende Flüssigkeit zu verhalten (Ausnahmen: Amalgambildner wie Kupfer, Silber, Gold, Aluminium), ist Grundlage für die Quecksilberporosimetrie. Hierbei wird Quecksilber unter Druck (0 bis 4000 bar) in Poren unterschiedlicher Größe gedrückt. Über den aufgewendeten Druck und die dabei benötigte Quecksilbermenge können Aussagen über die Beschaffenheit, Form, Verteilung und Größe von Poren und Hohlräumen gemacht werden. Anwendung findet diese Methode unter anderem in der Mineralogie, Pharmazie und den Keramik-Wissenschaften.
- Früher wurden Quecksilbersalze von Hutmachern, insbesondere zur Herstellung der im 18. Jahrhundert sehr modischen Kastorhüte aus Biberfell, verwendet. Der englische Ausdruck “mad as a hatter” (deutsch: „verrückt wie ein Hutmacher“) (siehe auch Hutmachersyndrom) geht vermutlich auf die Anwendung zurück. Er wurde auch durch die Figur des verrückten Hutmachers in Lewis Carrolls Alice im Wunderland populär.
- Quecksilber wurde in der Vergangenheit neben Wasser als Arbeitsmittel in Dampfkraftwerken verwendet. Der Dampf des Metalles erreichte dabei eine Temperatur von 500 °C bei einem Druck von 10 bar. Trotz seiner thermodynamischen Vorteile setzte sich das Verfahren wegen der Giftigkeit des Metalles nicht durch.
- Die ersten Atomreaktoren vom Typ schneller Brüter wurden mit Quecksilber gekühlt (z. B. Clementine-Reaktor in Los Alamos/USA 1946–1952[64] und ähnliche Reaktoren in der Sowjetunion). Wegen großer Korrosionsprobleme und wegen der schwierigen Handhabung des giftigen Quecksilbers wechselte man jedoch bald zu flüssigem Natrium. Während der Reaktor Clementine bis 1970 zurückgebaut wurde, steht das für die russischen vor mehr als 50 Jahren stillgelegten Quecksilber-gekühlten Reaktoren noch aus.
- Seit einigen Jahren ist bekannt, dass ab ca. 1955 in den USA siedendes Quecksilber im militärischen HERMEX-Projekt zur Abtrennung von waffenfähigem Plutonium aus abgebrannten Reaktorbrennelementen benutzt wurde.[65] Mehr als 1000 Tonnen plutoniumhaltigen Quecksilbers aus diesem stillgelegten HERMEX-Projekt werden im Oak Ridge National Laboratory noch gelagert.
- Ebenfalls im Oak Ridge National Laboratory wurde 1950–1963 ein umfangreiches Projekt zur Gewinnung von Tritium für Wasserstoffbomben unter Benutzung von ca. 11.000 Tonnen Quecksilber durchgeführt. Dabei gelangten ca. 3 % des Quecksilbers in die Umgebung.[66]
- Quecksilber findet (bzw. fand vor allem in der Vergangenheit) auch Verwendung als Arbeitsmittel in Diffusionspumpen zur Erzeugung von ölfreiem Hochvakuum.
- Quecksilberdampf diente zur Entwicklung des Bildes bei der Daguerreotypie, dem ersten praktikablen Fotografie-Verfahren. Das dabei entstehende Foto bestand aus einem Quecksilber-Niederschlag auf einer versilberten Kupferplatte.
- Der Mediziner Anton Nuck führte Ende des 17. Jahrhunderts die Injektion von Quecksilber in anatomische Präparate ein.[67]
- Quecksilber wird in Hochleistungsspallationsquellen als Target zur Erzeugung von Neutronen benutzt, z. B. SNS/USA oder JSNS/Japan. Dabei werden ca. 20 Tonnen Quecksilber mit einem Protonenstrahl von ca. 1 GeV Teilchenenergie beschossen. Quecksilberatomkerne werden dadurch zertrümmert und es werden pro eingestrahltem Proton ca. 20 Neutronen frei. Die in Lund (Schweden) geplante Europäische Spallationsquelle ESS wird voraussichtlich kein Quecksilber verwenden.
- Ab ca. 1892 wurden bei wenigen Leuchttürmen die Linsensysteme auf einem Quecksilber-Flotationssystem drehbar gelagert: Hierbei schwamm der Optikunterbau nahezu reibungsfrei in einer soliden, runden, U-förmigen, bis über die Mitte mit Quecksilber gefüllten Wanne. Bei entsprechender Auslegung war das System in der Lage, Linsen mit einem Gewicht von mehreren Tonnen zuverlässig zu tragen. Um Gesundheitsschäden der Leuchtturmwärter durch Quecksilberdämpfe zu vermeiden, wurde auf das Quecksilber eine Lage Öl gegossen.[68]
- Ein nahezu baugleiches System – allerdings weit kleiner – wurde in den 1980er Jahren ersonnen, um einen bewusst schweren Plattenteller eines Plattenspielers nahezu reibungsfrei und dabei geräuschfrei drehbar zu lagern. Es blieb bei einem Prototyp; eine Serienfertigung wurde nicht aufgenommen. Vor einem Nachbau wurde – unter Hinweis auf die Giftigkeit von Quecksilber – dringend abgeraten.[69]
Zurückdrängung der Anwendung und Gewinnung
Das Schwermetallprotokoll von Aarhus zum UNECE-Übereinkommen von 1979 über weiträumige grenzüberschreitende Luftverunreinigung trat 2003 in Kraft und bezweckt die Verminderung der Emissionen der Schwermetalle Blei, Cadmium und Quecksilber.[70]
Vom 9. (dem Tag der Apotheke) bis zum 25. Oktober 2007 wurden in einer Aktion von Lebensministerium und Apothekerkammer in Österreich über die Apotheken eine Million Quecksilberfieberthermometer aus Privathaushalten eingesammelt und über Pharmagroßhandel und den Entsorger Saubermacher in ein Untertage-Lager in Deutschland verbracht. Diese Menge entspricht einer Tonne Quecksilber. Als Anreiz gab es für jedes zurückgegebene ein digitales Fieberthermometer (im Wert von ca. 1 €).[71] Die Initiatoren rechneten nur mit 50.000 Thermometern und mussten 200.000 Digitalthermometer nachliefern.[72]
2009 entschied sich Schweden, den Gebrauch von Quecksilber generell zu verbieten. Das Verbot bedeutet, dass der Gebrauch von Amalgam in Zahnfüllungen eingestellt wird und dass quecksilberhaltige Produkte nicht mehr in Schweden vermarktet werden dürfen. Laut dem schwedischen Umweltministerium ist das Verbot „ein starkes Signal für andere Länder und der Beitrag Schwedens zu den Zielen von EU und UN, Gebrauch und Emission von Quecksilber zu reduzieren.“[73] Dem vorausgegangen war 2008 ein Verbot des Gebrauchs von Quecksilber in Norwegen.[74] Zu diesem Thema wurde 2010 auch eine UN-Konferenz in Stockholm abgehalten.[75] In der Schweiz sanken die eingeführten Quecksilbermengen nach 2008 stark von über 3000 kg auf rund 600 kg pro Jahr im Zeitraum 2009–2013 und weiter auf noch 70 kg im Jahr 2016. Für Dentalprodukte bestimmtes Quecksilber macht davon den Hauptanteil aus.[70] Die „Gemeinschaftsstrategie für Quecksilber“ der EU vom 28. Januar 2005 zielt auf die Reduktion von Emissionen, Angebot und Nachfrage von Quecksilber. Existierende Mengen sollen bewirtschaftet, Menschen vor Exposition geschützt, Verständnis geschaffen und Maßnahmen gefördert werden.[76] Per EU-Richtlinie vom September 2006 wurde der Quecksilbergehalt von Batterien und Akkus mit 0,0005 Gewichtsprozent (Knopfzellen jedoch 2 %) limitiert.[77][78]
Die EG-Verordnung über das Verbot der Ausfuhr von Quecksilber und bestimmten Verbindungen sowie die sichere Lagerung von Quecksilber vom 22. Oktober 2008 verbietet seit 15. März 2011 den Export von Quecksilber und Quecksilberhaltigem – mit Ausnahmen – aus der EU. Mit demselben Datum ist Quecksilber, das vor allem in der Chloralkali-Industrie durch Verfahrensumstellung außer Funktion gebracht wird, als gefährlicher Abfall zu behandeln und in Hochsicherheitsbereiche unter Tage, wie aufgelassenen Salzbergwerken, einzulagern und zu überwachen.[79][80] Europa war bisher der Haupterzeuger von Quecksilber weltweit. Das Inventar an Quecksilber vor allem in der in Deutschland konzentrierten Chloralkali-Elektrolyse beträgt rund 1000 t.
Die Weltproduktion von Quecksilber hat seit ihrem Maximum 1970 mit 10.000 t/a bis 1992 um 3.000 t/a abgenommen.[81]
Bereits seit 2001 haben die Vereinten Nationen in ihrem United Nations Environmental Program Governing Council Quecksilber auf der Liste der regulierten Substanzen der globalen Umweltverschmutzungen gesetzt.[82]
Zehn Jahre nach Anstoß durch Schweiz und Norwegen haben 140 Staaten nach langen Verhandlungen am 19. Januar 2013 in Genf das Minamata-Übereinkommen, das erste bindende Abkommen zur Einschränkung der Gewinnung und zur Eindämmung der Quecksilberemissionen, unterzeichnet. Das Übereinkommen regelt Produktion, Verwendung und Lagerung von Quecksilber und den Umgang mit Hg-haltigen Abfällen; seine Einhaltung wird durch eine beratende Kommission überwacht. Neue Minen dürfen nicht errichtet, bestehende müssen binnen 15 Jahren geschlossen werden, so dass dann Quecksilber nur mehr aus Recycling zur Verfügung steht. Durch den Menschen wurde in den letzten 100 Jahren die Quecksilber-Konzentration in den obersten 100 m der Ozeane verdoppelt, so ein UNO-Bericht.[83]
Entsorgung
Verschüttetes Quecksilber kann mit einer speziellen Quecksilberzange oder durch Gegeneinanderschaufeln von zwei geeignet gemuldeten Blättern Papier aufgenommen werden. Kleine Reste können mit einer Zinkplatte oder Zinkpulver amalgamiert oder mit Schwefel zum Sulfid umgewandelt und dann verfestigt zusammengekehrt werden. Quecksilberabfälle müssen als Sondermüll gesammelt und speziell entsorgt werden.
In der Laborpraxis sollte vermieden werden, dass Quecksilber in Bodenritzen fließt, von wo es über Jahre durch Verdunstung an die Umgebung freigesetzt würde.
Verbindungen
Anorganische Quecksilberverbindungen entstehen durch dessen Verbindung mit anderen Elementen auβer Kohlenstoff, wie beispielsweise Chlor, Schwefel oder Sauerstoff. Sie können Quecksilber entweder in der Oxidationsstufe I (Hg2++) oder II (Hg2+) enthalten. Anorganische Quecksilberverbindungen wurden und werden in einem außerordentlich breiten Spektrum von medizinischen und kosmetischen Produkten verwendet. Organische Quecksilberverbindungen sind eine Teilgruppe der metallorganischen Verbindungen, bei denen Quecksilber an einen organischer Rest oder eine organische Verbindung direkt gebunden ist. Sie enthalten u. a. Alkyl- und Phenylgruppen als organische Reste. Phenylquecksilberverbindungen werden hauptsächlich als Konservierungsstoffe in der Medizin eingesetzt.[84]
Hierbei sind entweder Quecksilber(I)- (auch Diquecksilber(I)-) oder Quecksilber(II)-verbindungen von Bedeutung:
- Dimethylquecksilber
- Quecksilber(II)-acetat
- Quecksilber(II)-amidchlorid (D0602Z)
- Quecksilber(I)-chlorid (Mineral Kalomel)
- Quecksilber(II)-chlorid (Sublimat)
- Quecksilber(II)-fulminat (Knallquecksilber)
- Quecksilber(II)-iodid (Neßler-Reaktion)
- Quecksilber(II)-nitrat
- Quecksilber(II)-oxid
- Quecksilber(II)-sulfid (Mineral Cinnabarit, Zinnober)
Analytik
Amalgamprobe

Quecksilbersalze können mit Hilfe der Amalgamprobe nachgewiesen werden. Die salzsaure Lösung wird auf ein Kupferblech gegeben und es bleibt ein fester, silbriger Amalgamfleck zurück. Silberionen können den Nachweis stören und werden daher als AgCl gefällt.
Glührohrprobe
Ein weiterer Nachweis für Quecksilber ist die Glührohrprobe. Dabei wird die zu analysierende Substanz mit etwa der gleichen Menge Natriumcarbonat (Soda) vermengt und im Abzug geglüht. Elementares Quecksilber scheidet sich als metallischer Spiegel an der Reagenzglaswand ab.
Qualitativer Nachweis im Trennungsgang
Im qualitativen Trennungsgang kann Quecksilber sowohl in der HCl-Gruppe als auch in der H2S-Gruppe nachgewiesen werden. Nach Zugabe von HCl bildet sich Kalomel, Hg2Cl2, welches nach Zugabe von Ammoniaklösung zu fein verteiltem Quecksilber und Quecksilber(II)-amidochlorid reagiert. Nach Einleiten von H2S fällt zweiwertiges Quecksilber in Form von schwarzem Zinnober, HgS, aus und kann mit Hilfe der Amalgamprobe nachgewiesen werden.
Instrumentelle Analytik des Quecksilbers
Für die Spurenanalytik des Quecksilbers und seiner Organoderivate stehen eine Reihe von Methoden zur Verfügung. Allerdings werden in der Literatur laufend neue bzw. verbesserte Verfahren vorgestellt. Ein nicht zu unterschätzendes Problem ist die Probenaufarbeitung.
Atomabsorptionsspektrometrie (AAS)
Unter den verschiedenen Techniken der AAS liefern die Quarzrohr- und die Graphitrohrtechnik die besten Ergebnisse für anorganische und metallorganische Quecksilberverbindungen. Dabei wird eine Quarzküvette elektrisch auf über 900 °C erhitzt und die Probe dabei atomisiert. Anschließend wird die Absorption bei 253,7 nm gemessen. Als Beispiel sei eine Nachweisgrenze für CH3HgCl von 100 µg/L genannt.[85] Eine weitere beliebte Technik zum Nachweis von elementarem Quecksilber oder Quecksilberorganylen ist die Kaltdampferzeugung in Verbindung mit der AAS. Bei sehr geringen Konzentrationen werden die volatilen Analytspezies zunächst unter Bildung von Amalgamen auf Gold- oder Silberoberflächen, welche in einer Graphitküvette platziert wurden, angereichert. Anschließend wird bei 1400 °C atomisiert und die Absorption gemessen. Auf diesem Wege wurde eine Nachweisgrenze von 0,03 ng erreicht.[86][87]
Atomemissionsspektrometrie (AES)
In der AES haben sich das mikrowelleninduzierte Plasma (MIP) und das induktiv gekoppelte Plasma (ICP) zur Atomisierung bewährt. Die Detektion findet auch bei dieser Methode bei 253,65 nm und 247,85 nm statt. Mit Hilfe der MIP-AES wurden absolute Nachweisgrenzen von 4,4 ng/g Probe gefunden. Die ICP-AES weist eine Nachweisgrenze von 20 bis 50 ng/mL auf.[88][89][90]
Massenspektrometrie (MS)
Quecksilber weist insgesamt sieben stabile Isotope unterschiedlicher Häufigkeit auf. Für die Massenspektrometrie sind jedoch häufig nur 201Hg (13,22 %) und 202Hg (29,80 %) relevant. Mit Hilfe der ICP-MS können anorganische Quecksilberverbindungen und Quecksilberorganyle wie Methylquecksilber, CH3Hg, mit Nachweisgrenzen von bis zu 2,6 ng/g bestimmt werden.[88][89]
Neutronenaktivierungsanalyse (NAA)
Die NAA basiert auf der Kernreaktion AHg(n,γ)A+1Hg (Bestrahlung von Quecksilber mit Neutronen). Dadurch entstehen radioaktive Quecksilbernuklide. Die Intensität resultierenden charakteristischen Gammastrahlung wird mit einem hochreinen Germaniumdetektor bestimmt. Sie ist proportional der Anzahl an vorhandenen aktivierten Kernen und es können durch interne Kalibrierung quantitative Aussagen getroffen werden. Häufig wird 197mHg mit einer Halbwertszeit von 2,7 Tagen bei 77,3 keV detektiert.[89]
Voltammetrie
Für die elektrochemische Bestimmung von Hg-Spuren eignet sich am besten die anodische Stripping-Voltammetrie (ASV). Dabei geht der voltammetrischen Messung eine reduktive Anreicherungsperiode auf der Gold-Messelektrode voraus. Es folgt die eigentliche Bestimmung durch Messung des Oxidationsstroms beim Scannen eines Spannungsfensters von 0 V bis 600 mV. Die Höhe des Oxidationspeaks bei 500 mV korreliert mit der Menge an vorhandenem Quecksilber. Es wurden Nachweisgrenzen von 12 pM (2,4 ng/l) Quecksilber im Meerwasser nach 2-minütiger Anreicherungszeit erzielt.[91] Daneben kommt die Invers-Voltammetrie an Gold-, Platin- oder Kohleelektroden in Frage.[92]
Automatisierte Analytik
Für die Routineanalytik von Quecksilber gibt es mittlerweile automatisierte Analysatoren. Sie beruhen üblicherweise auf dem Prinzip der thermischen Zersetzung, gefolgt von einer Amalgamierung und anschließender Messung der Atomabsorption (siehe AAS). Mit derartigen Analysengeräten können feste und flüssige Proben innerhalb von wenigen Minuten auf ihren Quecksilbergehalt untersucht werden. Diese kommerziell erhältlichen Geräte sind sehr empfindlich und genügen den Anforderungen von nationalen Qualitäts-sicherungsstandards wie der US-EPA-Methode 7473 und der ASTM-Methode D-6722-01.
Umweltemissionen
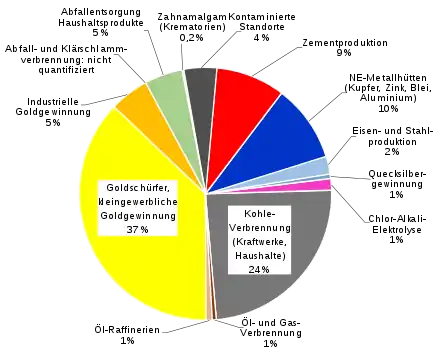
Quecksilber wird in großen Mengen durch menschliche Aktivitäten freigesetzt. Es wird geschätzt, dass jährlich etwa 2500 Tonnen durch anthropogene Emissionen als gasförmiges Quecksilber in die Atmosphäre abgegeben werden, zudem noch erhebliche Mengen in Böden und Gewässer. Der anthropogene Anteil an den Gesamtemissionen beträgt geschätzt rund 30 %.[95] Die gesamten von den Anfängen der Zivilisation bis 2010 durch menschliche Aktivitäten verursachten Emissionen in die Umwelt wurden auf 1,1–2,8 Millionen Tonnen geschätzt.[96]
Bedeutende Emissionsquellen sind:
- die (kleingewerbliche) Goldgewinnung (Artisanal Small Scale Mining). Nach Schätzungen werden 20 bis 30 Prozent des weltweit geförderten Goldes durch nicht industrielles Schürfen, also von Goldsuchern gewonnen.[97] Würden alle Goldschürfer auf der Welt das umweltschonende Borax-Verfahren anwenden, könnte die Emission von rund 1.000 Tonnen Quecksilber, etwa 30 % der weltweiten Quecksilber-Emissionen, vermieden werden.[98]
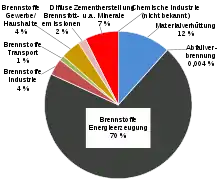
- Die Energiewirtschaft, insbesondere Kohlekraftwerke: Die Quecksilberemissionen durch die Energiewirtschaft werden fürs Jahr 2010 auf weltweit ca. 859 Tonnen beziffert, wovon etwa 86 % aus der Verbrennung von Kohle stammen.[99] Der anhaltende Ausbau von Kohlekraftwerken in China wird dazu führen, dass sich in Zukunft die Kohleverbrennung zum größten Emittenten entwickelt.[100] In Stein- und Braunkohle tritt Quecksilber zwar nur in Spuren auf, die hohe Menge der weltweiten verbrannten Kohle führt aber zu erheblichen Freisetzungsraten. In Deutschland emittiert die Energiewirtschaft seit 1995 konstant rund 7 Tonnen Quecksilber.[94]
- Zementwerke (durch Quecksilber im Kalkstein und beim Einsatz von Abfall/Klärschlamm als Brennstoff),
- Nichteisenmetallhütten (durch Quecksilber in Erzen, vor allem bei Gold-, Kupfer, Zink- und Bleigewinnung),
- Stahlerzeugung (vor allem bei Schrotteinsatz),
- Herstellung von Chlor, Wasserstoff und Natronlauge (Chlor-Alkali-Elektrolyse mit Amalgamverfahren).
Bei den luftseitigen Quecksilberemissionen aus Deutschland (10257 kg im Jahr 2013) hatte die Energiewirtschaft aufgrund der Kohlekraftwerke einen Anteil von 68 % (6961 kg), die Metallverhüttung 11 % (1080 kg) und die Zement- u. a. Mineralindustrie 6 % (609 kg).[94] Mit rund 10 Tonnen Quecksilberemission ist Deutschland zusammen mit Polen und Griechenland Spitzenreiter in Europa.[101]
Im Januar 2016 zeigte eine im Auftrag der Grünen erstellte Studie, dass die seit April 2015 in den USA für 1100 Kohlekraftwerke geltenden Quecksilber-Grenzwerte in Deutschland von keinem Kohlekraftwerk eingehalten werden, da entsprechend strenge gesetzliche Anforderungen fehlen.[102] Würden die gleichen Grenzwerte für Quecksilber-Emissionen wie in den USA gelten (im Monatsmittel umgerechnet etwa 1,5 µg/m³ für Steinkohlekraftwerke und 4,4 µg/m³ für Braunkohlekraftwerke), könnte von den 53 meldepflichtigen Kohlekraftwerken in Deutschland lediglich das inzwischen stillgelegte Kraftwerk Datteln (Block 1–3) am Netz bleiben.[102] Das Umweltbundesamt empfiehlt seit mehreren Jahren die Absenkung des Grenzwertes im Abgas von Kohlekraftwerken auf 3 µg/m³ im Tagesmittel und 1 µg/m³ im Jahresmittel.[103][104] Bei der Umsetzung der europäischen Industrieemissionsrichtlinie haben Bundesregierung und Bundestagsmehrheit Ende Oktober 2012 für Kohlekraftwerke Grenzwerte von 30 µg/m³ im Tagesmittel und (für bestehende Kraftwerke ab 2019) 10 µg/m³ im Jahresmittel beschlossen. Auf der Expertenanhörung im Umweltausschuss des Bundestags am 15. Oktober 2012 war eine Angleichung an die US-amerikanischen Grenzwerte empfohlen worden.[105][106] Im Juni 2015 hat eine von der Europäischen Kommission geleitete Arbeitsgruppe mit Vertretern aus Mitgliedstaaten, Industrie- und Umweltverbänden festgestellt, dass in Kohlekraftwerken mit quecksilberspezifischen Techniken Quecksilber-Emissionswerte unter 1 µg/m³ im Jahresmittel erreichbar sind.[107] Niedrige Quecksilberemissionen lassen sich durch die Zugabe von Aktivkohle, durch Fällungsmittel im Rauchgaswäscher oder Spezialfiltermodule erreichen. Katalysatoren und die Zugabe von Bromsalzen können die Quecksilberausschleusung verbessern, weil sie elementares in ionisches Quecksilber umwandeln. Die mit diesen Verfahren verbundene Erhöhung der Stromerzeugungskosten wird auf unter 1 Prozent geschätzt.[108]
Niedrige Quecksilber-Konzentrationswerte im Bereich von 1 Mikrogramm pro Normkubikmeter und darunter erreichen beispielsweise das Steinkohle-Kraftwerk in Lünen-Stummhafen,[109] das Steinkohle-Kraftwerk in Wilhelmshaven[110], das Steinkohle-Kraftwerk in Werne,[111] das Steinkohle-Kraftwerk in Hamm-Uentrop,[112] das Steinkohle-Kraftwerk in Großkrotzenburg bei Hanau[113] sowie das Braunkohlekraftwerk in Oak Grove (Texas/USA).[114][115]
Die beiden folgenden Tabellen nennen meldepflichtige Betriebe in Deutschland, die im Jahr 2010 mehr als 100 Kilogramm Quecksilber pro Jahr an die Luft gemeldet hatten bzw. mehr als 5 Kilogramm Quecksilbereinleitung pro Jahr in ein Gewässer meldeten. Fett gedruckte Zahlen markieren gegenüber dem Vorjahr gestiegene Emissionen.
| Anlagenart | Betriebsname | Betreiber | Quecksilber (kg) | ||||
|---|---|---|---|---|---|---|---|
| 2010 | 2012 | 2013 | 2014 | 2015 | |||
| Braunkohle-Kraftwerk | Kraftwerk Lippendorf* | Vattenfall | 1.160 | 482 | 410 | 489 | 490 |
| Braunkohle-Kraftwerk | Kraftwerk Jänschwalde** | Vattenfall | 592 | 505 | 330 | 501 | 431 |
| Braunkohle-Kraftwerk | Kraftwerk Niederaußem | RWE | 499 | 497 | 527 | 485 | 486 |
| Braunkohle-Kraftwerk | Kraftwerk Weisweiler | RWE | 271 | 299 | 227 | 232 | 176 |
| Braunkohle-Kraftwerk | Kraftwerk Schwarze Pumpe | Vattenfall | 243 | 228 | 194 | 303 | 339 |
| Stahlwerk | Peiner Träger | Salzgitter AG | 229 | 131 | 67,9 | 49,7 | 148 |
| Braunkohle-Kraftwerk | Kraftwerk Schkopau | E.ON, EP Energy | 227 | 441 | 430 | 405 | 267 |
| Braunkohle-Kraftwerk | Kraftwerk Boxberg | Vattenfall | 226 | 235 | 370 | 392 | 486 |
| Braunkohle-Kraftwerk | Kraftwerk Neurath | RWE | 181 | 497 | 667 | 672 | 708 |
| Steinkohle-Kraftwerk | Kraftwerk Bremen-Hafen | swb AG | 156 | 150 | 45,4 | < 10 | 16,6 |
| Braunkohle-Kraftwerk | Kraftwerk Frimmersdorf | RWE | 153 | 119 | 68,6 | 79,1 | 95,9 |
| Steinkohle-Kraftwerk | Grosskraftwerk Mannheim | RWE, EnBW, MVV Energie | 146 | 137 | 154 | 139 | 148 |
| Chemische Industrie | Werk Ludwigshafen am Rhein | BASF | 140 | 97 | 62,7 | 70,5 | 61,2 |
| Müllverbrennung | Müllverbrennung Hagen | Hagener Entsorgungsbetrieb | 140*** | < 10 | < 10 | < 10 | < 10 |
| Stahlwerk | Werk Kehl | Badische Stahlwerke | 140 | 211 | 211 | 117 | k. A. |
| Steinkohle-Kraftwerk | Kraftwerk Scholven | E.ON | 135 | 144 | 155 | 151 | 79 |
| Chemische Industrie | Werk Frankfurt am Main | Akzo Nobel Industrial Chemicals | 131 | 63,9 | 63,9 | 63,9 | 31,9 |
| Chemische Industrie | Werk Lülsdorf | Evonik Degussa | 111 | 68,5 | 68,5 | 8,17 | 47,2 |
| Steinkohle-Kraftwerk | Kraftwerk Farge | GDF Suez | 106 | 109 | 113 | 17,1 | 15,5 |
| Chlor-Alkali-Elektrolyse | Werk Rüstersiel | INEOS Chlor Atlantik | 101 | 77 | 58,2***** | - | - |
| Summe | 5.087 | 4.491 | 4.223 | 4.174 | 4.026 | ||
| Deutschland Gesamt[117] | 10.310 | 9.985 | 9.627 | 9.239 | 9.095 | ||
| Anteil aufgeführter Betriebe an Gesamt**** | 49 % | 45 % | 44 % | 45 % | 44 % | ||
| * mit Klärschlamm-Abfallverbrennung ** mit Ersatzbrennstoff-Abfallverbrennung *** Mess-/Meldefehler; tatsächlich: < 10[118] **** Werte < 10 kg mit Null berechnet ***** Juli 2013 geschlossen | |||||||
| Flusseinzugsgebiet | Betriebsname | Betreiber | Quecksilber (kg) | ||
|---|---|---|---|---|---|
| 2010 | 2012 | 2015 | |||
| Isar/Donau | München I Gut Großlappen | Münchner Stadtentwässerung | 19,5 | 7,69 | < 1 |
| Isar/Donau | München II – Gut Marienhof | Münchner Stadtentwässerung | 11,3 | 2,45 | < 1 |
| Weiße Elster/Saale/Elbe | Kläranlage Rosenthal | Kommunale Wasserwerke Leipzig | 10,8 | 8,1 | 8,1 |
| Spree/Havel/Elbe | Klärwerk Waßmannsdorf | Berliner Wasserbetriebe | 9,8 | < 1 | < 1 |
| Rur/Maas | Zentralkläranlage Düren-Merken | Wasserverband Eifel-Rur | 8,89 | 2,12 | < 1 |
| Elbe | Klärwerk Magdeburg/Gerwisch | Städtische Werke Magdeburg | 8,1 | < 1 | k. A. |
| Weser | Kläranlage Minden-Leteln | Städtische Betriebe Minden | 7,53 | 5,9 | < 1 |
| Wupper/Rhein | Kläranlage Buchenhofen | Wupperverband | 7 | 2 | 2 |
| Elbe | Klärwerksverbund Köhlbrandhöft/Dradenau | Hamburger Stadtentwässerung | 6 | < 1 | 3,4 |
| Rhein | Kläranlage Huckingen | Wirtschaftsbetriebe Duisburg | 6 | < 1 | < 1 |
| Spree/Havel/Elbe | Klärwerk Ruhleben | Berliner Wasserbetriebe | 5,8 | < 1 | < 1 |
| Summe | 101 | 38 | 13,5 | ||
In der Schweiz macht der Eintrag aus Kläranlagen in Oberflächengewässer etwa 1,5 bis 3 Prozent aus (was etwa 5 kg entspricht), der Rest stammt aus diffusen Quellen.[120][121]
In Norwegen sind quecksilberhaltige Produkte seit 2008,[122] in Schweden seit 2009 verboten.[73]
Aufgrund der bekannten Gefahren durch freigesetztes Quecksilber erarbeitete das UN-Umweltprogramm (UNEP) ein internationales Abkommen („Minamata-Übereinkommen“), das im Oktober 2013 von 140 Staaten unterschrieben wurde. Ziel ist die weltweite Minderung von Quecksilberemissionen aus Bergbau, Produktionsverfahren, Produkten und Abfällen. Das Abkommen wurde durch die Ratifizierung des 50. Unterzeichnerstaates am 18. Mai 2017 verbindlich und trat am 16. August 2017 in Kraft.[123]
Das amerikanische Blacksmith Institute ermittelt seit 2006 die Top 10 der am stärksten verseuchten Orte der Erde. Quecksilber gehört hier häufig zu den Schadstoffen der „nominierten“ Orte.[124]
Der Export von Quecksilber bzw. von quecksilberhaltigen Stoffen mit einer Konzentration von über 95 % Quecksilber aus der EU in Nicht-EU-Staaten ist verboten.[80]
Gesundheitsschäden durch Quecksilber
| Nahrungsmittel | Gehalt Hg (µg pro 100 g) |
|---|---|
| Früchte | 0,12 |
| Eier und Eierprodukte | 0,12 |
| Gemüse | 0,7 |
| Trinkwasser | 0,01 |
| zusammengesetzte Lebensmittelerzeugnisse | 1,8 |
| Barsch | 20,3 |
| Aal | 17,8 |
| Herring | 3,6 |
| Thunfisch | 29 |
| Schwertfisch | 121,2 |
| Fisch (allgemein) | 16,6 |
Quecksilber ist ein giftiges Schwermetall, das bereits bei Zimmertemperatur Dämpfe abgibt. Bei der Aufnahme über den Verdauungstrakt ist reines metallisches Quecksilber vergleichsweise ungefährlich, eingeatmete Dämpfe wirken aber stark toxisch.
Extrem toxisch sind organische Quecksilberverbindungen, da diese im Gegensatz zu elementarem Quecksilber fettlöslich sind. Sie können mit der Nahrung aufgenommen werden, aber auch über die Haut. Sie durchdringen problemlos die meisten Schutzhandschuhe. Diese organischen Quecksilberverbindungen werden fast vollständig resorbiert und in fetthaltiges Gewebe eingebaut. Sie entstehen in der Nahrungskette durch Biomethylierung von Quecksilber (oder Quecksilbersalzen) zu Methylquecksilber. Die Hauptquelle für die menschliche Belastung mit Methylquecksilber ist die Aufnahme über den Konsum von Meeresfisch. Vergiftungen durch organische Quecksilberverbindungen wurden weltweit Mitte der 1950er Jahre durch die Berichterstattung über die Minamata-Krankheit bekannt. Bei der Belastung mit anorganischem Quecksilber sind die Hauptquellen die Aufnahme über die Nahrung und über Dentalamalgam.[70]
Je nach Aufnahme sind sowohl eine akute als auch eine chronische Vergiftung möglich. Als Beispiel kann der Fall des englischen Schiffes Triumph im Jahre 1810 dienen, auf dem sich mehr als 200 Menschen vergifteten, als ein Fass mit Quecksilber auslief.
In den Jahren 2007 und 2015 sind ayurvedische Mittel mit hohen Quecksilbergehalten aufgefallen.[126][127]
Siehe auch
- Hautaufhellung
- Minamata-Krankheit (chronische Vergiftung durch Quecksilber)
- Minamata-Übereinkommen
- Quecksilberhorizont
- Schadstoffe aus Kohlekraftwerken
- Thiomersal
Literatur
- Günther Tölg, Irmgard Lorenz: Quecksilber – ein Problemelement für den Menschen? In: Chemie in unserer Zeit. 11(5), 1977, S. 150–156, doi:10.1002/ciuz.19770110504.
- Klaus Brodersen: Quecksilber – ein giftiges, nützliches und ungewöhnliches Edelmetall. In: Chemie in unserer Zeit. 16(1), 1982, S. 23–31, doi:10.1002/ciuz.19820160105.
- Fritz Schweinsberg: Bedeutung von Quecksilber in der Umweltmedizin – eine Übersicht. In: Umweltmedizin in Forschung und Praxis. 7(5), 2002, S. 263–278.
- Ralf Ebinghaus u. a.: Mercury Contaminated Sites – Characterization, Risk Assessment and Remediation. Springer Verlag, Berlin 1999, ISBN 3-540-63731-1.
- Carl J. Watras, John W. Huckabee: Mercury Pollution – Integration and Synthesis. Lewis Publishers, Ann Arbor 1994, ISBN 1-56670-066-3.
- Jander Blasius, Joachim Strähle, Eberhard Schweda: Lehrbuch der analytischen und präparativen anorganischen Chemie. 16. Auflage. S. Hirzel Verlag, 2006, ISBN 3-7776-1388-6, S. 466.
- Bruno Lange, Zdenek J. Vejdelek: Photometrische Analyse. Verlag Chemie, Weinheim 1987, ISBN 3-527-25853-1.
- Rolf Schiller: Recycling von Sonderabfällen. Quecksilberhaltige Abfälle. Dornier-System GmbH Mai 1977. Studie für das Bundesministerium für Forschung und Technologie (BMFT).
- A. Ritscher: Verwendung, Entsorgung und Umwelteinträge von Quecksilber. Übersicht über die Situation in der Schweiz. Bundesamt für Umwelt, Bern 2018. Umwelt-Zustand Nr. 1832: 51 S.
Historische Quellen
- Georg August Richter: Das Quecksilber als Heilmittel. Rücker, Berlin 1830. Digitalisierte Ausgabe der Universitäts- und Landesbibliothek Düsseldorf
- Lutz Sauerteig: Quecksilber. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 1208 f.
Weblinks
- Quecksilber im Mineralienatlas
- Allum: Informationen zum Thema Quecksilber
- Handlungsanweisung bei zerbrochenem Quecksilberthermometer
- Mercury and Human Health, Environmental Health & Toxicology, Specialized Information Services, National Library of Medicine (engl.)
- Quecksilber-Emissionsminderungsprogramm der Vereinten Nationen
- Torsten Arndt: Problematik, Klinik und Beispiele der Spurenelementvergiftung – Quecksilber. In: Toxichem Krimtech. 79(2), 2012, S. 51 PDF-Datei
- Stoffmonographie Quecksilber – Referenz- und Human-Biomonitoring-Werte(HBM), Umweltbundesamt Berlin. Springer Verlag, 1999
- Quecksilber Fachinformationen des Bundesamts für Umwelt
- Quecksilber – Informationen des Bundesamts für Lebensmittelsicherheit und Veterinärwesen
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Quecksilber) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu mercury in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu mercury bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Quecksilber) entnommen.
- Elementstruktur von Quecksilber. In: uni-konstanz.de. Universität Konstanz, 29. März 2016, abgerufen am 26. Oktober 2020.
- Eintrag zu Quecksilber in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Dezember 2019. (JavaScript erforderlich)
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- M. Simon, P. Jönk, G. Wühl-Couturier, S. Halbach: Mercury, Mercury Alloys, and Mercury Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2006, doi:10.1002/14356007.a16_269.pub2.
- Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, 2005, ISBN 3-11-017485-5, S. 361.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Quecksilber) entnommen.
- Xuefang Wang, Lester Andrews, Sebastian Riedel, Martin Kaupp: Mercury Is a Transition Metal: The First Experimental Evidence for HgF4. In: Angewandte Chemie. 119, 2007, S. 8523–8527, doi:10.1002/ange.200703710.
- Eintrag zu Mercury im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7439-97-6 bzw. Quecksilber), abgerufen am 2. November 2015.
- Jacob Grimm, Wilhelm Grimm: Deutsches Wörterbuch. Band 13, Verlag von S. Hirzel, Leipzig.
- Friedrich Kluge, Alfred Götze: Etymologisches Wörterbuch der deutschen Sprache. 20. Auflage, hrsg. von Walther Mitzka. De Gruyter, Berlin/ New York 1967; Neudruck („21. unveränderte Auflage“) ebenda 1975, ISBN 3-11-005709-3, S. 361 (keck) und 574 (Quecksilber).
- Klein: Was nun? Der Sturz des Quecksilbers. In: Naturarzt. Band 50, 1922, S. 46–50.
- Lutz Sauerteig: Quecksilber. 2005, S. 1208.
- Wilhelm Hassenstein, Hermann Virl: Das Feuerwerkbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdruckes aus dem Jahr 1529 mit Übertragung ins Hochdeutsche und Erläuterungen von Wilhelm Hassenstein. Verlag der Deutschen Technik, München 1941, S. 40.
- Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 147.
- Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 147.
- C. B. Khadilkar: Mercury and its uses in medicine (for the last 3000 year). In: Med. Bull. (Bombay). 15, 1947, S. 152–162.
- Johann Almkvist: Über die Quecksilberbehandlung in Europa während des Mittelalters. In: Wiener klinische Wochenschrift. 60, 1948, S. 15–19.
- Otto Loeb: Neue Mittel. Über Asurol zur Behandlung der Syphilis. Von Dr. Hoffmann, aus d. Klinik f. Hautkrankheiten der Krankenanstalten der Stadt Düsseldorf. In: Medizinische Klinik. Band 6, 1910, S. 1054; auch in Therapeutische Monatshefte. Band 24, 1910, S. 553.
- Walther Schönfeld: Über die einzeitig kombinierte intravenöse Quecksilbersalvarsanbehandlung der Syphilis unter besonderer Berücksichtigung von Novasurol-Silbersalvarsanmischungen. In: Münchener medizinische Wochenschrift. Band 68, 1921, S. 197–199.
- Carl Sigmund (Ritter von Ilanor): Die Einreibungscur mit grauer Quecksilbersalbe bei Syphilisformen. (eingeschränkte Vorschau in der Google-Buchsuche).
- Volker Zimmermann: Die beiden Harburger Syphilis-Traktate. In: Würzburger medizinhistorische Mitteilungen. Band 7, 1989, S. 72 und 77.
- Lutz Sauerteig: Quecksilberkur. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, S. 1209.
- Gottfried Schramm: Zur Geschichte der subkutanen Injektionen und Injektabilia in der zweiten Hälfte des 19. Jahrhunderts mit besonderer Berücksichtigung der Quecksilbertherapie. Stuttgart 1987.
- Fränztl: Enterotomie bei Ileus. In: Virchows Archiv. Band 49, 1870, S. 164–192.
- Unkonventionelle Supraleiter und ihre Parallelen. (Memento vom 30. September 2007 im Internet Archive) In: Neue Zürcher Zeitung. 28. September 2005.
- Vgl. Bernhard D. Haage: Das alchemistische Bildgedicht vom „Nackten Weib“ in seiner bisher ältesten Überlieferung. In: Centaurus. Band 26, 1982, S. 204–214.
- Vgl. auch [Anonymus:] Vers-Bild-Allegorie vom Mercurius philosophorum (15. Jh.) In: Joachim Telle: Sol und Luna. Literar- und alchemiegeschichtliche Studien zu einem altdeutschen Bildgedicht. Hürtgenwald 1980 (= Schriften zur Wissenschaftsgeschichte. Band 2), S. 130.
- Lotte Kurras: Kluge, Hans. In: Verfasserlexikon. 2. Auflage. Band 5, Sp. 1264.
- F. J. C. Milara: The mining park of Almadén. In: Urban Research & Practice. Band 4, Nr. 2, 2011, S. 215–218, doi:10.1080/17535069.2011.605847.
- Paul F. Schuster et al.: Permafrost Stores a Globally Significant Amount of Mercury. In: Geophysical Research Letters. Band 45, 2018, S. 1463–1471, doi:10.1002/2017GL075571.
- Francesca Sprovieri, Nicola Pirrone, Mariantonia Bencardino, Francesco D’Amore, Francesco Carbone: Atmospheric Mercury Concentrations observed at ground-based monitoring sites globally distributed in the framework of the GMOS network. In: Atmospheric Chemistry and Physics Discussions. 7. Juni 2016, S. 1–32, doi:10.5194/acp-2016-466 (atmos-chem-phys-discuss.net [abgerufen am 9. März 2019]).
- Malcolm Back, William D. Birch, Michel Blondieau und andere: The New IMA List of Minerals – A Work in Progress – Updated: January 2021. (PDF; 3,4 MB) In: cnmnc.main.jp. IMA/CNMNC, Marco Pasero, Januar 2021, abgerufen am 24. Februar 2021 (englisch).
- Ernest H. Nickel, Joel D. Grice: The IMA Commission on new Minerals and Mineral Names: Procedures and Guidelines on Mineral Nomenclature. In: The Canadian Mineralogist. Band 36, 1998, S. 1–14 (englisch, cnmnc.main.jp [PDF; 336 kB; abgerufen am 24. Februar 2021]).
- Ernest H. Nickel, Monte C. Nichols: IMA/CNMNC List of Minerals 2009. (PDF; 1,82 MB) In: cnmnc.main.jp. IMA/CNMNC, Januar 2009, abgerufen am 24. Februar 2021 (englisch, Quecksilber (Mercury) siehe S. 184).
- David Barthelmy: Minerals Arranged by the New Dana Classification. – 01.01. Native Elements with metallic elements other than the platinum group. In: webmineral.com. Abgerufen am 24. Februar 2021 (englisch).
- Werner Schröter, K.-H. Lautenschläger: Chemie für Ausbildung und Praxis. Verlag Harry Deutsch, Thun/ Frankfurt am Main 1996, ISBN 3-8171-1484-2, S. 314.
- Lars D. Hylander, Markus Meili: 500 years of mercury production: global annual inventory by region until 2000 and associated emissions. In: Science of The Total Environment. 304, 2003, S. 13–27, doi:10.1016/S0048-9697(02)00553-3.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. Weinheim 1988, ISBN 3-527-26169-9.
- E. Méndez-Lango, J. Ancsin: Triple point and melting point of mercury. In: Thermochimica Acta. 287, 1996, S. 183, doi:10.1016/s0040-6031(96)02979-6.
- Florent Calvo, Elke Pahl, Michael Wormit, Peter Schwerdtfeger: Evidence for Low-Temperature Melting of Mercury owing to Relativity. In: Angewandte Chemie International Edition. 52, 2013, online (keine endgültige Seitenangabe). doi:10.1002/anie.201302742.
- J. M. Ziman: A theory of the electrical properties of liquid metals. I: The monovalent metals. In: Philosophical Magazine. Band 68, Nr. 6, 1961, S. 1013. doi:10.1080/14786436108243361
- unbekannt: The international temperature scale of 1990. In: Bulletin of Alloy Phase Diagrams. 11, 1990, S. 107, doi:10.1007/BF02841688.
- Guminski, C. "The Melting and Boiling Points of Mercury (Hg)." Journal of Phase Equilibria and Diffusion, volume 13, number 4, 1992, p. 339. doi:10.1007/BF02674977
- Mercury Handbook: Chemistry, Applications and Environmental Impact, von L. F. Kozin, Steve C. Hansen.
- E. Méndez-Lango, J. Ancsin: Triple point and melting point of mercury. In: Thermochimica Acta. Band 287, Nr. 2, 1996, ISSN 0040-6031, S. 183–190, doi:10.1016/S0040-6031(96)02979-6 (sciencedirect.com).
- Herbert Windisch: Thermodynamik: Ein Lehrbuch für Ingenieure. Walter de Gruyter & Co KG, 2017, ISBN 978-3-11-053368-2 (books.google.com).
- matpack.de: 80-Hg-194 (Memento vom 18. Januar 2012 im Internet Archive)
- Richtlinie 2007/51/EG des Europäischen Parlamentes und des Rates vom 25. September 2007 zur Änderung der Richtlinie 76/769/EWG des Rates hinsichtlich der Beschränkung des Inverkehrbringens bestimmter quecksilberhaltiger Messinstrumente.. In: Amtsblatt der Europäischen Union. L, Nr. 257, 3. Oktober 2007, S. 13–15.
- EU verbietet Amalgam für Schwangere und Kinder orf.at, 14. März 2017, abgerufen am 14. März 2017.
- Verordnung (EU) 2017/852 des Europäischen Parlaments und des Rates vom 17. Mai 2017 über Quecksilber und zur Aufhebung der Verordnung (EG) Nr. 1102/2008
- Chemicals and Waste Branch UNEP: ASGM: Eliminating the worst practices, YouTube, September 2017.
- The Secret Tomb of China’s 1st Emperor: Will We Ever See Inside? 17. Aug. 2012.
- Archäologen finden flüssiges Quecksilber in Kammer unterhalb der Tempelpyramide des Quetzalcoatl.
- Ormolu, antique instruments, archiviert in der waybackmachine
- Ebenen mit Nanometerhügeln In: PTB-Maßstäbe. Heft 5, 2004, S. 12 f.
- Merle E. Bunker: Early Reactors From Fermi’s Water Boiler to Novel Power Prototypes. In: Los Alamos Science Report (1983). (PDF; 998 kB).
- Solubilities of selected matals in mercury: Hermex Process. (Memento vom 14. Mai 2011 im Internet Archive) (PDF; 5,6 MB).
- S. C. Brooks, G. R. Southworth: History of mercury use and environmental contamination at the Oak Ridge Y-12 Plant. In: Environmental Pollution. 159, 2011, S. 219–228. doi:10.1016/j.envpol.2010.09.009.
- J. Stahnke: Ludwik Teichmann (1823–1895). Anatom in Krakau. In: Würzburger medizinhistorische Mitteilungen. 2, 1984, S. 205–267; hier: S. 224.
- United States Lighthouse Society – Lens Rotation by Thomas Tag
- Turntable, platter floating on mercury auf bonavolta.ch
- Bundesamt für Umwelt BAFU: Verwendung, Entsorgung und Umwelteinträge von Quecksilber. Abgerufen am 10. März 2019.
- Durchschlagender Erfolg: 1 Million Quecksilber-Thermometer von den KonsumentInnen zurückgegeben. 9. November 2007.
- Österreich: 1000 kg Quecksilber gesammelt; Fieberthermometer-Sammelaktion beendet. 25. Oktober 2007 im Blog Quecksilber? Nein Danke! der Zero Mercury Campaign des Europäischen Umweltbüros (EEB), umgesetzt (2007–2009) vom Deutschen Naturschutzring (DNR).
- Government bans all use of mercury in Sweden (Memento vom 23. September 2012 im Internet Archive)
- Bans mercury in products – regjeringen.no. The Ministry of the Environment, abgerufen am 15. April 2011.
- UN’s Mercury Conference in Stockholm – preparation for a global agreement on Mercury — Nordic cooperation (Memento vom 14. Mai 2011 im Internet Archive) 7.–11. Juni 2010.
- Gemeinschaftsstrategie für Quecksilber. Zusammenfassung der Gesetzgebung. In: EUR-Lex. Amt für Veröffentlichungen der Europäischen Union, abgerufen am 20. Oktober 2021. Mitteilung der Kommission vom 28. Januar 2005.
- Entsorgung von Altbatterien. Zusammenfassung der Gesetzgebung. In: EUR-Lex. Amt für Veröffentlichungen der Europäischen Union, abgerufen am 20. Oktober 2021.
- Richtlinie 2006/66/EG des Europäischen Parlaments und des Rates vom 6. September 2006 über Batterien und Akkumulatoren sowie Altbatterien und Altakkumulatoren und zur Aufhebung der Richtlinie 91/157/EWG
- Infozentrum UmweltWirtschaft: EG-Verordnung über das Verbot der Ausfuhr von Quecksilber, bestimmten -verbindungen und -gemischen sowie die sichere Lagerung von Quecksilber., auf Website Bayerisches Landesamt für Umwelt, Informationszentrum UmweltWirtschaft, abgerufen am 21. Januar 2013.
- Verordnung (EG) Nr. 1102/2008 des Europäischen Parlaments und des Rates vom 22. Oktober 2008 über das Verbot der Ausfuhr von metallischem Quecksilber und bestimmten Quecksilberverbindungen und -gemischen und die sichere Lagerung von metallischem Quecksilber. In: Amtsblatt der Europäischen Union. L 304, 14. November 2008, S. 75–79.
- uni-karlsruhe.de: Selen und Quecksilber – Von der Lagerstätte zur Verwendung. (Memento vom 12. Oktober 2013 im Internet Archive) (PDF; 458 kB), Geochemie-Seminararbeit von Astrid Rafoth, 2003/04.
- D. S. Kim, K. Choi: Global trends in mercury management. In: J Prev Med Public Health. 45(6), Nov 2012, S. 364–373. PMID 23230466.
- Internationale Einigung auf Quecksilberreduktion. auf: orf.at, 19. Januar 2013.
- Tore Syversen, Parvinder Kaur: Die Toxikologie des Quecksilbers und seiner Verbindungen. In: Perspectives in Medicine. Band 2, Nr. 1, 2014, ISSN 2211-968X, S. 133–150, doi:10.1016/j.permed.2013.09.006 (sciencedirect.com).
- P. Craig, R. Jeniks, G. Stojak; The Analysis of Inorganic and MEthyl Mercury by Derivatisation Methods, Opportunities and Difficulties. In: Chemosphere. 39, 1999, S. 1181–1197.
- E. Flores, B. Welz, A. Curtius: Determination of mercury in mineral coal using cold vapor generation directly from slurries, trapping in a graphite tube, and electrothermal atomization. In: Spectrochimica Acta. 56, 2001, S. 1605–1614.
- W. Clevenger, B. Smith, J. Winefordner: Trace Determination of Mercury: A Review. In: Critical Reviews in Analytical Chemistry. 27, 1997, S. 1–26.
- Qu. Tu, J. Qian, W. Frech: Rapid determination of methylmercury in biological materials by GCMIP-AES or GC-ICP-MS following simultaneous ultrasonic-assisted in situ ethylation and solvent extraction. In: Journal of Analytical Atomic Spectrometry. 15, 2000, S. 1583–1588.
- R. Lobinski, Z. Marczenko; Spectrochemical Trace Analysis for Metals and Metalliods. Elsevier 1997, ISBN 0-444-82879-6.
- Z. Chen, N. Zhang, L. Zhuo, B. Tang; Catalytic kinetic methods for photometric or fluorometric determination of heavy metal ions. In: Microchim Acta. 164, 2009, S. 311–336.
- P. Salaun, C. van der Berg: Voltammetric Detection of Mercury and Copper in Seawater Using a Gold Microwire Electrode. In: Analytical Chemistry. 78, 2006, S. 5052–5060.
- R. Neeb: Inverse Polarographie und Voltammetrie. Akademie-Verlag, Berlin 1969, S. 193–195.
- Global Mercury Assessment 2013: Sources, Emissions, Releases and Environmental Transport. (PDF; 8,92 MB) United Nations Environment Programme, 10. September 2013, abgerufen am 7. März 2020 (englisch).
- Emissionsentwicklung 1990–2013 für Schwermetalle, Umweltbundesamt, Dessau-Roßlau, 2015 (Excel 180 kB).
- United Nations Environment Programme (Hrsg.): Global Mercury Assessment 2018. 24. Februar 2019, S. 8 (GMA 2018 [PDF; 16,6 MB; abgerufen am 8. März 2020]).
- David G. Streets, Hannah M. Horowitz, Daniel J. Jacob, Zifeng Lu, Leonard Levin, Arnout F. H. ter Schure, Elsie M. Sunderland: Total Mercury Released to the Environment by Human Activities. In: Environmental Science & Technology. 51, 2017, S. 5969–5977, doi:10.1021/acs.est.7b00451.
- Nina Weber: Illegale Schürfer: Teures Gold zerstört den Regenwald. In: Spiegel online. 20. April 2011.
- Filipino Gold Miner’s Borax Revolution (Memento vom 13. Oktober 2016 im Internet Archive). Website des Blacksmith Institute, März/April 2012.
- G. Qu. Chen u. a.: An overview of mercury emissions by global fuel combustion: The impact of international trade. In: Renewable and Sustainable Energy Reviews. Band 65, 2016, S. 345–355, doi:10.1016/j.rser.2016.06.049.
- David G. Streets, Qiang Zhang, Ye Wu: Projections of Global Mercury Emissions in 2050. In: Environmental Science & Technology. 43 (8), 2009, S. 2983–2988; doi:10.1021/es802474j.
- European Union emission inventory report 1990–2013 under the UNECE Convention on Long-range Transboundary Air Pollution (LRTAP) – Technical report No 8/2015. European Environment Agency (EEA), Kopenhagen, 2. Juli 2015.
- Quecksilber-Emissionen aus Kohlekraftwerken – Auswertung der EU-Schadstoffregistermeldungen nach einer Idee der BZL GmbH (PDF 1.438 kB) Christian Tebert, Ökopol – Institut für Ökologie und Politik, Hamburg, 2015.
- Rolf Beckers, Joachim Heidemeier, Falk Hilliges (Umweltbundesamt): Kohlekraftwerke im Fokus der Quecksilberstrategie (PDF; 763 kB). Umweltbundesamt, Dessau-Roßlau, 2012.
- Ralph Ahrens: USA will Quecksilber-Emissionen drastisch senken. auf: ingenieur.de, VDI nachrichten, 24. Februar 2012.
- Harald Schönberger, Christian Tebert, Uwe Lahl: Expertenanhörung im Umweltausschuss (PDF 1 MB) ReSource, Rhombos Verlag, Berlin, 04/2012.
- Textarchiv des Bundestages zur Anhörung am 15. Oktober 2012
- BVT-Schlussfolgerungen ('BAT Conclusions'), Technische Arbeitsgruppe zur Überarbeitung des Merkblatts über beste verfügbare Techniken für Großfeuerungsanlagen, Gemeinsame Forschungsstelle, Europäische Kommission, Sevilla, 21. Oktober 2015.
- Christian Tebert et al.: Quecksilber-Minderungsstrategie für Nordrhein-Westfalen (Memento vom 13. März 2017 im Internet Archive) (PDF 6,24 MB) Gutachten im Auftrag des Landes Nordrhein-Westfalen, Ökopol – Institut für Ökologie und Politik / Öko-Institut / Rechtsanwalt Kremer, Hamburg/Berlin, April 2016.
- Ralph Ahrens: Weniger Quecksilberemission aus Kohlekraftwerken mit mehr Technik. auf: ingenieur.de, VDI nachrichten, 24. Oktober 2014.
- Jahresmittelwert 2014: < 0,001 mg/m³ Unterrichtung der Öffentlichkeit gemäß § 23 der 17. BImSchV über den Betrieb des Kohlekraftwerkes in Wilhelmshaven mit Klärschlamm-Mitverbrennung. (Memento vom 9. Januar 2016 im Internet Archive) E.ON Kraftwerke GmbH, Hannover, 31. Juli 2015.
- Jahresmittelwert: 1,2 µg/m³, Bernd Kröger: Gersteinwerk stößt weniger Quecksilber aus als andere. wa.de, Westfälischer Anzeiger, 8. Januar 2016.
- Jahresmittelwert 2014: 0,6 µg/m³, Alexander Schäfer: Kraftwerk Westfalen liegt weit unter Grenzwert. wa.de, Westfälischer Anzeiger, 5. Januar 2016.
- Jahresmittelwert 2012: 0,9 µg/m³, Christian Tebert: Quecksilber-Emissionen aus Kohlekraftwerken in Deutschland und den USA vor dem Hintergrund der BVT-Diskussion und gesetzlicher Anforderungen (Vortrag) VDI-Fachkonferenz Messung und Minderung von Quecksilberemissionen, Düsseldorf, 15. April 2015.
- Luminant Oak Grove Power Station PROMECON Prozess- und Messtechnik Conrads GmbH, Barleben. Abgerufen am 8. Januar 2016.
- Luminant’s Oak Grove Power Plant earns Powers Highest Honor. In: POWER Magazine. Electric Power, 8. Januar 2010.
- PRTR – Europäisches Emissionsregister.
- Emissionsentwicklung 1990–2014, klassische Luftschadstoffe, Schwermetalle Nationale Trendtabellen für die deutsche Berichterstattung atmosphärischer Emissionen seit 1990, Umweltbundesamt (Excel-Tabelle), Stand: 3. Februar 2015.
- Telefonische Auskunft des Betriebsleiters der Müllverbrennungsanlage Hagen, 23. April 2014.
- PRTR – Europäisches Emissionsregister.
- E. Suess, M. Berg, S. Bouchet, L. Cayo, S.J. Hug, R. Kaegi, A. Voegelin, L.H.E. Winkel, E.Tessier, D. Amouroux, A.M. Buser: Mercury loads and fluxes from wastewater: A nationwide survey in Switzerland. In: Water Research. Band 175, 15. Mai 2020, S. 115708, doi:10.1016/j.watres.2020.115708.
- Kläranlagen halten 96 Prozent des Quecksilbers zurück. Eawag, 6. Januar 2021, abgerufen am 14. Januar 2021.
- Bans mercury in products. auf: regjeringen.no
- Chapter XXVII, Environment, 17. Minamata Convention on Mercury bei treaties.un.org, Status per 17. Januar 2018.
- Top Ten Threats 2013.pdf des Blacksmith Institutes.
- Scientific Opinion on the risk for public health related to the presence of mercury and methylmercury in food. In: EFSA Journal. Band 10, Nr. 12, 2012, S. 31 ff., doi:10.2903/j.efsa.2012.2985.
- Nahrungsergänzung: Gift in Ayurveda-Produkten entdeckt. (Memento vom 30. September 2007 im Internet Archive) In: Ökotest. 1. März 2007.
- Ayurveda-Medizin: Zwei deutsche Ehepaare auf Sri Lanka vergiftet. In: Spiegel online. 26. September 2015.


