Elektrodenpotential
Das Elektrodenpotential (Symbol: E) wird durch die Quellenspannung, die eine Elektrode einer elektrochemischen Zelle liefert, definiert. Zwecks Bemessung wird diese Elektrode in eine Prüfzelle neben eine Referenzelektrode, die definitionsgemäß auf Nullpotential ist, gestellt. In der allgemeinen Praxis ist diese Referenzelektrode die Standardwasserstoffelektrode. Das Elektrodenpotential der zu messenden Elektrode ist gleich ihrer stromlos gegen die Referenzelektrode gemessenen Spannung.
Ferner gibt das Elektrodenpotential an, welche elektrische Spannung eine Elektrode in einem Elektrolyt liefern kann oder welche Spannung benötigt wird, um – beispielsweise bei einer Elektrolyse – einen bestimmten Zustand stabil zu erhalten. Es ist damit die vielleicht wichtigste Größe zur Beschreibung des Zustandes einer Elektrode und ein zentraler Begriff der Elektrochemie. Elektrodenpotentiale erlauben die Berechnung der elektrischen Spannung, die Batterien oder Akkumulatoren liefern können oder die für eine Elektrolyse benötigt wird.
Grundlagen
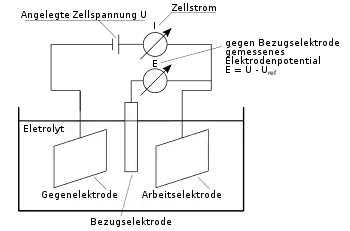
Die Messung einer elektrischen Spannung erfolgt immer zwischen zwei Punkten, beispielsweise zwischen zwei Elektroden. Die Spannung zwischen zwei Polen ist definiert als die elektrostatische Energie, die man benötigt, um ein Coulomb Ladung von einem Pol zum andern zu bewegen. Diese Energie kann man direkt messen, wenn man Ladungen im Vakuum, innerhalb eines Metalls oder zwischen zwei Metallpolen bewegt. Wenn man aber eine Ladung, beispielsweise ein Elektron, aus einer Metallelektrode in eine Elektrolytlösung bringt, so ist die dafür benötigte Energie nicht nur durch elektrostatische, sondern auch durch chemische Wechselwirkungen des Elektrons mit dem Metall oder mit den Lösungsbestandteilen bestimmt. Deswegen kann man zwischen einer Elektrode und dem Elektrolyten keine Spannung messen, man benötigt immer zwei Elektroden zur Spannungsmessung.
Das Elektrodenpotential E ist nun die Spannung der Elektrode, die gegenüber einer Bezugselektrode gemessen wird. Bezugselektroden sind Elektroden mit bekanntem Potential, das heißt mit bekanntem elektrochemischen Zustand. Die zwischen zwei beliebigen Elektroden möglichen Spannungen können dann anhand der Elektrodenpotentiale berechnet werden: Die Spannung U ist gleich der Potentialdifferenz ΔE aus den Potentialen E1 und E2 der Elektroden 1 und 2:
- .
Um den Begriff Potential anschaulich zu machen, wird bisweilen der Begriff „Elektronendruck“ verwendet. Eine Elektrode mit einer großen negativen Ladung im Metall hat ein negatives Potential und einen großen „Elektronendruck“. Sie hat das Bestreben, diese Elektronen abzugeben, sie kann also reduzierend auf die Umgebung wirken. Verbindungen, die ihre Elektronen leicht abgeben, also leicht oxidiert werden, können eine Elektrode negativ aufladen, also ein negatives Potential erzeugen. Anhand des Potentials kann man also angeben, welche Vorgänge an einer Elektrode ablaufen können. Das Potential muss hierbei jedoch in seiner Negativität immer im Vergleich zur korrespondierenden Elektrode gesehen werden.
Wenn in einer galvanischen Halbzelle zwei Oxidationsstufen eines chemischen Elements oder einer Verbindung miteinander im Gleichgewicht stehen, ist das Potential der Zelle festgelegt: Im Gleichgewicht werden über die Metallelektrode Elektronen zwischen den unterschiedlich elektrisch geladenen Formen ausgetauscht. Die Lage des Gleichgewichts und damit das Elektrodenpotential hängen von den Konzentrationsverhältnissen sowie der Temperatur ab. Diese Abhängigkeit wird mit der Nernst-Gleichung berechnet.
Bestimmung
Das Elektrodenpotential wird durch eine einfache Spannungsmessung bestimmt. Der Wert wird in Volt (V) angegeben. Da das Potential einer Elektrode immer gegen eine Bezugselektrode gemessen wird, muss angegeben werden, welche Bezugselektrode verwendet wurde, es sei denn, es wurde die Normalwasserstoffelektrode verwendet: Diese ist der wichtigste Bezugspunkt, und in der Regel beziehen sich Elektrodenpotentiale auf diese Elektrode.
Eine Liste von Elektrodenpotentialen findet man unter Elektrochemische Spannungsreihe. Die dort angegebenen Potentiale beziehen sich auf Aktivitäten von 1 mol/l, also auf etwa einmolare Lösungen.
In der Lösung vor der Referenzelektrode tritt ein ohmscher Spannungsabfall auf, wenn ein Strom fließt. Daher muss für genaue Potentialmessungen entweder komplett stromlos oder zumindest möglichst hochohmig gemessen werden, oder es wird eine Dreielektrodenanordnung benutzt, bei der die Potentialdifferenz zur Referenzelektrode stromlos gemessen wird, auch wenn ein Strom zur Arbeitselektrode fließt. Die stromlos gemessene Klemmenspannung einer galvanischen Zelle heißt Leerlaufspannung (historisch: Elektromotorische Kraft).
Normalpotential
Wird das Elektrodenpotential einer Standardelektrode mit der Normal-Wasserstoffelektrode als Referenz bestimmt, spricht man vom Normalpotential. Die Normal-Wasserstoffelektrode selbst besitzt folglich ein Normalpotential von E0 = 0 Volt.
Das Vorzeichen für das Normalpotential bezieht sich immer auf den Reduktionsprozess an einer Elektrode. Man spricht deshalb oft auch vom Reduktionspotential. Je größer (positiver) das Elektrodenpotential (beziehungsweise Normalpotential) einer Halbzelle ist, desto stärker ist die Oxidationskraft der oxidierten Form.
Das Normalpotential ist eine Kenngröße eines chemischen Elements im Periodensystem. Das Element mit der höchsten Normalpotential-Differenz ist Lithium mit −3,04 Volt, was seine gute Eignung als Speicher elektrischer Energie in Lithium-Ionen-Akkus erklärt.[1]
Beispiel
Die Halbzelle besitzt einen -Wert von +2,85 V. Das bedeutet, schaltet man diese Zelle gegen eine Normal-Wasserstoffelektrode, so stellt man eine elektrische Spannung von 2,85 V fest. Bei Stromfluss fließen die Elektronen durch den elektrischen Leiter von der Halbzelle zur Halbzelle . An den Elektroden laufen dann folgende Reaktionen ab:
und
Fluor ist das stärkste elementare Oxidationsmittel, es lassen sich durch chemische Prozesse mit Elementen also keine größeren Elektrodenpotentiale gegen die Normal-Wasserstoffelektrode erreichen.
Absolutes Elektrodenpotential
Elektrodenpotentiale können nur als Spannung gemessen werden, wofür man eine zweite Elektrode benötigt. Daher ist das Potential einer einzelnen Elektrode nicht direkt messbar, sondern muss immer in Bezug auf eine Referenz angegeben werden. Ein theoretischer Bezugspunkt für eine Potentialangabe ist – für eine Elektrode wie für Ladungen in der Elektrostatik – dagegen ein Elektron in unendlicher Entfernung. Elektrodenpotentiale, die relativ zu einem solchen System ohne Metall-Elektrolyt-Phasengrenze angegeben werden, nennt man absolute Elektrodenpotentiale. Sie lassen sich zwar nicht direkt messen, können aber anhand von Messwerten berechnet werden. Für die Normalwasserstoffelektrode wird ein absolutes Elektrodenpotential von 4,44 V angegeben, nach anderen Messungen aber auch ein Wert von 4,7 V. Die Unsicherheit in der Angabe des absoluten Elektrodenpotentials ist also viel größer als die typische Messgenauigkeit bei einer Potentialmessung gegen eine Referenzelektrode. Die Umrechnung eines gegen eine Referenzelektrode gemessenen Potentials in ein absolutes Elektrodenpotential ist daher nicht sinnvoll.
Siehe auch
Literatur
- Eintrag zu absolute electrode potential. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00022 – Version: 2.3.1.
- Eintrag zu standard hydrogen electrode. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.S05917 – Version: 2.3.1.
- Sergio Trasatti: The „absolute“ electrode potential: an explanatory note. In: Pure and Applied chemistry. Bd. 58, Nr. 7, 1986, ISSN 0033-4545, S. 955–966, online (PDF; 381 kB).
Einzelnachweise
- BMBF batterieforum-deutschland.de: Lithium-Ionen-Batterien, abgerufen 22. Februar 2020