Natriumthiosulfat
Natriumthiosulfat ist das stabile Natriumsalz der in freiem Zustand instabilen Thioschwefelsäure.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
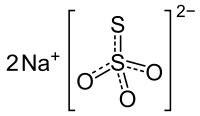 | ||||||||||
| Allgemeines | ||||||||||
| Name | Natriumthiosulfat | |||||||||
| Andere Namen |
Natriumhyposulfit (veraltet) | |||||||||
| Summenformel | Na2S2O3 | |||||||||
| Kurzbeschreibung |
farb- und geruchlose, salzig-bitter schmeckende Kristalle[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code |
V03AB06 | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | ||||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
Zersetzung ab 300 °C[4] | |||||||||
| Löslichkeit |
gut in Wasser (701 g·l−1 bei 20 °C)[4] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Natriumthiosulfat wird durch Erhitzen von fein verteiltem Schwefel in einer Natriumsulfitlösung unter Druck hergestellt[2]:
Alternativ kann das Natriumsulfit auch mit Natriumdisulfid umgesetzt werden.[2]
Eigenschaften

Natriumthiosulfat bildet unter Normalbedingungen mit 5 Äquivalenten Kristallwasser farblose Kristalle, welche gut wasserlöslich sind. Beim Lösungsvorgang kühlt sich die Flüssigkeit stark ab, da die Hydratationsenthalpie kleiner ist als die Gitterenergie und die fehlende Wärmemenge dem System entzogen wird. Das Pentahydrat Na2S2O3·5H2O ist auch unter dem Namen Fixiersalz bekannt, da es bei der Filmentwicklung zur Fixierung dient. Unter dem Namen Antichlor wird es nach dem Bleichen von Papier- und Textilfasern verwendet, um überschüssiges Chlor zu entfernen.
Die Pentahydrat-Kristalle haben einen Schmelzpunkt von 48,5 °C, die Schmelze kann unterkühlt werden und gibt beim Erstarren eine große Menge von Kristallisationswärme ab.
Wasserfreies Natriumthiosulfat tritt in vier polymorphen Kristallformen auf.[3] Die bei Raumtemperatur stabile α–Form kristalliert in einem monoklinen Kristallgitter. Bei 330 °C wandelt sie sich in die trikline β–Form um. Diese bildet beim weiteren Erhitzen bei 388 °C eine kubische γ–Form. Alle Phasenübergänge sind reversibel und die Formen stehen enantiotrop zueinander. Eine metastabile orthorhombische α'–Form kann durch die Dehydratation des Pentahydrats oder Abkühlung der β–Form erhalten werden. Diese wandelt sich um 155 °C exotherm in die α–Form um und steht somit monotrop zu dieser. Die γ–Form zersetzt sich ab 444 °C in einer exothermen Reaktion zu Natriumsulfat und Natriumpentasulfid.[3]
Wird zur wässrigen Natriumthiosulfat-Lösung Säure hinzugefügt, so scheidet sich nach kurzer Zeit Schwefel in Form einer gelblichen Trübung aus. Die freigesetzte, instabile Thioschwefelsäure (H2S2O3) zerfällt nämlich rasch zu Schwefel und Schwefeldioxid:
Die wasserunlöslichen Silberhalogenide (AgCl, AgBr) werden durch eine Fixiersalzlösung aufgelöst. Durch die Bildung des wasserlöslichen Natriumdithiosulfatoargentat(I)-Komplexes wird der entwickelte Film lichtunempfindlich:
Natriumthiosulfat ist ein Reduktionsmittel und reagiert daher leicht mit dem Oxidationsmittel Kaliumpermanganat.
Verwendung
Natriumthiosulfat kann in der Analogfotografie als Fixiersalz dienen, im Bergbau zur Extraktion von Silberchlorid aus Silbererzen und in der Galvanotechnik zur Herstellung von Gold- und Silberbädern. In der Medizin wird es als Gegenmittel bei Cyanidvergiftungen verwendet, dabei wird weniger gefährliches Thiocyanat gebildet.
Natriumthiosulfat dient als Antichlor zum Beenden von Bleich- oder Desinfektionsprozessen mit Chlor. Dabei wird das Chlor zu Chlorid (bzw. Salzsäure) reduziert, und es entsteht Hydrogensulfat:[5]
In der Chemie wird es zur Bestimmung der Iodzahl verwendet, in der Iodometrie wird Thiosulfat zu Tetrathionat oxidiert:[5][6]
- .
Weitere Verwendung findet es als Pentahydrat in sogenannten Wärmekissen. Durch das Biegen eines Metallplättchens entsteht ein Kristallisationskeim, der die exotherme Kristallisation auslöst. Die Regeneration des Kissens erfolgt durch Erwärmen in kochendem Wasser, wobei die Kristalle wieder geschmolzen (gelöst) werden.
Im Rahmen von Studien erfolgt die Anwendung von Thiosulfat zur Verhinderung von Hörverlusten, die im Rahmen einer cisplatinhaltigen Chemotherapie speziell bei Kindern auftreten können.[7]
Einzelnachweise
- Eintrag zu SODIUM THIOSULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Natriumthiosulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. März 2021.
- Heike von Benda, Klaus von Benda: Zur Polymorphie des Na2S2O3 in Z. Naturforsch. 34B (1979) 957–968, pdf.
- Eintrag zu Natriumthiosulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Dezember 2019. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 594.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 670 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- Penelope R. Brock, Rudolf Maibach, Margaret Childs, Kaukab Rajput, Derek Roebuck: Sodium Thiosulfate for Protection from Cisplatin-Induced Hearing Loss. In: New England Journal of Medicine. Band 378, Nr. 25, 21. Juni 2018, S. 2376–2385, doi:10.1056/nejmoa1801109.