Cer
Cer (IPA: [t͡seːɐ̯][12][13], ; auch Zer bzw. Cerium genannt) ist ein chemisches Element mit dem Elementsymbol Ce und der Ordnungszahl 58. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der Seltenen Erden.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Cer, Ce, 58 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Lanthanoide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | La, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-154-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.322 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 43 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 140,116(1)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | 185 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 204 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f1 5d1 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 5.5386(4) eV[4] ≈ 534.39 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 10.956(20) eV[4] ≈ 1057.09 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 20.1974(25) eV[4] ≈ 1948.75 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 36.906(9) eV[4] ≈ 3560.9 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 65.55(25) eV[4] ≈ 6320 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 6,773 g/cm3 (25 °C)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 2,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 1,4 · 10−3)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1068 K (795 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3743 K[9] (3470 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 20,69 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 398 kJ/mol[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 5,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 2100 m·s−1 bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1,35 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 11 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 3, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,34 V (Ce3+ + 3 e− → Ce) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,12 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte

Cer wurde 1803 von Jöns Jakob Berzelius und Wilhelm von Hisinger und gleichzeitig von Martin Heinrich Klaproth entdeckt. Es wurde nach dem Zwergplaneten Ceres benannt. Die Herstellung des Elements gelang Carl Gustav Mosander 1825 durch Reduktion des Chlorids mit Natrium.
Vorkommen
In der Natur kommt Cer vergesellschaftet mit anderen Lanthanoiden in sogenannten Ceriterden vor, wie zum Beispiel im Allanit (Ca, Ce, La, Y)2(Al, Fe)3(SiO4)3(OH), im Monazit (Ce, La, Th, Nd, Y)PO4 sowie im Bastnäsit (Ce, La, Y)CO3F. Cer ist das häufigste Element der Lanthanoide und steht in der Elementhäufigkeit auf Platz 28. In der Erdkruste, bis in eine Tiefe von 16 km gerechnet, ist es mit 68 g/t vertreten und kommt damit häufiger als Zinn oder Blei vor. Wichtige Lagerstätten befinden sich in Skandinavien, USA, Kongo, Südafrika und Indien. Die weltweit bekannten Cer-Reserven werden auf 40 Mio. Tonnen geschätzt. Cer gehört zu den sogenannten leichten Seltenen Erden, die 2014 von der BGR als unkritisch bezüglich der Versorgungslage eingeschätzt wurden.[14] Elementares („gediegenes“) Cer kommt auf der Erde wegen seiner hohen Reaktivität nicht vor. Es wurde jedoch in mikroskopischen Partikeln in Mondgestein gefunden. Wahrscheinlich entsteht es auf dem Mond durch Impaktereignisse.[15]
Gewinnung und Herstellung
Nach einer aufwendigen Abtrennung der Cer-Begleiter wird das Oxid mit Fluorwasserstoff zum Cerfluorid umgesetzt. Anschließend wird es mit Calcium unter Bildung von Calciumfluorid zum Cer reduziert. Die Abtrennung verbleibender Calciumreste und Verunreinigungen erfolgt in einer zusätzlichen Umschmelzung im Vakuum. Die jährliche Weltproduktion liegt bei ca. 24.000 t.[16]
Eigenschaften
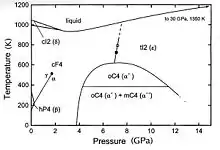
Physikalische Eigenschaften
Von Cer sind vier Modifikationen bekannt:[17]
Das silbrigweiß glänzende Metall ist hinter Europium das zweitreaktivste Element der Lanthanoide. Oberhalb von 150 °C verbrennt es unter heftigem Glühen zum Cerdioxid. Mit Wasser reagiert es zum Cer(III)-hydroxid.
Chemische Eigenschaften
Cer kommt in Verbindungen als dreiwertiges farbloses oder vierwertiges gelbes bis orangefarbiges Kation vor.
Unter Wärmeeinfluss wird es durch Ethanol und Wasser sehr stark angegriffen. Auch in Laugen wird es unter Bildung von Cer-Hydroxiden stark angegriffen. In Säuren wird es zu Salzen gelöst.
Verwendung
Da sich die chemischen Eigenschaften der Seltenen Erden ähneln, wird metallisches Cer selten in Reinform eingesetzt, sondern in der Mischung, in der es bei der Herstellung aus den Seltenerd-Mineralien anfällt, dem sogenannten Mischmetall.
- In der Metallurgie dient Mischmetall als Zusatz für Aluminiumlegierungen und hochtemperaturbeständige Eisenbasislegierungen. Es unterstützt im Schmelzprozess die Abtrennung von Schwefel und Sauerstoff.
- Die Eisen-Mischmetall-Legierung Cereisen dient als Ausgangsstoff für Zündsteine für die Verwendung in Feuerzeugen und zur Erzeugung von Funkenregen auf Achterbahnen und in Filmszenen (Unfallszenen).
Geringe Beimengungen von (mehr oder weniger reinen) Cer-Verbindungen verleihen anderen Materialien bestimmte Eigenschaften:
- Cerdioxid (CeO2) wird zur Stabilisierung des keramischen Katalysatorträgers aus Aluminiumoxid für Autoabgaskatalysatoren verwendet
- Bestandteil einiger Spezialgläser, zum Beispiel UV-Filter und Windschutzscheiben, und Enttrübungsmittel in der Glasherstellung
- Zur Färbung von Emaille
- Cerdioxid findet Verwendung als Poliermittel in der Glasbearbeitung
- Cer-dotierte Fluoreszenz-Farbstoffe (Leuchtstoffe) in Bildröhren und weißen Leuchtdioden
- als Dotierung in Glühstrümpfen
- Selbstreinigende Backöfen enthalten eine cerhaltige Beschichtung
- Cer(IV)-sulfat als Oxidationsmittel in der Quantitativen Analyse (Cerimetrie)
- als Kontrastmittel bei Kernspinresonanz
- als Leuchtstoff in Gasentladungsröhren
- zur Regeneration von Rußpartikelfiltern im Kraftstoff gelöst beigemischt
- Es wird als Oxidkathode testweise als CerHexaBorid angeboten[18]
- als Teil von nichtedelmetallhaltigen Aufbrennlegierungen in der Zahntechnik (Keramik)
- als Oxidationsmittel für organische Synthesen mit Ceriumammoniumnitrat, (NH4)2Ce(NO3)6
- als Katalysator-Komponente zur Spaltung von CO2. Ein Forscherteam um Dr. Dorna Esrafilzadeh der RMIT-Universität in Melbourne verwendet Cer als eine Komponente in einem Flüssigmetall-Katalysator, um das Treibhausgas CO2 bei Raumtemperatur in Kohlenstoff und Sauerstoff zu spalten. Die katalytisch eingesetzte Flüssigmetall-Legierung aus Gallium, Indium, Zinn und Cer dient dabei als Stromleiter und Elektrolyt. In dem chemischen Prozess wird das dreiwertige Kation (Cer3+) zum metallischen Cer reduziert.[19][20][21]
Biologische Bedeutung
2013 wurde erstmals ein Enzym in Bakterien entdeckt, das Cer-Ionen für seine Funktion benötigt. Die Bakterien der Art Methylacidiphilum fumariolicum wurden aus vulkanischen Schlammtümpeln in Italien isoliert. Sie benötigen Cer zum Aufbau der Methanol-Dehydrogenase, einem Enzym im Methan-Stoffwechsel. Das Ion hat dabei die Rolle, die in ähnlichen Enzymen in anderen Bakterien von Calciumionen übernommen wird.[22]
Sicherheitshinweise
Cer ist, wie alle Lanthanoide, leicht giftig. Metallisches Cer kann sich schon ab 65 °C entzünden. Als fein verteiltes Metall kann es sich an der Luft ohne Energiezufuhr erhitzen und schließlich entzünden. Die Zündbereitschaft hängt u. a. sehr stark von der Korngröße und dem Verteilungsgrad ab. Cerbrände dürfen nicht mit Wasser gelöscht werden, da sich gasförmiger Wasserstoff entwickelt.
Verbindungen
Oxide
- Cer(III)-oxid Ce2O3, goldglänzender keramischer Feststoff
- Cer(IV)-oxid CeO2
- Cer(III,IV)-oxid Ce3O5, blauer keramischer Feststoff
Halogenide
- Cer(III)-fluorid CeF3
- Cer(IV)-fluorid CeF4
- Cer(III)-chlorid CeCl3 · 7 H2O, weiße stark hygroskopische Substanz
- Cer(III)-bromid CeBr3
- Cer(III)-iodid CeI3
Sonstige Verbindungen
- Cer(III)-sulfat Ce2(SO4)3 · 8 H2O, farblose Substanz
- Cer(IV)-sulfat Ce(SO4)2, gelbe Substanz
- Cer(III)-nitrat Ce(NO3)3 · 6 H2O
- Cer(III)-oxalat Ce2(C2O4)3 · 10 H2O
- Ammoniumcer(IV)-nitrat (CAN) (NH4)2Ce(NO3)6, orangerot
- Ammoniumcer(IV)-sulfat (NH4)4Ce(SO4)4· H2O
- Cer(IV)-perchlorat Ce(ClO4)4
- Cerwolframat Ce2(WO4)3
 Cer(III)-chlorid
Cer(III)-chlorid-sulfat-2.JPG.webp) Cer(IV)-sulfat
Cer(IV)-sulfat Ammoniumcer(IV)-nitrat
Ammoniumcer(IV)-nitrat
Weblinks
- Eintrag zu Cer. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind (soweit nicht anders angegeben) aus www.webelements.com (Cer) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu cerium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu cerium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind (soweit nicht anders angegeben) aus www.webelements.com (Cer) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1579.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind (soweit nicht anders angegeben) aus www.webelements.com (Cer) entnommen.
- Eintrag zu Cer, Späne in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. April 2018. (JavaScript erforderlich)
- Dr. Stefan Kleiner, Dr. Ralf Knöbl, Prof. Dr. Max Mangold (†) et al. in Zusammenarbeit mit der Dudenredaktion: Duden Aussprachewörterbuch. 7. Auflage. Band 6. Dudenverlag, Berlin 2015, ISBN 978-3-411-04067-4, S. 268.
- angepasst von: Eva-Maria Krech, Eberhard Stock, Ursula Hirschfeld, Lutz Christian Anders et al.: Deutsches Aussprachewörterbuch. 1. Auflage. Walter de Gruyter, Berlin, New York 2009, ISBN 978-3-11-018202-6, S. 406.
- Bundesanstalt für Geowissenschaften und Rohstoffe: Aktuelle BGR-Recherche: Anteil Chinas an weltweiter Seltene Erden-Produktion sinkt nur langsam. 12. März 2014.
- https://rruff.info/uploads/DES382_83.pdf
- MMTA: Minor Metals in the Periodic Table: Ce.
- Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3, S. 145.
- LaB6-Keramik und -Kathoden (Lanthanhexaborid). Abgerufen am 1. November 2021.
- Arne Grävemeyer: CO2 wird zu Kohle bei Raumtemperatur; heise online, 8. März 2019 - https://www.heise.de/newsticker/meldung/CO2-wird-zu-Kohle-bei-Raumtemperatur-4329963.html
- Robert F.Service: New way to turn carbon dioxide into coal could ‘rewind the emissions clock’. In: Science, 27. Februar 2019 doi:10.1126/science.aax1527
- Esrafilzadeh et al.: Room temperature CO2 reduction to solid carbon species on liquid metals featuring atomically thin ceria interfaces. In: Nature Communications 10, 865 (2019)
- Arjan Pol, Thomas R.M. Barends u. a.: Rare earth metals are essential for methanotrophic life in volcanic mudpots. In: Environmental Microbiology. 2013, S. n/a–n/a, doi:10.1111/1462-2920.12249.
