Helium
Helium (altgriechisch ἥλιος hélios, deutsch ‚Sonne‘) ist ein chemisches Element und hat die Ordnungszahl 2. Sein Elementsymbol ist He. Im Periodensystem steht es in der 18. IUPAC-Gruppe, der früheren VIII. Hauptgruppe, und zählt damit zu den Edelgasen. Es ist ein farbloses, geruchloses, geschmacksneutrales und ungiftiges Gas.
| Eigenschaften | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Helium, He, 2 | ||||||||||||||||||||||||||||||
| Elementkategorie | Edelgase | ||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 18, 1, s | ||||||||||||||||||||||||||||||
| Aussehen | Farbloses Gas | ||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||
| EG-Nummer | 231-168-5 | ||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.334 | ||||||||||||||||||||||||||||||
| ATC-Code |
V03AN03 | ||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,004 ppm[1] | ||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||
| Atommasse | 4,002602(2)[3][4] u | ||||||||||||||||||||||||||||||
| Kovalenter Radius | 28 pm | ||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 140 pm | ||||||||||||||||||||||||||||||
| Elektronenkonfiguration | 1s2 | ||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 24.58738880(15) eV[5] ≈ 2372.32 kJ/mol[6] | ||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 54.4177650(3) eV[5] ≈ 5250.51 kJ/mol[6] | ||||||||||||||||||||||||||||||
| Physikalisch [7] | |||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig | ||||||||||||||||||||||||||||||
| Dichte | 0,1785 kg·m−3[8] | ||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch ( = −1,1 · 10−9)[9] | ||||||||||||||||||||||||||||||
| Schmelzpunkt | 0,95 K (−272,2 °C, bei 2,5 MPa) | ||||||||||||||||||||||||||||||
| Siedepunkt | 4,15 K[10] (−269 °C) | ||||||||||||||||||||||||||||||
| Molares Volumen | (fest) 21,00 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 0,0840 kJ/mol[10] | ||||||||||||||||||||||||||||||
| Schmelzenthalpie | 0,02 kJ·mol−1 | ||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 970 m·s−1 bei 273,15 K | ||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 5193 J·kg−1·K−1 | ||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,1513 W·m−1·K−1 | ||||||||||||||||||||||||||||||
| Chemisch [11] | |||||||||||||||||||||||||||||||
| Oxidationszustände | 0 | ||||||||||||||||||||||||||||||
| Elektronegativität | 5,50 (Allred&Rochow); 4,86 (Mulliken); 5,2 (Durchschnitt);[12] keine Angaben zur (Pauling-Skala) | ||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||
Helium bleibt bis zu sehr tiefen Temperaturen gasförmig, erst nahe dem absoluten Nullpunkt wird es flüssig. Es ist die einzige Substanz, die selbst am absoluten Nullpunkt (0 K bzw. −273,15 °C) unter Normaldruck nicht fest wird. Neben Neon ist Helium das einzige Element, für welches selbst unter Extrembedingungen bis jetzt keine Verbindungen nachgewiesen werden konnten, die nicht sofort nach der Bildung zerfallen sind. Helium kommt nur atomar vor. Das häufigste stabile Isotop ist 4He; ein weiteres stabiles Isotop ist das auf der Erde extrem seltene 3He.
Das Verhalten der beiden flüssigen Phasen Helium I und Helium II (rsp. Helium-I und Helium-II) (insbesondere das Phänomen der Suprafluidität) von 4He ist Gegenstand aktueller Forschungen auf dem Gebiet der Quantenmechanik. Flüssiges Helium ist ein unverzichtbares Hilfsmittel zur Erzielung tiefster Temperaturen. Diese sind unter anderem zur Kühlung von Infrarotdetektoren von Weltraumteleskopen und zur Untersuchung von Eigenschaften wie zum Beispiel der Supraleitung von Materie bei Temperaturen nahe dem absoluten Nullpunkt erforderlich.
Helium ist nach Wasserstoff das zweithäufigste Element im Universum und macht etwa ein Viertel der Gesamtmasse der Materie im Universum aus.[13] Nach anerkannter Theorie vereinigten sich rund zehn Sekunden nach dem Urknall Protonen und Neutronen durch Kernfusion zu ersten Atomkernen. Etwa 25 % von deren gesamter Masse sind 4He, 0,001 % Deuterium sowie Spuren von 3He. Somit ist der größte Teil des Heliums schon beim Urknall entstanden. Das später im Inneren von Sternen durch Fusion von Wasserstoff entstandene Helium fusionierte zum größten Teil weiter zu schwereren Elementen.
Auf der Erde wird 4He in Form von Alphateilchen bei dem Alphazerfall verschiedener radioaktiver Elemente wie Uran oder Radium gebildet. Helium entsteht daraus, wenn das Alphateilchen anderen Atomen zwei Elektronen entreißt. Der Großteil des auf der Erde vorhandenen Heliums ist daher nichtstellaren Ursprungs. Das so entstandene Helium sammelt sich in natürlichen Erdgasvorkommen in Konzentrationen bis zu 16 Volumenprozent.[14] Daher kann Helium durch fraktionierte Destillation aus Erdgas gewonnen werden.
Erste Hinweise auf Helium entdeckte 1868 der französische Astronom Jules Janssen bei Untersuchungen des Lichtspektrums der Chromosphäre der Sonne, wobei er die bis dahin unbekannte gelbe Spektrallinie von Helium fand.
Helium findet Anwendungen in der Tieftemperaturtechnik, besonders als Kühlmittel für supraleitende Magneten, in Tiefsee-Atemgeräten, bei der Altersbestimmung von Gesteinen, als Füllgas für Luftballons, als Traggas für Luftschiffe und als Schutzgas für verschiedene industrielle Anwendungen (zum Beispiel beim Metallschutzgasschweißen, als Trägergas bei der Kapillargaschromatographie und bei der Herstellung von Silizium-Wafern). Nach dem Einatmen von Helium verändert sich aufgrund der im Vergleich zu Luft höheren Schallgeschwindigkeit kurzzeitig die Stimme („Micky-Maus-Stimme“).
Geschichte

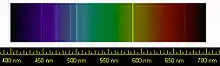
Hinweise auf das Element Helium erhielt man zum ersten Mal aufgrund einer hellen gelben Spektrallinie bei einer Wellenlänge von 587,49 Nanometern im Spektrum der Chromosphäre der Sonne. Diese Beobachtung machte der französische Astronom Jules Janssen in Indien während der totalen Sonnenfinsternis vom 18. August 1868. Als er seine Entdeckung bekannt machte, glaubte ihm zunächst niemand, da bislang noch nie ein neues Element im Weltall gefunden worden war, bevor der Nachweis auf der Erde geführt werden konnte. Am 20. Oktober desselben Jahres bestätigte der Engländer Norman Lockyer, dass die gelbe Linie tatsächlich im Sonnenspektrum vorhanden ist, und schloss daraus, dass sie von einem bislang unbekannten Element verursacht wird. Da diese Spektrallinie sehr nahe (1,8 nm von der Mitte) der Fraunhofer-Doppel-D-Linie (D2 = 589,00 nm, D1 = 589,60 nm) des Metalls Natrium lag, nannte er die Linie D3, um sie von diesen Linien D1 und D2 des Natriums zu unterscheiden. Er und sein englischer Kollege Edward Frankland schlugen vor, das neue Element Helium (von griechisch helios, Sonne) zu nennen.[13]
14 Jahre später, im Jahre 1882, gelang es Luigi Palmieri durch die Spektralanalyse von Vesuv-Lava erstmals, das Element Helium auch auf der Erde nachzuweisen.

Am 23. März 1895 gewann der britische Chemiker William Ramsay Helium, indem er das Uran-Mineral Cleveit, eine Varietät des Uraninits, mit Mineralsäuren versetzte und das dabei austretende Gas isolierte.[16] Er war auf der Suche nach Argon, konnte jedoch die gelbe D3-Linie beobachten, nachdem er Stickstoff und Sauerstoff von dem isolierten Gas getrennt hatte. Dieselbe Entdeckung machten fast gleichzeitig der britische Physiker William Crookes und die schwedischen Chemiker Per Teodor Cleve und Nicolas Langlet in Uppsala in Schweden. Diese sammelten ausreichende Mengen des Gases, um dessen Atommasse feststellen zu können.
Während einer Ölbohrung in Dexter in Kansas wurde eine Erdgasquelle gefunden, deren Erdgas 12 Volumenprozent eines unbekannten Gases enthielt. Die amerikanischen Chemiker Hamilton Cady und David McFarland der Universität von Kansas fanden 1905 heraus, dass es sich dabei um Helium handelte. Sie publizierten eine Meldung, dass Helium aus Erdgas gewonnen werden kann. Im selben Jahr stellten Ernest Rutherford und Thomas Royds fest, dass Alphateilchen Heliumkerne sind.
Die erste Verflüssigung von Helium wurde 1908 vom niederländischen Physiker Heike Kamerlingh Onnes durchgeführt, indem er das Gas auf eine Temperatur von unter 1 K kühlte. Festes Helium konnte er auch bei weiterem Abkühlen nicht erhalten, dies gelang erst 1926 Willem Hendrik Keesom, einem Schüler Kamerlingh Onnes’, durch Komprimieren des Heliums auf 25 bar bei analoger Temperatur. Kamerlingh Onnes beschrieb zuerst das Phänomen suprafluider Flüssigkeiten, das heute als Onnes-Effekt bekannt ist.
Im frühen 20. Jahrhundert wurden große Mengen Helium in Erdgasfeldern der amerikanischen Great Plains gefunden, und damit wurden die Vereinigten Staaten zum führenden Weltlieferanten für Helium. Nach einem Vorschlag von Sir Richard Threlfall förderte die US-Marine drei kleine experimentelle Heliumproduktionsbetriebe während des Ersten Weltkrieges, um Helium als Füllgas für Sperrballone zu gewinnen. Eine Gesamtmenge von 5.700 Kubikmeter Gas mit einem Heliumanteil von 92 % wurde von diesen Betrieben gewonnen. Dieses Helium wurde 1921 im ersten heliumgefüllten Luftschiff benutzt, dem C-7 der US-Navy.
Die Regierung der USA ließ 1925 die National Helium Reserve in Amarillo in Texas errichten, um eine Versorgung von militärischen Luftschiffen in Kriegszeiten und Verkehrsluftschiffen in Friedenszeiten zu sichern. Das Lager befindet sich in einer natürlichen Gesteinsformation 20 km nordwestlich von Amarillo. Obwohl die Nachfrage nach dem Zweiten Weltkrieg sank, wurde die Förderungsanlage in Amarillo erweitert, damit flüssiges Helium als Kühlmittel für Sauerstoff-Wasserstoff-Raketentreibstoff und andere zu kühlende Gegenstände bereitgestellt werden konnte. Der Heliumverbrauch der USA stieg im Jahr 1965 auf das Achtfache des Spitzenverbrauchs in Kriegszeiten.
Nachdem in den USA das Helium Acts Amendments of 1960 (Public Law 86-777) beschlossen worden war, wurden weitere fünf private Heliumförderanlagen errichtet. Das US-Minenministerium ließ dafür eine 685 Kilometer lange Pipeline von Bushton in Kansas nach Amarillo in Texas bauen; dieses Lager enthielt 1995 rund eine Milliarde Kubikmeter Helium und 2004 etwa das Zehnfache des Weltjahresbedarfs an Helium. Bis 2015 soll das Lager leer sein und aufgelöst werden (Helium Privatization Act).
Die Reinheit des gewonnenen Heliums stieg nach dem Zweiten Weltkrieg rasant an. Wurde 1945 noch eine Mischung von 98 % Helium und 2 % Stickstoff für Luftschiffe benutzt, konnte 1949 bereits Helium mit einer Reinheit von 99,995 % kommerziell vertrieben werden. Um diesen Reinheitsgrad zu erreichen, ist Aktivkohle nötig, um verbliebene Verunreinigungen – meistens bestehend aus Neon – mittels Druckwechsel-Adsorption zu entfernen.
Vorkommen
Weltall

Nach der Urknalltheorie entstand der größte Teil des heute im Weltraum vorhandenen Heliums in den ersten drei Minuten nach dem Urknall. Helium ist nach Wasserstoff das zweithäufigste Element. 23 % der Masse der sichtbaren Materie bestehen aus Helium, obwohl Wasserstoffatome achtmal so häufig sind. Außerdem wird Helium durch Kernfusion in Sternen produziert. Dieses sogenannte Wasserstoffbrennen liefert die Energie, die die Sterne auf der Hauptreihe, also die Mehrheit aller Sterne, zum Leuchten bringt. Dieser Prozess liefert den Sternen die Energie für den größten Teil ihres Lebens. Wenn der größte Teil des Wasserstoffes am Ende des Lebens eines Sterns im Kern aufgebraucht ist, zieht sich der Kern zusammen und erhöht seine Temperatur. Dadurch kann nun Helium zu Kohlenstoff verbrannt werden (Heliumflash, Heliumbrennen). In einer Schale um diesen Kern findet weiterhin das Wasserstoffbrennen statt. Auch Kohlenstoff kann weiter zu anderen Elementen verbrannt werden. Dieser Prozess wird normalerweise bis zum Eisen fortgesetzt, falls keine Supernovaexplosion auftritt. Bei einer Supernovaexplosion werden auch schwerere Elemente als Eisen synthetisiert, die durch die Explosion im Weltraum verteilt werden. Im Verlauf der Zeit reichert sich die interstellare Materie dadurch mit Helium und schwereren Elementen an, sodass später daraus entstandene Sternpopulationen auch einen größeren Anteil an Helium und schwereren Elementen haben.
Auf Sternoberflächen und in Nebeln kommt Helium bevorzugt neutral oder einfach ionisiert vor. Anders als in der Physik und Chemie üblich wird in der Astronomie nicht die Notation mit hochgestelltem „+“ (He+) verwendet, da andere Elemente so hochionisiert vorkommen können, dass diese Notation unpraktisch wird (z. B. sechzehnfach ionisiertes Eisen in der Sonnenkorona). Ionisationsstufen werden in der Astronomie mit römischen Ziffern bezeichnet, wobei neutrales Helium als He I bezeichnet wird, einfach ionisiertes entsprechend He II und vollständig (= zweifach) ionisiertes als Helium III (Helium-III).
Helium ist auch in Planeten-Atmosphären in unterschiedlichen Anteilen vorhanden. Nachfolgend beispielhaft der bodennahe bzw. bei den Gasplaneten äußere Stoffmengenanteil:
| Neptun | 19 % ± 3,2 % |
| Uranus | 15,2 % ± 3,3 % |
| Jupiter | 10,2 % |
| Saturn | 3,25 % |
| Venus | 0,0012 % (12 ppm) |
| Erde | 0,00052 % (5,2 ppm) |
Meteoriten, Asteroiden und Mond
Helium kann in Meteoriten und oberflächlichem Mondgestein auch durch Wechselwirkung (Spallation) mit Kosmischer Strahlung erzeugt werden. Besonders 3He kann deswegen benutzt werden, um das sogenannte Bestrahlungsalter, welches meist dem Zeitraum vom Losschlagen des Meteoriten vom Mutterkörper bis zu seiner Ankunft auf der Erde entspricht, zu bestimmen. Daneben entsteht 4He in Meteoriten durch Zerfall schwerer radioaktiver Elemente. Auch gibt es in Meteoriten weitere Heliumanteile, welche aus der Zeit der Entstehung des Sonnensystems stammen.
Der Hauptanteil des auch im Regolith des Mondes gebundenen Heliums stammt aus dem Sonnenwind, wenn er ungehindert durch eine Atmosphäre oder ein Magnetfeld auf die Oberfläche trifft. Etwa 4 % des Sonnenwindes sind Heliumionen, davon etwa 0,48 ‰ Helium-3. Die Heliumionen des Sonnenwindes haben eine Energie von etwa 3 keV, dringen in Feststoffe ein und verbleiben dort (siehe Ionenimplantation). Helium ist wegen der geringen Ionen-Eindringtiefe (Sub-Mikrometerbereich) besonders im Feinanteil des Regolith an der Oberfläche und wegen der Durchmischung bis zu Tiefen von einigen Metern zu finden. Es ist besonders in Titanoxid-reichen, leitfähigen Mineralien (Ilmenit) verblieben. Es kommt hier in Konzentrationen bis zu 70 Masse-ppm vor. Etwa 100 ppm des im Mondgestein gebundenen Heliums ist das Isotop Helium-3, welches auf der Erde äußerst selten ist und dessen Verwendung in Fusionsreaktoren diskutiert wird.[17][18]
Erde

4He entsteht im Erdkörper beim radioaktiven Zerfall (Alphazerfall) schwerer Elemente wie Uran oder Thorium, wobei Helium-Kerne als Alphateilchen ausgesandt werden und anschließend Elektronen einfangen. Es kann in verschiedenen uran- und thoriumhaltigen Mineralen wie der Pechblende gefunden werden.
Aus der Entstehungszeit der Erde stammt ein Anteil von 3He im Erdmantel, der weit über dem atmosphärischen Wert liegt, das sogenannte Mantelhelium; das 4He/3He-Verhältnis liegt im oberen Erdmantel, der weitgehend entgast ist und dessen Heliumbestand daher im Wesentlichen durch 4He aus Alpha-Zerfällen wiederaufgefüllt wird, bei etwa 86.000. Wenn das Konvektionssystem des unteren Erdmantels weitgehend von dem des oberen getrennt und der Massenaustausch zwischen beiden entsprechend gering ist, liegt das Verhältnis im unteren, kaum entgasten Mantel zwischen 2500 und 26.000, das heißt, der Anteil von 3He ist höher. Von besonderem geodynamischem Interesse ist dies im Hinblick auf die Ursachen von Hotspot-Vulkanismus: während für Basalte von mittelozeanischen Rücken, die durch Schmelzprozesse von Material des oberen Mantels entstehen, 4He/3He = 86.000 typisch ist, sind Basalte von einigen Hotspots, zum Beispiel ozeanischen Vulkaninseln wie Hawaii und Island, rund drei- bis viermal 3He-reicher. Dies wird gemeinhin damit erklärt, dass dieser Vulkanismus durch Mantelplumes verursacht wird, deren Ursprung an der Kern-Mantel-Grenze liegt und die daher zumindest teilweise aus Material des unteren Erdmantels bestehen.
Helium kommt – durch den gleichen Mechanismus der Ansammlung – in Erdgas (mit bis zu 16 Volumenprozent Anteil) und in geringen Mengen im Erdöl (0,4 %) vor. Europäische Erdgasvorkommen enthalten dabei lediglich Anteile um 0,12 (Nordsee) bis 0,4 Volumenprozent (Polen), während in sibirischen, nordamerikanischen (Kanada, Texas, Kansas und Oklahoma) und algerischen Erdgasvorkommen bis zu 16 Volumenprozent möglich sind.[14]
In unteren Schichten der Erdatmosphäre, besonders der vom Wetter durchmischten Troposphäre beträgt der Heliumgehalt etwa 5,2 ppm. In sehr großer Höhe entmischen sich Gase tendenziell entsprechend ihrer unterschiedlichen Dichte auch entgegen der durchmischenden Wirkung der ungerichteten molekularen Wärmebewegung. Oberhalb 100 km Höhe (Homosphäre) liegt die Atmosphäre zunehmend entmischt vor, Helium wird so in Höhen >400 km, (teilchenanzahlmäßig) das vorherrschende Gas. Dabei entweichen Heliumatome in diesen Höhen in den Weltraum – im stationären Fall so viel, wie aus der Erdoberfläche durch Diffusion, Förderung und Vulkanismus nachgeliefert wird.
Gewinnung
Erdgas mit einem Heliumanteil ab 0,2 %[19] ist der größte und wirtschaftlich wichtigste Heliumlieferant. Da Helium eine sehr niedrige Siedetemperatur besitzt, ist es durch Herunterkühlen des Erdgases möglich, das Helium von den anderen im Erdgas enthaltenen Stoffen, wie Kohlenwasserstoffen und Stickstoffverbindungen, zu trennen.
Viele Jahre lang gewannen die USA über 90 % des kommerziell nutzbaren Heliums der Welt. Noch 1995 wurden in den USA insgesamt eine Milliarde Kubikmeter Helium gefördert. Der restliche Anteil wurde von Förderungsanlagen in Kanada, Polen, Russland (wobei große Mengen in den unzugänglichen Gebieten Sibiriens liegen) und anderen Ländern geliefert. Nach der Jahrtausendwende kamen Algerien und Katar dazu. Algerien konnte sich rasch zum zweitwichtigsten Heliumlieferanten entwickeln. 2002 stellte Algerien 16 % des Heliums her, das in der Welt vertrieben wurde. Das Helium wird dort im Zuge der Erdgasverflüssigung gewonnen.
Bei Amarillo in Texas lagerte 2004 etwa das Zehnfache des Weltjahresbedarfs an Helium. Diese ehemals strategische Reserve der US-amerikanischen Regierung muss jedoch aufgrund des Helium Privatization Act der Clinton-Regierung aus dem Jahr 1996 bis 2015 an die Privatwirtschaft verkauft werden.
Dadurch wurde zunächst eine Heliumschwemme mit sehr niedrigen Preisen verursacht, die zu verschwenderischem Umgang führte und lange Zeit keine Maßnahmen zur Sparsamkeit aufkommen ließ. Weil der Verbrauch jedoch ständig steigt, droht Helium knapp zu werden, und Anlagen zur Wiedergewinnung des Heliums wurden bei Großverbrauchern zunehmend in Betrieb genommen. Experten warnen sogar vor einem Heliummangel, da Helium nur aus einigen Erdgasen gewonnen werden kann.[20][21] Im Jahr 2016 wurde jedoch ein gewaltiges Helium-Vorkommen in Tansania entdeckt, so dass die Heliumkrise vorerst als abgewendet gilt. Da ebenfalls die geologischen Bedingungen ermittelt werden konnten, unter denen sich Helium bildet, erhofft man sich weitere Funde in der Zukunft.[22] Im September 2019 wurde wieder auf eine drohende weltweite Heliumkrise hingewiesen.[23]
Das Isotop 3He ist nur zu etwa 1,4 ppm in natürlichem Helium der Erde enthalten und daher um ein Vielfaches teurer als das natürliche Isotopengemisch.
Erzeugung
Prinzipiell kann Helium auch in Kernreaktionen gewonnen werden. Helium 4He entsteht durch Neutronenbeschuss von Lithium 6Li in einem Kernreaktor; als Nebenprodukt entsteht Tritium 3H (überschwerer Wasserstoff):
Tritium zerfällt zu 3He durch Betazerfall mit einer Halbwertszeit von 12,33 Jahren.
Auch werden sehr geringe Mengen von Helium 3He in mit Wasser moderierten Reaktoren erbrütet, wenn die im Wasser enthaltenen Wasserstoffatome Neutronen einfangen. Aus dem normalen Wasserstoff bildet sich dadurch Schwerer Wasserstoff (Deuterium) und daraus durch einen weiteren Neutroneneinfang Tritium, das wiederum durch Betazerfall zu Helium 3He wird. Bei normalem Wasserstoff ist die Einfangrate höher als beim darauf folgenden Schritt des Neutroneneinfanges durch schweren Wasserstoff (deshalb können Kernkraftwerke, die Schweres Wasser als Moderator verwenden, auch mit Natururan betrieben werden):
Die angegebenen Zeiten sind Halbwertszeiten.
Eigenschaften
Physikalische Eigenschaften
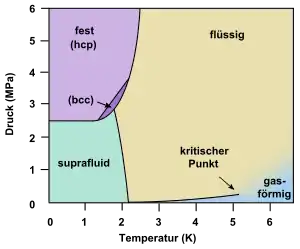
hcp: hexagonal-dichteste Kugelpackung
bcc: kubisch-raumzentriertes Kristallsystem
Helium ist nach Wasserstoff das chemische Element mit der zweitgeringsten Dichte und besitzt die niedrigsten Schmelz- und Siedepunkte aller Elemente. Daher existiert es nur unter sehr tiefen Temperaturen als Flüssigkeit oder Feststoff. Bei Temperaturen unter 2,17 K liegt 4He in einer suprafluiden Phase vor. Bei Normaldruck wird Helium selbst bei einer Temperatur nahe 0 K nicht fest. Erst bei einem Druck oberhalb 2,5 MPa (rund 25-facher Atmosphärendruck) geht Helium bei hinreichend tiefen Temperaturen in eine feste Phase über.
Im gasförmigen Zustand
Helium ist ein farbloses, geruchloses, geschmacksneutrales und ungiftiges Gas. Unter Standardbedingungen verhält sich Helium nahezu wie ein ideales Gas. Helium ist praktisch unter allen Bedingungen atomar. Ein Kubikmeter Helium hat bei Standardbedingungen eine Masse von 179 g, Luft ist dagegen etwa siebenmal so schwer. Helium weist nach Wasserstoff die größte thermische Leitfähigkeit unter allen Gasen auf und seine spezifische Wärmekapazität ist außergewöhnlich groß. Helium ist ein guter elektrischer Isolator. Die Löslichkeit von Helium in Wasser ist mit 1,5 mg/l[24] (9,3 ml/l) bei 20 °C und 101.325 kPa geringer als bei jedem anderen Gas. Seine Diffusionsrate durch Festkörper beträgt das Dreifache von Luft und ca. 65 Prozent von Wasserstoff.[25] Helium hat bei Standardbedingungen einen negativen Joule-Thomson-Koeffizienten, das heißt, dieses Gas erwärmt sich bei Ausdehnung. Erst unterhalb der Joule-Thomson-Inversionstemperatur (ca. 40 K bei Atmosphärendruck) kühlt es sich bei Expansion ab. Daher muss Helium unter diese Temperatur vorgekühlt werden, ehe es durch Expansionskühlung verflüssigt werden kann. Seine kritischen Daten sind ein Druck von 2,27 bar, eine Temperatur von −267,95 °C (5,2 K) und eine Dichte von 0,0696 g/cm3.[14]
Helium I
Bei Normaldruck bildet Helium zwischen dem Lambdapunkt bei 2,1768 K und dem Siedepunkt bei 4,15 K eine farblose Flüssigkeit.
Helium II
Flüssiges 4He entwickelt unterhalb seines Lambdapunktes sehr ungewöhnliche Eigenschaften. Helium mit diesen Eigenschaften wird als Helium II bezeichnet.
Helium II ist ein suprafluider Stoff. So fließt es etwa durch kleinste Öffnungen in Größenordnungen von 10−7 bis 10−8 m und hat keine messbare Viskosität. Jedoch konnte bei Messungen zwischen zwei sich bewegenden Scheiben eine Viskosität ähnlich der von gasförmigem Helium festgestellt werden. Dieses Phänomen wird mit dem Zwei-Fluid-Modell (rsp. Zwei-Flüssigkeiten-Modell) nach László Tisza erklärt. Laut dieser Theorie ist Helium II wie ein Gemisch aus 4He-Teilchen im normalfluiden sowie im suprafluiden Zustand, demnach verhält sich Helium II so, als gäbe es einen Anteil an Heliumatomen mit und einen ohne messbarer Viskosität. Anhand dieser Theorie können viele Phänomene der Tiefentemperaturphysik wie zum Beispiel der „Thermomechanische Effekt“ relativ einfach und klar erklärt werden. Allerdings muss man deutlich darauf hinweisen, dass die zwei Flüssigkeiten weder theoretisch noch praktisch trennbar sind.[26] In Helium II konnten die von Lew Landau postulierten Rotonen als kollektive Anregungen nachgewiesen werden.

Helium II zeigt den Onnes-Effekt: Wenn eine Oberfläche aus dem Helium hinausragt, bewegt sich das Helium auf dieser Fläche auch gegen die Schwerkraft. Helium II entweicht auf diese Weise aus einem Behälter, der nicht versiegelt ist. Wenn es einen wärmeren Bereich erreicht, verdunstet es. Aufgrund dieses Kriechverhaltens und der Fähigkeit des Heliums II, selbst durch kleinste Öffnungen auszulaufen, ist es sehr schwierig, flüssiges Helium in einem begrenzten Raum zu halten. Es ist ein sehr sorgfältig zu konstruierender Behälter nötig, um Helium II aufzubewahren, ohne dass es entweicht oder verdunstet.
Die Wärmeleitfähigkeit von Helium II lässt sich nicht mit der klassischen Wärmeleitung vergleichen, sie weist eher Parallelen zum Wärmetransport mittels Konvektion auf. Dadurch ist ein schneller und effektiver Wärmetransport über weite Distanzen möglich, was bei klassischer Wärmeleitung selbst mit sehr guten Wärmeleitern nicht möglich ist. Diese Art der Leitung wird auch als zweiter Schall bezeichnet, da er genauso wie Schall durch eine longitudinale Wellengleichung beschrieben werden kann: Helium II bei 1,8 K leitet Wärme als Impuls mit einer Geschwindigkeit von 20 m/s.
1971 gelang David M. Lee, Douglas D. Osheroff und Robert C. Richardson, das Helium-Isotop 3He ebenfalls in einen suprafluiden Zustand zu versetzen, indem sie das Isotop unter die Temperatur von 2,6 Milli-Kelvin abkühlten. Dabei geht man davon aus, dass zwei Atome 3He ein Paar bilden, ähnlich einem Cooper-Paar. Dieses Paar besitzt ein magnetisches Moment und einen Drehimpuls. Die drei Wissenschaftler erhielten für diese Entdeckung 1996 den Nobelpreis für Physik.
In festem Zustand
Helium kann als einziger Stoff unter Normaldruck nicht verfestigt werden. Dies gelingt nur unter erhöhtem Druck (etwa 2,5 MPa/0 K bei Helium-4, 2,93 MPa/0,315 K bei Helium-3) und bei sehr niedriger Temperatur (weniger als 1,5 K). Der beim Phasenübergang entstehende, fast vollkommen durchsichtige Feststoff ist sehr stark komprimierbar. Im Labor kann dessen Volumen um bis zu 30 % verringert werden; Helium ist mehr als 50-mal leichter komprimierbar als Wasser. Im festen Zustand bildet es kristalline Strukturen aus. Festes und flüssiges Helium sind optisch kaum voneinander zu unterscheiden, da ihre Brechungsindizes fast gleich sind.
In einem anderen Fall kann bei Unterschreiten von etwa 200 mK und gleichzeitigem Zentrifugieren ein Zustand erreicht werden, den man suprasolide oder auch suprafest nennt.[27] Hierbei stoppt ein Teil des Feststoffes die eigene Rotation und durchdringt die restlichen Teile der Materie. Zu diesem teilweise umstrittenen Effekt gibt es noch keine bekannten Thesen oder Theorien.
Atomare Eigenschaften
Die zwei Elektronen des Heliumatoms bilden die abgeschlossene, kugelsymmetrische Elektronenschale des 1s-Atomorbitals. Diese Elektronenkonfiguration ist energetisch äußerst stabil, es gibt kein anderes Element mit einer höheren Ionisierungsenergie und einer geringeren Elektronenaffinität. Helium ist trotz seiner größeren Elektronenzahl kleiner als Wasserstoff und damit das kleinste Atom überhaupt.
Abhängig von der Spinorientierung der zwei Elektronen des Heliumatoms spricht man vom Parahelium im Falle von zwei einander entgegengerichteten Spins (S = 0) und von Orthohelium bei zwei parallelen Spins (S = 1). Beim Orthohelium befindet sich eines der Elektronen nicht im 1s-Orbital, da dies das Pauli-Verbot verletzen würde.
Die Benennung dieser Zustände geht auf einen früheren Irrtum zurück: Da der elektromagnetische Übergang zwischen dem Grundzustand des Orthoheliums und dem Grundzustand des Paraheliums (also dem Helium-Grundzustand) verboten ist, erscheinen die beiden „Varianten“ des Heliums spektroskopisch wie zwei unterschiedliche Atome. Dies führte dazu, dass Carl Runge und Louis Paschen postulierten, Helium bestehe aus zwei getrennten Gasen, Orthohelium („richtiges Helium“) und Parahelium (für das sie den Namen Asterium vorschlugen).
Neben der Elektronenkonfiguration des Orthoheliums können die Elektronen – zum Beispiel durch Beschuss mit Elektronen – weitere angeregte Zustände einnehmen. Diese langlebigen angeregten Zustände werden als metastabile Energieniveaus bezeichnet.
Chemische Eigenschaften
Helium ist ein Edelgas. Die einzige Elektronenschale ist mit zwei Elektronen voll besetzt. Beide Elektronen sind durch die räumliche Nähe zum Atomkern sehr stark an diesen gebunden. Nicht zuletzt deswegen ist Helium selbst im Vergleich zu anderen Edelgasen ausgesprochen reaktionsträge. Das zeigt sich auch an den hohen Ionisierungsenergien des Heliumatoms.
Helium-Dimer
Wie anhand des Molekülorbital-Schemas ersichtlich wird, bilden Helium-Atome untereinander keine chemische Bindung. Beim Helium ist das 1s-Orbital mit einem Elektronenpaar besetzt. Bei der Kombination zweier dieser voll besetzten Atomorbitale (a) und (b) ist sowohl das bindende als auch das antibindende Molekülorbital mit je einem Elektronenpaar besetzt. Bei den sich (hypothetisch) ausbildenden Bindungsorbitalen wird der energetisch günstigere, sog. bindende Zustand durch den ebenfalls besetzten, aber energetisch ungünstigeren Antibindenden kompensiert. Das Gesamtsystem liegt energetisch nicht niedriger, und es kommt keine Bindung zustande.
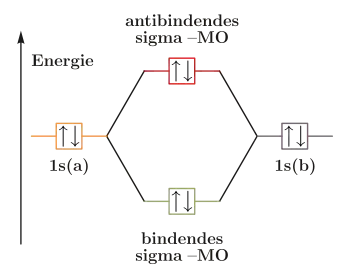 Besetzung der Orbitale eines hypothetischen He2-Moleküls. |
| Besetzung der Orbitale eines hypothetischen He2-Moleküls. |
Aufgrund der für alle Atome und Moleküle wirksamen Van-der-Waals-Wechselwirkung existiert jedoch auch bei Helium ein Dimer, allerdings mit einer äußerst kleinen Bindungsenergie von circa 1,1 mK (= 9,5 · 10−26 J)[28] und einem entsprechend großen Bindungsabstand von circa 52 Å.[29]
Ionische Bindungen
Unter extremen Bedingungen ist es möglich, eine quasichemische Verbindung von Helium mit einem Proton (HeH+) zu erzeugen. Diese Verbindung ist bei Normalbedingungen sehr instabil und kann nicht in Form eines Salzes wie HeH+X− isoliert werden.
- In einem Gemisch aus Helium und Wasserstoff bildet sich während einer elektrischen Entladung ein Heliumhydrid-Ion
Eine entsprechende Reaktion kann zwischen zwei Helium-Atomen ablaufen, wenn die zur Ionisierung notwendige Energie zugeführt wird.
Diese Verbindungen können aber nicht als wirkliche chemische Verbindungen bezeichnet werden, sondern eher als ionische Agglomerationen, die unter Ausnahmebedingungen entstehen, nur sehr kurz bestehen und sehr rasch wieder zerfallen.
Isotope
| 3He | 4He | |
|---|---|---|
| Ruheenergie in MeV | 2809 | 3728 |
| Dichte in kg/m3 | 0,134 | 0,178 |
| Kritische Temperatur in K | 3,32 | 5,20 |
| Lambdapunkt in K | 0,0025 | 2,1768 |
| Schmelzdruck bei T = 0 K in MPa | 3,439 | 2,536 |
| Siedepunkt in K | 3,19 | 4,21 |
Von den acht bekannten Isotopen des Heliums sind lediglich 3He und 4He stabil. In der Erdatmosphäre existiert pro Million 4He-Atome nur ein 3He-Atom. Jedoch variiert die Proportion der beiden Isotope je nach dem Herkunftsort der untersuchten Heliumprobe. Im interstellaren Medium sind 3He-Atome hundertmal so häufig. In Gesteinen der Erdkruste und des Erdmantels liegt die Proportion ebenfalls weit über dem atmosphärischen Wert und variiert je nach Herkunft um den Faktor 10. Diese Variationen werden in der Geologie benutzt, um die Herkunft des Gesteines zu klären (siehe auch Abschnitt Erde).
3He und 4He weisen aufgrund der unterschiedlichen Symmetrieeigenschaften (3He-Atome sind Fermionen, 4He-Atome sind Bosonen) einige unterschiedliche physikalische Eigenschaften auf, die sich insbesondere bei tiefen Temperaturen zeigen. So trennen sich gleiche Anteile von flüssigem 3He und 4He unter 0,8 Kelvin aufgrund ihrer unterschiedlichen Quanteneigenschaften in zwei unmischbare Flüssigkeiten, ähnlich Öl und Wasser. Dabei schwimmt eine Phase aus reinem 3He auf einer Phase, die hauptsächlich aus 4He besteht. Weiterhin unterscheiden sich die zwei Isotope deutlich in ihren suprafluiden Phasen (siehe Abschnitt Helium II).
Kernfusion
In Ankündigungen neuer Raumfahrt-Missionen der USA, Russlands und Chinas, weiterhin auch Europas, Indiens und Japans zum Mond wurden mehrfach die dortigen anteilig größeren Vorkommen von 3He als lohnende Quelle genannt, um Kernfusionsreaktoren auf Basis dieses Isotops auf der Erde zu ermöglichen. Im Gegensatz zur Deuterium-Tritium-Fusionsreaktion liefert die Deuterium-3He-Reaktion bei ähnlich großem Energiegewinn keine freien Neutronen, sondern Protonen. Dies würde die Radioaktivitätsprobleme der Fusionsenergiegewinnung dramatisch verringern. Andererseits ist die Herbeiführung dieser Reaktion wegen der nötigen viel höheren Plasmatemperatur eine noch ungelöste technische Herausforderung.[30]
Hypothetisches Diproton
Ein besonderes, fiktives Isotop des Heliums ist 2He, dessen Kern, das Diproton, im Falle seiner Existenz lediglich aus zwei Protonen bestünde. Für ein System aus zwei Protonen gibt es jedoch keinen gebundenen Zustand, da sich diese wegen des Pauli-Prinzips – im Gegensatz zum Proton und Neutron beim Deuteron – nur in einem Singulett-Zustand mit antiparallelen Spins befinden dürfen. Auf Grund der starken Spinabhängigkeit der Nukleon-Nukleon-Wechselwirkung ist dieser aber energetisch angehoben und daher nicht gebunden.
Verwendung und Handelsformen
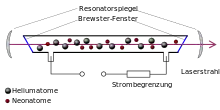
Das im Großhandel angebotene Helium stammt weltweit aus Großanlagen in fünf Ländern (USA, Russland, Polen, Katar und Algerien[19]), die Gewinnung von Helium erfolgt aus Erdgas.
Ausgeliefert im Bereich Technische Gase wird Helium in Form von verdichtetem Gas in Druckflaschen mit 200 bar Druck und Reinheitsgraden von Helium 4.6 (99,996 % Heliumanteil) bis zu hochreinem Helium 7.0 (99,99999 % Heliumgehalt).[31] Stahlflaschen mit typisch 10-50 Liter Volumen enthalten bei 200 bar nur 1,8 bis 9,1 Normkubikmeter Helium, da es sich bei 200 bar schon deutlich nichtideal verhält. Größere Mengen werden in Paletten zu je zwölf Flaschen oder Flaschenbündeln zu ebenfalls je zwölf 50-Liter-Flaschen geliefert. Noch größere Mengen kommen tiefkalt flüssig in Kryo-Sattelaufliegern oder Tube Trailern mit typisch zehn 12 m langen Rohren gefüllt mit etwa 200 bar Helium, in Summe 5000 Normkubikmeter.[32]
Helium wird auch tiefkalt verflüssigt in Kryo-Schiffen transportiert, etwa von einer Produktionsstätte in Afrika zu einem Hafen westlich nahe bei Marseille. Helium für Endverbraucher wird im Handel mit geringer Reinheit von ca. 98 % bis über 99 % primär in Form von Einweggasflaschen als sogenanntes „Ballongas“ angeboten, um damit auf Veranstaltungen und Feiern einfach und gefahrlos kleinere Mengen von Luftballons aufblasen und aufsteigen lassen zu können.[33] Ballongas kann grundsätzlich auch als Traggas für größere Ballone wie Wetterballone eingesetzt werden, ist aber im Vergleich zu Wasserstoff in dieser Anwendung teurer.
Helium wird vielseitig verwendet:
- Helium-Sauerstoff-Gemisch (80:20) dient in der Intensivmedizin als Atemgas. Das Gemisch strömt mit geringerem Widerstand durch Verengungen und lässt sich daher leichter atmen.
- Beim professionellen Tauchen werden verschiedene Gemische mit Helium wie Trimix (bestehend aus Sauerstoff, Stickstoff und Helium), Hydreliox (Wasserstoff, Helium und Sauerstoff) und Heliox (Helium und Sauerstoff) als Atemgas verwendet. Nachteilig wirkt sich hier die hohe Wärmekapazität des Heliums aus, was (bei kalter Umgebung) zum Auskühlen der Lunge und damit des Tauchers führt.[34][35]
- In der Lebensmittelindustrie wird es als Treibgas oder Packgas verwendet und ist als Lebensmittelzusatzstoff E 939 zugelassen.[36]
- Helium ist ein bevorzugtes Traggas für Ballons und Luftschiffe, denn es hat eine im Vergleich zu Luft sehr geringe Dichte, brennt nicht und kann daher gefahrlos mit Luft vermischt werden. Helium hat deshalb den brennbaren Wasserstoff, der mit Luft explosiv entzündliche Mischungen bildet, weitgehend verdrängt, auch wenn die Dichte von Helium höher und damit seine Tragkraft etwas niedriger als die des Wasserstoffs ist. Allerdings ist aufgrund der hohen Diffusionsrate die Anforderung an die Dichtheit der Hülle höher als bei allen anderen Gasen.
- In der Schweißtechnik wird Helium in Reinform oder als Zumischung als Inertgas eingesetzt, um die Schweißstelle vor Sauerstoff zu schützen. Zudem lässt sich mit Helium die Einbrenntiefe und die Schweißgeschwindigkeit steigern sowie die Bildung von Spritzern verringern, insbesondere bei Roboterschweißungen und bei der Verarbeitung von Aluminium und rostfreien Stählen.
- Technisch wird verflüssigtes Helium (die Isotope 4He und 3He) als Kühlmittel zum Erreichen sehr tiefer Temperaturen eingesetzt (siehe dazu: Kryostat). Mit 4He lassen sich durch Verdampfungskühlen Temperaturen bis etwa 1 K erreichen, mit dem Isotop 3He bis etwa 240 mK.[37] Mit dem Verfahren der 3He-4He-Mischungskühlung werden bis etwa 5 mK erreicht,[37] wobei dieses Verfahren deutlich kostengünstiger als eine reine 3He-Kühlung ist. Beim Einsatz von supraleitenden Magneten dient Helium als Kühlmittel, um damit den Supraleiter unter seiner Sprungtemperatur zu halten. Praktische Anwendungen sind hier besonders die Kernspintomographie (MRT) für medizinische Anwendungen sowie die Magnetresonanzspektroskopie (NMR) und der Betrieb von Teilchenbeschleunigern in der Forschung. In der Raumfahrt kühlt flüssiges Helium Infrarotteleskope und die hochempfindlichen Infrarotkameras in Weltraumteleskopen, die nur nahe dem Absoluten Nullpunkt ohne zu stark störende Eigenwärme arbeiten können. Beispiele sind: IRAS, ISO, das Spitzer- und das Herschel-Weltraumteleskop. Ein weiteres Anwendungsgebiet ist die Herstellung von optischen Glasfasern in heliumgekühlten Falltürmen.
- Komprimiertes Heliumgas kann als Kühlmittel eingesetzt werden, insbesondere dort, wo ein chemisch wie auch kernphysikalisch besonders inertes Kühlmittel benötigt wird. Kernphysikalisch inert ist allerdings nur die Hauptkomponente 4He, während 3He durch thermische Neutronen leicht in radioaktives Tritium überführt wird. Als Beispiel sei der Thorium-Hochtemperaturreaktor (kurz: THTR) genannt, wo das Helium bei sehr hohen Temperaturen verwendet wurde. Zu beachten ist, dass Helium zwar eine hohe spezifische, aber eine niedrige molare Wärmekapazität besitzt. Dies ist insbesondere bei geschlossenen Apparaturen problematisch, da es im Falle eines Temperaturanstiegs (zum Beispiel bei Stromausfall) schnell zu einer massiven Druckerhöhung kommt. Als nachteilig bei der Anwendung als Kühlmittel hat sich die (wie bei allen Gasen) mit steigender Temperatur zunehmende Viskosität von Helium erwiesen, da das die Kühlung heißer Bereiche verschlechtern kann.
- Die Suche nach Undichtigkeiten in Druckgasarmaturen wird durch eine Befüllung mit Helium erleichtert. Außen an der Druckarmatur wird ein Lecksuchspray aufgebracht. Helium dringt besonders leicht durch Leckstellen und erzeugt deutlichere Schaumblasen als das Betriebsgas.
- Bei Vakuumanlagen wird Helium als diffusionsfreudigstes Lecksuchgas eingesetzt, indem die Vakuumapparatur mit einer Pumpe evakuiert wird und ein Massenspektrometer hinter die Pumpe gehängt wird. Wird nun die Apparatur – außen, nur lokal um Leckstellen zu finden – mit Helium angeblasen, kann mit Hilfe des Massenspektrometers ein eventueller Heliumeintritt in die Apparatur detektiert und die Leckrate gemessen werden. Diese rasche und empfindliche Lecksuchmethode wird auch an Chemieanlagen und bei der Fertigung von Wärmetauschern für Klimaanlagen oder Benzintanks für Autos benutzt.
- Helium wird in Gasform in der Raketentechnik eingesetzt, um bei pumpgeförderten Flüssigtreibstoffraketen den verbrauchten Treibstoff zu ersetzen, damit die dünnwandigen Treibstofftanks der Raketen nicht implodieren, wenn der Treibstoff von den Treibstoffpumpen der Triebwerke aus den Tanks gesaugt wird. Bei druckgasgeförderten Flüssigtreibstoffraketen drückt Helium den Treibstoff in die Triebwerke. Helium wird hier wegen seines niedrigen Gewichtes und seiner niedrigen Siedetemperatur benutzt. Da es als Edelgas nicht mit dem Treibstoff reagieren kann, stellen auch aggressive hypergolische Treibstoffe kein Problem dar.
- Helium wird als Hilfsgas in verschiedenen Lasertypen eingesetzt, zum Beispiel dem Helium-Neon-Laser, dem Helium-Cadmium-Laser sowie einiger Typen des Kohlendioxidlasers. Es dient als Stoßpartner zur An- oder Abregung der Laserniveaus der eigentlichen aktiven Lasermedien.
- Reinsthelium dient als Trägergas in der Gaschromatographie (Analytik).
- In Gasentladungsröhren leuchtet Helium gelblich/weiß.
- Aufgrund seiner thermodynamischen Eigenschaften ist Helium ein sehr gutes Arbeitsmedium für Stirlingmotoren.
- Hyperpolarisiertes 3He wird in der Diagnostik versuchsweise als Kontrastmittel für kernspintomografische Aufnahmen der Lunge verwendet.
- Statt Druckluft zum Antrieb von Schlagschraubern beim Radwechsel im Formel-1-Automobilsport. Damit konnten diese bei einem bestimmten Druck um 30 % schneller betrieben werden. Um Kosten zu vermeiden, ab 2012 per Reglement verboten.[38][39]
- Bei Festplattenlaufwerken reduziert die Füllung mit Helium statt Luft Strömungseffekte und Vibrationen im Betrieb und erlaubt so kleinere Abstände der einzelnen Magnetscheiben voneinander. Bei gleicher Baugröße können dadurch mehr Magnetscheiben untergebracht und die Speicherkapazität der Festplatte dadurch erhöht werden.[40]
Gefahren
Helium zählt zu den Inertgasen und ist ungiftig. Bei der Handhabung von größeren Mengen gasförmigen Heliums müssen dann Sicherheitsmaßnahmen getroffen werden, wenn aufgrund der Gasmenge und der räumlichen Situation die Gefahr besteht, dass es zu einer Verdrängung von Atemluft kommen kann. Die Unfallzahlen durch Ersticken sind bei Helium im Gegensatz zu anderen häufig als Inertgas eingesetzten Gasen (z. B. Stickstoff) niedriger, da aufgrund der geringen Dichte gasförmiges Helium sofort aufsteigt und es somit auch in schlecht belüfteten Räumen in unteren Bereichen nur in seltenen Fällen zu einer vollständigen Sauerstoffverdrängung der Umgebungsluft und damit zu der Gefahr einer Erstickung kommt. Potentielle Gefahrenbereiche können Ansammlungen von Heliumgas in nach oben dichten baulichen Strukturen sein, beispielsweise Dachstühle, unter denen sich eine „Heliumblase“ bilden kann.[41]
Beim Hantieren mit Flüssig-Helium (UN-Nummer UN 1963) – es ist um 73 K kälter als Flüssig-Stickstoff, der ebenfalls als „tiefkalt“ bezeichnet wird – ist die Verwendung von Schutzkleidung notwendig, um Erfrierungen durch Kontakt zu verhindern. Die Gefahr geht im Wesentlichen von tiefgekühlten Behältern, Apparaturen und Armaturen bzw. durch die Vorkühlung durch LN2 aus, da Flüssig-Helium selbst nur eine extrem geringe Kühlleistung (220 ml LHe hat die Kühlleistung von 1 ml LN2) hat. Eine Schutzbrille schützt die Augen oder ein Visier das ganze Gesicht, dichte Handschuhe einer gewissen Dicke und mit Stulpe die Hände. Offene Taschen oder Stiefelschäfte sind Eintrittspforten für Spritzer und daher zu vermeiden. Weitere Gefahren gehen durch Vereisung und damit verbundener Verstopfung und Explodieren von Leitungen und Gefäßen aus.
Heliumdruckgasbehälter – meist nahtlose Stahlzylinder für 200 bar Hochdruck oder aber geschweißte (oft: Einweg-)Flaschen – stehen unter hohem Druck. Ihr Erhitzen über den Richtwert von 60 °C oder Kontakt mit Feuer ist strikt zu vermeiden. Denn einerseits steigt der Innendruck mit der Temperatur und andererseits nimmt die Festigkeit der Stahlwandung ab, sodass ein sehr energisches Platzen des Gefäßes droht. Auch das Abreißen des Ventils, etwa wenn eine Flasche ohne Schutzkappe fällt, oder das Brechen einer Berstscheibe löst einen Gasstrahl mit gefährlichen Folgen aus.
Sonstiges
Nach dem Einatmen von Helium klingt, solange die Atemwege einen relevant hohen Anteil an Helium enthalten, die menschliche Stimme erheblich höher. (Populär wird dieser Effekt „Micky-Maus-Stimme“ genannt, die allerdings durch schnelleres Abspielen von Tonband, also Erhöhung aller Frequenzen (und des Tempos) um einen bestimmten Faktor erzielt wurde.) Die Klangfarbe einer Stimme hängt dagegen von der Lage der Formanten im Mundraum ab, die durch Faktoren wie Zungen- und Lippenstellung beeinflusst werden. (Formanten sind diejenigen Frequenzbereiche, die am stärksten durch Resonanzwirkung verstärkt werden.) Diese Formanten hängen auch von der Schallgeschwindigkeit c im entsprechenden Medium ab (cLuft = 350 m/s, cHelium = 1030 m/s). Beträgt zum Beispiel die Lage der ersten drei Formanten in Luft 220, 2270 und 3270 Hz, so ändert sich dies in (reinem) Helium zu 320, 3900 und 5500 Hz. Dadurch ergibt sich ein anderes Stimmbild und die Stimme erscheint insgesamt höher, selbst wenn die Höhe des Stimmtones durch das Edelgas unverändert bliebe.
Einen ähnlichen Effekt gibt es, wenn ein (anfangs nur luftgefülltes) Blasinstrument mit Helium angeblasen wird.
Siehe auch
Literatur
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V. Stenke, E. Leicht, H. Stenger: Noble Gases. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006 (doi:10.1002/14356007.a17_485).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 417–429.
- F. A. Cotton, G. Wilkinson, C. A. Murillo, M. Bochmann: Advanced Inorganic Chemistry. Kap. 18. D. Wiley, New York 61999, ISBN 0-471-19957-5, S. 974.
- Christoph Haberstroh: Flüssigheliumversorgung. TUDpress, Dresden 2010, ISBN 978-3-941298-77-4.
- C. E. Housecroft, A. G. Sharpe: Inorganic Chemistry. Kapitel 22.8a. Pewson, Prentice Hall 2005, ISBN 0-13-039913-2. S. 666.
- Ekkehard Fluck, Klaus G. Heumann: Periodensystem der Elemente, Tafel. Wiley-VCH, Weinheim 2002, ISBN 3-527-30716-8.
- R. B. King (Hrsg.): Encyclopedia of Inorganic Chemistry. Band 8. D. Wiley, New York 1994, ISBN 0-471-93620-0. S. 4094.
Weblinks
- Jahresbericht des Bureau of Land Management (englisch, PDF, 76 KiB)
- Low Temperature Laboratory Helsinki (englisch)
- „Unmögliches“ Helium-Mineral im Erdinneren? scinexx.de, 9. Januar 2019
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus webelements.com (Helium) entnommen.
- Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements (IUPAC Technical Report) In: Pure and Applied Chemistry Vol. 83, No. 2, 2011, S. 359–396.
- IUPAC, Standard Atomic Weights Revised 2013.
- Eintrag zu helium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu helium bei WebElements, https://www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus webelements.com (Helium) entnommen.
- Eintrag zu Helium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. April 2017. (JavaScript erforderlich)
- R. E. Glick: On the Diamagnetic Susceptibility of Gases. In: J. Phys. Chem. 1961, 65, 9, S. 1552–1555; doi:10.1021/j100905a020.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337; doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus webelements.com (Helium) entnommen.
- L. C. Allen, J. E. Huheey: The definition of electronegativity and the chemistry of the noble gases.
- C. R. Hammond: The Elements. In: R. C. Weast (ed.). Handbook of Chemistry and Physics, 59th edition, CRC Press, 1977
- Eintrag zu Helium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. März 2013.
- Spektrum der Sonne und die Anteile von Wasserstoff und Helium.
- William Ramsay: Helium, a Gaseous Constituent of Certain Minerals. Part I. In: Proceedings of the Royal Society of London (1854–1905). 58, 1895, S. 80–89; doi:10.1098/rspl.1895.0010.
- Lunar Helium-3 and Fusion Power. NASA Conference Publication 10018, Proceedings eines Workshops in Cleveland/Ohio, 25. bis 26. April 1988
- Shashwat Shukla, Valentyn Tolpekin, Shashi Kumar, Alfred Stein: Investigating the Retention of Solar Wind Implanted Helium-3 on the Moon from the Analysis of Multi-Wavelength Remote Sensing Data. In: Remote Sensing, 4. Oktober 2020, Jg. 12, S. 3350.
- Kaltes Gas – heiss begehrt. (PDF) (Nicht mehr online verfügbar.) In: Linde Technology, #1, 2008. Linde AG, 2008, S. 11–15, archiviert vom Original am 17. März 2014; abgerufen am 13. September 2014.
- hda: Edelgas, Nobelpreisträger warnt vor weltweitem Helium-Mangel. Spiegel Online, 24. August 2010; abgerufen am 30. Juni 2012.
- Robert Gast: Inerte Gase, Das unterschätzte Element. Spektrum.de, 29. Juni 2012; abgerufen am 30. Juni 2012.
- Harald Frater: Rettender Fund wendet Heliumkrise ab: Forscher entdecken gigantisches Helium-Reservoir in Tansania. In: scinexx.de. Abgerufen am 30. Juni 2016.
- Christoph Seidler: Helium: Forscher warnen vor weltweiter Knappheit. In: Spiegel Online. 17. September 2019, abgerufen am 24. September 2019.
- Eintrag zu Helium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Dezember 2019. (JavaScript erforderlich)
- The Encyclopedia of the Chemical Elements, S. 261.
- Enns, Hunklinger: Tiefentemperaturphysik. 2000, S. 13 ff.
- Angelika Leute: Atomphysik: Suprafestes Helium entdeckt. In: Physik in unserer Zeit. Band 35, Nr. 6. WILEY-VCH, Weinheim 2004, S. 261, doi:10.1002/piuz.200490097.
- Zur Umrechnung von in Kelvin angegebenen Energieeinheiten in Joule siehe Kelvin#Temperatur und Energie.
- R. E. Grisenti, W. Schöllkopf, J. P. Toennies, G. C. Hegerfeldt, T. Köhler, M. Stoll: Determination of the Bond Length and Binding Energy of the Helium Dimer by Diffraction from a Transmission Grating. In: Phys. Rev. Lett., 85, 11, 2000, S. 2284–2287; bibcode:2000PhRvL..85.2284G.
- Energie vom Mond. heise.de/tr, 31. August 2007.
- Helium 7.0 Datenblatt. (PDF) Abgerufen am 22. Juli 2018.
- Helium Tube Trailer - 10 Tubes DOT 3T 2850 psi 40 ft. cmwelding.com; abgerufen 30. Oktober 2019.
- EG Sicherheitsdatenblatt GA342 Ballongas. (PDF) The Linde Group, abgerufen am 22. Juli 2018.
- Technisches Tauchen. In: Unterwasser, Ausgabe 05/2010 vom 13. April 2010.
- spez. Wärmekapazität von He / N2 / O2 = 5193 / 1040 / 920 J/(kg · K) = ca. 5 : 1 : 0,95 (bei 298 K).
- Zusatzstoff-Zulassungsverordnung: Anlage 3 (zu § 5 Abs. 1 und § 7) Allgemein zugelassene Zusatzstoffe.
- Jens Wiebe: Aufbau einer 300-mK-Ultrahochvakuum-Rastertunnelmikroskopie-Anlage mit 14-T-Magnet und Untersuchung eines stark ungeordneten zweidimensionalen Elektronensystems. Dissertation, Universität Hamburg, 2003. S. 17; physnet.uni-hamburg.de (Memento vom 27. August 2016 im Internet Archive; PDF; 7,4 MB) S. 23.
- Helium-Verbot in Schlagschraubern geplant. motorsport-total.com; abgerufen am 10. November 2011.
- Formel 1-Reglement 2012, Whiting erklärt die neuen Regeln. auto-motor-und-sport.de, November 2011; abgerufen 29. April 2015.
- Christof Windeck: Erste 6-Terabyte-Festplatte kommt mit Helium-Füllung. In: heise online. 4. November 2013, abgerufen am 11. Mai 2019.
- Hazards of inert gases and oxygen depletion. European Industrial Gases Association AISBL, 2009, abgerufen am 21. Juli 2018.


