Atomradius
Einem Atom wird ein Atomradius zugeschrieben, mit dem seine räumliche Größe näherungsweise bestimmt werden kann.
Ein absoluter Radius eines Atoms – und mithin auch eine absolute Größe – kann nicht angegeben werden, denn ein Atom zeigt je nach Typ seiner aktuellen chemischen Bindung verschiedene effektive Größe und besitzt nach den Vorstellungen der Quantenmechanik ohnehin keine definierte Grenze.
Der Atomradius ermittelt sich aus dem Abstand der Atomkerne in den chemischen Verbindungen des betreffenden Typs:
- In überwiegend ionisch aufgebauten Systemen werden den Atomen Ionenradien zugeschrieben.
- Für Atome in molekularen, als kovalent charakterisierten Verbindungen werden Kovalenzradien angegeben.
- In Metallen erhalten die Atome Metallatomradien.
- Zwischen den Molekülen kovalenter Verbindungen wirken Van-der-Waals-Kräfte; entsprechend gibt es dazu die Van-der-Waals-Radien.
Atomradien liegen in der Größenordnung von 10−10 m (=1 Ångström =100 pm =0,1 nm). So beträgt z. B. der Kovalenzradius im Wasserstoffmolekül 32 pm und der Metallradius von 12-fach koordiniertem Caesium 272 pm.
Zusammenhang mit der Stellung im Periodensystem
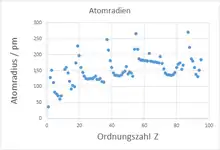

Die Atomradien nehmen innerhalb einer Gruppe des Periodensystems von oben nach unten zu und innerhalb einer Periode von links nach rechts ab.
Dies erklärt sich daraus, dass innerhalb einer Periode die Kernladungszahl und damit die positive Ladung des Kerns wächst; somit werden die negativen Elektronen des Atoms stärker angezogen. Die Verringerung des Atomradius innerhalb der Periode vom Halogen zum Edelgas lässt sich auf die besonders stabile Elektronenkonfiguration der Edelgase zurückführen.
Der Anstieg des Radius von einer Zeile zur nächsten innerhalb jeder Gruppe resultiert daraus, dass zusätzliche Schalen mit Elektronen besetzt werden und das Atom somit nach außen wächst.
| Ordnungs- zahl | Symbol | Radius [pm] |
|---|---|---|
| 1 | H | 32 |
| 2 | He | 28 |
| 3 | Li | 152 |
| 4 | Be | 112 |
| 5 | B | 88 |
| 6 | C | 77 |
| 7 | N | 70 |
| 8 | O | 66 |
| 9 | F | 64 |
| 10 | Ne | 58 |
| 11 | Na | 186 |
| 12 | Mg | 160 |
| 13 | Al | 143 |
| 14 | Si | 117 |
| 15 | P | 110 |
| 16 | S | 104 |
| 17 | Cl | 99 |
| 18 | Ar | 106 |
| 19 | K | 231 |
| 20 | Ca | 197 |
Metallatomradius, Kugelpackung und Bravais-Gitter
Kubisch-primitives Gitter
Im einfachsten Fall kristallisiert ein Element wie in Bild 1 dargestellt (simple cubic, kubisch einfach oder primitiv). In diesem Fall lässt sich der Durchmesser D eines Atoms (Abstand der Mittelpunkte nächster benachbarter Atome) wie folgt berechnen.
Man geht von einem Würfel aus, der gerade 1024 Atome enthält und dessen Kanten demnach von 108 Atomen gebildet werden. Ein Mol sind 6,022·1023 Atome (Avogadro-Zahl). Und ein Mol wiegt auch so viel Gramm, wie die Atommasse A angibt. A/0,6022 Gramm ist also die Masse des Würfels mit 1024 Atomen. Dividiert man diese Masse noch durch die Dichte ρ in g/cm³, dann ist A/(0,6022·ρ) cm3 das Volumen des Würfels. Die dritte Wurzel daraus ergibt die Länge einer Kante, und diese durch 108 dividiert ist der Atomdurchmesser D.
Beim Element Polonium z. B. (A=208,983 g/mol; ρ=9,196 g/cm3) beträgt das Volumen dieses Würfels 37,737 cm3 und die Kantenlänge 3,354 cm. Daraus folgt ein Atomradius von 167,7 pm; in Datensammlungen angegeben werden 167,5 pm,[1] was eine ziemlich gute Übereinstimmung bedeutet.

Kubisch-flächenzentriertes Gitter
Bei Gold (A=196,967 g/mol; ρ=19,282 g/cm3) stimmt das nicht mehr so genau, die entsprechende Berechnungergibt eine Kantenlänge, die etwa 12 % kleiner ist als die experimentell gemessene.
Der Grund für diese Diskrepanz ist, dass Goldatome nicht kubisch primitiv gepackt sind, sondern dichter (kubisch flächenzentriert, face centered cubic, fcc, eine der beiden dichtesten Kugelpackungen; Bild 2). Dabei sind
- in einer Ebene die Reihen der Atome um einen halben Atomdurchmesser gegeneinander verschoben, so dass sie näher aneinandergerückt werden können, und
- die Atome der Ebene darüber liegen jeweils in einer Mulde zwischen drei anderen Atomen. Sie bilden zusammen Tetraeder.
Charakterisiert man eine Reihe von Atomen durch eine Gerade, die die Atommittelpunkte auffädelt, dann ist der Abstand zweier Reihen in einer Ebene im kubisch-primitiven/sc-Gitter gerade D. Im kubisch-flächenzentrierten/fcc-Gitter ist er kleiner, nämlich (= Höhe eines gleichseitigen Dreiecks), und der Abstand zweier Ebenen ist gleich der Höhe eines Tetraeders. Aus dem Produkt der beiden Faktoren findet man: Ein fiktiver Goldwürfel mit kubisch primitiver Kristallstruktur hätte ein um √2 ≈ 1,41421 größeres Volumen, bzw. seine Dichte wäre um √2 kleiner.
Führt man nun die o. g. Berechnung des Atomradius mit dieser fiktiven geringeren Dichte durch, weil der Rechengang von einer kubisch-primitven Kugelpackung ausgeht (nur dann ergibt sich die Teilchenzahl auf einer Würfelkante als dritte Wurzel der Teilchenzahl im gesamten Würfel, ansonsten ist sie niedriger), so erhält man für Gold D=288 pm bzw. r=144 pm, in Übereinstimmung mit dem Ergebnis aus der experimentell beobachteten Röntgenbeugung.
Einfacher geht es, wenn man die Packungsdichten kennt (den Anteil, den die als kugelförmig angenommenen Atome am Volumen ausmachen):
- ein kubisch primitives Gitter hat eine Packungsdichte von 0,523599
- beim kubisch flächenzentrierten Gitter (Schichtfolge ABC) und beim hexagonalen Gitter (AB) beträgt sie jeweils 0,740480;
der Quotient 0,74…/0,52… ergibt wieder den Faktor √2.
Kubisch-raumzentriertes Gitter
Für die kubisch raumzentrierte Elementarzelle (body centered cubic, bcc) ist die Packungsdichte 0,68175. Hier muss für einen fiktiven Würfel mit sc-Struktur die Dichte durch (0,68…/0,52…) dividiert bzw. das Volumen mit diesem Faktor multipliziert werden.
So erhält man z. B. bei Natrium (A=22,9898 g/mol; ρ=0,968 g/cm3) aus der dritten Wurzel aus [22,9898/(0,6022·0,968/(0,68…/0,52…))] ein D=371,4 pm bzw. r=185,7 pm; gemessen wurden 186 pm.
Tabelle berechneter Radien
In folgender Tabelle sind Beispiele von Elementen aufgeführt, deren Kristallstruktur kubisch flächenzentriert oder hexagonal ist, zusammen mit dem Ergebnis der Rechnung und dem gemessenen Atomradius.
| Ordnungs- zahl | Element | Kristall- struktur | Atommasse [u] | Dichte [g/cm3] | rcalc [pm] | rexp [pm] |
|---|---|---|---|---|---|---|
| 4 | Be | hex | 9,012 | 1,848 | 112,7 | 112 |
| 12 | Mg | hex | 24,305 | 1,738 | 160,1 | 160 |
| 20 | Ca | fcc | 40,078 | 1,55 | 196,5 | 197 |
| 22 | Ti | hex | 47,867 | 4,506 | 146,1 | 147 |
| 27 | Co | hex | 58,933 | 8,86 | 125,0 | 125 |
| 28 | Ni | fcc | 58,693 | 8,908 | 124,6 | 124 |
| 29 | Cu | fcc | 63,546 | 8,933 | 127,8 | 128 |
| 40 | Zr | hex | 91,224 | 6,506 | 160,3 | 160 |
| 46 | Pd | fcc | 106,42 | 12,023 | 137,5 | 137 |
| 47 | Ag | fcc | 107,868 | 10,501 | 144,5 | 144 |
| 57 | La | hex | 138,905 | 6,162 | 187,7 | 187 |
| 76 | Os | hex | 190,23 | 22,59 | 135,2 | 135 |
| 77 | Ir | fcc | 192,217 | 22,56 | 135,7 | 136 |
| 78 | Pt | fcc | 195,084 | 21,45 | 138,7 | 138,5 |
| 79 | Au | fcc | 196,967 | 19,282 | 144,2 | 144 |
Klassische Methode
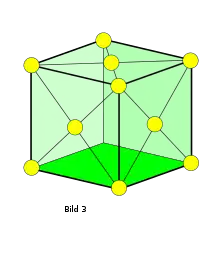
Die klassische kristallographische Methode zählt, wie viele Atome eine Elementarzelle umfasst. Die Berechnung mit dieser Methode liefert dieselben Zahlenwerte für die Atomradien der verschiedenen Gittertypen wie die oben vorgestellte Methode.
Kubisch-flächenzentriertes Gitter
Im Fall kubisch-flächenzentriert (fcc) enthält die Elementarzelle Anteile von vier ganzen Atomen (Bild 3). Aus der Atommasse A, der Dichte und der Avogadro-Zahl lässt sich das Volumen VEZ ermitteln, in dem sich vier Atome befinden, also die Größe der Elementarzelle (in diesem Fall von der Form eines Würfels):
Der Durchmesser eines Atoms ist der Abstand der Mittelpunkte zweier Atome, die den kleinsten in der Zelle vorkommenden Abstand aufweisen. Sie sind entlang der Flächendiagonalen angeordnet (und nicht entlang der Kante, dort sind sie weiter voneinander entfernt). Eine Flächendiagonale ist vier Atomradien bzw. zwei Atomdurchmesser lang (in Bild 3 sind die Atome der Übersichtlichkeit wegen kleiner eingezeichnet).
Aus dem Volumen erhält man die Kantenlänge a:
Aus der Kantenlänge erhält man die Länge Fd der Flächendiagonale:
Aus der Flächendiagonale erhält man den Atomradius r:
bzw. den Atomdurchmesser D:
Kubisch-primitives Gitter
Mit der kubisch-primitiven Elementarzelle lässt sich die Rechnung in analoger Weise für Polonium durchführen.[2]
Hier enthält die Elementarzelle Anteile von genau einem ganzen Atom (von jedem der acht Eckatome gerade ein Achtel), und der kleinste Abstand zweier Atommittelpunkte ist gerade entlang einer Kante der Elementarzelle zu finden. Daher gelten hier folgende abweichende Gleichungen:
und
- .
Weiterhin gilt unverändert:
- .
Kubisch-raumzentriertes Gitter
Hier enthält die Elementarzelle Anteile von zwei Atomen (von jedem der acht Eckatome gerade ein Achtel + das ganze Atom in Zellenmitte):
Der kleinste Abstand zweier Atommittelpunkte beträgt gerade die halbe Raumdiagonale der Elementarzelle:
- .
Siehe auch
- Bindungslängen in kovalenten Systemen
- Lanthanoidenkontraktion
Literatur
- Charles E. Mortimer, Ulrich Müller: Chemie. Das Basiswissen der Chemie. 9., überarbeitete Auflage. Thieme, Stuttgart 2007, ISBN 978-3-13-484309-5.
- Hans Rudolf Christen: Grundlagen der allgemeinen und anorganischen Chemie. 6. Auflage. Salle u. a., Frankfurt am Main u. a. 1980, ISBN 3-7935-5394-9.
Einzelnachweise
- Polonium. uniterra.de. Abgerufen am 28. Mai 2011.
- Frank Rioux: Calculating the Atomic Radius of Polonium (PDF; 114 kB) users.csbsju.edu. Abgerufen am 28. Mai 2011.