Dischwefeldichlorid
Dischwefeldichlorid ist eine chemische Verbindung aus der Gruppe der Schwefelchloride, die vor allem als Sulfidierungs- und Chlorierungsmittel eingesetzt wird.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
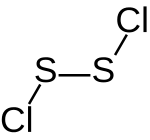 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dischwefeldichlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | S2Cl2 | ||||||||||||||||||
| Kurzbeschreibung |
goldgelbe Flüssigkeit mit üblem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 135,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,69 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
138 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,658 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
S2Cl2 wird erzeugt durch Chlorierung von elementarem Schwefel:[7]
- (ΔH = −58,2 kJ/mol S2Cl2)
Mit überschüssigem Chlor reagiert das Produkt in Gegenwart von Eisenchloriden weiter zu Schwefeldichlorid:
- (ΔH = −40,6 kJ/mol)
Praktisch erfolgt die Herstellung durch Einleiten von Chlor in geschmolzenen Schwefel und anschließende fraktionierte Destillation.[8] Industriell erfolgt die Chlorierung kontinuierlich bei 240 °C. Das Nebenprodukt Schwefeldichlorid wird durch Erhitzen zum Rückfluss unter Zugabe von Schwefel in Dischwefeldichlorid überführt.
Eigenschaften
Physikalische Eigenschaften
Dischwefeldichlorid ist eine klare goldgelbe, rauchende, ölige Flüssigkeit mit einem durchdringenden erstickenden Geruch, die sich in Kohlendisulfid löst[8] und bei Normaldruck bei 138 °C siedet. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,0648, B = 1417,43 und C = −61.685 im Temperaturbereich von 266 bis 411 K.[9] Die Wärmekapazität beträgt bei 25 °C 124,3 J·mol−1·K−1 bzw. 0,92 J·g−1·K−1.[10] Es besitzt eine Viskosität von 0,9 mPa·s bei 20 °C.[3]
Chemische Eigenschaften
Die Verbindung reagiert mit Wasser zu einer Vielzahl von Produkten wie Schwefel, Chlorwasserstoff, Schwefeldioxid, Schwefelwasserstoff und Thiosulfat. In Dischwefeldichlorid können bei Raumtemperatur bis zu 67 % Schwefel gelöst werden[8], wobei dieser beim Erwärmen teilweise unter Ausbildung von kettenförmigen Chlorsulfanen SnCl2 mit n > 2 eingebaut wird.[11]
Dischwefeldichlorid ist ein Sulfidierungs- und Chlorierungsmittel, das sich einerseits wie gelöstes Chlor verhält, andererseits aber mit einer Vielzahl (organischer) Verbindungen Kohlenstoff-Schwefel-Bindungen ausbildet.
In der organischen Synthesechemie dient es als Reagenz zur Herstellung verschiedener schwefelhaltiger organischen Verbindungen. So können Thioketone und Thioaldehyde durch die Umsetzung mit Hydrazonen erhalten werden. Die Additionsreaktion an Alkene ergibt über primäre Additionszwischenprodukte die entsprechenden Episulfide. Über Substitutionsreaktionen mit Aromaten können Disulfide gewonnen werden. Durch die Umsetzung mit Oximen sind heterocyclische Verbindungen des Typs der Dithiazole zugänglich.[12]
Verwendung
Dischwefeldichlorid wird industriell verwendet zur Herstellung von:
- Additiven für Hochdruckschmiermittel und Schneidöle
- Kautschuk-Vulkanisationsmitteln[8]
- Schwefeldichlorid
- anderen organischen Schwefelverbindungen, die ihrerseits zur Herstellung von Pharmazeutika, Pflanzenschutzmitteln, Farbstoffen und Kautschuk verwendet werden
- Chlorierung von Dicarbonsäuren, von z. B. Oxalsäure (Ethandisäure) zu Oxalylchlorid
Es dient auch als Katalysator bei Chlorierungsreaktionen, z. B. Chlorierung von Essigsäure.
Sicherheitshinweise
Dischwefeldichlorid ist ein Ausgangsstoff zur Herstellung von chemischen Kampfstoffen und steht deshalb unter Ausfuhrkontrolle.[13]
Weblinks
Einzelnachweise
- Schwefelchlorür. In: Meyers Großes Konversations-Lexikon. 6. Auflage. Band 18, Bibliographisches Institut, Leipzig/Wien 1909, S. 157.
- Eintrag zu Dischwefeldichlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt Dischwefeldichlorid (PDF) bei Merck, abgerufen am 23. Februar 2010.
- Datenblatt Sulfur monochloride bei Sigma-Aldrich, abgerufen am 28. März 2011 (PDF).
- Eintrag zu Disulphur dichloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 10025-67-9 bzw. Dischwefeldichlorid), abgerufen am 2. November 2015.
- F. Fehér in: G. Brauer (Hrsg.), Handbuch der Präparativen Anorganischen Chemie, 3. Auflage, Band 1, F. Enke Verlag, Stuttgart, 1975, S. 380–381.
- Eintrag zu Schwefelchloride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Juli 2017.
- Stull, D.R.: Vapor Pressure of Pure Substances Organic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- Chase, M.W., Jr., NIST-JANAF Themochemical Tables, Fourth Edition, J. Phys. Chem. Ref. Data, Monograph 9, 1998, 1-1951.
- L. Kolditz: Anorganische Chemie, Deutscher Verlag der Wissenschaften, Berlin 1983, S. 469.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999-2013, John Wiley and Sons, Inc., Eintrag für Disulfur Dichloride, abgerufen am 25. Juli 2017.
- Ausfuhrkontrolle


