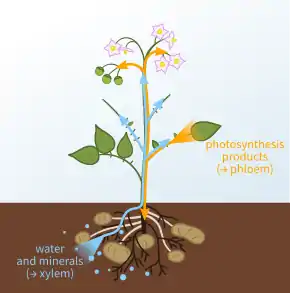
Xylem
Das Xylem [ksy’le:m] (griechisch ξύλον xýlon ‚Holz‘) oder der Holzteil der höheren Pflanzen (Gefäßpflanzen) ist ein komplexes, holziges Leitgewebe, das dem Transport von Wasser und anorganischen Salzen durch die Pflanze dient, aber auch Stützfunktionen übernimmt.
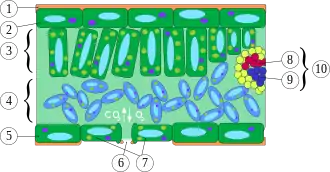
2 obere Epidermis
3 Palisadengewebe
4 Schwammgewebe
5 untere Epidermis
6 Spalt der Spaltöffnung
7 Schließzellen,
8 Xylem
9 Phloem
10 Blattader (Leitbündel)
Das Xylem findet sich zusammen mit dem Phloem in Leitungsbahnen, den sogenannten Leitbündeln, die die Sprossachsen (bei krautigen Pflanzen Stängel, bei Bäumen Stamm genannt), die Blattstiele und Blätter durchziehen. Die Wurzeln von Dikotyledonen besitzen einen zentralen Xylemkern.
Primäres und sekundäres Xylem
Xylem kann gefunden werden:
- als primäres Xylem in Leitbündeln von nicht verholzten Pflanzen sowie in den nicht verholzten Pflanzenteilen von verholzten Pflanzen
- als sekundäres Xylem in verholzten Pflanzen, gebildet von einem Kambium zwischen primärem Xylem und Phloem
- als ein Teil von Stelen, die nicht in Leitbündeln angeordnet sind, in vielen Farnen
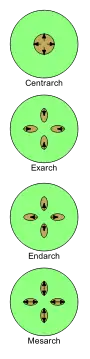
Primäres Xylem wird während des primären Wachstums in den Vegetationskegeln der Sprossachse und der Wurzeln vom Prokambium gebildet. Es umfasst Protoxylem und Metaxylem. Metaxylem entwickelt sich nach dem Protoxylem aber vor dem sekundären Xylem. Xylem entwickelt sich nach bestimmten Mustern, die in der jeweiligen Position von Proto- und Metaxylem variieren, z. B. endarch, in welchem das Protoxylem zum Zentrum des Stammes oder der Wurzel gerichtet ist und exarch, in welchem das Metaxylem zum Zentrum hin gerichtet ist.
Sekundäres Xylem wird durch Zellteilung des Kambiums, welches sich zwischen Xylem und Phloem befindet, gebildet. Das Kambium gibt nach innen Zellen des sekundären Xylems ab, nach außen Zellen des sekundären Phloems. Ein solches Kambium, welches nach zwei Seiten Gewebe bildet, nennt man dipleurisches Kambium. Sekundäres Xylem wird in den Gnetophyta und Ginkgophyta und in geringerem Umfang auch bei Cycadophyta gefunden, jedoch sind die beiden wichtigsten Gruppen:
- Nadelbäume (Koniferen): Es gibt rund 600 Arten von Nadelbäumen. Alle Arten besitzen sekundäres Xylem, das in dieser Gruppe in seiner Struktur relativ gleichmäßig ist. Viele Koniferen werden große Bäume, das sekundäre Xylem solcher Bäume wird als Weichholz verkauft.
- Bedecktsamer (Angiospermen): Es gibt über 400.000 Arten von Angiospermen. Sekundäres Xylem kann bei Dikotylen, nicht aber bei Monokotylen gefunden werden. Bei nicht-monokotylen Angiospermen kann sekundäres Xylem vorhanden sein, muss aber nicht. Es kann auch innerhalb einer Art durch die individuelle Umgebung der Pflanze variieren. Angesichts der Größe dieser Gruppe ist es nicht überraschend, dass es innerhalb der Angiospermen keine absoluten Regeln für die Struktur des sekundären Xylem gibt. Viele nicht-monokotyle Angiospermen werden Bäume und das sekundäre Xylem von ihnen wird als Hartholz verkauft.
In Übergangsphasen von Pflanzen mit sekundärem Wachstum schließen sich primäres und sekundäres Xylem nicht gegenseitig aus, wobei ein Leitbündel normalerweise nur primäres Xylem enthalten wird.
Die Verzweigungen des Xylems folgen Murrays Gesetz.[1]
Zelltypen und ihre Funktionen
Holz (also Xylem im sekundären Zustand) dient als Festigungssystem, als Wasserleitungssystem und als Speichersystem für Assimilate. Die verschiedenen Zelltypen lassen sich diesen Funktionen zuordnen.
Tracheiden
Tracheiden sind lang gestreckte lebende, später abgestorbene Zellen mit dicken, stark verholzten Zellwänden. Die Querwände der Einzelzellen sind nicht vollständig aufgelöst, sondern durch kleine, fest umrissene dünne Bereiche gekennzeichnet, die sogenannten Tüpfel (Hoftüpfel).
Die getüpfelten Tracheiden dienen sowohl der Festigung wie auch der Wasserleitung (mit maximal 0,4 mm/s). Die Tüpfel dienen ebenfalls der Wasserleitung. Sie haben auch eine Ventilfunktion, indem sie einen Lufteintritt verhindern (Luftembolie!).[2]
Tracheen
Tracheen- oder Gefäßglieder sind spezialisierte Tracheiden, deren Zellwände an ihren Enden eine oder mehrere Poren aufweisen. Vertikal aneinandergereiht bilden abgestorbene Einzelzellen lange Röhrensysteme, die Tracheen oder Gefäße.
Die Tracheen haben einen wesentlich größeren Durchmesser, was in einem geringeren Widerstand und damit einem schnelleren Wassertransport resultiert (bis zu 15 mm/s, in Extremfällen 40 mm/s).[2]
Tracheen kommen vor allem in Angiospermen vor und dienen zur Leitung von Wasser und den darin gelösten Salzen (Elektrolyten).
Holzfasern
Holzfasern (Sklerenchymfasern) sind ebenfalls spezialisierte Tracheiden. Sie besitzen jedoch wesentlich stärker verdickte Wände und keine Tüpfel.
Ihre Aufgabe besteht in der mechanischen Festigung des Xylems. Manche Holzfasern sind noch lebendig, in diesem Fall dienen sie in geringem Umfang auch der Speicherung.
Parenchymzellen
Die Zellen des Holz- oder Xylem-Parenchyms sind wenig spezialisierte lebendige Zellen im Holzteil. Anders als die zuvor genannten Zelltypen sind sie nicht längsgestreckt. Ihr Zelldurchmesser sind in allen Richtungen annähernd gleich.
Sie dienen der Speicherung von Stärke und Öl und spielen eine Rolle bei der Reparatur von Embolien.
Xylem bei verschiedenen Pflanzengruppen
- Das Holz der Gymnospermen besteht in erster Linie aus Tracheiden und ist monoton aufgebaut. Tracheen sind nicht vorhanden und Parenchym nur um Holzstrahlen und Harzkanäle.
- Das Holz der Angiospermen ist komplizierter gebaut. Hier sind Tracheen auf die Wasserleitung spezialisiert und Holzfasern auf Festigung. Holzstrahlen sind umfangreicher und aus mehreren Zellschichten aufgebaut.[2]
- Das Xylem von Pflanzen, die entwicklungsgeschichtlich sehr alt sind, etwa von Farnen und Koniferen, besteht ausschließlich aus Tracheiden. Bei den meisten Bedecktsamern (Angiospermen) enthält das Xylem auch gut entwickelte Gefäße und Holzfasern. Da die Abfolge der Schritte in der Spezialisierung all dieser Gewebe gut zu beobachten ist, liefert die Erforschung des Xylems wichtige Hinweise auf die Entwicklungsgeschichte der höheren Pflanzen.
- Die Gesamtheit des Wasserleitgewebes der Laubmoose (Bryophyta) wird als Hadrom bezeichnet. Das Hadrom ist ein Xylem ohne Festigungszellen, also ohne Sklerenchymfasern. Es ist dem Xylem ähnlich.
Der Wassertransport
Das Xylem transportiert Wasser und gelöste Mineralsalze von den Wurzeln durch und in die Pflanze. Es wird auch verwendet, um das durch Transpiration und Photosynthese verlorene Wasser zu ersetzen. Xylemsaft besteht hauptsächlich aus Wasser und anorganischen Ionen, obwohl es auch eine Reihe von organischen Molekülen enthalten kann.
Kohäsionstheorie
Die Kohäsionstheorie führt den Aufstieg des Wassers im Xylem auf intermolekulare Anziehung zurück, gestützt auf die klassische Forschung von Dixon & Joly (1894),[3] Askenasy (1895)[4] und Dixon (1914, 1924).[5]
Wasser ist ein polares Molekül. Wenn Wassermoleküle miteinander in Wechselwirkung treten, bilden sich Wasserstoffbrückenbindungen. Das negativ polarisierte Sauerstoffatom eines Wassermoleküls bildet eine Wasserstoffbrücke mit einem positiv polarisierten Wasserstoff-Atom eines anderen Wassermoleküls. Diese attraktive Wechselwirkung führt gemeinsam mit anderen intermolekularen Kräften zur Kohäsion der Wasserteilchen untereinander und zum Auftreten der Oberflächenspannung in flüssigem Wasser.
Es ermöglicht Pflanzen, Wasser entgegen der Schwerkraft aus der Wurzel durch das Xylem in das Blatt zu bewegen.
Durch Transpiration von der Oberfläche, Verbrauch von Wachstumswasser oder Verstoffwechselung verliert die Pflanze Wasser. Wenn Wassermoleküle das Xylem durch Verdunstung verlassen, veranlasst die Kapillarkraft die unmittelbar nachfolgenden Moleküle dazu, das Xylem wieder aufzufüllen. Dieser Mechanismus wird als Transpirationssog bezeichnet. Transpiration erzeugt Spannung (negativen Druck) in den Mesophyllzellen.
Bis zu einer gewissen Steighöhe lässt der atmosphärische Druck auch alle weiteren Moleküle in der Wassersäule nachrücken (die Kapillarkraft wirkt jeweils nur an der Grenzfläche zwischen Wasser, Wandung und Luft). Ab einer Steighöhe von etwa 3 Metern genügt der atmosphärische Druck nicht mehr, das Gewicht des Wassers und den Strömungswiderstand des Xylems auszugleichen. In der Wassersäule würden sich ein Vakuum oder Siedebläschen bilden. Der Wassertransport in höher gewachsenen Pflanzen wird daher mit der Kohäsion der Wassermoleküle untereinander erklärt, die der Bildung eines Vakuums bzw. dem Sieden des Wassers im Xylem entgegenwirken. Ebenso wirkt der Wurzeldruck unterstützend.
Triebkraft der Kapillarwirkung ist die Adhäsion der Wassermoleküle zu den hydrophilen Zellwänden des Xylems aufgrund der Grenzflächenspannung.
In der Pflanzenphysiologie wird der Mechanismus des Wasserdurchflusses auch durch den Wasserpotentialgradienten (Wasser fließt von Orten mit hohem Wasserpotential zu Orten mit niedrigem Wasserpotential) erklärt.
Druckmessung
Bis vor Kurzem konnte die Druckdifferenz des Transpirationssogs nur indirekt gemessen werden, durch Anlegen eines externen Druckes durch eine Scholander Bombe, um den internen Druck auszugleichen. Als Techniken ausgereift genug waren, um direkte Messungen vorzunehmen, gab es Diskussionen darüber, ob die klassische Theorie korrekt war, da es zum Teil nicht möglich war, negative Drücke nachzuweisen. Neuere Messungen scheinen die klassische Theorie größtenteils zu bestätigen. Der Xylem-Transport wird durch eine Mischung aus Transpirationssog und Wurzeldruck erzeugt, was eine Interpretation von Messungen erschwert.
Einzelnachweise
- Katherine A. McCulloh, John S. Sperry, Frederick R. Adler: Water transport in plants obeys Murray's law. In: Nature. Band 421, Nr. 6926, 2003, S. 939–942, doi:10.1038/nature01444, PMID 12607000.
- Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, Gunther Neuhaus, Uwe Sonnewald: Lehrbuch der Botanik. Begründet von Eduard Strasburger. 36. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1455-7, S. 187 ff.
- Henry Horatio Dixon: On the ascent of sap. In: Annals of Botany. Band 8, Nr. 4, 1894, S. 468–470 (online [PDF]).
- M. Möbius: Besprechung von E. Askenasy: Ueber das Saftsteigen. In: Botanisches Centralblatt. Band 62, Nr. 7–8, 1895, S. 237–238 (Digitalisat [abgerufen am 23. März 2015]).
- Henry Horatio Dixon: Transpiration and the ascent of sap in plants. Macmillian, New York 1914, doi:10.5962/bhl.title.1943.