Wasserstoffperoxid
Wasserstoffperoxid (H2O2) ist eine blassblaue, in verdünnter Form farblose, weitgehend stabile Flüssigverbindung aus Wasserstoff und Sauerstoff. Es ist etwas viskoser als Wasser, eine schwache Säure und gegenüber den meisten Stoffen ein sehr starkes Oxidationsmittel, das als solches heftig mit Substanzen wie etwa Kupfer, Messing, Kaliumiodid reagiert und somit als starkes Bleich- und Desinfektionsmittel fungiert. In hochkonzentrierter Form ist es sowohl als Einzel- als auch als Komponentenraketentreibstoff einsetzbar.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
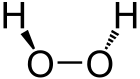 | |||||||||||||||||||
| Keile zur Verdeutlichung der räumlichen Struktur | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Wasserstoffperoxid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | H2O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, fast geruchlose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 34,02 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
150,2 °C (rein)[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−188 kJ·mol−1[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Im Handel ist Wasserstoffperoxid meist als wässrige Lösung zu beziehen und unterliegt je nach Konzentration variablen Vorschriften.
Geschichte
Wasserstoffperoxid wurde zum ersten Mal 1818 von Louis Jacques Thénard durch Reaktion von Bariumperoxid mit Salpetersäure hergestellt.[9] Das Verfahren wurde zunächst durch den Einsatz von Salzsäure, dann von Schwefelsäure verbessert. Letzteres eignet sich besonders gut, da das Nebenprodukt Bariumsulfat dabei ausfällt. Thénards Verfahren wurde vom Ende des 19. Jahrhunderts bis in die Mitte des 20. Jahrhunderts benutzt.[10]
Lange Zeit glaubte man, dass reines Wasserstoffperoxid instabil sei, da Versuche, es vom bei der Herstellung anfallenden Wasser zu trennen, scheiterten. Dies war der Tatsache geschuldet, dass Festkörperspuren und Schwermetallionen zu einem katalytischen Abbau oder gar zu einer Explosion führen. Absolut reines Wasserstoffperoxid wurde erstmals 1894 von Richard Wolffenstein per Vakuumdestillation gewonnen.[11]
Gewinnung und Herstellung
Früher wurde Wasserstoffperoxid hauptsächlich durch Elektrolyse von Schwefelsäure hergestellt. Dabei bildet sich Peroxodischwefelsäure, die dann wieder zu Schwefelsäure und Wasserstoffperoxid hydrolysiert wird.
Heute wird Wasserstoffperoxid technisch durch das Anthrachinon-Verfahren hergestellt. Dazu wird Anthrahydrochinon mit Luftsauerstoff unter Druck zu Wasserstoffperoxid und Anthrachinon umgesetzt. Anthrachinon kann im nächsten Schritt erneut mit Wasserstoff zum Anthrahydrochinon reduziert werden.
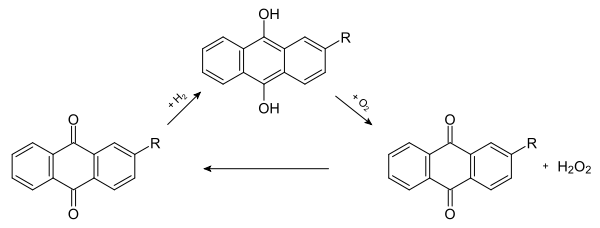
Die Bruttogleichung lautet:
Im Labormaßstab wird Wasserstoffperoxid auch bei der Behandlung von Peroxiden mit Säuren hergestellt. Ein historisch wichtiges Reagens ist Bariumperoxid, das in einer schwefelsauren Lösung zu Wasserstoffperoxid und Bariumsulfat reagiert.
Die molaren Standardbildungsenthalpien betragen:
- ΔfH0 gas: −136,11 kJ/mol
- ΔfH0 liq: −188 kJ/mol
- ΔfH0 sol: −200 kJ/mol
Eigenschaften
Physikalische Eigenschaften
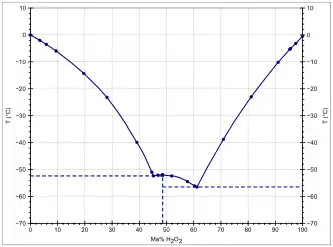
Die Verbindung ist mit Wasser in jedem Verhältnis mischbar. Obwohl die Schmelzpunkte der reinen Komponenten relativ ähnlich sind, werden in Mischungen signifikant niedrigere Schmelzpunkte beobachtet. Dabei wird ein definiert bei −52,1 °C schmelzendes Dihydrat (H2O2·2H2O) gefunden.[12] Dieses bildet mit den Reinstoffkomponenten zwei Eutektika bei einem Wasserstoffperoxidgehalt von 452 g/kg mit −52,4 °C und von 612 g/kg mit −56,5 °C.[12] Wasserstoffperoxid und Wasser bilden kein azeotrop siedendes Gemisch.[13]
Das H2O2-Molekül ist hinsichtlich der beiden O–O–H-Ebenen gewinkelt (Diederwinkel = 90,2±0,6°).[14] Die O–O-Bindungslänge beträgt 145,3±0,7 pm, die O–H-Bindungslänge 99,8±0,5 pm sowie der O–O–H-Bindungswinkel 102,7±0,3°.[14] In flüssiger Phase werden wie beim Wasser Wasserstoffbrücken gebildet. Die gewinkelte Struktur und geänderte Wasserstoffbrückenstruktur führt zu einer im Vergleich zu Wasser wesentlich höheren Dichte und etwas höheren Viskosität.
| Physikalische Eigenschaften von wässrigen Wasserstoffperoxidlösungen.[13] | ||||||||||||
| H2O2-Massenanteil (w ) | 0 % | 10 % | 20 % | 35 % | 50 % | 70 % | 90 % | 100 % | ||||
| Schmelzpunkt (in °C) | 0 | −6[12] | −14[12] | −33 | −52,2 | −40,3 | −11,9 | −0,43 | ||||
| Siedepunkt (in °C, 101,3 kPa) | 100 | 101,7[15] | 103,6[15] | 107,9 | 113,8 | 125,5 | 141,3 | 150,2 | ||||
| Dichte (in g·cm−3) | 0 °C | 0,9998 | 1,1441 | 1,2110 | 1,3071 | 1,4136 | 1,4700 | |||||
| 20 °C | 0,9980 | 1,03[15] | 1,07[15] | 1,1312 | 1,1953 | 1,2886 | 1,3920 | 1,4500 | ||||
| 25 °C | 0,9971 | 1,1282 | 1,1914 | 1,2839 | 1,3867 | 1,4425 | ||||||
| Dampfdruck (in hPa) | 20 °C | 23[16] | 17[17] | 8[2] | 1,9[2] | |||||||
| 30 °C | 42[16] | 30,7[17] | 14,7[2] | 6,67[2] | 3,9[2] | |||||||
| 50 °C | 123[16] | 13,2[2] | ||||||||||
| Spezifische Wärmekapazität (in J·K−1·g−1) | 25 °C | 4,18[18] | 3,96[18] | 3,78[18] | 3,57[18] | 3,35[18] | 3,06[18] | 2,77[18] | 2,62[18] | |||
| Viskosität (in mPa·s) | 0 °C | 1,792 | 1,82 | 1,87 | 1,93 | 1,88 | 1,819 | |||||
| 20 °C | 1,002 | 1,11 | 1,17 | 1,23 | 1,26 | 1,249 | ||||||
| Brechungsindex () | 1,3330 | 1,3563 | 1,3672 | 1,3827 | 1,3995 | 1,4084 | ||||||
Wasserstoffperoxid ist eine sehr schwache Säure. In Wasser stellt sich das folgende Gleichgewicht ein:
Die Säurekonstante beträgt KS = 1,6·10−12 bzw. pKS = 11,8.[19]
Chemische Eigenschaften
Wasserstoffperoxid neigt dazu, in Wasser und Sauerstoff zu zerfallen. Insbesondere bei hochkonzentrierten Lösungen und bei Kontakt mit Metalloberflächen beziehungsweise der Gegenwart von Metallsalzen und Oxiden kann eine spontane Zersetzung erfolgen. Die Zerfallsreaktion verläuft mit einer Reaktionswärme von −98,20 kJ·mol−1 bzw. −2887 kJ·kg−1 stark exotherm.[3] Zudem wird mit 329 l·kg−1 Wasserstoffperoxid eine erhebliche Gasmenge freigesetzt:
- Disproportionierung zweier Moleküle Wasserstoffperoxid zu Wasser und Sauerstoff.
Die spezifischen Zersetzungswärmen relativieren sich mit zunehmender Verdünnung, wobei ein praktisch linearer Zusammenhang mit der Wasserstoffperoxidkonzentration besteht.[20]
| Zersetzung von Wasserstoffperoxidlösungen.[20] | ||||||||||||
| H2O2-Massenanteil (w ) | 0 % | 10 % | 20 % | 30 % | 40 % | 50 % | 60 % | 70 % | 80 % | 90 % | 100 % | |
| Konzentration H2O2 (in mol·kg−1) | 0 | 2,94 | 5,88 | 8,82 | 11,76 | 14,70 | 17,64 | 20,58 | 23,53 | 26,45 | 29,39 | |
| Zersetzungswärme (in kJ·kg−1) | 0 | 281,2 | 557,8 | 838,2 | 1118,6 | 1402,1 | 1691,1 | 1982,4 | 2275,3 | 2596,4 | 2884,7 | |
| Gasfreisetzung (in l·kg−1) | 0 | 32,9 | 65,8 | 98,7 | 131,7 | 164,6 | 197,5 | 230,4 | 263,3 | 296,2 | 329,1 | |
Diese Zersetzungsreaktion wird unter anderem durch Schwermetallionen, I−- und OH−-Ionen katalysiert. Daher werden H2O2-Lösungen im Handel mit Stabilisatoren (unter anderem Phosphorsäure) versetzt.[21] Es ist ein starkes Oxidationsmittel. Unter Verminderung der Oxidationsstufe von −I auf −II entstehen als Reaktionsprodukte nur Wasser und Sauerstoff. Schwer abzutrennende oder störende Nebenprodukte fallen nicht an, was seine Anwendung im Labor vereinfacht.
Abhängig von der Lage beider Redox-Potentiale kann H2O2 auch als Reduktionsmittel wirken, so wird im Sauren das MnVII (im Kaliumpermanganat) reduziert.[22]
Wasserstoffperoxid ist eine sehr schwache Säure; seine anorganischen Salze und organischen Ester sind die Hydroperoxide und Peroxide.
Biologische Eigenschaften (Physiologie)

Wasserstoffperoxid wirkt stark ätzend, besonders als Dampf. Falls man Wasserstoffperoxid auf die Haut bekommt, sollte man die Stelle mit Wasser gut spülen (Verdünnung) oder das Wasserstoffperoxid zumindest sofort von der Haut entfernen. Dringt es in die Haut ein, so zersetzt es sich dort rasch, und die entstehenden Sauerstoffbläschen lassen die Haut weiß erscheinen.
Allgemein wirkt Wasserstoffperoxid zytotoxisch und durch seine starke Toxizität gegenüber vielen prokaryotischen Kleinstlebewesen desinfizierend.
Wasserstoffperoxid entsteht bei zahlreichen biochemischen Prozessen. Im biologischen Kreislauf entsteht es durch die oxidative Metabolisierung von Zucker. Der Organismus schützt sich gegen seine toxische Wirkung mittels Enzymen – Katalasen, Peroxidasen, die es wieder zum ungiftigen O2 und H2O zersetzen.
Zudem stellt Wasserstoffperoxid ein Signalmolekül für die Induktion der pflanzlichen Abwehr von Pathogenen dar (Aspekt der Zytotoxizität).
Graufärbung von Haaren im Alter
Deutsche und britische Forscher gaben in einer Studie im März 2009 bekannt, dass die „Graufärbung“ (eigentlich Weißfärbung) von Haaren im Alter Folge eines geringeren Abbaus von Wasserstoffperoxid in den Haaren ist. Man konnte im Laborversuch zeigen, dass Wasserstoffperoxid die Funktion des Enzyms Tyrosinase behindert, das für die Melaninproduktion benötigt wird. Dies geschieht durch Oxidation der in der Tyrosinase enthaltenen Aminosäure Methionin.[23]
Verwendung
Wasserstoffperoxid als starkes Oxidationsmittel eignet sich dazu, als Sauerstoffträger für auf Verbrennung basierende Sprengstoffe zu dienen. Daher sind bei Konzentrationen ab 120 g/kg in der EU die Abgabe an sowie der Besitz, die Verwendung und die Verbringung durch Personen, die nicht zu beruflichen oder gewerblichen Zwecken handeln, verboten und nur bis 349 g/kg genehmigungsfähig.[24] Für den Industriebedarf gibt es wässrige Lösungen mit Konzentrationen von bis zu 70 % H2O2. Hochkonzentrierte Lösungen von Wasserstoffperoxid können sich spontan unter Explosion zersetzen.
Bleichmittel
Wasserstoffperoxid ist ein Bleichmittel. Weltweit die häufigste Anwendung ist das Bleichen von Zellstoff. Zellstoff wird aus Holz gewonnen, und das enthaltene Lignin gibt dem Zellstoff einen Gilbton, der bei der Hauptverwendung von Zellstoff für Papier und Papiererzeugnisse als störend empfunden wird.
Im Handwerk werden Hölzer bei der Restaurierung oder der Renovierung mit Wasserstoffperoxid gebleicht und dadurch aufgehellt.
Es kommt beim Blondieren sowie Färben, Tönen und Intensivtönen und zur Fixierung dauerhafter Umformungen (Dauerwelle und Volumenwelle) sowie zum Fixieren permanenter Glättung von Haaren zum Einsatz. Ein sehr heller, künstlicher Blondton wird daher „wasserstoffblond“ genannt. Noch deutlicher wird der Zusammenhang in der englischen Bezeichnung peroxide blonde.
In der Zahnmedizin wird es in unterschiedlichen Konzentrationen zum Bleichen von Zähnen verwendet.
Häufig wird es als an Carbamid gebundenes Peroxid eingesetzt.
Wasserstoffperoxid und wasserstoffperoxidhaltige Bleichmittel, wie etwa ein Peroxyessigsäure-Wasserstoffperoxid-Gemisch, werden in der Werbesprache auch mit dem Kunstwort „Aktiv-Sauerstoff“ bezeichnet. Außer dem Wasserstoffperoxid kommen für Bleichzwecke auch andere Peroxide in Frage, die beim Zutritt von Wasser zerfallen und den aktiven atomaren Sauerstoff abgeben.
Auch bei der Tierpräparation wird es verwendet, um bei Tierschädeln den Knochen weiß zu bleichen. Die hierfür erforderlichen Konzentrationen erfordern entweder ein Gewerbe (Berufsjäger) oder eine Genehmigung nach Art. 5 Abs. 3 der EU-Verordnung.
Trinkwasser
Bei der Einwirkung von UV-Strahlen auf Wasserstoffperoxid wird das Hydroxyl-Radikal, ein wesentlich stärkeres Oxidationsmittel als das Peroxid selbst, gebildet. Nachfolgend die Gleichung für die Bildung:
Diese starke Oxidationswirkung wird in der Wasseraufbereitung zum Abbau organischer Verunreinigungen verwendet. Als Beispiel das sogenannte UVOX-Verfahren (UV-Licht und OXidation), mit dem das Herbizid Atrazin und sein Abbauprodukt Desethylatrazin oder auch andere toxische Inhaltsstoffe aus dem Trinkwasser sicher entfernt werden können.[25] Durch diese „nasse Verbrennung“ des Atrazin werden nur Abbauprodukte wie Wasser, Sauerstoff, Kohlenstoffdioxid und Stickstoff gebildet, und es tritt keine zusätzliche Aufsalzung des Wassers auf. Zudem ersetzt diese Methode die Verwendung von Aktivkohle, die deutlich kostenintensiver ist.
Kühlwasser
Wasserstoffperoxid wird auch Kühlkreisläufen zugesetzt, um ein Verkeimen, u. a. mit Legionellen, zu verhindern. Dazu wird dem Kühlwasser in periodischen Zeitabständen höherprozentiges (maximal 349 g/kg) Wasserstoffperoxid automatisch dosiert zugesetzt.
Desinfektion und Sterilisation
Eine 3-prozentige Lösung Wasserstoffperoxid wird zur Desinfektion, auch im Haushaltsbereich, eingesetzt. Einsatzbeispiele sind Mund- und Rachenraum (zur Mundspülung wird es auf 0,3 % verdünnt), die Zahnmedizin, die Desinfektion von Kontaktlinsen in Reinigern, die Entkeimung von Packstoffen oder die Desinfektion der Hände in Krankheitsfällen. Demgemäß kommt es in Gesichtscremes zum Einsatz: zur Reinigung der Poren und der Bekämpfung von Pickeln und Hautverunreinigungen. Auch bei der Reinigung von industriellen Abwässern und in der Schwimmbadtechnik erfolgt damit die Desinfektion des Wassers.
Die 35-prozentige Lösung von Wasserstoffperoxid wird in der Lebensmittelindustrie in aseptischen Abfüllanlagen zur Sterilisation von PET-Flaschen, Kunststoffbehältern und den typischen mehrschichtigen Kartonverpackungen verwendet. Zahlreiche Lebensmittel (Getränke, Milch, Milchprodukte, Soßen, Suppen) werden heute zur besseren Haltbarkeit und Produktqualität in Kartons, Becher, Flaschen und Folien aseptisch abgepackt. Dabei wird das Verpackungsmaterial mit 35-prozentigem Wasserstoffperoxid desinfiziert, bevor das jeweilige Lebensmittel eingefüllt wird.
Ein weiteres Anwendungsgebiet ist der Einsatz von gasförmigem H2O2 zur Reinraumdekontamination. Dazu wird eine üblicherweise 35-prozentige Lösung in einem speziellen Apparat verdampft und in den zu dekontaminierenden Bereich (Raum, Kammer usw.) geblasen.
Die hohe bakterizide Wirkung von H2O2, die Umweltverträglichkeit und die gute technische Realisierbarkeit sind die Gründe für die weite Verbreitung dieses Verfahrens.
Ein anderes Verfahren zur Raumdesinfektion mit Wasserstoffperoxid stellt die Kaltverneblung dar. Dabei wird Wasserstoffperoxid in ein Aerosol überführt und je nach Konzentration (ab 3 %) nach einem festgelegten Prozesszyklus durch einen Aerosolerzeuger im Raum verteilt. Die Aerosole haben eine Tröpfchengröße von 0,5–40 µm. Die Tröpfchengröße ist abhängig von der eingesetzten Technologie zur Generation der Aerosole. Die Aerosole verteilen sich nach kurzer Zeit gleichmäßig im Raum. Eine geringe Tröpfchengröße wirkt sich positiv auf die Verteilung und die Schwebefähigkeit der Tröpfchen aus. Je nach klimatischen Ausgangsbedingungen des Raumes wird ein Teil der in flüssiger Phase vorliegenden Tröpfchen in die Gasphase überführt. Die dazu notwendige Energie wird der Raumtemperatur entnommen. Der Prozess ist identisch zur adiabaten Befeuchtung. Das Medium durchmischt sich mit dem Medium Luft und bewirkt bei fachgerechter Anwendung eine holotische Desinfektion. Die Apparatur (Generator) zur Verneblung sowie das spezielle Verfahren müssen im Vorfeld zur Wirksamkeit validiert werden. Darüber hinaus ist diese auf Basis vorliegender Normung auf Wirksamkeit zu überprüfen. Hierbei wird das System aus Desinfektionsprodukt und Aerosolerzeuger in einem Labor auf seine Wirksamkeit getestet.
Für den Spezialfall SARS-CoV-2/COVID-19 kommt eine systematische Übersichtsarbeit aus dem Jahr 2020 über Wasserstoffperoxid (H2O2)-Mundspülungen zu dem Schluss, dass diese keinen Einfluss auf die viruzide Aktivität haben, und empfiehlt, dass "Zahnpflegeprotokolle während der COVID-19-Pandemie überarbeitet werden sollten."[26][27]
Sauerstoffzuführung
Wasserstoffperoxid kann in Aquarien zum Zuführen von Sauerstoff benutzt werden. Die Sauerstofferzeugung geschieht in einem Oxidator. Dazu wird in einem Gefäß im Aquarium Wasserstoffperoxid mit Hilfe eines Katalysators in Wasser und Sauerstoffradikale gespalten.
Gegen Schimmelbefall
Bei der Innenrenovierung kann Schimmelpilzbefall mit Wasserstoffperoxid bekämpft werden. Dabei wirkt es desinfizierend sowohl gegen die biologisch aktiven Pilzzellen – als Fungizid – als auch gegen die „Konidien“ genannten Sporen der Schimmelpilze.
Durch die bleichende Wirkung entfernt es auch „optisch“ die Rückstände des Schimmelbelags von porösen Untergründen. Wasserstoffperoxid hat gegenüber Alkohol oder Chlorbleichlauge einige Vorteile, da es im Gegensatz zu Alkohol unbrennbar ist, bleichende Wirkung hat und im Gegensatz zu Chlorbleichlauge keine chlorierten Nebenprodukte hinterlässt.
Medizin
In der Zahnmedizin wird H2O2 als dreiprozentige wässrige Lösung zur lokalen Desinfektion des Zahngewebes und zur Blutstillung bei kleineren Eingriffen verwendet. In der Medizin und Notfallmedizin kann die Substanz zur Desinfektion von Oberflächen, Instrumenten, Haut und Schleimhaut verwendet werden. Bei der Reinigung von Wunden kommt Wasserstoffperoxid heutzutage zwar noch vereinzelt zum Einsatz, hat aber seine traditionell bedingte Bedeutung inzwischen verloren, denn es wird innerhalb der Wunde bei Kontakt mit roten Blutkörperchen unter Aufschäumen schnell inaktiviert und entfaltet daher seine Wirkung nur kurz.[28]
Seit geraumer Zeit wird ein Verfahren zum Sterilisieren von bestimmten Medizinprodukten und chirurgischen Instrumenten angewandt, in dem H2O2 als Prozesschemikalie Verwendung findet (H2O2-Plasmaverfahren). Besonders bei thermolabilen Produkten bringt es Vorteile gegenüber der Dampfsterilisation. Es kann z. B. im Vakuum bei Raumtemperatur verdampft und zusätzlich ionisiert werden.[29]
Zudem wird H2O2 zur Desinfektion von Piercings verwendet. Dort soll es die betroffene Stelle desinfizieren und eine mögliche Blutung gerinnen lassen, wodurch ein schnellerer Heilprozess eintreten soll.
Landwirtschaft
In der Landwirtschaft wird Wasserstoffperoxid zur Desinfektion in Gewächshäusern und zur Sauerstoffanreicherung in Nährlösungen von Hydrokulturen benutzt. Wasserstoffperoxid wird auch zur Desinfektion von Tränkeleitungssystemen oder Stalleinrichtungen zum Beispiel in der Schweinehaltung verwendet.
Biologie
Für die Bestimmung von Bakterienkulturen wird der Katalase-Test mit dreiprozentiger Wasserstoffperoxidlösung durchgeführt. Die meisten aeroben und fakultativ anaeroben Bakterien wie auch Pilze haben das Enzym Katalase, das imstande ist, das für die Zellen giftige H2O2 zu spalten.
Experimentell wird Wasserstoffperoxid in der Biologie zur Herbeiführung des programmierten Zelltodes von isolierten eukaryotischen Zellen genutzt.
Forensik
Wasserstoffperoxid wurde in der Forensik zum Nachweis von Blut verwendet. Louis Jacques Thénard entdeckte 1818, dass Hämoglobin Wasserstoffperoxid zersetzt. Christian Friedrich Schönbein entwickelte daraus 1863 einen Test auf Blut. Heute wird jedoch der empfindlichere Kastle-Meyer-Test zum Nachweis von Blut verwendet.
Ätzmittel
In der Mikroelektronik benutzt man das Gemisch von Schwefelsäure und Wasserstoffperoxid – „Piranha“ genannt – zur Reinigung der Oberfläche von Wafern und zur Erzeugung einer dünnen, etwa drei bis vier Nanometer dicken hydrophilen Oxidschicht auf den Wafern. Heutzutage ist die Bezeichnung „SPM“ (Sulfuric Peroxide Mixture) geläufiger. Die Hauptanwendung ist das Entfernen von Fotolacken auf Wafern.
Bei der Herstellung von gedruckten Leiterplatten (Platinen) werden konzentrierte Wasserstoffperoxid-haltige Kupferchlorid-Ätzbäder zum Entfernen des Kupfers verwendet:
- .
- Elementares Kupfer reagiert mit Kupfer(II)-chlorid zu Kupfer(I)-chlorid. Es handelt sich hierbei um eine Komproportionierung.
Zur Regeneration der Kupferchlorid-Ätzbäder wird Wasserstoffperoxid zusammen mit Salzsäure eingesetzt:
- .
- Durch Reaktion des Kupfer(I)-chlorid mit Wasserstoffperoxid und Salzsäure wird das Kupfer(II)-chlorid regeneriert. Das Kupferatom wird dabei oxidiert.
Dabei werden die Wasserstoffperoxid- und Salzsäurezugabe über das Redoxpotential gesteuert; die hier verwendeten Fotolacke sind stabil gegen Wasserstoffperoxid.
Raketen-/Torpedotriebwerke

Als Sauerstofflieferant wird H2O2 durch Zersetzung (vorzugsweise über Braunstein) in U-Booten eingesetzt. In konzentrierter Form kam es bei Raketenantrieben bei Max Valier und der Messerschmitt Me 163 zum Einsatz, außerdem bei U-Boot-Antrieben (Walter-U-Boot). Mit Hilfe von Kaliumpermanganat zersetztes Wasserstoffperoxid wurde als Treibgas für die Treibstoffpumpen (370 kW Leistung) der Rakete A4 (auch bekannt als „Wunderwaffe V2“) verwendet.
In britischen Raketen (z. B. Black Arrow) wurde unzersetztes 85-prozentiges Wasserstoffperoxid als bei Normaltemperatur flüssiger Sauerstoffträger benutzt und mit Kerosin verbrannt, mit dem es hypergolisch reagiert.[30]
Eine der Thesen zum Untergang des russischen Atom-U-Boots K-141 Kursk im Jahre 2000 besagte, dass Wasserstoffperoxid aus einem Tank eines Torpedos drang, mit Eisenoxid im Abschussrohr reagierte und sich entzündete. Der Torpedo explodierte und verursachte ein verheerendes Feuer.
Ein derartiges Treibstoffgemisch (85–98 % Wasserstoffperoxid) für Raketen und Torpedos wird im Englischen auch als HTP (High Test Peroxide) bezeichnet.
Wasserstoffperoxid neigt zu unkontrollierter Zersetzung. So starben am 16. Juli 1934 Kurt Wahmke und zwei Techniker in Kummersdorf bei der Explosion eines mit Wasserstoffperoxid betriebenen Triebwerkes. Aufgrund der Gefährlichkeit in Einsatz und Handhabung (Ätzwirkung, unkontrollierte Zersetzung, Explosion bei Verunreinigungen in Tank und Leitungssystem) ist der Gebrauch heute auf Kleinraketentriebwerke (Rekordversuche, Steuertriebwerke) beschränkt.
Die polnische Höhenforschungsrakete ILR-33 Burstyn verwendet als Treibstoff 98%iges Wasserstoffperoxid, welches katalytisch zersetzt wird[31]
Brandgefahr kann in geeigneter Verbindung mit Eisenspänen und Putzlappen entstehen; die Unfallverhütungsvorschriften schreiben deshalb Vorsichtsmaßnahmen bei der Prozesswasseraufbereitung in metallverarbeitenden Betrieben vor.
Sprengstoffherstellung
Durch die Peroxidgruppe ist die Verbindung energiereich und zerfällt unter Sauerstofffreigabe. Wasserstoffperoxid reagiert in Anwesenheit eines geeigneten Katalysators mit Aceton zu Acetonperoxid, das ein Triaceton-Triperoxid ist und als Sprengstoff mit TATP bezeichnet wird. Unter Verwendung von Wasserstoffperoxid wird auch der Sprengstoff Hexamethylentriperoxiddiamin (HMTD) hergestellt.
Analytik
Klassische qualitative und quantitative Analytik
Diese klassischen Methoden verlieren wegen ihrer geringen Nachweisgrenzen und ihrer Umständlichkeit ihre Bedeutung in der Laborpraxis.
Nachweis als blaues Chromperoxid (CrO(O2)2)
Chromtrioxid CrO3 wird im stark sauren Bereich (pH<0) durch Wasserstoffperoxid zum tiefblau gefärbten und etherlöslichen Chrom(VI)-peroxid umgesetzt. Dazu wird Kaliumdichromat im Reagenzglas mit verdünnter Schwefelsäure angesäuert und mit etwas Ether überschichtet. Bei Anwesenheit von H2O2 färbt sich die Etherphase bläulich. Wegen der Verwendung giftiger und karzinogener Chrom(VI)-Verbindungen ist dieser Test heute nur noch von akademischem Interesse.
Nachweis als gelbes Peroxotitanyl(IV)-Ion
Der Nachweis als Titangelb (nicht zu verwechseln mit dem gleichnamigen organischen Reagenz) ist sehr empfindlich. Titan(IV)-Ionen reagieren mit Spuren von Wasserstoffperoxid zu intensiv orangegelb gefärbten Peroxotitanyl-Komplexionen.
Redox-Titration mit Kaliumpermanganat
Die Konzentration von Wasserstoffperoxid in schwefelsaurer wässriger Lösung kann mit Kaliumpermanganat titrimetrisch ermittelt werden. Ist stattdessen Salzsäure vorhanden, wird Reinhardt-Zimmermann-Lösung hinzugefügt. Der Titration liegt folgende Reaktion zu Grunde:
Der Farbumschlag erfolgt von farblos bis zur schwachen Rosafärbung, die für eine Minute bestehen bleiben sollte. Der Verbrauch von 1 ml KMnO4-Lösung (0,02 mol/l = 0,1N) entspricht 1,701 mg H2O2. Auf diesem Weg können auch Verbindungen titriert werden, die in schwefelsaurer Lösung H2O2 abspalten, wie Peroxide, Perborate oder Percarbonate.[32]
Nachweis mit Iodidstärke-Papier
Iodid-getränktes und stärkehaltiges Filterpapier zeigt bereits geringe Peroxidmengen durch Blaufärbung an. Hierbei oxidiert das Peroxid das Iodid zu Iod, das wiederum mit Stärke zusammen einen charakteristischen blauen Komplex bildet.
Optische Methoden
Photometrie
Das Oxidationsvermögen von H2O2 ermöglicht eine Vielzahl von (zum Teil enzymatisch katalysierten) chromogenen Reaktionen. Dadurch sind photometrische oder reflektometrische Bestimmungen von H2O2 möglich. Eine der bewährtesten Oxidationsreaktionen ist die „Trinder-Reaktion“ von Phenol mit 4-Aminoantipyrin zu einem violetten Farbstoff. Die Absorbanz ist proportional zur Analytkonzentration und kann bei 510 Nanometer gemessen werden.[33] Chemische Modifikationen der Reagenzien erlauben auch eine Messung bei Wellenlängen von 550 und 750 Nanometer. Mit dieser Methode konnte eine Nachweisgrenze von 1 µmol erzielt werden.[34]
Fluorometrie
Eine der wohl wichtigsten Nachweismethoden für Wasserstoffperoxid ist die peroxidase-katalysierte Oxidation von Amplex Red durch H2O2 zu Resorufin. Resorufin zeigt nach Anregung bei 535 Nanometer eine deutliche Fluoreszenz bei 590 Nanometer, während Amplex Red nicht fluoresziert. Die Wasserstoffperoxidkonzentration kann so mit einer Nachweisgrenze von 5 nmol/l bestimmt werden.[35]
Amperometrische Sensorik
Amperometrische Sensoren zum Nachweis von Wasserstoffperoxid sind schon länger bekannt. Das Messprinzip beruht darauf, dass Wasserstoffperoxid an einer Arbeitselektrode bei einem konstanten Potential entweder kathodisch reduziert oder anodisch oxidiert wird.[36] Der resultierende Strom ist dabei proportional zur Konzentration des H2O2. Das Potential für die kathodische Reduktion liegt meist zwischen −100 und −200 mV und das Potentialfenster für die anodische Oxidation reicht von 600 bis 800 mV bezogen auf eine Ag/AgCl-Referenzelektrode.[37]
Ein weiterer Ansatz ist die Immobilisierung von Enzymen (etwa der Meerrettichperoxidase) auf einer Kompositschicht aus Kohlenstoffnanoröhren und Chitosan.[38] Mit diesen Biosensoren wurde eine Nachweisgrenze von 10,3 µmol/l erzielt.[39] Eine zunehmend wichtigere Rolle spielen biomimetische, nichtenzymatische Sensoren auf Basis von magnetischen Eisenoxid-Nanopartikeln. Diese übernehmen die katalytische Funktion der Peroxidase und ermöglichen eine Nachweisgrenze von 3,6 µmol/l.[40][41] Weitere Sonden bedienen sich sogenannter Mn-NTA-Nanodrähte (Mangan-Nitrilotriacetat-Komplex), die amperometrisch die elektrochemische Oxidation des Wasserstoffperoxids verfolgen. Es wurde eine Nachweisgrenze von 0,2 µmol/l beschrieben.[42]
Vorschriften
Situation in Deutschland
Die jeweils geltenden Vorschriften für den Stoff und seine wässrige Lösung hängen von der in "Massen-Prozent" oder auch "g/kg" angegebenen massebezogenen Konzentration ab. Hier gibt es verschiedene Grenzwerte.
Konzentration unter 8 %
Nur recht allgemeine Sicherheitsregeln.
Konzentration 8 bis unter 35 %
Ab 80 g/kg gilt die Lösung als Gefahrstoff. Die Zersetzungstemperatur liegt oberhalb von 100 °C. Es gilt:
- Durchfahrverbot für Tunnel der Kategorie E.
- Einstufung als Gefahrgut der Klasse 5.1 (brandfördernd)
- UN-Nummer 2984 / Kennzeichnung 50.
Ab 120 g/kg zählt die EU Wasserstoffperoxid zu den beschränkten Ausgangsstoffen für Explosivstoffe mit der Folge, dass die Verwendung, der Besitz, die Verbringung und die Abgabe durch und an Personen verboten ist, die nicht zu beruflichen oder gewerblichen Zwecken handeln; die berufliche oder gewerbliche Zweckbestimmung ist bei Verkauf zu überprüfen und verdächtige Transaktionen sowie Diebstahl sind meldepflichtig[43]. Verstöße gegen das Besitz- und Verwendungsverbot sind in Deutschland strafbar[44]. Ausnahmegenehmigungen sind jedoch für Gemische bis 35 % möglich[24].
Ab 200 g/kg ist die Lösung auch als Gefahrgut Klasse 8 (ätzend) zu deklarieren. Die Kennzeichnung erfolgt mit der UN-Nummer 58 / 1014[45].
Konzentration 35 bis unter 50 %
Konzentration 50 bis unter 60 %
Hier verschärfen sich besonders Empfehlungen und Sicherheitsregeln. Die Neigung zur Zersetzung steigt erheblich, die Zersetzungstemperatur liegt aber immer noch über 60 °C[47].
Konzentration ab 60 %
Aufgrund der extremen Zersetzungsgefahr gilt bei mind. 600 g/kg die Einstufung H271: "Kann Brand oder Explosion verursachen; starkes Oxidationsmittel". Auch der Kontakt mit schlecht entflammbaren Substanzen kann zur Selbstentzündung führen. Aus diesem Grund gelten beim Transport viel strengere Regeln.
- Lagerklasse ist 5.1 A statt 5.1 B
- Kennzeichnung der Gefahr: 558, UN-Nummer 2015
- Wird es in Tanks befördert, so dürfen auch Tunnel der Kategorien B, C, und D nicht durchfahren werden[48].
Literatur
- Werner R. Thiel: Neue Wege zu Wasserstoffperoxid: Alternativen zu etablierten Prozessen? In: Angewandte Chemie. 111, Nr. 21, 1999, S. 3349–3351 (doi:10.1002/(SICI)1521-3757(19991102)111:21<3349::AID-ANGE3349>3.0.CO;2-P).
- Heribert Offermanns, Gunther Dittrich, Norbert Steiner: Wasserstoffperoxid in Umweltschutz und Synthese. In: Chemie in unserer Zeit. 34, Nr. 3, 2000, S. 150–159 (doi:10.1002/1521-3781(200006)34:3<150::AID-CIUZ150>3.0.CO;2-A).
Weblinks
- Wasserstoffperoxid in Zahnbleichmitteln (Kurzfassung eines Berichts des Wissenschaftlichen Ausschusses „Konsumgüter“ der Europäischen Kommission)
- ESO: Wasserstoffperoxid im Weltraum entdeckt 6. Juli 2011
Einzelnachweise
- Eintrag zu HYDROGEN PEROXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- Eintrag zu Wasserstoffperoxid (>70 %) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. April 2020. (JavaScript erforderlich)
- Eintrag zu Wasserstoffperoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juli 2012.
- D’Ans-Lax: Taschenbuch für Chemiker und Physiker, 3. Auflage, Band 1, Springer-Verlag, Berlin-Göttingen-Heidelberg 1967 (ChemieOnline – pKb- und pKs-Werte), abgerufen am 27. April 2012.
- Eintrag zu Hydrogen peroxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Hydrogen peroxide solution bei Sigma-Aldrich, abgerufen am 8. Mai 2017 (PDF).
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7722-84-1 bzw. Wasserstoffperoxid), abgerufen am 2. November 2015.
- PAETEC-Formelsammlung Ausgabe 2003, S. 116.
- Louis Jacques Thénard in: Annales de chimie et de physique. 8, 1818, S. 308.
- Craig W. Jones: Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry, Cambridge 1999, ISBN 978-1-84755-013-2.
- Richard Wolffenstein: Concentration und Destillation von Wasserstoffsuperoxyd. In: Berichte der deutschen chemischen Gesellschaft. 27, Nr. 3, 1894, S. 3307–3312, doi:10.1002/cber.189402703127.
- Foley, W.T.; Giguere, P.A.: Hydrogen peroxide and its analogues II. Phase equilibrium in the system hydrogen peroxide-water. In: Canadian Journal of Chemistry. 29, 1959, S. 123–132, doi:10.1139/v51-016.
- Goor, G.; Glenneberg, J.; Jacobi, S.; Dadabhoy, J.; Candido, E.: Hydrogen peroxide in Ullmann’s Encyclopedia of Industrial Chemistry, 2019 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a13_443.pub3.
- Busing, W.R.; Levy, H.A.: Crystal and Molecular Structure of Hydrogen Peroxide: A Neutron‐Diffraction Study in J. Chem. Phys. 42 (1965) 3054–3059, doi:10.1063/1.1696379.
- Eintrag zu Wasserstoffperoxid (<35 %) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. April 2020. (JavaScript erforderlich)
- Eintrag zu Wasser in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. April 2020. (JavaScript erforderlich)
- Eintrag zu Wasserstoffperoxid (<50 %) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. November 2019. (JavaScript erforderlich)
- Giguere, P.A.; Carmichael, J.L.: Heat Capacities for the Water-Hydrogen Peroxide System between 25° and 60° C. in J. Chem. Eng. Data 7 (1962) 526–527, doi:10.1021/je60015a024.
- L. Kolditz: Anorganische Chemie, VEB Deutscher Verlag der Wissenschaften, Berlin 1983, S. 459.
- Giguere, P.A.; Morisette, B.G.; Olmos, A.W.; Knop, O.:Hydrogen peroxide and its Analogues VII. Calorimetric Properties of the Systems H2O-H2O2 and D2O-D2O2 in Can. J. Chem. 33 (1955) 804–820, doi:10.1139/v55-098, pdf.
- Eberhard Schweda: Jander / Blasius, Anorganische Chemie I, 17. Auflage, 2012, S. 202.
- Holleman-Wiberg Lehrbuch der Anorganischen Chemie 91.–100. Auflage 1985 de Gruyter-Verlag S. 468
- J. M. Wood u. a.: Senile hair graying: H2O2-mediated oxidative stress affects human hair color by blunting methionine sulfoxide repair. In: The FASEB Journal. 23, Nr. 7, S. 2065–2075, doi:10.1096/fj.08-125435.
- Art. 4 Verordnung (EU) Nr. 98/2013 des Europäischen Parlaments und des Rates vom 15. Januar 2013 über die Vermarktung und Verwendung von Ausgangsstoffen für Explosivstoffe bis 1. Februar 2021, seither Verordnung (EU) 2019/1148 des Europäischen Parlaments und des Rates vom 20. Juni 2019 über die Vermarktung und Verwendung von Ausgangsstoffen für Explosivstoffe
- K. H. Pettinger, B. Wimmer, D. Wabner: Atrazinentfernung aus Trinkwasser durch UV-aktiviertes Wasserstoffperoxid. In: Das Gas- und Wasserfach. Ausgabe Wasser, Abwasser. 132, Nr. 10, 1991, S. 553–557.
- K.L. Ortega, B.O. Rech, G.L.C. El Haje, C.B. Gallo, M. Pérez-Sayáns: Do hydrogen peroxide mouthwashes have a virucidal effect? A systematic review. In: Journal of Hospital Infection. Band 106, Nr. 4, Dezember 2020, ISSN 0195-6701, S. 657–662, doi:10.1016/j.jhin.2020.10.003, PMID 33058941, PMC 7548555 (freier Volltext) – (10.1016/j.jhin.2020.10.003 [abgerufen am 13. Juli 2021]).
- Unbelegt: Wasserstoffperoxid gurgeln gegen Coronavirus. Abgerufen am 13. Juli 2021 (deutsch).
- Vasel-Biergans, Probst: Wundversorgung für die Pflege, wissenschaftliche Verlagsgesellschaft Stuttgart (2011), Stuttgart 2. Aufl., S. 157.
- Deutscher Bundestag – Drucksache 13/1049 vom 4. April 1995
- Bernd Leitenberger: Von der Diamant zur Ariane 4. Europas steiniger Weg in den Orbit. Books on Demand, Norderstedt 2009, ISBN 3-8370-9591-6 (Europäische Trägerraketen. Band 1), S. 63–64.
- ILR-33 rocket “Amber” and the QUERCUS 2 multispectral platform awarded at INTARG 2018. ilot.lukasiewicz.gov.pl (in Englisch), abgerufen am 3. September 2020
- Jander/Jahr: Maßanalyse, 15. Auflage, de Gruyter, Berlin 1989, S. 168.
- P. Trinder: Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. In: Annals of Clinical Biochemistry. 6, 1969, S. 24–27.
- M. Mizoguchi, M. Ishiyama, M. Shiga: Water-soluble chromogenic reagent for colorimetric detection of hydrogen peroxide–an alternative to 4-aminoantipyrine working at a long wavelength. In: Analytical Communications. 35, 1998, S. 71–74, doi:10.1039/a709038b.
- A. Zhu, R. Romero, H. R. Petty: A sensitive fluorimetric assay for pyruvate. In: Analytical Biochemistry. 396, Nr. 1, 2010, S. 146–151, doi:10.1016/j.ab.2009.09.017.
- Joseph Wang: Analytical Electrochemistry. 3. Auflage. Wiley-VCH, Hoboken 2006, ISBN 978-0-471-79030-3.
- Joseph Wang: Electrochemical Glucose Biosensors. In: Chemical Reviews. 108, Nr. 2, 2008, S. 814–825, doi:10.1021/cr068123a.
- Joseph Wang: Carbon-Nanotube Based Electrochemical Biosensors: A Review. In: Electroanalysis 17, Nr. 1, 2005, S. 7–14, doi:10.1002/elan.200403113.
- Lei Qiana, Xiurong Yang: Composite film of carbon nanotubes and chitosan for preparation of amperometric hydrogen peroxide biosensor. In: Talanta. 68, Nr. 3, 2006, S. 721–727, doi:10.1016/j.talanta.2005.05.030.
- G. S. Lai, H. L. Zhang, D. Y. Han: Amperometric hydrogen peroxide biosensor based on the immobilization of horseradish peroxidase by carbon-coated iron nanoparticles in combination with chitosan and cross-linking of glutaraldehyde. In: Microchimica Acta. 165, Nr. 1–2, 2009, S. 159–165, doi:10.1007/s00604-008-0114-2.
- Qing Chang u. a.: Determination of hydrogen peroxide with the aid of peroxidase-like Fe3O4 magnetic nanoparticles as the catalyst. In: Microchimica Acta. 165, Nr. 3–4, 2009, S. 299–305, doi:10.1007/s00604-008-0133-z.
- S. Liu u. a.: A novel non-enzymatic hydrogen-peroxide sensor based on Mn-nitrilotriacetate acid (Mn-NTA) nanowires. In: Talanta. 81, Nr. 1–2, 2010, S. 727–731, doi:10.1016/j.talanta.2009.12.057.
- Art. 5 der Verordnung (EU) 2019/1148 des Europäischen Parlaments und des Rates vom 20. Juni 2019 über die Vermarktung und Verwendung von Ausgangsstoffen für Explosivstoffe mit Anhang I, Inkrafttreten Art. 23, Prüfungs- und Meldepflichten der Wirtschaftsteilnehmer und Online-Marktplätze Art. 8 und 9, Ausnahmegenehmigung nach Art. 5 Abs. 3 mit Spalte 3 des Anhangs I; vor 1. Februar 2021 Art. 4 Verordnung (EU) Nr. 98/2013
- § 13 Ausgangsstoffgesetz
- Eintrag zu Wasserstoffperoxid 8 ... <35 % in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. April 2021. (JavaScript erforderlich)
- Eintrag zu Wasserstoffperoxid 35 ... <50 % in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. April 2021. (JavaScript erforderlich)
- Eintrag zu Wasserstoffperoxid 35 ... <50 % in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. April 2021. (JavaScript erforderlich)
- Eintrag zu Wasserstoffperoxid ab 60 % in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. April 2021. (JavaScript erforderlich)


