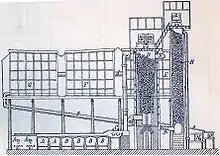
Bleikammerverfahren
Das Bleikammerverfahren ist ein historisches Verfahren zur Herstellung von Schwefelsäure. Dieses Verfahren wurde in England zu Beginn der Industriellen Revolution ab 1746 in Birmingham in größerem Maßstab eingesetzt, war aber schon seit dem Mittelalter bekannt.
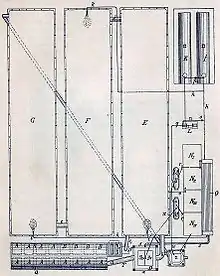
(I,K) Dampfkessel,
(L) Druckluftpumpe,
(M) Druckkessel,
(N) Behälter für Gloversäure,
(O) Röhrenkühler.[2]
Durchführung
Um Schwefeltrioxid zu erhalten, vermengte man den Schwefel mit etwas Salpeter als zusätzlichem Oxidationsmittel. Das Reaktionsprodukt wurde dann auf Wasser geleitet. Dies war das ursprüngliche Verfahren zur Herstellung von Schwefelsäure, es wurde aber 1746 von John Roebuck in Birmingham zur industriellen Produktion weiterentwickelt:
- Schwefeldioxid reagiert mit Salpetersäure zu Schwefelsäure und Stickstoffdioxid.
Die Glaskolben ersetzte man später durch große Kammern, die mit Blei ausgeschlagen waren, dem einzigen Gebrauchsmetall, das den hier auftretenden, sehr aggressiven Dämpfen und der Schwefelsäure widersteht, da es sich mit einer Schutzschicht aus Bleisulfat überzieht. Die umständliche Salpeterzugabe vermied man, als man bemerkte, dass auch Stickstoffdioxid das Schwefeldioxid oxidiert. Dabei wird es selbst zum Monoxid reduziert und reagiert sofort wieder mit dem Luftsauerstoff zum Dioxid und wiederholt den Prozess:
- Schwefeldioxid reagiert mit Stickstoffdioxid zu Schwefelsäure und Stickstoffmonoxid.
Dadurch wird das Schwefeldioxid durch den Luftsauerstoff weiteroxidiert und die nitrosen Gase wirken dabei als Katalysatoren. Optimiert wurde das Verfahren durch die Einführung des Glover- und des Gay-Lussac-Turms. Diese gestatteten nicht nur ein effektives Recycling der Stickoxide, sondern auch eine Aufkonzentrierung der Schwefelsäure auf ca. 80 % („Gloversäure“). Die Konzentration der „Kammersäure“ lag dagegen bei nur 63 … 70 %. Zur Gewinnung von konzentrierter, 96-prozentiger Schwefelsäure wurde die Kammersäure in großen Glas- oder Platinretorten eingedampft.[3]
Heutige Anwendungen in der Rauchgasreinigung
Anwendung findet das Bleikammerverfahren heute in der Rauchgasreinigung von Gasen mit verhältnismäßig hohen SO2-Konzentrationen (>0,5 Vol.-%), wie sie zum Beispiel in der Röstung von Molybdänerzen vorkommen.[4][5] Hierbei werden, wie bereits oben erwähnt, die im Rauchgas enthaltenen Stickoxide als Katalysatorsubstanz ausgenutzt oder eventuell aus einer weiteren Stickoxidquelle ergänzt.
Eine zukünftige Anwendung kann das Verfahren im Zusammenhang mit der Aufreinigung von aus Kraftwerksprozessen abgeschiedenem CO2 erlangen. Zur leichteren Endlagerung wird das abgeschiedene CO2 komprimiert, um es letztendlich zu verflüssigen. Bei einem Druck von 30 bar kann das Bleikammer-Verfahren vereinfacht in einem einzigen Absorptionswäscher mit 70wt% Schwefelsäure durchgeführt werden, da die geschwindigkeitslimitierende Oxidationsreaktion des Stickstoffmonoxids beschleunigt stattfindet.[6] Auf diese Weise kann das zu lagernde CO2 nahezu komplett entschwefelt werden.
Quellenangaben
- H. Ost: Lehrbuch der Technischen Chemie, Verlag von Robert Oppenheim, Berlin, 1890, S. 53.
- H. Ost: Lehrbuch der Technischen Chemie, Verlag von Robert Oppenheim, Berlin, 1890, S. 54.
- H. Ost: Lehrbuch der Technischen Chemie, Verlag von Robert Oppenheim, Berlin, 1890, S. 55 f.
- U. Sander, V. Fattinger: Chemical Engineering and Economic Aspects of Converting Dilute SO2 Gases into Sulfuric Acid,. Chem-Ing-Tech: 55(8): 601-7 (1983)
- B. Keilin, 1972, Development of the catalytic chamber process for the manufaction of sulfuric acid and nitric acids from waste flue gases., Govt. Pep.Announce, vol. 72(13)
- R. J. Allam, V. White, E. J. Miller: Air Products and Chemicals, Inc., (US), Purification of carbon dioxide, US2007/0122328A1 (2007)