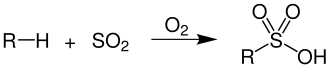Sulfonsäuren
Sulfonsäuren sind organische Schwefelverbindungen mit der allgemeinen Struktur R–SO2–OH, wobei R ein organischer Rest ist. Ihre Salze und Ester mit der allgemeinen Struktur R–SO2–O− und R1–SO2–O–R2 heißen Sulfonate.
| Sulfonsäuren und Sulfonate |
|---|
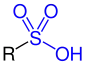 Sulfonsäure |
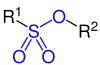 Sulfonsäureester |
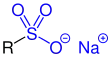 Sulfonsäuresalze |
| R, R1 und R2 sind Organylgruppen. Die funktionellen Gruppen sind blau markiert. |
Sulfonsäuren und die ihnen zugehörigen Salze und Ester werden in zwei Gruppen eingeteilt: die aliphatischen Sulfonsäuren bzw. Alkansulfonsäuren oder -sulfonate und die aromatischen Sulfonsäuren bzw. Arensulfonsäuren oder -sulfonate.
Gewinnung und Darstellung
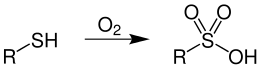
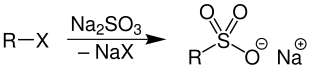
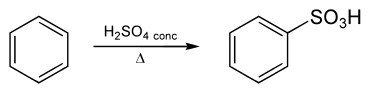
Für die technische Herstellung der Sulfonsäuren gibt es mehrere Synthesewege, von denen hier beispielhaft einige dargestellt werden.[1]
Ein Gemisch aus Alkansulfonsäuren entsteht durch die Einwirkung von Schwefeldioxid und Sauerstoff auf höhere Alkane in Gegenwart von Radikalbildnern.
Aliphatische und aromatische Sulfonsäuren können durch Oxidation von Thiolen synthetisiert werden.
Durch nucleophile Substitutionen werden aus Halogenalkanen und Natriumsulfit die entsprechenden Sulfonsäuresalze dargestellt.
Arensulfonsäuren werden durch die Sulfonierung von Arenen hergestellt. Es findet eine elektrophile aromatische Substitution statt. Das elektrophile Reagens Schwefeltrioxid liegt in konzentrierter Schwefelsäure im Gleichgewicht vor.
Verwendung und Vorkommen

Natriumsalze der Sulfonsäurederivate werden oft als anionische Tenside in Reinigungsmitteln eingesetzt.[2] Von den Alkylbenzolsulfonaten (ABS) mit der allgemeinen Formel CnH2n+1–C6H4–SO3− Na+ war der wichtigste Vertreter bis in die 1960er-Jahre das Tetrapropylenbenzolsulfonat (TBS). Es hatte in den 1950er-Jahren die Seife als Tensid weitgehend verdrängt. TBS wird allerdings (wie viele Vertreter der stark verzweigten ABS) im Abwasser nur schlecht abgebaut, was u. a. zu Schaumbergen auf Flüssen führte. Deshalb wurde es ab 1964 durch sogenannte lineare Alkylbenzolsulfonate (LAS) abgelöst, die seitdem die wichtigsten Tenside in der Waschmittelchemie sind. Praktisch handelt es sich dabei häufig um sekundäre Alkylbenzolsulfonate, eines der am meisten verwendeten ist Natriumdodecylbenzolsulfonat. Weitere sind lineare (sekundäre) Alkylsulfonate (SAS).
Sekundäre Alkylsulfonsäureester des Phenols finden Verwendung als Weichmacher für PVC, PUR und Kautschuke.
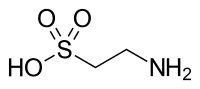
Taurin ist als Aminosulfonsäure eine der wenigen natürlich vorkommenden Sulfonsäuren.
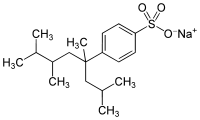 Tetrapropylenbenzolsulfonat (TBS)
Tetrapropylenbenzolsulfonat (TBS)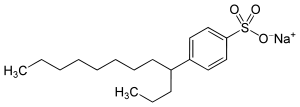 Natriumdodecylbenzolsulfonat, Beispiel aus dem Isomerengemisch.
Natriumdodecylbenzolsulfonat, Beispiel aus dem Isomerengemisch.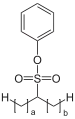
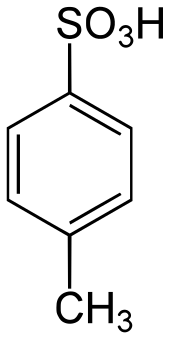 p-Toluolsulfonsäure ist ein wichtiges Reagenz in der organischen Synthese.
p-Toluolsulfonsäure ist ein wichtiges Reagenz in der organischen Synthese.
Eine spezielle Anwendung finden Polymere mit Sulfonatgruppen bei der Wasseraufbereitung, wo sie in Ionenaustauschern für Kationen eingesetzt werden.
Des Weiteren sind Sulfonsäuren und ihre Derivate in Gerbstoffen und Arzneimitteln enthalten.[1] Auch viele Farbstoffe tragen Sulfonatgruppen, um eine hohe Wasserlöslichkeit zu erreichen.
Eigenschaften
Alkansulfonsäuren sind im Allgemeinen viskose Flüssigkeiten, wobei die Arensulfonsäuren hygroskopische Kristalle bilden. Diese lösen sich leicht in Wasser und können durch Natriumchlorid ausgesalzen werden. Einige Sulfonsäuren bilden stabile, kristalline Hydrate.[1] Einfache Alkansulfonsäuren wie z. B. die Methansulfonsäure sind farblose Flüssigkeiten.
Sulfonsäuren sind deutlich stärkere Säuren als Carbonsäuren und sie weisen in der Regel negative pKs-Werte auf. Die starke Säurewirkung beruht auf der Stabilität der korrespondierenden Base, des Sulfonatanions. Durch die gleichmäßige Delokalisierung der negativen Ladung auf die drei äquivalenten Sauerstoffe ist das Anion stark mesomeriestabilisiert. Trifluormethansulfonsäure ist sogar stärker als Perchlorsäure und gehört damit zu der Gruppe der Supersäuren.[3]
Reaktionen
Nucleophile Substitution
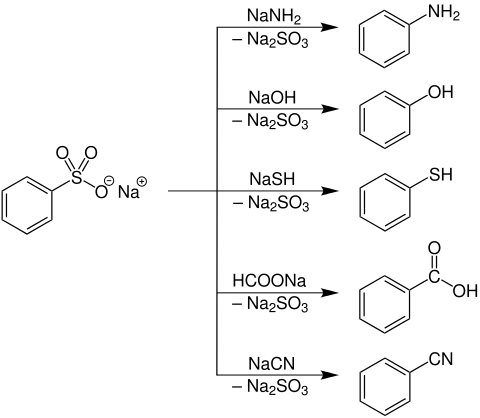
Arensulfonate können bei Temperaturen von 200 bis 300 °C durch eine nucleophile Substitution in Amine, Phenole, Carbonsäuren oder Nitrile umgewandelt werden.[1]
Salzbildung
Sulfonsäuren sind wie Schwefelsäure starke Säuren, die mit Metallhydroxiden Salze bilden. Im Gegensatz zu den entsprechenden Sulfaten (Salze der Schwefelsäure) lösen sich aber Calcium-, Barium- und Blei(II)-sulfonate gut in Wasser.[1]
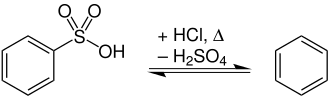
Desulfonierung von Arensulfonsäuren
Die Sulfonierung von Arenen zur Herstellung von Arensulfonsäuren ist eine reversible Reaktion. Die bei der Herstellung angegebene Benzolsulfonsäure wird beispielsweise durch verdünnte Salzsäure bei Temperaturen von 150 bis 200 °C zu Benzol hydrolysiert:[1]
Siehe auch
- Sulfonylgruppe (hier sind beide organischen Reste direkt an den Schwefel gebunden)
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie. Deutscher Verlag für Grundstoffindustrie, 1985, ISBN 3-87144-902-4, S. 480–482.
- Joachim Buddrus: Grundlagen der Organischen Chemie. 4. Auflage. de Gruyter Verlag, Berlin 2011, ISBN 978-3-11-024894-4, S. 97.
- Hans Beyer: Lehrbuch der Organische Chemie. S. Hirzel Verlag, Stuttgart/ Leipzig 1998, ISBN 3-7776-0808-4, S. 158–160.