Ferredoxine
Ferredoxine sind eisen- und schwefelhaltige Proteine, die als Elektronenüberträger in metabolischen Reaktionen mitwirken und in Eukaryoten und anaeroben Bakterien vorkommen. Das menschliche Ferredoxin wird Adrenodoxin genannt. Ein anderes Redox-Protein, das 1962 aus Chloroplasten im Spinat von Tagawa und Arnon isoliert wurde, wird „Chloroplasten-Ferredoxin“ genannt. Dieses Protein spielt sowohl in der zyklischen als auch nichtzyklischen Photophosphorylierung bei der Photosynthese eine Rolle. In der nichtzyklischen Photophosphorylierung ist Ferredoxin der letzte Elektronenakzeptor und reduziert das Coenzym NADP+ zu NADPH/H+. Es nimmt Elektronen von dem durch Sonnenlicht angeregten Chlorophyll auf und überträgt diese dem Enzym Ferredoxin-NADP(+)-Reduktase.
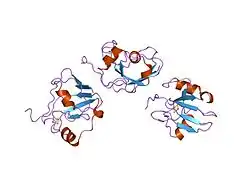
| 2Fe-2S-Ferredoxin (Escherichia coli K12) | ||
|---|---|---|
| ||
| nach 1I7H | ||
|
Vorhandene Strukturdaten: 1I7H | ||
| Masse/Länge Primärstruktur | 111 Aminosäuren | |
| Kofaktor | (2Fe-2S) | |
| Bezeichner | ||
| Gen-Name(n) | fdx (EcoGene) | |
| Externe IDs | ||
Ferredoxine sind kleine Proteine, die Eisen- und Schwefelatome enthalten, die in einem Eisen-Schwefel-Cluster angeordnet sind. Ferredoxine wirken als „biologische Kondensatoren“, indem das Eisenatom seine Oxidationsstufe (+2 oder +3) ändern kann. Somit wirken sie in biologischen Redoxreaktionen als Elektronenüberträger.
Fe2S2 Ferredoxine
Pflanzliche Ferredoxine
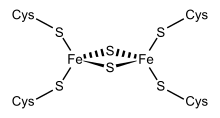
Die ursprünglich in Chloroplasten gefundene Sorte von Ferredoxine werden „Chloroplasten-Ferredoxine“ genannt. Das aktive Zentrum ist hier ein [Fe2S2] Cluster, in dem die Eisenatome durch anorganische Schwefelatome und durch Schwefelreste des Cysteins tetraedrisch angeordnet sind. In Chloroplasten wirken die Fe2S2 Ferredoxine als Elektronenüberträger in der Elektronentransportkette des Photosystems I und als Elektronendonatoren für verschiedene Proteine, wie Glutamatsynthase, Nitratreduktase und Schwefelreduktase. In bakteriellen Dioxygenasesystemen dienen sie als Elektronenüberträger zwischen Flavoproteinreduktase und Oxygenase.
Adrenodoxin-Ferredoxine
Adrenodoxin, Putidaredoxin und Terpredoxin sind lösliche Fe2S2 Ferredoxine die als Elektronenüberträger arbeiten. Im mitochondrialen Monooxygenasesystemen überträgt Adrenodoxin ein Elektron von NADPH-Adrenodoxin-Reduktase an die membrangebundene Cytochrom P450 Cholesterin-Monooxygenase (CYP11A1) oder Steroid-11beta-Hydroxylasen (CYP11B1 bzw. CYP11B2). Dabei wirkt das System seitenkettenabspaltend und ist in den Mitochondrien der Nebennierenrinde zu finden, wo es bei der Katalyse von Steroidhormonen mitwirkt.[1] In Bakterien dienen Putidaredoxin und Terpedoxin als Elektronenüberträger zwischen den NADH-abhängigen Ferredoxinreduktasen und löslichen P450 Cytochromen. Weitere Funktionen anderer Ferredoxine dieser Sorte sind bisher noch nicht geklärt. Obwohl es zwischen der Aminosäurensequenz von pflanzlichem Ferredoxin und Adrenodoxin keine großen Übereinstimmungen gibt, weisen beide Moleküle dennoch eine ähnliche Faltungsstruktur auf.
Thioredoxin-Ferredoxine
Fe2S2 Ferredoxin von Clostridium pasteurianum (Cp2FeFd) wird aufgrund seiner andersartigen Aminosäurensequenz, spektroskopischen Eigenschaften seines Eisen-Schwefel-Clusters sowie seiner einzigartigen Fähigkeit, Liganden zwischen Cystein und dem [Fe2S2] Cluster tauschen zu können als eigene Proteinfamilie anerkannt. Obwohl die physiologische Rolle dieses Ferredoxins bisher unklar ist, konnte eine spezifische Wechselwirkung zwischen Cp2FeFd und der Molybdän-Eisen-Gruppe der Nitrogenase festgestellt werden. Homologe Ferredoxine von Azotobacter vinelandii (Av2FeFdI) und Aquifex aeolicus (AaFd) wurden ebenfalls beschrieben. Die Kristallstruktur von AaFd wurde aufgeklärt, AaFd ist als Dimer vorhanden. Die Struktur des AaFd Monomers unterscheidet sich von anderen Fe2S2 Ferredoxinen. Die Faltung der Sekundärstruktur umfasst α- und β-Faltungen, wobei die ersten vier β-Ketten und zwei α-Ketten eine Variante der Thioredoxinfaltung annehmen.
Fe4S4 und Fe3S4 Ferredoxine
Fe4S4 Ferredoxine werden weiter unterteilt in „low-potential“ Ferredoxine (LPF) (bei Bakterien) und „high-potential“ (HiPIP) Ferredoxine. Beide Kategorien sind sich im Schema der Redoxreaktionen ähnlich:
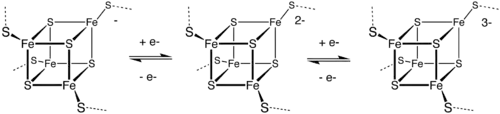
Bei LPF können die Oxidationszahlen des Eisens [2Fe3+, 2Fe2+] oder [1Fe3+, 3Fe2+] sein, bei HiPIP [3Fe3+, 1Fe2+] oder [2Fe3+, 2Fe2+].
Bakterielle Ferredoxine
Eine Art von Fe4S4 Ferredoxinen, die ursprünglich bei Bakterien gefunden wurde, wird „Bakterielle Art“ genannt. Bakterielle Ferredoxine können wiederum in weitere Untergruppen gegliedert werden, je nach vorliegender Aminosäurensequenz. Die meisten enthalten mindestens eine erhaltene Domäne, welche vier Cysteinreste beinhaltet, die an das [Fe4S4] Cluster binden. Bei dem Ferredoxin von Pyrococcus furiosus ist eine erhaltene Cysteindomäne durch Asparaginsäure ersetzt.
Während der Evolution der bakteriellen Ferredoxine kam es durch Genduplikationen und Genaustausch zum Auftreten von Proteinen mit mehreren Eisen-Schwefel-Zentren. In einigen bakteriellen Ferredoxinen hat eine der verdoppelten Domänen eine oder mehrere erhaltene Cysteinreste verloren. Diese Domänen haben dann entweder ihre Eisen-Schwefel bindende Eigenschaft verloren oder binden an einen [Fe3S4] Cluster, anstatt an einen [Fe4S4] Cluster. Mittlerweile sind die 3-D Raumstrukturen für einige bakterielle Ferredoxin Mono- und Dicluster bekannt. Die Faltung ist α und β, wobei 2-7-α-Windungen und vier β-Stränge eine fassähnliche Struktur ausbilden und eine durchgedrückte Schleife, die drei proximale Cystein Liganden des Eisen-Schwefel Clusters enthält.
High-potential Eisen-Schwefel-Proteine
High-potential Eisen-Schwefel-Proteine (HiPIPs) stellen eine eigene Familie der Fe4S4 Ferredoxine dar, die in der anaeroben Elektronentransportkette wirken. Einige HiPIPs verfügen über höhere Redoxpotentiale als irgendwelche anderen Eisen-Schwefel-Proteine (so hat das HiPIP von Rhodopila globiformis ein Redoxpotential von etwa 450 mV). Die Struktur einiger HiPIPs wurden inzwischen geklärt, ihre Faltungen sind auf α und β Faltungen zurückzuführen. Wie auch in anderen bakteriellen Ferredoxinen, nimmt auch hier der [Fe4S4] Cluster eine cubanähnliche Struktur an und ist durch vier Cysteinreste mit dem Protein verbunden.
Literatur
- K. M. Ewen, M. Kleser, R. Bernhardt: Adrenodoxin: the archetype of vertebrate-type [2Fe-2S] cluster ferredoxins. In: Biochimica et Biophysica Acta, Band 1814, Nummer 1, Januar 2011, S. 111–125, doi:10.1016/j.bbapap.2010.06.003, PMID 20538075.
- G. Hanke, P. Mulo: Plant type ferredoxins and ferredoxin-dependent metabolism. In: Plant, cell & environment. Band 36, Nummer 6, Juni 2013, S. 1071–1084, doi:10.1111/pce.12046, PMID 23190083.
- J. Meyer: Ferredoxins of the third kind. In: FEBS letters, Band 509, Nummer 1, November 2001, S. 1–5, PMID 11734195.
- M. Bruschi, F. Guerlesquin: Structure, function and evolution of bacterial ferredoxins. In: FEMS microbiology reviews, Band 4, Nummer 2, 1988 Apr–Jun, S. 155–175, PMID 3078742.
- S. Ciurli, F. Musiani: High potential iron-sulfur proteins and their role as soluble electron carriers in bacterial photosynthesis: tale of a discovery. In: Photosynth. Res.. 85, Nr. 1, 2005, S. 115–131. doi:10.1007/s11120-004-6556-4. PMID 15977063.
- K. Fukuyama: Structure and function of plant-type ferredoxins. In: Photosynth. Res.. 81, Nr. 3, 2004, S. 289–301. doi:10.1023/B:PRES.0000036882.19322.0a. PMID 16034533.
- A.V. Grinberg, F. Hannemann, B. Schiffler, J. Müller, U. Heinemann, R. Bernhardt: Adrenodoxin: structure, stability, and electron transfer properties. In: Proteins. 40, Nr. 4, 2000, S. 590–612. doi:10.1002/1097-0134(20000901)40:4<590::AID-PROT50>3.0.CO;2-P. PMID 10899784.
- H.M. Holden, B.L. Jacobson, J.K., Hurley, G. Tollin, B.H. Oh, L. Skjeldal, Y.K. Chae, H. Cheng, B. Xia, J.L. Markley: Structure-function studies of [2Fe-2S] ferredoxins. In: J. Bioenerg. Biomembr.. 26, Nr. 1, 1994, S. 67–88. doi:10.1007/BF00763220. PMID 8027024.
Weblinks
- Adrenodoxin. EBI-Datenbank
- HiPIPs. EBI-Datenbank
- Röntgenstruktur eines Ferredoxins von Aquifex aeolicus. rcsb.org
Einzelnachweise
- Adrenodoxin. In: Lexikon der Biologie. Spektrum der Wissenschaft, abgerufen am 13. September 2016.