Thioharnstoff
Thioharnstoff ist ein Derivat des Harnstoffs, dessen Sauerstoffatom durch ein Schwefelatom ersetzt ist.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
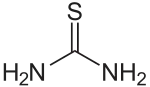 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thioharnstoff | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH4N2S | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 76,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,41 g·cm−3 bei 20 °C[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung[1] | |||||||||||||||
| Löslichkeit |
137 g·l−1 bei 20 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
nicht festgelegt[1] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−89,1 kJ/mol[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Thioharnstoff kann aus Ammoniumthiocyanat gewonnen werden, wobei die Auftrennung von Produkt und Edukt in der Gleichgewichtsreaktion schwierig ist.[4]

Die technische Synthese erfolgt durch das Einleiten von Schwefelwasserstoff und Kohlendioxid in eine wässrige Suspension von Calciumcyanamid.[4]
Eigenschaften
Physikalische Eigenschaften
Thioharnstoff bildet farblose und geruchlose Kristalle. Die Verbindung zeigt keinen scharfen Schmelzpunkt, da ab 153 °C eine Umlagerung zum Ammoniumthiocyanat erfolgt.[4] Die Literatur gibt Schmelzpunkte zwischen 167 °C und 182 °C an.[4] Thioharnstoff hat bei Raumtemperatur eine orthorhombische Kristallstruktur mit Raumgruppe Pnma (Raumgruppen-Nr. 62).[5] Das Kohlenstoff- und das Schwefelatom liegen auf einer Spiegelebene, sodass das Molekül die Punktgruppensymmetrie CS besitzt. Es ist beinahe planar und die Symmetrie somit näherungsweise C2v. Beim Abkühlen des Kristalls[6] oder bei hohem Druck[7] entstehen durch Fest-fest-Phasenübergänge Kristallstrukturen mit anderer Symmetrie.
Chemische Eigenschaften
Thioharnstoff ist eine organische Verbindung und ein Komplexbildner. Er tritt in zwei tautomeren Formen auf. In wässrigen Lösungen dominiert die Thionform:
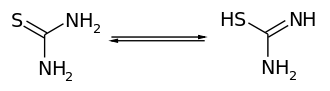
Verwendung
Im Jahr 1993 betrug die weltweite jährliche Produktion 10.000 Tonnen.[8] Als reine Verbindung wird Thioharnstoff hauptsächlich (25 % der Produktion) zur Extraktion von Metallen wie Gold und Silber aus Erzen eingesetzt. Außerdem wird er als Hilfsstoff in Diazo-Papier (16 % der Produktion) und als Katalysator zur Isomerisierung von Maleinsäure in Fumarsäure verwendet (12 % der Produktion). Als Reaktant dient Thioharnstoff vor allem zur Herstellung von Thioharnstoffdioxid (27,5 % der Produktion.[9]) Weitere wichtige Anwendungen sind:
- Als Glanzzusatz in galvanischen Bädern[10]
- In der Analytik zum Nachweis von Bismut (Gelbfärbung in salpetersaurer Lösung)[11]
- Additiv in Sprengstoffen (Sprengschlamm)[8]
- Metallveredelung (Kupferveredelung)[8]
- Metallreinigung (Silberreinigung)[8]
- Modifikation von Harzen[8]
- Herstellung von Hilfsstoffen für die Textil- und Farbenindustrie[8]
- Herstellung von chemischen Zwischenstufen[8]
- Umsetzen zu Thiobarbituraten (Barbiturate, Arzneimittel wie etwa Thiopental) mittels Diethylmalonsäureesterderivate
- Trennung von n-Alkanen und iso-Alkanen in der Harnstoff-Extraktiv-Kristallisation[12]
Biologische Bedeutung
Thioharnstoff kann die Enzyme Tyrosinase und Urease hemmen.
Sicherheitshinweise
Thioharnstoff ist als krebserregend, Kategorie 2 (Verdacht auf karzinogene Wirkung beim Menschen) und reproduktionstoxisch, Kategorie 2 (Kann vermutlich das Kind im Mutterleib schädigen) eingestuft.[1] Er kann nur sehr schwer mit normalen Abwasserreinigungsmethoden aus Abwässern entfernt werden.
Abgeleitete Verbindungen
- Thioharnstoffdioxid
- Thioharnstoffnitrat (CH5N3O3S)
- Propylen-thioharnstoff
- Thioharnstoff-Chelat
- Propylthiouracil
Siehe auch
Weblinks
Einzelnachweise
- Eintrag zu Thioharnstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Thioharnstoff im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- Mertschenk, B.; Knott, A.; Bauer, W.: Thiourea and Thiourea Derivatives, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; doi:10.1002/14356007.a26_803.pub3.
- M. R. Truter: Comparison of photographic and counter observations for the X-ray crystal structure analysis of thiourea. In: Acta Crystallographica. Band 22, Nr. 4, 1967, S. 556–559, doi:10.1107/S0365110X67001124.
- I. Takahashi, A. Onodera, Y. Shiozaki: Structural changes of thiourea in connection with its phase transitions: reappraisal of rigidity and libration of the molecule. In: Acta Crystallographica Section B. Band 46, Nr. 5, 1990, S. 661–664, doi:10.1107/S0108768190006012.
- T. Asahi, K. Hasebe, A. Onodera: Crystal Structure of the High Pressure Phase VI of Thiourea. In: Journal of the Physical Society of Japan. Band 69, 2000, S. 2895–2899, doi:10.1143/JPSJ.69.2895.
- Concise International Chemical Assessment Document (CICAD) für Thiourea, abgerufen am 9. Dezember 2014.
- Herwig Hulpke, Herbert A. Koch, Reinhard Nießner: RÖMPP Lexikon Umwelt, 2. Auflage, 2000. Georg Thieme Verlag, 2014, ISBN 3-13-179342-2, S. 795 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ullmanns Enzyklopädie: Ullmanns Enzyklopädie der technischen Chemie, Wiley Verlag.
- Jander/Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie, S. Hirzel-Verlag Stuttgart, 1985.
- Friedrich Asinger: Chemie und Technologie der Paraffinkohlenwasserstoffe. Akademie Verlag, 1956, S. 53–59.


