Oxidationszahl
Oxidationszahlen oder Oxidationsstufen (auch Oxidationszustand, elektrochemische Wertigkeit) sind das Ergebnis einer formalistischen Modellvorstellung vom Aufbau der Moleküle. Oxidationszahlen geben die hypothetischen Ionenladungen der Atome in einer chemischen Verbindung oder in einem mehratomigen Ion an für den hypothetischen Fall, dass die Verbindung bzw. das mehratomige Ion nur aus einatomigen Ionen aufgebaut ist, wobei gemeinsame Bindungselektronen dem Atom mit der höheren Elektronegativität zugerechnet werden.[1][2] Daraus folgt, dass die Summe der Oxidationszahlen aller Atome einer Verbindung oder eines mehratomigen Ions gleich der Ladung der Verbindung oder des Ions sein muss. Aufgrund ihrer Einfachheit, ihrer hohen Vorhersagekraft und ihrer breiten Anwendbarkeit hat diese Betrachtungsweise eine große Bedeutung für Chemiker. Als eine Art Buchhaltungssystem ermöglichen es Oxidationszahlen schnell und übersichtlich nachzuvollziehen, welche Atome der an einer Reaktion beteiligten Substanzen durch Aufnahme von Elektronen reduziert wurden bzw. welche Atome durch eine entsprechende Abgabe von Elektronen oxidiert wurden.[3]
Die einfach zu ermittelnden Oxidationszahlen sind in der anorganischen und organischen Chemie zum Verständnis von Redoxreaktionen wichtig und bei der Formulierung von Redoxgleichungen sehr hilfreich. Die höchst mögliche bzw. die niedrigst mögliche Oxidationszahl hat ein Atom in einer Verbindung oder in einem Ion dann erreicht, wenn es so viele Elektronen abgegeben bzw. aufgenommen hat, dass es die nächsthöhere bzw. nächstniedrigere Edelgaskonfiguration erreicht.[4] Eine Übersicht der möglichen Oxidationszahlen von chemischen Elementen findet sich in der Liste der Oxidationsstufen der chemischen Elemente. Die Ermittlung der Oxidationszahlen von Atomen in Verbindungen und Ionen, folgt einigen einfachen Regeln.
Angabe von Oxidationszahlen: Beispiele und Reaktionsgleichungen
Während tatsächliche Ionenladungen in Formeln als Ladungszahlen mit nachgestelltem + oder − geschrieben und hinter der Formel platziert werden, werden bei der Angabe von Oxidationszahlen in Formeln das + oder − als Vorzeichen dem Wert vorangestellt und oberhalb der Atomsymbole platziert. In Texten und Namensbezeichnungen können Oxidationszahlen sowohl mit arabischen als auch mit römischen Ziffern angegeben werden. Im Falle der Oxidationszahl null wird ±0 geschrieben.
Die Angabe der oxidation number ist wichtig bei der Nomenklatur von anorganischen Salzen, z. B. im Falle von Eisen(III)-chlorid und Eisen(II)-chlorid, und bei der Benennung von Metallkomplexen, bei denen die Oxidationszahl immer die Oxidationszahl des Zentralatoms angibt, z. B. im Falle von Kaliumhexacyanidoferrat(II) und Kaliumhexacyanidoferrat(III). Verwendet werden nur ganzzahlige Oxidationszahlen, die außer der Zahl 0 immer als römische Zahlen angegeben werden. Bei der Darstellung von Oxidationszahlen in Formeln werden sie meist als arabische Ziffern angegeben[5] und sind in der Regel ganzzahlig.
- Beispiele
Kaliumper-
manganatMangan-
dioxidSulfat-Ion Sulfit-Ion Ammoniak Ammonium
-IonSchwefel-
wasserstoffSauerstoff Eisen(II)-Ion
Bei der Formulierung von Redoxgleichungen werden üblicherweise nur die Oxidationszahlen der Atome angegeben, die oxidiert bzw. reduziert werden, weil sich die Oxidationszahlen der übrigen Atome nicht ändern. Die Anzahl der ausgetauschten Elektronen muss bei der Überprüfung der Ladungsbilanz einer Redoxgleichung berücksichtigt werden. Sie muss zwingend genau so groß sein wie die Differenz der beiden Oxidationszahlen. Die Atombilanzen müssen ausgeglichen werden durch die im Reaktionsmedium vorhandene Begleitsubstanzen, wie z. B. Wasser H2O und Säure (Hydroxoniumionen H3O+) oder Base (Hydoxylionen OH-). Als Endkontrolle muss dann auch die Ladungsbilanz der Reaktionsgleichung stimmen.
- Beispiel: Zwei Teilreaktionen von Redoxreaktionen mit dem Permanganat-Anion als Oxidationsmittel, das unterschiedlich reduziert wird, entweder in saurer Lösung, oder in basischer Lösung.
Eine stöchiometrisch ablaufende Redoxreaktion ist z. B. die Tollensprobe, bei der Acetaldehyd mit Ag+ zu Essigsäure oxidiert wird und elementares Ag entsteht.
Bei stöchiometrisch richtig aufgestellten Redoxreaktionen ist die Summe der Oxidationszahlen der Edukte gleich der Summe der Oxidationszahlen der Produkte.[Anm. 1]
Bedeutung und Nutzen
Die Oxidationszahl eines Atoms kann der formalen Beschreibung der Elektronendichte bei einem Atom dienen, wobei eine positive Oxidationszahl eine verringerte Elektronendichte (gegenüber dem Zustand im Element) und eine negative Oxidationszahl eine erhöhte Elektronendichte anzeigt. Als rein formale Größe korreliert die Oxidationszahl jedoch nur schlecht mit der tatsächlichen Elektronendichte- beziehungsweise Ladungsverteilung.
Oxidationszahlen haben eine große Bedeutung bei der sachgerechten Formulierung und Bestimmung der Stöchiometrie von Redoxreaktionen. Sie dienen dazu, die unterschiedlichen Oxidationsstufen und ihre Veränderungen bei Redoxreaktionen darzustellen und die Anzahl der ausgetauschten Elektronen zu ermitteln. Eine Erniedrigung der Oxidationszahl einer Atomsorte bei einer Redoxreaktion bedeutet, dass diese Atomsorte reduziert wurde; analog bedeutet eine Erhöhung der Oxidationszahl einer Atomsorte, dass diese Atomsorte oxidiert wurde.
Nach IUPAC können die Bezeichnungen oxidation state[1] und oxidation number[6] verwendet werden. Die Bezeichnung oxidation state (Oxidationszustand) entspricht in ihrer Bedeutung der Oxidationszahl und wird in der organischen Chemie häufig benutzt, um verschiedene Substanzklassen hinsichtlich ihres Oxidationszustandes zu vergleichen, z. B. mit den folgenden Aussagen: Carbonsäuren sind im gleichen Oxidationszustand wie Carbonsäureester und andere strukturell vergleichbare Derivate von Carbonsäuren wie z. B. auch Carbonsäurechloride. Carbonsäuren und ihre Derivate sind aber in einem höheren Oxidationszustand als Aldehyde und Alkohole und in einem niedrigeren Oxidationszustand als das Kohlendioxid.[7]
- Durch den Vergleich von Oxidationszahlen lässt sich schnell erkennen, dass die Umsetzung eines primären Alkohols zu einem Aldehyd und auch die Umsetzung eines Aldehyds zu einer Carbonsäure beides Oxidationen sind.
Ethanol Acetaldehyd Essigsäure - Bei verschiedenen Kohlenwasserstoffen werden die unterschiedlichen Oxidationszustände der C-Atome deutlich.
Methan Ethan Propan Propen
Besondere Oxidationszahlen
Oxidationszahlen können auch gebrochene Werte annehmen. So haben z. B. im Hyperoxid KO2 (Kaliumhyperoxid) beide Sauerstoffatome die Oxidationszahl −0,5. Ihr Oxidationszustand unterscheidet sich vom Oxidationszustand der Sauerstoffatome in normalen Peroxiden, die das Peroxidanion O22− bzw. die Peroxygruppe –O–O– enthalten, mit Sauerstoff im Oxidationszustand −1.
Im Fe3O4 (Eisen(II,III)-oxid) hat Eisen eine durchschnittliche Oxidationszahl von +8/3. Die im Namen in römischen Zahlen aufgeführten Oxidationsstufen deuten darauf hin, dass Eisenatome in dieser Verbindung in den Oxidationszuständen +2 und +3 vorliegen. FeIIFe2IIIO4 hat eine inverse Spinellstruktur (Vereinfacht: FeO·Fe2O3) und formale Fe2+- und Fe3+-Ionen können lokalisiert werden.
Aus der Summenformel des Thiosulfat-Anions (S2O32−) berechnet sich eine durchschnittliche Oxidationszahl von + 2 für Schwefel. Jedoch zeigt die Struktur des Anions, dass es sich um zwei Schwefelatome in völlig unterschiedlichen Bindungsverhältnissen handelt, mit den unterschiedlichen Oxidationszuständen +5 und −1, wie es sich aus der Struktur ableiten lässt. Für stöchiometrische Berechnungen und zur Formulierung von Redoxreaktionen eignen sich die mittlere und die beiden diskreten Oxidationsstufen. Das Thiosulfat-Anion darf nicht mit dem Disulfat-Anion verwechselt werden, in dem die S-Atome wie im normalen Sulfat-Anion im höchstmöglichen Oxidationszustand +6 vorliegen.
Kalium-peroxid Kalium-hyperoxid Eisen(II,III)-oxid
mit diskreten OxidationsstufenEisen(II,III)-oxid
mit mittlerer OxidationsstufeThiosulfat-Ion
mit mittlerer OxidationsstufeThiosulfat-Ion
mit diskreten Oxidationsstufen
Die niedrigste bekannte Oxidationsstufe eines Atoms in einem Molekül ist −4 (bei Elementen der Kohlenstoffgruppe), die höchste +9 (in [IrO4]+ bei Iridium).[8][9]
Ermittlung von Oxidationszahlen
Hauptregeln
Oxidationszahlen in Elementen, anorganischen und organischen, neutralen oder ionischen Verbindungen lassen sich mit Hilfe folgender Regeln ermitteln bzw. nach der Ermittlung überprüfen:
- Die Summe der Oxidationszahlen aller Atome einer neutralen oder geladenen Verbindung muss genau so groß sein wie die Ladung der Verbindung. Daraus ergeben sich bereits die folgenden Regeln.
- Atome in atomaren und molekularen Elementen haben im elementaren Zustand immer die Oxidationszahl 0. Beispiele: Li, Mg, B, C, O2, P4, S8, I2, Ar. Die Oxidationszahl 0 kann sich aber auch bei der Ermittlung ergeben für Atome in Verbindungen mit anderen Elementen (Beispiel für C s. unten).
- Bei einatomigen Ionen entspricht die Oxidationszahl der Ionenladung. Z. B. hat im Kation Cu2+ das Kupfer die Oxidationszahl +2. Im Anion Cl- hat das Chlor die Oxidationszahl −1.
- Die Summe der Oxidationszahlen aller Atome einer mehratomigen neutralen Verbindung ist gleich 0.
- Die Summe der Oxidationszahlen aller Atome in einem mehratomigen Ion muss gleich der Gesamtladung des Ions sein.
- Bei den mit kovalenten Bindungen formulierten organischen Verbindungen kann in den Valenzstrichformeln (Lewis-Formeln) die Verbindung anhand der Elektronegativität formal in Ionen so aufgeteilt werden, dass die Oxidationszahlen aller Atome ermittelt werden können. Dabei wird bei der formalen Aufteilung angenommen, dass die an einer Bindung beteiligten Elektronen vom elektronegativeren Atom vollständig übernommen werden (Beispiel s. unten)
Hilfreiche ergänzende Hinweise
- Die meisten Elemente können in mehreren Oxidationsstufen auftreten.
- Die höchstmögliche Oxidationszahl eines Elementes entspricht der Haupt- bzw. Nebengruppenzahl im Periodensystem (PSE).
- Das Fluoratom (F) als Element mit der höchsten Elektronegativität hat in allen Verbindungen immer die Oxidationszahl −1.
- Sauerstoff als Element sehr hoher Elektronegativität hat in fast allen Verbindungen die Oxidationszahl −2. Es gibt aber drei wichtige Ausnahmen: In Peroxiden haben die O-Atome die Oxidationszahl −1 und in Hyperoxiden die Oxidationszahl −0,5. In der Verbindung mit Fluor (Sauerstoffdifluorid) hat Sauerstoff die Oxidationszahl +2.
- Außer Fluor haben die anderen Halogenatome Chlor, Brom und Iod in organischen Verbindungen immer und in anorganischen Verbindungen meistens die Oxidationszahl −1. Es gibt aber viele Ausnahmen, wie die Verbindungen mit Sauerstoff (Halogenoxide) oder Verbindungen untereinander Interhalogenverbindungen mit einem Halogen, das im Periodensystem höher steht.
- Metallatome haben in ionischen Verbindungen immer eine positive Oxidationszahl.
- Alkalimetalle haben stets die Oxidationszahl +1 und Erdalkalimetalle stets die Oxidationszahl +2.
- Wasserstoffatome haben stets die Oxidationszahl +1, außer wenn Wasserstoff mit „elektropositiveren“ Atomen wie den Metallen (Hydride) verbunden ist.
- Experimentell können Oxidationsstufen an Oberflächen beispielsweise mit der Photoelektronenspektroskopie (XPS) untersucht werden. Der Oxidationszustand zeigt sich dabei durch eine charakteristische Verschiebung der Hauptlinie des jeweiligen Elementes[10][11].
Ermittlung durch Aufteilung anhand der Elektronegativität
Zur Bestimmung der Oxidationszahlen in einer Verbindung werden bindende Elektronenpaare gedanklich dem elektronegativeren Bindungspartner zugewiesen (formale heterolytische Spaltung). Bindende Elektronenpaare zwischen gleichen Atomen werden geteilt (formale homolytische Spaltung). Die Atome in Modifikationen der Elemente haben damit die Oxidationszahl null.
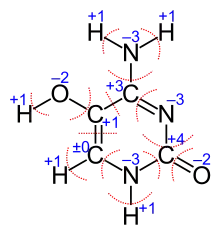
Wenn eine Lewis-Formel des Moleküls vorliegt, lassen sich Oxidationszahlen in organischen Verbindungen anhand der Elektronegativitäten der an den Bindungen beteiligten Elemente bestimmen. Dabei gilt für die an einer Bindung beteiligten Atome die Regel: dem Atom mit der größeren Elektronegativität werden die Bindungselektronen zugeordnet. Bei gleicher Elektronegativität erfolgt Aufteilung.
Die Grafik rechts zeigt beispielhaft das Vorgehen beim Ermitteln der Oxidationszahlen der Atome des 5-Hydroxycytosin-Moleküls. Als Beispiel wird die Vorgehensweise am Kohlenstoff-Atom mit der Oxidationszahl ±0 erläutert. Dieses Kohlenstoffatom bildet drei Bindungen zu Nachbaratomen aus, zu Stickstoff und Wasserstoff jeweils Einfachbindungen und zum benachbarten Kohlenstoffatom eine Doppelbindung. Der Vergleich der Elektronegativitäten der an den Bindungen beteiligten Elemente ergibt:
- Kohlenstoff hat eine Elektronegativität von 2,55. Stickstoff hat eine höhere Elektronegativität von 3,04 und deshalb werden dem Stickstoff beide Bindungselektronen zugeordnet.
- Wasserstoff mit einer Elektronegativität von 2,2 hat eine niedrigere Elektronegativität als Kohlenstoff. Deshalb werden beide Bindungselektronen dem Kohlenstoff zugeordnet.
- Das obere C-Atom hat die gleiche Elektronegativität wie das untere C-Atom und daher teilen sich die beiden Kohlenstoffatome die an der Bindung beteiligten Bindungselektronen. Da es sich um eine Doppelbindung handelt, erhielten beide C-Atome zwei Elektronen.
- Addiert man die dem unteren C-Atom zugeordneten Elektronen hat dieses Kohlenstoffatom also vier Bindungselektronen. Da Kohlenstoff als Element ebenfalls vier Bindungselektronen hat, hat sich seine Ladung durch die imaginäre Zuordnung also nicht geändert. Seine Oxidationszahl ist demnach: 0.
Im Vergleich dazu bekommt das unterste Stickstoffatom sechs Bindungselektronen bei der imaginären Zuordnung (je zwei von den beiden C-Atomen und zwei von dem Wasserstoffatom). Stickstoff als Element besitzt aber nur drei Bindungselektronen. Da Elektronen negativ geladen sind, besäße das Stickstoffatom daher nach der imaginären Zuordnung die Ladung −3 und dies ist auch seine Oxidationszahl.
Zur Überprüfung müssen alle auf diese Weise ermittelten Oxidationszahlen addiert werden. Ihre Summe muss Null ergeben, wenn das Gesamtmolekül ungeladen ist bzw. muss mit der Ladung übereinstimmen, wenn das Gesamtmolekül ein geladenes Ion ist.
Anmerkungen
- Die Aussage ist anhand von Redoxgleichungen, die nicht für jedes Atom Oxidationszahlen zeigen, nur mühsam kontrollierbar, weil auch noch die stöchiometrischen Koeffizienten berücksichtigt werden müssen. Die Aussage entspricht aber der einfach zu überprüfenden Grundregel, dass eine stöchiometrisch richtig aufgestellte Redoxreaktionsgleichung eine ausgeglichene Landungsbilanz haben muss
Einzelnachweise
- Eintrag zu Oxidation state. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.O04365 – Version: 2.3..
- Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.
- Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten: Chemie. Die zentrale Wissenschaft. Pearson Studium, 2007, ISBN 978-3-8273-7191-1, S. 164–167.
- Brown, Le May: Chemie, ein Lehrbuch für alle Naturwissenschaftler. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26241-5, S. 781 ff.
- Karl-Heinz Lautenschläger, Werner Schröter, Joachim Teschner, Hildegard Bibrack, Taschenbuch der Chemie, 18. Auflage, Harri Deutsch, Frankfurt (Main), 2001.
- Eintrag zu Oxidation number. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.O04363 – Version: 2.3..
- Clayden, Greeves Warren, Wothers: Organic Chemistry. Oxford University Press Inc, New York 2001, ISBN 978-0-19-850346-0, S. 35 f.
- Guanjun Wang, Mingfei Zhou, James T. Goettel, Gary G. Schrobilgen, Jing Su, Jun Li, Tobias Schlöder, Sebastian Riedel: Identification of an iridium-containing compound with a formal oxidation state of IX. In: Nature. 514, 21. August 2014, S. 475–477. doi:10.1038/nature13795.
- Steve Ritter: Iridium Dressed To The Nines – Periodic Table: IrO4+ is the first molecule with an element in the +9 oxidation state, Chemical & Engineering News, 2014.
- XPS Labor Analyse von Oxidationszustaenden - nanoAnalytics. Abgerufen am 16. November 2020.
- Photoelektronenspektroskopie | Arbeitsgruppe Prof. Dr. Tobias Reich. Abgerufen am 16. November 2020.
