Legierung
Eine Legierung (von lateinisch ligare ‚binden, vereinen‘) ist in der Metallurgie ein makroskopisch homogener metallischer Werkstoff aus mindestens zwei Elementen (Komponenten), von denen mindestens eins ein Metall ist und die gemeinsam das metalltypische Merkmal der Metallbindung aufweisen.[1] Aus chemischer Sicht gibt es Legierungen, die Gemische darstellen, und intermetallische Verbindungen mit definiertem stöchiometrischem Verhältnis der beteiligten Metalle. Im Allgemeinen haben Legierungen zudem einen kristallinen Aufbau. Es gibt jedoch auch amorphe metallische Gläser.
Je nach Art der Legierungsbildung kann eine Legierung auf mikroskopischer Ebene homogen oder heterogen sein. Legierungen, die ausschließlich Mischkristalle oder ausschließlich intermetallische Verbindungen bilden, sind homogen. Alle anderen, die aus mehreren Phasen bestehen, sind heterogen.[2]
Das Verhalten der Elemente in einer Legierung und ihr Einfluss auf deren Eigenschaften sind in der Regel von drei Faktoren abhängig: Art und Anzahl der Legierungspartner, ihrem Massenanteil an der Legierung sowie der Temperatur. Diese Faktoren bestimmen die jeweilige Aufnahmefähigkeit, das heißt Löslichkeit des einen Elementes im anderen und ob die Legierungspartner Mischkristalle oder Gemische aus reinen Kristallen (auch Kristallgemische) der jeweiligen Legierungskomponenten bilden.
Das Zeitwort legieren stammt ursprünglich vom lateinischen ligare und bedeutet zusammenbinden, verbinden oder auch vereinigen. Im 17. Jahrhundert wurde das inzwischen leicht abgewandelte legare (mit derselben Bedeutung) ins Deutsche übernommen.[3]
Eigenschaften
Das Legierungselement kann mit dem Grundelement eine feste Lösung bilden (einphasige Legierung) oder es bilden sich mehrere Phasen. Während bei einphasigen Legierungen die Eigenschaften im Wesentlichen durch die chemische Zusammensetzung bestimmt werden, werden diese bei mehrphasigen Legierungen zusätzlich maßgeblich durch die Verteilung der Phasen (Gefüge) beeinflusst. Basismetall und Legierungselemente werden auch Komponenten einer Legierung genannt. In der Liste der Legierungselemente werden sie und ihre Wirkungen auf die jeweiligen Basismetalle aufgeführt. Mischkristalle weisen eine höhere Härte und Zugfestigkeit, jedoch eine geringere Schmelztemperatur als das Basismetall auf. Bei Metallen sinkt zudem die elektrische Leitfähigkeit. Für die relativ weichen, reinen Metalle ist die Mischkristallverfestigung eine von vier möglichen festigkeitssteigernden Vorgängen, um einen harten Werkstoff herzustellen.
Mit der Erstarrung einer vergossenen Legierung ist die Kristallisation nicht in jedem Fall abgeschlossen. Bestimmte Legierungen können auch noch als Gussstück – kalt ausgelagert, oder erwärmt – („angelassen“) ihre mechanischen Eigenschaften (Bruchfestigkeit, Härte, Dehnung) verbessern. Bei Knetlegierungen ist die das Gefüge verfestigende Umkristallisation durch Kaltauslagerung oder Warmbehandlung sogar Voraussetzung für die Fertigung von Halbzeug.
Beispiele für „natürliche Legierungen“ sind Elektrum, eine Gold-Silber-Legierung, und Stibarsen, eine Antimon-Arsen-Legierung.
Bei „künstlich hergestellten Legierungen“ unterscheidet man solche, die bewusst hergestellt wurden, um Werkstoffeigenschaften (Beispiele Härte, Korrosionsbeständigkeit) der „Basismetalle“ auf die gewünschte Weise zu ändern, und solche, die unbeabsichtigt entstehen, weil Fremdstoffe (Metallurgie) bereits durch die Herstellung in die Legierung gelangen und negative Wirkungen auf die Werkstoffeigenschaften ausüben können. Beispiele für Letzteres sind unter anderem Bismut und/oder Arsen in Messingen, ebenso Bismut in AlSi-Legierungen, wo es die Gefügeausbildung stark beeinträchtigt.
Geschichte
Kupfer, Zinn und Bronze

Kupfer ist eines der ersten von Menschen genutzten Metalle; es wurde wohl vor etwa 6000 bis 10000 Jahren zufällig in unter Luftzufuhr besonders heiß brennenden Holzkohlefeuern entdeckt. Es gab der Kupfersteinzeit ihren Namen. Bei einem Schmelzpunkt von 1083 °C kann es aus Kupferadern im Gestein in flüssiger Form austreten. Durch Erhitzung kupferhaltiger, oxidischer Erze kann Kupfer hingegen nur bei reduzierender Feuerung, also in Gegenwart von Holzkohle, gewonnen werden. Zinn (Schmelzpunkt 232 °C) wurde vor ca. 5000 Jahren entdeckt.[4]
Bronze als Legierung aus Kupfer und Zinn (CuSn) ist vorgeschichtlich seit ca. 3300 v. Chr. in Palästina nachgewiesen. Bronze ist härter und schnitthaltiger als Kupfer und gab der Bronzezeit (etwa 2200 bis 800 v. Chr.) ihren Namen. Gebrauchsgegenstände, Werkzeug, Waffen und Schmuck wurden aus Bronze hergestellt.[5] Glocken werden bis heute aus Bronze gegossen; ebenso viele Plastiken.
Messing

Messing ist eine Legierung aus Kupfer und Zink (CuZn, Schmelzpunkt 420 °C). Zink wurde, meist in Form des Zinkcarbonats „Galmei“ (Smithsonit), seit der Bronzezeit um etwa 3000 v. Chr. in Babylon und Assyrien verwendet, in Palästina etwa 1400 bis 1000 v. Chr.[6] Messing war lange Zeit ein wichtiges Münzmetall bei der Münzprägung. Es wurde und wird wegen seines goldenen Glanzes auch zur Herstellung von Schmuck und Plastiken verwendet. Je höher der Zinkgehalt ist, desto heller ist sein Farbton.
Eisenlegierungen

Eisen-Legierungen wurden bereits in prähistorischer Zeit verwendet, allerdings nur aus Meteoriten, in denen sich häufig die Legierung Eisen-Nickel (FeNi) befindet. Da Meteoriten selten gefunden wurden, waren Gegenstände aus Eisen entsprechend wertvoll. Die Sumerer nannten es „Himmelsmetall“, die alten Ägypter „schwarzes Kupfer vom Himmel“.[7] Verhüttetes Eisen (Erkennung durch Fehlen von Nickel) wurde in Mesopotamien, Anatolien und Ägypten gefunden und ist etwa 3000 bis 2000 v. Chr. entstanden. Es war wertvoller als Gold und wurde vor allem für zeremonielle Zwecke verwendet. Eisen ist härter als Bronze und Kupfer, was in vielen Anwendungsfällen wichtig war und ist. Verbesserungen in der Eisengewinnung und -verarbeitung ließen die Menschen dazu übergehen, Waffen und Werkzeuge wie Pflüge aus Eisen zu fertigen (siehe auch Geschichte der Produktionstechnik). Die Bronzezeit ging zu Ende und die Eisenzeit begann.
Einteilung
Je nach Anzahl der Komponenten in der Legierung spricht man von einer Zwei-, Drei-, Vier- oder Mehrstofflegierung (binäre, ternäre, quaternäre oder polynäre Legierung), wobei nur diejenigen Komponenten gezählt werden, die die charakteristischen Eigenschaften bestimmen. Da Eisen und Stahl in der Technik von besonderer Bedeutung sind, werden Legierungen in Eisen- und Nichteisen-Legierungen unterteilt. Weitere Einteilungen ergeben sich durch die Art der Legierungsbildung, da diese nicht nur durch Zusammenschmelzen der Komponenten entstehen oder auch durch besondere Fähigkeiten von Legierungen.
- Natürliche Legierungen entstehen durch Hitzeeinwirkung und Aufschmelzen von Elementen zum Beispiel im Inneren von Himmelskörpern. Da diese Legierungen nicht von Menschen gesteuert wurden, unterliegen sie auch nicht deren definierten Zusammensetzungen und Eigenschaften.
- Eisenlegierungen werden in Gusseisen und Stahl unterteilt. Die Unterscheidung beruht auf dem Gehalt an Kohlenstoff. Siehe Hauptartikel Eisen-Kohlenstoff-Diagramm. Besondere Bedeutung haben die Edelstähle: legierte oder unlegierte Stähle mit besonderem Reinheitsgrad.
- Nichteisen-Legierungen (NE-Legierungen; Beispiel Bronze, Messing, Amalgame, Weißgold, Rotgold) sind Legierungen auf der Basis von Nichteisenmetallen.
- Diffusionslegierungen entstehen durch die Diffusion von Atomen ins Kristallgitter der Basismetalle. Besonders die ersten Elemente im Periodensystem sind wegen der Kleinheit ihrer Atome gegenüber dem Basismetall in der Lage, in dessen Kristallgitter einzuwandern. Das beste Beispiel für eine Diffusionslegierung ist das Aufkohlen von Werkstücken, um sie härten zu können (s. Tempern).
- Heuslersche Legierungen sind sehr spezielle ferromagnetische Legierungen, die kein Eisen, Kobalt oder Nickel enthalten (Beispiel Cu2AlMn).
- Formgedächtnis-Legierungen sind Metalle, die nach einer Verformung durch Hitzeeinwirkung zu ihrer Ursprungsform zurückkehren.
- Gusslegierungen dienen direkter Formgebung.
- Knetlegierungen sind als „Halbzeug“ ein Zwischenprodukt, das zu weiterer walzender, pressender oder ziehender Umformung bestimmt ist.
- Pseudolegierungen nennt man die durch Sintern (Zusammenpressen verschiedener, innig vermengter Metallpulver bei hoher Temperatur) entstandenen Werkstücke. Mit diesem Verfahren lassen sich auch Elemente mischen, die sich im schmelzflüssigen Zustand nicht ineinander lösen würden. Viele Wolfram-Legierungen werden z. B. so hergestellt.
Legierungsformel
Zur Kennzeichnung einer Legierung wird meist zuerst das Basismetall genannt, dahinter folgen der oder die wichtigsten Bestandteile als Kürzel für das Metall mit angehängter Zahl, die den jeweiligen Prozentanteil (Massenprozent) wiedergibt. Eine Legierung CuZn37 (frühere Bezeichnung Messing 63) besteht aus der Kupferbasis, der 37 % Zink zugefügt wurden. Bei der Eisen-Kohlenstoff-Legierung Stahl gibt es je nach Menge der Legierungselemente Abweichungen von diesem System. Das Eisen wird jedenfalls nie ausdrücklich genannt. Der Stahl C37 beispielsweise enthält 0,37 % Kohlenstoff und sonst Eisen.
Die Angabe von Legierungsanteilen ist unter anderem durch die DIN 1310 Zusammensetzung von Mischphasen (Gasgemisch, Lösungen, Mischkristall); Grundbegriffe geregelt.
Zustandsschaubild (Zustandsdiagramm, Phasendiagramm)
Durch Kristallisations-Versuchsreihen mit verschiedenen Legierungen unterschiedlicher Zusammensetzung bei der Thermischen Analyse werden die Kristallisations- bzw. Kristallumwandlungspunkte aufgezeichnet und in ein Temperatur-Zusammensetzungs-Diagramm eingetragen, wobei die Temperatur in Abhängigkeit zur Legierungszusammensetzung steht.
Für Zweistoffsysteme haben sich dabei vor allem in Hinsicht auf das Kristallsystem drei typische Formen von Zustandsschaubildern ergeben:
Zweistoffsysteme mit vollständiger Löslichkeit im festen Zustand
Bei vollständiger Löslichkeit im festen Zustand bilden sich in jeder Zusammensetzung Mischkristalle. Es gibt zwei Möglichkeiten der Mischkristallbildung (MK), Einlagerungs- und Substitutionsmischkristall. Typische Substitutions-MK-Bildner sind die Legierungen Eisen-Chrom, Eisen-Nickel, Gold-Kupfer, Gold-Silber und Kupfer-Nickel. Ein wichtiger Einlagerungs-MK-Bildner ist Austenit (γ-Eisen-Kohlenstoff).
Damit eine Legierung in jeder Zusammensetzung Mischkristalle mit vollkommener Löslichkeit im festen Zustand bilden kann, sind folgende Voraussetzungen nötig:
- Beide Metalle müssen das gleiche Kristallsystem aufweisen (beispielsweise kubisch).
- Die Gitterkonstanten dürfen sich um maximal etwa 15 % unterscheiden.
- Die beiden Metalle müssen eine „gewisse chemische Ähnlichkeit“ haben.
- Die Elektronegativitätsdifferenz darf „nicht zu groß“ sein.
Durch die Mischkristallbildung wird auch bei noch so großer Ähnlichkeit der Legierungselemente immer das Kristallgitter verzerrt, da die verschiedenen Elemente auch verschiedene Atomdurchmesser besitzen. Dadurch entstehen Spannungen; die Gleitebenen der Kristallite werden dabei behindert, Verformungen nachzugeben. Die Gitterverzerrung erhöht also die Härte.
Ein beliebtes Beispiel für eine Legierung mit vollkommener Löslichkeit im festen Zustand ist das Zweistoffsystem Cu-Ni.
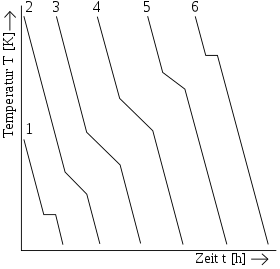 |
 |
| Abkühlkurven und Zustandsschaubild einer Legierung verschiedener Zusammensetzung mit Mischkristallbildung | |
Die Legierungen (Kurven 2–5) erstarren im Gegensatz zu den Basismetallen (Kurven 1,6) nicht bei einer festen Temperatur, sondern in einem Haltebereich. Die Temperatur bleibt also nicht konstant, sondern sinkt langsam. Die Haltebereiche verschiedener Zusammensetzungen einer Legierung liegen jedoch immer zwischen den jeweiligen Erstarrungstemperaturen ihrer reinen Komponenten.
Ursache dafür ist die „Behinderung“ der Kristallisation in einer Legierung durch Komponente A (Kurve 1), die, wenn sie könnte, bei noch tieferer Temperatur erstarren würde. Komponente B dagegen „drängt“ auf Erstarrung, die eigentlich schon eher hätte beginnen müssen. Diese Tatsache ist auch der Grund dafür, dass die während der Erstarrung entstehenden Kristalle ihr Mischungsverhältnis ändern und erst bei genügend langsamer Abkühlung (Thermisches Gleichgewicht) bis zum Ende der Erstarrung das gewünschte Mischungsverhältnis durch Diffusion erreicht wird.
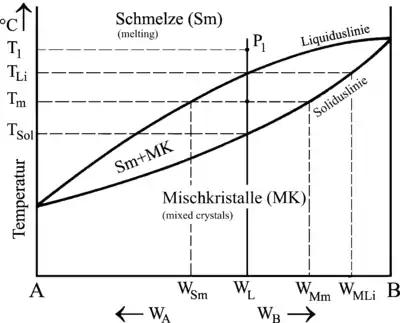
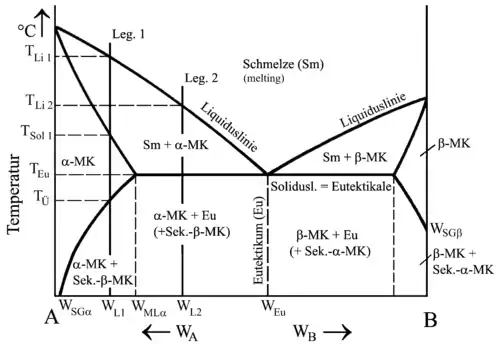
Ablesen lassen sich diese Zusammensetzungen am Zustandsschaubild, indem man durch jeden beliebigen Punkt an der ausgewählten Legierung (Bild WL) eine Waagerechte bis zur Soliduslinie zieht. Bei der Liquidustemperatur TLi (Beginn der Erstarrung) besitzen die ersten Kristalle also eine Zusammensetzung von WMLi. Auch die jeweilige Zusammensetzung der Restschmelze lässt sich auf diese Weise ermitteln, indem man zum Beispiel bei Tm die Waagerechte bis zur Liquiduslinie durchzieht. Die Schmelze hätte also an diesem Punkt die Zusammensetzung WSm und die Mischkristalle die Zusammensetzung WMm.
Mit Hilfe des Zustandsschaubildes und des Hebelgesetzes lässt sich auch berechnen, wie hoch bei jeder Zwischentemperatur der Anteil an Schmelze bzw. der Anteil an Mischkristallen ist:
|
|
MS = Anteil Schmelze |
Zweistoffsysteme mit vollständiger Unlöslichkeit im festen Zustand
Legierungen dieser Art sind zwar in der Schmelze ineinander gelöst, entmischen sich jedoch während der Kristallisation vollständig. Es entsteht ein Kristallgemisch der reinen Komponenten (siehe Gefügeschliffbilder-Eutektikum).
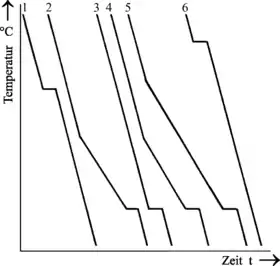 |
 |
| Abkühlkurven und Zustandsschaubild einer Legierung verschiedener Zusammensetzung bei getrennter Kristallbildung | |
Auch bei getrennter Kristallbildung erstarren die Legierungen 2, 4 und 5 zunächst in einem Haltebereich. Gegen Ende der Erstarrung beschreiben die Temperaturkurven allerdings einen Haltepunkt ähnlich dem eines reinen Metalls. Legierung 3 erstarrt sogar ausschließlich in einem Haltepunkt.
Der Grund für dieses Verhalten liegt in der starken, gegenseitigen Behinderung der beiden Komponenten, die sich während der Kristallisation entmischen, um Kristalle der eigenen Art bilden zu können. Das Maximum an gegenseitiger Störung liegt demnach bei Legierung 3, bei der sich im Erstarrungspunkt gleichzeitig Kristalle der Komponenten A und B bilden. Bedingt durch die anhaltende, gegenseitige Behinderung beim Entmischen und der tiefen Temperatur sind die Wege der Atome allerdings sehr klein und das Kristallgemisch daher sehr feinkörnig.
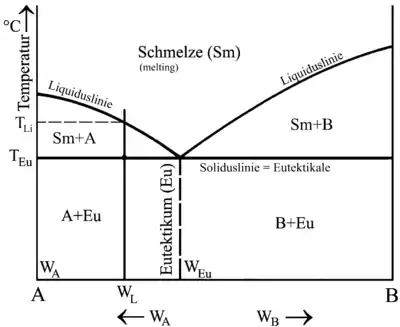
Dieser Besonderheit wegen erhält Legierung 3 den Namen Eutektische Legierung (= Das Feine; Das Wohlgebaute). Die allen Legierungen gemeinsame Soliduslinie wird entsprechend Eutektikale genannt und die dazugehörige Temperatur eutektische Temperatur (TEu).
Ein herausragendes Beispiel für eine eutektische Legierung mit besonders tiefem Schmelzpunkt ist die Wood’sche Legierung, deren Schmelzpunkt bei 70 °C liegt.
Bei Legierungen, die entweder links (= untereutektisch) oder rechts (= übereutektisch) vom Eutektikum liegen, erstarren zunächst Primärkristalle der Komponente A bzw. Primärkristalle der Komponente B. Der Anteil an Primärkristallen in einer Legierung lässt sich mithilfe des Zustandsschaubildes errechnen. Die Berechnung setzt dabei am Punkt TEu an, also an der Stelle, an der die Restschmelze gerade eben die eutektische Zusammensetzung erreicht:
| MEu = Anteil Restschmelze eutektischer Zusammensetzung = Anteil des Eutektikums MPr = Anteil Primärkristalle |
Zweistoffsysteme mit begrenzter Löslichkeit im festen Zustand
Legierungen dieser Art können zwar Mischkristalle bilden, jedoch nicht in jeder Zusammensetzung. Im Gegensatz zu Legierungen mit vollkommener Löslichkeit unterscheiden sich hier die Atomgrößen stärker, was bedeutet, dass die Gitterverzerrungen ab einer gewissen Zusammensetzung unerträglich werden. Auch das Kristallsystem kann ein Hindernis sein, wenn sich die Legierungselemente im Kristallsystem zwar ähnlich, aber nicht gleich sind.
So kann zum Beispiel jede Komponente in der Legierung Blei (kubisch-flächenzentriert) – Zinn (tetragonal-raumzentriert) mit der anderen in begrenztem Maße Austausch-Mischkristalle bilden.
Typische MK-Bildner begrenzter Löslichkeit: Aluminium-Magnesium, Blei-Zinn, Kupfer-Aluminium, Kupfer-Zink, Kupfer-Zinn, Zink-Aluminium
Begrenzte Löslichkeit im festen Zustand heißt aber nicht nur, dass die eine Komponente beim Kristallisieren bis zu einem gewissen Prozentsatz Atome der anderen Komponente aufnehmen kann, sondern auch, dass die Löslichkeit bei sinkender Temperatur abnimmt. Da die Bewegungsenergie der Atome geringer wird, schrumpft natürlich auch entsprechend die Gitterkonstante des vorliegenden Kristallsystems, und es bietet Fremdatomen weniger Platz. Die Folge davon ist, dass die Mischkristalle ab der Übergangstemperatur TÜ beginnen, sich zu entmischen.
Genau diese Eigenschaft – teilweise Entmischung der Komponenten durch abnehmende Löslichkeit bei tieferen Temperaturen – wird beim Härten einer solchen Legierung ausgenutzt. Man spricht hierbei auch von der Ausscheidungshärtung.
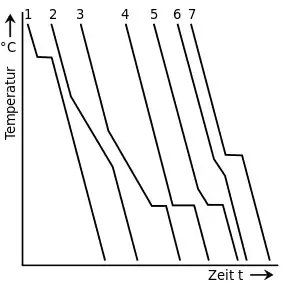 |
 |
| Abkühlkurven und Zustandsschaubild einer Legierung verschiedener Zusammensetzung mit Mischkristallbildung begrenzter Löslichkeit im festen Zustand | |
Legierung 1 erstarrt somit von TLi 1 bis TSol 1 zu Mischkristallen mit dem Kristallsystem von A, genannt α-Kristalle. Bis TÜ bleibt der homogene Zustand erhalten. Die Mischkristalle sind gesättigt, was bedeutet, dass Komponente A bis zur, für diese Legierung, maximalen Löslichkeit die Komponente B aufgenommen hat.
Bei TÜ wandern die Atome von B entsprechend der maximalen Löslichkeit für diese Temperatur zu den Korngrenzen und bilden dort Sekundär-Mischkristalle mit dem Kristallsystem von B, genannt β-Mischkristalle. Zum Ausgleich diffundieren entsprechend A-Atome ins Korninnere.
Der Anteil der Sekundär-Mischkristalle lässt sich nach folgender Formel berechnen:
| MSβ = Anteil Sekundär-β-Mischkristalle WL = Zusammensetzung Legierung WSα und WSβ entsprechen bei Raumtemperatur WSGα und WSGβ (SG = Sättigungsgrenze) |
Legierung 2 kristallisiert zunächst genau wie Legierung 1. Bei Erreichen der Eutektikalen erstarrt die Restschmelze jedoch in einem Haltepunkt und es bildet sich ein feinkörniges Gemisch aus α- und β-Mischkristallen, welches, wie bei getrennter Kristallbildung, Eutektikum genannt wird. Die zuvor entstandenen α-Mischkristalle entsprechen den Primärkristallen.
Unterhalb der Eutektikalen scheiden auch bei dieser Legierung aus den Primär-α-Mischkristallen B-Atome aus. Um hier den Anteil der Sekundär-β-Mischkristalle aus den Primär-Kristallen berechnen zu können, muss zuerst der Anteil an Primärkristallen an der Gesamtlegierung berechnet werden. Die Berechnung entspricht derjenigen bei getrennter Kristallisation. Anschließend wird der Anteil Sekundär-β-Mischkristalle aus den Primärkristallen berechnet und mit dem Anteil der Primärkristalle multipliziert:
| 1)
2) 3) |
MPr = Anteil Primärkristalle in % WEu = Zusammensetzung des Eutektikums |
Die Anteile der Sekundär-Kristalle im Eutektikum zu berechnen ist nicht sinnvoll, da sie hier keine neue Phase bilden. Es werden lediglich Atome, unter Erhaltung des Kristallsystems, umgruppiert. Weder im Gefügeschliffbild noch in den technischen Eigenschaften lassen sich deshalb Unterschiede feststellen.
Intermediäre Kristalle
Eine weitere Möglichkeit zur Legierungsbildung besteht darin, dass die beteiligten Elemente zwar einen gemeinsamen Kristall bilden, der jedoch keinem Kristallsystem der Basiselemente ähnelt. Es entsteht ein eigenes Kristallsystem, das im Gegensatz zu denen von reinen Metallen sehr kompliziert aufgebaut sein kann. Solche Verbindungen sind zudem sehr hart und spröde. Außerdem erfordern diese Kristalle ein festes Atomzahlenverhältnis. Eine Legierung mit intermediärer Kristallbildung, deren Legierungselemente ausschließlich Metalle sind, nennt man Intermetallische Phase (mit Löslichkeit für die konstituierenden Elemente) oder auch intermetallische Verbindung (bei stöchiometrischer Zusammensetzung). Tritt eine solche Phase auf, lässt sich im Schmelzdiagramm ein Dystektikum beobachten.
Beispiele für intermediäre Kristallisation sind Al2Cu, Mg2Si, Cu4Sn, Fe3C (Zementit) und WC (Wolframcarbid).
Die Kristallisationsformel gleicht der Formel für chemische Verbindungen, welche aber im Gegensatz zu Legierungen eine völlig andere Verbindungsart aufweisen.
Einteilung im Schema der chemischen Stoffe
| Schematische Einteilung der Stoffe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Literatur
- Stephan Hasse: Gießerei-Lexikon. Schiele&Schön, Berlin 1997, ISBN 3-7949-0606-3 (Anhang ab S. 1430 mit zahlreichen Zustandsschaubildern binärer und ternäre Legierungssysteme).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Alfred Böge: Das Techniker Handbuch. 13., überarbeitete Auflage. Vieweg, Braunschweig 1992, ISBN 3-528-14053-4.
- Erhard Hornbogen: Werkstoffe. Springer, Berlin, Heidelberg, New York 2006, ISBN 3-540-30723-0.
- Dieter Kohtz: Einführung in die Werkstoffkunde für Metallschweißer. In: Der Praktiker: das Magazin für Schweißtechnik und mehr. 9/1982 bis 1/1985. DVS-Verlag, ISSN 0554-9965.
- Erwin Riedel: Anorganische Chemie. de Gruyter, Berlin 2002, ISBN 3-11-017439-1.
- Ulrich Müller: Anorganische Strukturchemie. B. G. Teubner, Stuttgart 2004, ISBN 3-519-33512-3.
- Wilhelm Domke: Werkstoffkunde und Werkstoffprüfung. 10. Auflage. Cornelsen, Düsseldorf 1987, ISBN 3-590-81220-6.
Weblinks
Einzelnachweise
- Dieter Kohtz: Einführung in die Werkstoffkunde für Metallschweißer – Was ist eine Legierung. In: Der Praktiker: das Magazin für Schweißtechnik und mehr. Band 1. DVS-Verlag, 1984, ISSN 0554-9965, S. 4.
- Lexikon der Physik: Legierungen. Spektrum Akademischer Verlag, 1998, abgerufen am 27. Januar 2018.
- www.fremdwort.de: Legierung.
- Friedrich Baumann: Geschichte des Zinngießens. (Nicht mehr online verfügbar.) Archiviert vom Original am 2. März 2009; abgerufen am 2. April 2009.
- http://www.kupfer-institut.de/front_frame/frameset.php3?client=1&lang=1&idcat=27&parent=14 (Link nicht abrufbar)
- Marianne Schönnenbeck, Frank Neumann: Geschichte des Zink. Rheinzink, abgerufen am 26. März 2018 (Kompletter Bericht als eBook).
- Helmut Föll: Geschichte des Stahls. In: Einführung in die Materialwissenschaft I. Abgerufen am 2. April 2009.