Wolfram
Wolfram [ˈvɔlfram] ist ein chemisches Element mit dem Elementsymbol W und der Ordnungszahl 74. Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der 6. Nebengruppe (Gruppe 6) oder Chromgruppe. Wolfram ist ein weißglänzendes Schwermetall hoher Dichte, das bereits bei sehr geringen Verunreinigungen spröde wird. Es ist das chemische Element mit dem höchsten Schmelz- und Siedepunkt. Seine bekannteste Verwendung ist daher die Glühwendel in Glühlampen. Wolfram gilt als sogenannter Konfliktrohstoff, weil sein Abbau in Entwicklungsländern mit Menschenrechtsverletzungen, Korruption und Geldwäsche in Verbindung gebracht wird. Seit 2021 müssen EU-Importeure deshalb besondere Auflagen entlang der Lieferkette erfüllen.[14]
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Wolfram, W, 74 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 6, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | gräulich weiß, glänzend | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-143-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.312 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 64 ppm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 183,84(1)[3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 135 (193) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 162 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f145d46s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 7.86403(10) eV[4] ≈ 758.76 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 16.37(15) eV[4] ≈ 1580 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 26.0(4) eV[4] ≈ 2510 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 38.2(4) eV[4] ≈ 3690 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 51.6(3) eV[4] ≈ 4979 kJ/mol[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch raumzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 19,25 g/cm3 (20 °C)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 7,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 7,8 · 10−5)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 3695 K (3422 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 6203 K[9] (5930 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 9,47 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 774 kJ/mol[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 35,2[10] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 5174 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 138 J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,55 eV[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 18,52 · 106 A·V−1·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 170 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 6, 5, 4, 3, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,119 V (WO2 + 4H+ + 4e− → W + 2H2O) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,36 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte
Bereits im 16. Jahrhundert beschrieb der Freiberger Mineraloge Georgius Agricola das Vorkommen eines Minerals in sächsischen Zinnerzen, das die Zinngewinnung durch Verschlackung des Zinnanteils erheblich erschwerte. Der Namensbestandteil Wolf- rührt von dieser Eigenschaft, da das Mineral das Zinnerz wie ein Wolf „auffraß“. Ob es sich dabei um Wolframit handelte, ist auch heute noch umstritten, da Agricola von der „Leichtigkeit“ des Minerals sprach. Er nannte das Mineral lupi spuma, was aus dem Lateinischen übersetzt so viel wie „Wolf(s)-Schaum“ bedeutet. Später wurde es Wolfram genannt, von mittelhochdeutsch rām „Ruß, Rahm, Dreck“, da sich das schwarzgraue Mineral sehr leicht zerreiben lässt und dann an Ruß erinnert.[15] Sein chemisches Symbol W stammt von dem Namen Wolfram.
Das im Englischen, Italienischen und Französischen gebräuchliche Wort tungsten leitet sich von tung sten (schwedisch für „schwerer Stein“) ab. Damit wurde in Schweden seinerzeit aber nicht Wolfram selbst (schwedisch volfram), sondern Calciumwolframat bezeichnet. In diesem erkannte 1781 der deutsch-schwedische Chemiker Carl Wilhelm Scheele ein bis dahin unbekanntes Salz. Reines Wolfram wurde erstmals 1783 von den spanischen Brüdern Fausto und Juan José Elhuyar durch Reduktion von Wolframtrioxid, das man aus Wolframit gewinnt, hergestellt.
Vorkommen

Der Wolframgehalt der kontinentalen Erdkruste liegt etwa bei 1 ppm oder 0,0001 Gew.%.[16] Das Metall konnte in der Natur bisher nicht gediegen (in reiner Form) nachgewiesen werden. Die Doklady Akademii Nauk in Russland veröffentlichten 1995 einen Bericht zu gediegen Wolfram, ohne dass dieser von der zur IMA gehörenden Commission on new Minerals, Nomenclature and Classification (CNMNC) geprüft wurde.[17] Es sind einige Minerale, vor allem Oxide und Wolframate bekannt. Die wichtigsten Wolframerzminerale sind Wolframit (Mn, Fe)WO4 und Scheelit CaWO4. Daneben gibt es weitere Wolframminerale, wie Stolzit PbWO4 und Tuneptit WO3 · H2O.
Die größten Lagerstätten findet man in China, Peru, den USA, Korea, Bolivien, Kasachstan, Russland, Österreich und Portugal. Auch im Erzgebirge findet man Wolframerze. Die sicheren und wahrscheinlichen Weltvorkommen betragen derzeit 2,9 Mio. Tonnen reines Wolfram.
Das bedeutendste bekannte Vorkommen von Wolfram in Europa befindet sich im Felbertal in den Hohen Tauern (Bundesland Salzburg in Österreich).
Förderung weltweit
2017 betrug die Wolframförderung 95 000 Tonnen.[18] Der mit Abstand größte Produzent an Wolfram ist China. Mehr als 80 % des auf der Welt produzierten Wolframs wird dort gewonnen. Die Staaten mit der größten Förderung von Wolfram sind:
| Land | 2006[19] | 2007[19] | 2013[20] | 2014[20] | 2015[21] | 2016[18] | 2017[18] | Reserven[18] |
|---|---|---|---|---|---|---|---|---|
| (in Tonnen) | ||||||||
| 320 | 600 | 160.000[20] | ||||||
| 870 | 870 | 1.250 | 1.300 | 1.460 | 1.110 | 1.110 | 53.000[20] | |
| 79.000 | 77.000 | 68.000 | 68.000 | 73.000 | 72.000 | 79.000 | 1.800.000 | |
| 2.560 | 2.600 | 2.130 | 2.220 | 1.680 | 0 | 290.000[21] | ||
| 830 | 800 | keine Angaben | ||||||
| 753 | 150 | 63.000 | ||||||
| 600 | 600 | keine Angaben | ||||||
| 1.300 | 1.300 | 850 | 850 | 861 | 954 | 950 | 10.000 | |
| 780 | 800 | 692 | 700 | 474 | 549 | 680 | 3.100 | |
| 730 | 700 | 850 | 820 | 650 | keine Angaben | |||
| 4.000 | 4.400 | 3.600 | 3.600 | 2.600 | 3.100 | 3.100 | 160.000 | |
| 835 | 650 | 570 | 54.000 | |||||
| 150 | 736 | 1.100 | 43.000 | |||||
| 1.660 | 2.000 | 5.600 | 6.500 | 7.200 | 95.000 | |||
| andere Länder | 1.680 | 2.040 | 1.290 | 1.700 | 1.910 | 880 | 860 | 950.000 |
| Gesamt | 90.800 | 89.600 | 81.400 | 82.400 | 89.400 | 88.100 | 95.000 | 3.200.000 |
Förderung in Österreich
In Österreich wurde Scheelit erstmals 1815/16 auf der Goldlagerstätte Schellgaden in der Gemeinde Muhr (Bundesland Salzburg) entdeckt. In der Folge fand man in vielen Klüften der Hohen Tauern schöne, mitunter mehrere Zentimeter große Scheelitkristalle. Diese Funde waren allesamt von keinem praktischen Nutzen. Die große Lagerstätte im Felbertal blieb vorerst unentdeckt.
1950 wurde bekannt, dass in der bereits seit 1927 im Abbau befindlichen Magnesitlagerstätte auf der Wanglalm bei Lanersbach/Tux (Tirol) im hinteren Zillertal Scheelit in größeren Mengen auftrat. Es handelte sich dabei um derben, mit Magnesit und Quarz verwachsenen Scheelit. In den folgenden Jahren wurden jeweils etwa 10.000 Tonnen Erz mit einem Wolframoxidgehalt von durchschnittlich 1,8 % gewonnen. Wegen des niedrigen Marktpreises wurde die Wolframgewinnung Ende der 1960er Jahre eingestellt, aber 1971 wiederaufgenommen und bis zur Beendigung des Magnesitbergbaues 1976 weitergeführt.
1967 wurde schließlich die bislang größte Scheelitlagerstätte Europas im Felbertal, 6 km südlich von Mittersill entdeckt[22]. Den in Bächen vorhandenen Erzstücken wurde dabei mit Hilfe von UV-Licht nachgespürt (Scheelit fluoresziert). Die schwierigen Explorationsarbeiten im hochalpinen Gelände (höchste Abbaustelle am Brentling in 2100 m Seehöhe) begannen 1971, der von der Firma Wolfram Bergbau und Hütten AG (WBH) zunächst übertägige Bergbau wurde im Felbertal 1976 aufgenommen. Ab 1979 wurde Erz auch im Tiefbau gewonnen und der Tagebaubetrieb 1986 aus Umweltschutzgründen eingestellt. Das Wolframerz aus dem Felbertal wird seitdem über eine untertägige Förderanlage nach Mittersill transportiert und dort von WBH aufbereitet. Von hier gelangt das Scheelitkonzentrat nach Sankt Martin im Sulmtal (Steiermark). Die Jahresproduktion beträgt etwa 1200 t WO3.[22] Auf dem Gelände der 1976 geschlossenen Untertage-Braunkohlengrube von Pölfing-Bergla entstand die Wolframhütte, in der seit 1977 aus Konzentraten aus Mittersill und anderen Ländern Wolframoxid-, Wolframmetall- und Wolframcarbidpulver hergestellt werden.[23] Von Anfang 1993 bis Mitte 1995 war der Bergbau wegen des niedrigen Marktpreises für Wolfram vorübergehend eingestellt.[24] Bedeutendste Verarbeiter sind in Deutschland die Firma H.C. Starck, sowie in Österreich die WBH und die Plansee Group.
Gewinnung und Darstellung

Wolfram kann nicht durch Reduktion mit Kohle aus den oxidischen Erzen gewonnen werden, da hierbei Wolframcarbid entsteht.
Wolframhaltige Erze werden zunächst durch Verfahren wie Schweretrennung oder Flotation auf WO3-Konzentrationen von 10 bis 75 % angereichert. Das Konzentrat wird anschließend in einer oxidierenden Atmosphäre bei 500–600 °C calciniert, um Verunreinigungen, wie Additive aus dem Flotationprozess, zu entfernen. Wolframit-Erze werden danach mit Natronlauge, Scheelit-Erze mit einer Natriumcarbonat-Lösung umgesetzt, wobei sich Natriumwolframat Na2WO4 bildet, welches danach durch eine Reihe von Umfällungen gereinigt wird. Aus der erhaltenen gereinigten Lösung wird durch Flüssig-Flüssig-Extraktion mit ammoniakalischen Lösungen oder Ionenaustausch mit Ammoniumionen Wolfram(VI)-oxid als Ammoniumparawolframat gefällt. Wolframhaltiger Schrott wie Hartmetall-Schrott kann nach einer Oxidation ebenfalls in Natriumwolframat und danach in Ammoniumwolframat überführt werden.[25] Dieser Komplex wird abfiltriert und anschließend bei 600 °C in relativ reines Wolfram(VI)-oxid überführt. Durch Glühen erhält man wasserfreies Wolfram(VI)-oxid (WO3), welches bei 800 °C in einer Wasserstoffatmosphäre reduziert wird:
Dabei entsteht stahlgraues Wolframpulver, welches meist in Formen verdichtet und elektrisch zu Barren gesintert wird. Bei Temperaturen über 3400 °C kann in speziellen Elektroöfen mit reduzierender Wasserstoffatmosphäre ein kompaktes Wolframmetall erschmolzen werden (Zonenschmelzverfahren).[26]
Recycling
Auf Grund des hohen Materialwerts hat das Recycling von Wolfram eine beachtliche wirtschaftliche Bedeutung. Technologisch erfolgt eine Unterscheidung in Weichschrotte und Hartschrotte. Wolfram-Weichschrotte sind Schleifschlämme, Pulver und Späne aus der Bearbeitung wolframhaltiger Werkstücke. Wolfram-Hartschrotte sind dagegen Stücke aus Hartmetall, Wolframmetall und Wolframlegierungen.
Wolfram-Weichschrotte werden in Etagen- oder Drehrohröfen geröstet. Das entstehende Wolframoxid wird unter Druck mit Natronlauge zu Natriumwolframat umgesetzt. Wolfram-Hartschrotte erfordern einen oxidierenden Schmelzaufschluss mit Natriumnitrat. Aus dem daraus entstehenden Schmelzkuchen wird eine Natriumwolframat-Rohlösung gewonnen. Für sortenreine, saubere Hartmetallschrotte gibt es ein Verfahren, mit dem Hartmetallpulver zurückgewonnen werden kann, ohne den Umweg über die Oxidation zu gehen. In einer Zinkschmelze werden die Hartmetallstücke unter Schutzgas auf 900 bis 1.000 °C erhitzt. Zink dringt in das Bindemetall ein und sprengt den Verbund mit dem Wolframcarbidpulver. Anschließend wird das Zink verdampft und das Pulver aus Wolframcarbid und Bindemetall zu neuen Hartmetallprodukten verarbeitet.[27]
In allen Verfahren ist neben dem Hauptprodukt Wolfram die Rückgewinnung von Cobalt, Nickel, Kupfer, Silber und Tantal technisch möglich und wird praktiziert. Aus End-of-Life-Schrotten werden weltweit ca. 30 % des enthaltenen Wolframs zurückgewonnen. Die Rückführung von Hartmetallwerkzeugen funktioniert besser als die Rückführung wolframhaltiger Legierungen, Chemikalien und Katalysatoren. In Konsumgütern wie z. B. Lampen, Kugelschreibern und Smartphones ist zwar Wolfram enthalten, jedoch ist dessen Konzentration für das Recycling zu gering.[28]
Zusammen mit Neuschrotten, die bei der Produktion und Weiterverarbeitung anfallen, ergibt sich eine Schrotteinsatzquote von ca. 35 % in der Wolframproduktion.[29]
Eigenschaften
Physikalische Eigenschaften
Wolfram ist ein weißglänzendes, in reinem Zustand dehnbares Metall mittlerer Härte, sowie hoher Dichte und Festigkeit. Die Dichte ist fast gleich hoch wie die von Gold, die Brinellhärte beträgt 250 HB, die Zugfestigkeit 550–620 N/mm2 bis 1920 N/mm2.[30] Das Metall existiert in einer stabilen kubisch-raumzentrierten α-Modifikation mit einem Netzebenenabstand (=Gitterkonstante) von 316 pm bei Raumtemperatur.[31] Dieser Kristallstrukturtyp wird häufig Wolfram-Typ genannt. Bei einer als metastabile β-Modifikation des Wolframs (verzerrt kubisch-raumzentriert) bezeichneten Substanz handelt es sich hingegen um das wolframreiche Oxid W3O.[32]
Wolfram besitzt mit 3422 °C den höchsten Schmelzpunkt aller chemischen Elemente (Kohlenstoff schmilzt nicht, sondern geht bei 3642 °C direkt in den gasförmigen Zustand über) und mit 5930 °C auch den höchsten Siedepunkt.[9]
Das Metall ist ein Supraleiter mit einer Sprungtemperatur von 15 mK.[33]
Chemische Eigenschaften
Wolfram ist ein chemisch sehr widerstandsfähiges Metall, das selbst von Fluorwasserstoffsäure und Königswasser (zumindest bei Zimmertemperatur) kaum angegriffen wird. Es löst sich aber in Gemischen aus Fluss- und Salpetersäure und geschmolzenen Gemischen aus Alkalinitraten und -carbonaten auf.
Isotope
Von Wolfram sind 33 Isotope und fünf Kernisomere bekannt. In der Natur kommen davon fünf Isotope vor 180W, 182W, 183W, 184W und 186W. Das Wolframisotop 184W weist dabei die größte Häufigkeit auf. Alle fünf natürlichen Isotope könnten theoretisch instabil sein, allerdings gelang erst 2004 dem CRESST-Experiment am Laboratori nazionali del Gran Sasso als Nebenergebnis der Suche nach Dunkler Materie der Nachweis, dass das Isotop 180W dem Alphazerfall unterliegt.[34] Die Halbwertszeit beträgt extrem lange 1,8 Trillionen Jahre, daher ist dieser Zerfall in normaler Laborumgebung nicht nachweisbar. Die Radioaktivität dieses natürlichen Isotops ist so gering, dass sie für alle praktischen Zwecke ignoriert werden kann. Die etwaigen Halbwertszeiten der anderen vier natürlichen Isotope müssten nach heutigem Stand der Kenntnis länger als mindestens acht Trillionen Jahre sein. Die künstlichen radioaktiven Isotope von Wolfram haben dagegen kurze Halbwertszeiten zwischen 0,9 ms bei 185W und 121,2 Tagen bei 181W.
Verwendung
Wissenschaft, Technik und Medizin
Ca. 65 Prozent der weltweit produzierten Wolframmengen werden zu Wolframcarbid verarbeitet, welches zur Herstellung von Hartmetall-Werkzeugen eingesetzt wird. Daneben findet Wolfram vor allen Dingen als Legierungselement Verwendung.[29]

Reines Wolfram wird wegen seines hohen Schmelzpunktes als Glühwendel in Glühlampen und in Leuchtstofflampen, als Elektrode in Gasentladungslampen und als Kathoden-Heizwendel oder Kathode in Elektronenröhren eingesetzt. In Glühlampen ist der hohe spezifische Widerstand von Wolfram (höher als Eisen) von Vorteil, erlaubt er doch das Erzeugen eines ausreichend hohen Widerstands mit nicht allzu dünnem Draht. Dennoch wird für Glühlampen oft eine Doppelwendel eingesetzt. Dünner Draht ist empfindlich auf Erschütterungen. Eine kompakte plane rechteckige Leuchtfläche wird durch Flachwendeln aus vergleichsweise dickem Wolframdraht erzielt (Projektoren). Der Schmelzpunkt einer Glühwendel von Wolfram limitiert die Betriebstemperatur und damit die Lichtfarbe einer Glühlampe ohne Farbfilter. Bei hoher Betriebstemperatur kommt es mit längerer Betriebsdauer zum Umkristallisieren des Wolframs und typisch zu einem Verkürzen und Versteifen der Wendel, beim Ein- und Ausschalten zusätzlich zu Längenänderungen durch den Temperaturwechsel. Glühwendeln sind daher federnd aufgehängt mit etwas Spielraum für Verkürzung.
Wolfram kann direkt in spezielle Borosilikatgläser eingeschmolzen werden. Solche Glas-Metall-Verbindungen sind vakuumdicht und dienen zum Beispiel als Stromanschluss.
Wegen seiner hohen Korrosionsbeständigkeit kann Wolfram auch als Werkstoff für Apparaturen in chemischen Anlagen verwendet werden. Allerdings wird dies wegen der schlechten Bearbeitbarkeit von Wolfram (Wolfram kann nur mittels Laser- oder Elektronenstrahl geschweißt werden) nur selten angewandt.
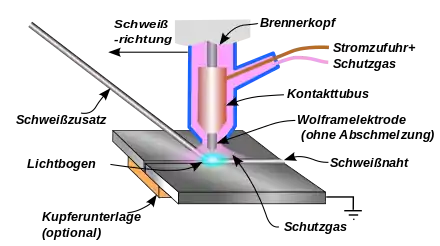
Elektroden zum Schweißen werden teilweise aus Wolfram hergestellt, zum Beispiel beim Widerstandsschweißen, wenn Werkstoffe wie Kupfer, Bronze oder Messing geschweißt werden. Beim Wolfram-Inertgasschweißen (WIG-Schweißen) besteht eine Elektrode aus Wolfram oder einer Legierung davon. Diese Elektrode wird beim Schweißen nicht abgeschmolzen. Der Lichtbogen brennt in einem Schutzgas zwischen der Wolfram-Elektrode und dem Bauteil. Das Zusatzmaterial wird als Stab oder Draht separat zugeführt.
Wolfram ist ein Legierungsbestandteil von Wolfram-Molybdän-Legierungen u. a. für Turbinenschaufeln im Heißgasbereich von Gasturbinen.
Aufgrund seiner hohen Dichte wird es für Ausgleichsgewichte und zur Abschirmung von Strahlung verwendet. Obwohl seine Dichte und damit die Abschirmwirkung wesentlich höher sind als die von Blei, wird es seltener als Blei für diesen Zweck verwendet, da es teurer und schwerer zu verarbeiten ist.
Wolframblech wird zu Verdampfungs-Schiffchen zum Bedampfen im Labormaßstab verarbeitet. Die Schiffchen werden direkt durch Strom geheizt.
In der Rastertunnelmikroskopie wird Wolfram oft als Material für die Sondenspitze verwendet. In der Physiologie, besonders der Neurophysiologie, werden Mikroelektroden aus Wolfram für extrazelluläre Ableitungen verwendet.
Die - und -Linien der charakteristischen Röntgenstrahlung liegen um 59 keV bzw. 67 keV. Wolfram findet bei der Erzeugung von Röntgenstrahlen als Anodenmaterial in Röntgenröhren oder als Target bei Linearbeschleunigern Anwendung. Durch das Aufprallen von beschleunigten Elektronen auf dem gekühlten Wolframtarget wird Röntgenstrahlung als Bremsstrahlung erzeugt. Die so erzeugten Röntgenstrahlen werden unter anderem in der Medizin bei der Röntgendiagnostik eingesetzt.
Militär
Wegen der hohen Dichte des Wolframs wird in einigen Armeen panzerbrechende Munition mit einem Projektilkern aus Wolframcarbid anstelle des aus der Urananreicherung angefallenen, waffentechnisch und kollateral tödlicheren, giftigen abgereicherten Urans verwendet. Im Zweiten Weltkrieg wurden Wuchtgeschosse aus Wolfram zuerst von der deutschen Wehrmacht eingesetzt und werden auch heute in der Bundeswehr verwendet. Das NS-Regime betrieb einen hohen Aufwand, um an große Mengen des als kriegswichtig geltenden Wolframs zu gelangen. Portugal exportierte in dieser Zeit Wolfram sowohl an die Alliierten als auch an das Deutsche Reich.[35] In Norwegen förderte die Knabengrube MO-Konzentrat für Deutschland. Besitzer der Grube war die I.G. Farben und Friedrich Krupp AG.[36] Das OKW berichtete 1944, dass es seinen Bedarf zu 25 % aus Finnland und zu 40 % aus Norwegen deckte.
Sport
Im Sport wird Wolfram für hochwertige Dart-Barrels sowie für Spitzen besonderer Pfeile beim Bogenschießen verwendet. Beim Hammerwurf wurden Hammerköpfe zeitweise zur Reduktion des Luftwiderstandes und des Rotationsradius ebenfalls aus Wolfram gefertigt. Außerdem werden Wolframplatten als Zusatzgewichte in der Formel 1 verwendet, um das vorgeschriebene Mindestgewicht von Formel-1-Wagen zu erreichen. Auch im Segelsport kommt es seit einiger Zeit in den Kielbomben großer Racer zum Einsatz. Dabei wird der Wasserwiderstand durch die größere Dichte gegenüber herkömmlichen Materialien wie Blei oder Gusseisen stark verringert. Ebenso gibt es bereits Schläger im Tennissport, in deren Carbonrahmengeflecht Wolframfasern eingearbeitet wurden. So können ganz gezielt bestimmte Bereiche des Schlägerrahmens zusätzlich stabilisiert werden, um die Spielpräzision zu erhöhen. Im Golfsport wird Wolfram manchmal als Ausgleichsgewicht für kleinere, präzisere Schlägerköpfe verwendet.
Beim Fliegenfischen werden Angelköder mit durchbohrten, auf den Hakenschenkel geschobenen Wolframperlen beschwert, damit sie schneller und tiefer abtauchen. Beim Angeln, insbesondere beim Spinnfischen, wird Wolfram als umweltfreundlicher und noch besser sinkender Ersatz für Blei verwendet.
Sonstiges

Seit Anfang des 21. Jahrhunderts wird Wolframcarbid, fälschlicherweise als Wolfram bezeichnet, auch zu Schmuck (Tungsten-Schmuck), z. B. Ringen verarbeitet. Dieses ist zum Beispiel anhand der Härte und der Dichte zu belegen. WC hat die Mohshärte 9,5, Wolfram nur 7,5. Alle auf dem Markt befindlichen „Wolfram-“ und „Tungsten“–Schmuckteile sind üblicherweise aus Wolframcarbid hergestellt.
Saiten für Musikinstrumente werden zum Teil mit Wolfram umsponnen, um ihr Gewicht zu erhöhen und dadurch die Tonhöhe zu verringern.
Aufgrund der ähnlichen Dichte von Wolfram und Gold gibt es Fälle, dass Wolfram zum Fälschen von Goldbarren (Wolframkern mit Goldummantelung) verwendet wird.[37]
Physiologie
Wolfram wird als positives Bioelement von Bakterien und Archaeen verwendet.[38] Vor allem gut untersucht sind verschiedene Enzyme, die Wolfram als Teil des Cofaktors besitzen, aus dem hyperthermophilen und strikt anaeroben Archaeon Pyrococcus furiosus.[39][40] Auch konnten aus anaeroben Bakterien wie Eubacterium acidaminophilum solche Wolfram-Enzyme untersucht werden. E. acidaminophilum ist ein Aminosäuren vergärendes Bakterium, das Wolfram in den Enzymen Formiat-Dehydrogenase und der Aldehyd-Oxidoreduktase nutzt. In diesen Organismen ersetzt Wolfram das Molybdän, weil es in deren natürlichen Umgebung (Vulkanschlote am Meeresboden) weitaus häufiger vorkommt.[41][42][43] Aber auch mesophile fakultativ anaerobe Mikroorganismen besitzen Wolfram-Enzyme und konnten schon untersucht werden.[44]
Toxikologie
Nach dem derzeitigen Wissensstand gelten Wolfram und seine Verbindungen als physiologisch unbedenklich. Lungenkrebserkrankungen bei Arbeitern in Hartmetall produzierenden oder verarbeitenden Betrieben werden auf das ebenfalls anwesende Cobalt zurückgeführt.[45]
Im Tiermodell wurde festgestellt, dass die größte Menge an peroral aufgenommenen Wolfram-Verbindungen wieder rasch über den Urin ausgeschieden wird. Ein kleiner Teil des Wolframs geht in das Blutplasma und von dort in die Erythrozyten über. Danach wird es in den Nieren und im Knochensystem abgelagert. Drei Monate nach der Verabreichung wird der größte Anteil des insgesamt nur in sehr kleiner Menge vom Körper aufgenommenen Wolframs in den Knochen gefunden.[46]
2003 wurden in Fallon/Nevada mit 16 seit 1997 an Leukämie erkrankten Kindern und in Sierra Vista/Arizona mit neun ebenfalls an Blutkrebs erkrankten Kindern zwei sogenannte Krebscluster – das sind lokale Gebiete mit einer überdurchschnittlich hohen Rate an Krebserkrankungen – identifiziert. In beiden Orten weist das Trinkwasser außergewöhnlich hohe Konzentrationen von Wolfram auf. Im Urin der Bevölkerung wurden deutlich erhöhte Wolframkonzentrationen nachgewiesen. Beide Orte sind für ihre Vorkommen von Wolfram-Erzen bekannt.[47][48] In den nachfolgenden, etwa ein Jahr dauernden Untersuchungen des Centers for Disease Control (CDC) konnte allerdings kein direkter Zusammenhang zwischen Wolfram und den Leukämie-Erkrankungen festgestellt werden. Wolfram zeige in keinem Testverfahren karzinogene Wirkungen, und in anderen Orten Nevadas mit ähnlich hohen Wolframwerten im Urin der Bevölkerung seien keine Krebscluster feststellbar.
Sicherheitshinweise
Als Pulver oder Staub ist es leicht entzündlich, in kompakter Form nicht brennbar.[13]
Verbindungen
Oxide
Wolfram bildet mehrere Oxide.[49] Zwischen dem Anfangsglied:
- Wolfram(VI)-oxid WO3 – zitronengelb
und dem Endglied:
- Wolfram(IV)-oxid WO2 – braun
gibt es noch folgende intermediäre Oxide:
- W10O29 blauviolett, Homogenitätsbereich WO2,92-WO2,88
- W4O11 rotviolett, Homogenitätsbereich WO2,76-WO2,73
- W18O49, WO2,72, rotviolettes Kristallpulver. Halbleiter. Dichte 7,72 g/cm3, Kristallstruktur: deformierter DO6-Typ, monoklin, Raumgruppe P2/m (Raumgruppen-Nr. 10), Gitterparameter: a = 1832 pm, b = 379 pm, c = 1404 pm, β = 115,2°.[50]
- W20O50, WO2,50
Sonstige Verbindungen
- Natriumwolframat Na2WO4
- Zirkoniumwolframat ZrW2O8 zeigt beim Erwärmen eine Anomalie.
- Wolframoxidhydroxide bestimmter Zusammensetzung und mit Oxidationszahlen zwischen 5 und 6 haben eine blaue Farbe. Sie werden als Wolframblau bezeichnet und entsprechen in vielfacher Hinsicht dem Molybdänblau. Wolframblau dient als Nachweis von Wolframaten, aus denen es durch Reduktion entsteht.[51]
- Wolframbronzen MxWO3; M=Alkali-, Erdalkalimetall, Lanthanoid, ca. 0,3 < x < 0,9 besitzen elektrische Leitfähigkeit und sind intensiv und je nach Metallgehalt unterschiedlich gefärbt.
- Calciumwolframat CaWO4 ist als Mineral unter dem Namen Scheelit bekannt.
- Wolframcarbid WC ist eine extrem harte metallähnliche Verbindung. Daneben gibt es noch Diwolframcarbid W2C.
- Wolframhexafluorid WF6
- Bleiwolframat PbWO4
- Wolframdisulfid WS2 Einsatz als Trockenschmiermittel (Ähnlich MoS2)
Verwendung der Verbindungen
Wolframcarbid wird als Neutronenreflektor bei Kernwaffen eingesetzt, um die kritische Masse herabzusetzen. Wolframcarbide (Hartmetall) werden aufgrund ihrer hohen Härte in der Materialbearbeitung verwendet.
Wolframate werden zur Imprägnierung von Stoffen verwendet, um diese schwer entflammbar zu machen.
Wolframhaltige Farben werden in der Malerei sowie in der Keramik- und Porzellanindustrie verwendet.
Bleiwolframat wird als moderner Szintillator in der Teilchenphysik verwendet.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Hans Breuer: dtv-Atlas Chemie. Band 1, 9. Auflage. dtv-Verlag, 2000, ISBN 3-423-03217-0.
- M. Binnewies: Allgemeine und Anorganische Chemie. Spektrum Verlag, 2004, ISBN 3-8274-0208-5.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. VCH Verlagsgesellschaft, 1988, ISBN 3-527-26169-9.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Wolfram) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu tungsten in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu tungsten bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Wolfram) entnommen.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1291.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- E. Lassner, W.-D. Schubert, E. Lüderitz, H. U. Wolf: Tungsten, Tungsten Alloys, and Tungsten Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a27_229.
- Hütte, Das Ingenieurwissen 34. Auflage, Tabelle16-6, Springer Vieweg 2012
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Wolfram) entnommen.
- Eintrag zu Wolfram (Pulver) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. April 2017. (JavaScript erforderlich)
- Wissenswertes über die Verordnung - Europäische Kommission. Abgerufen am 2. November 2021.
- Kluge: Etymologisches Wörterbuch der deutschen Sprache. 24. Auflage. Walter de Gruyter, Berlin 2002, ISBN 3-11-017473-1, S. 995–996.
- K. H. Wedepohl: The composition of the continental crust. In: Geochimica et Cosmochimica Acta. Volume 59, Issue 7, 1995, S. 1217–1232; doi:10.1016/0016-7037(95)00038-2.
- IMA/CNMNC List of Mineral Names – Tungsten (englisch, PDF 1,8 MB, S. 290).
- U.S. Geological Survey, Mineral Commodity Summaries, January 2018: TUNGSTEN.
- U.S. Geological Survey, Mineral Commodity Summaries, January 2008: TUNGSTEN.
- U.S. Geological Survey, Mineral Commodity Summaries, January 2015: TUNGSTEN.
- U.S. Geological Survey, Mineral Commodity Summaries, January 2017: TUNGSTEN.
- A. Ordosch, J.G. Raith, S. Schmidt, K. Aupers. Polyphase scheelite and stanniferous silicates in a W-(Sn) skarn close to Felbertal tungsten mine, Eastern Alps. In: Mineralogy and Petrology. Band 13, S. 703–725, 2019
- Das Unternehmen WOLFRAM. In: wolfram.at. 1. Februar 2014, abgerufen am 26. August 2018.
- Wolfram Bergbau- und Hütten-GmbH Nfg. KG (Memento vom 15. September 2013 im Internet Archive), abgerufen am 21. April 2009.
- Sverker Wahlberg: Nanostructured Tungsten Materials by Chemical Methods. Dissertation 2011, urn:nbn:se:kth:diva-42702
- Abbildung zonengeschmolzene Wolfram Stücke.
- Gerhard Gille, Andreas Meier: Recycling von Refraktärmetallen. In: Thomé-Kozmiensky / Goldmann (Hrsg.): Recycling und Rohstoffe Bd. 5, TK-Verlag, Neuruppin 2012, ISBN 978-3-935317-81-8, S. 537–560.
- Wolfram Recyclingsteckbrief. (PDF) Rewimet e.V., S. 8, abgerufen am 21. April 2020.
- Recycling of Tungsten - Current Share, Economic Limitations and Future Potential. (PDF; 4,21 MB) In: itia.info. International Tungsten Industry Association (ITIA), Mai 2018, S. 6, abgerufen am 25. August 2018 (englisch).
- Wolfram - online Katalog - Lieferant von Materialien in kleinen Mengen für die Forschung - Goodfellow.
- Tungsten Properties.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1426.
- Cristina Cozzini u. a.: Detection of the natural α decay of tungsten. In: Physical Review C. 70, 064606, 2004, doi:10.1103/PhysRevC.70.064606.
- Tobias Gohlis: Siebenmal mehr Gold. In: Die Zeit. Nr. 5, 2003.
- Robert Bohn (Hrsg.): Neutralität und totalitäre Aggression: Nordeuropa und die Grossmächte im Zweiten Weltkrieg. Steiner, Stuttgart 1991, ISBN 978-3-515-05887-2, ab Seite 290.
- https://www.faz.net/aktuell/finanzen/spektakulaerer-fall-von-gefaelschten-goldbarren-in-niedersachsen-15742977.html Christian Siedenbiedel: Spektakulärer Fall von gefälschten Goldbarren, Mitteilung der Frankfurter Allgemeinen Zeitung vom 17. August 2018, abgerufen am 9. Dez. 2020
- A Kletzin: Tungsten in biological systems. In: FEMS Microbiology Reviews. Band 18, Nr. 1, März 1996, S. 5–63, doi:10.1016/0168-6445(95)00025-9.
- M. Chan, S. Mukund, A. Kletzin, M. Adams, D. Rees: Structure of a hyperthermophilic tungstopterin enzyme, aldehyde ferredoxin oxidoreductase. In: Science. Band 267, Nr. 5203, 10. März 1995, S. 1463–1469, doi:10.1126/science.7878465.
- Roopali Roy, Swarnalatha Mukund, Gerrit J. Schut, Dianne M. Dunn, Robert Weiss: Purification and Molecular Characterization of the Tungsten-Containing Formaldehyde Ferredoxin Oxidoreductase from the Hyperthermophilic Archaeon Pyrococcus furiosus: the Third of a Putative Five-Member Tungstoenzyme Family. In: Journal of Bacteriology. Band 181, Nr. 4, Februar 1999, S. 1171–1180, PMID 9973343, PMC 93494 (freier Volltext).
- D. Rauh u. a.: Tungsten-containing aldehyde oxidoreductase of Eubacterium acidaminophilum. In: Eur J Biochem., 271/2004, S. 212–219; PMID 14686934.
- Martin-Luther-Universität Halle-Wittenberg, Wolframat-Aufnahme Gram-positiven anaeroben Bakterien, abgerufen am 23. November 2007.
- L. E. Bevers, P. L. Hagedoorn, W. R. Hagen: The bioinorganic chemistry of tungsten. In: Coord Chem Rev. Band 253, 2009, S. 269–290, doi:10.1016/j.ccr.2008.01.017.
- Fabian Arndt, Georg Schmitt, Agnieszka Winiarska, Martin Saft, Andreas Seubert: Characterization of an Aldehyde Oxidoreductase From the Mesophilic Bacterium Aromatoleum aromaticum EbN1, a Member of a New Subfamily of Tungsten-Containing Enzymes. In: Frontiers in Microbiology. Band 10, 31. Januar 2019, doi:10.3389/fmicb.2019.00071, PMID 30766522, PMC 6365974 (freier Volltext).
- Agency for Toxic Substances & Disease Registry: Toxicologic Profile for Tungsten, abgerufen am 22. Februar 2009.
- George Kazantzis, Per Leffler: ? In: Handbook on the Toxicology of Metals. 3. Auflage. 2007, S. 871–879.
- Wolfram für die Entstehung von Leukämie mitverantwortlich? In: innovations-report.de, 4. Februar 2003.
- Pressetext Austria vom 4. Februar 2003, Wolfram verändert Leukämie-Zellen.
- Heinrich Remy: Lehrbuch der Anorganischen Chemie. Band I + II, Leipzig 1973.
- Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band III. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1565.
- Heinrich Remy: Lehrbuch der Anorganischen Chemie. Band II, Akademische Verlagsgesellschaft Geest & Portig, Leipzig 1961, S. 218.
