Thiomargarita namibiensis
Thiomargarita namibiensis ist eine Art der gramnegativen Schwefelbakterien und die einzige Vertreterin ihrer Gattung aus der Familie der Thiotrichaceae. Mit Durchmessern von bis zu 0,75 Millimetern sind diese Bakterien ihrem Volumen nach die größten bekannten prokaryotischen Lebewesen der Welt. Sie sind für den Menschen mit bloßem Auge sichtbar. Sie kommen ausschließlich am Meeresboden unmittelbar an der Küste Namibias vor und gewinnen als sogenannte chemolithotrophe Lebewesen ihre Energie aus der Umsetzung anorganischer Stoffe, insbesondere von Sulfiden mit Nitrat, das sie in hoher Konzentration in ihrem Zellinneren speichern. Im Gegensatz zu den meisten Schwefelbakterien können sie die Sulfide unter bestimmten Bedingungen auch mit Sauerstoff umsetzen, sind also fakultativ aerob. Die Art wurde erst 1997 von deutschen Forschern entdeckt und 1999 erstbeschrieben.[1]
| Thiomargarita namibiensis | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
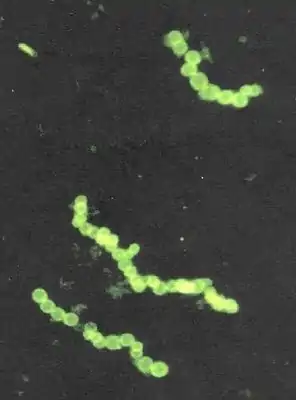
Thiomargarita namibiensis (Bild: NASA) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Thiomargarita namibiensis | ||||||||||||
| Schulz et al., 1999 |
Beschreibung
Die Zellen sind kugelförmig oder tonnenförmig, haben ein Volumen von bis zu 0,2 Kubik-Millimeter (= 200 Millionen Kubikmikrometer)[2] und normalerweise Durchmesser zwischen 100 und 300 Mikrometer, erreichen aber regelmäßig auch Größen bis zu 750 Mikrometer. Durchschnittlich 4 bis 20 Zellen verbinden sich durch eine Schleimhülle zu geraden oder verzweigten Ketten. Bei hohen Populationsdichten können mehrere Ketten wiederum kugelförmige Strukturen bilden. Gelegentlich konnte in sehr dichten Populationen auch die Bildung großer, blumenkohlförmiger Aggregationen aus deutlich kleineren und undurchsichtigeren Zellen beobachtet werden. Es ist noch unklar, ob es sich hierbei um ein Überlebensstadium von Thiomargarita oder eine eigenständige, bisher unbeschriebene Art handelt.
Ultrastruktur
Der größte Teil der einzelnen Zellen, rund 98 %, wird von der flüssigen Vakuole eingenommen, die als Nitratspeicher dient. In Hinblick auf die Ultrastruktur fallen zwei Dinge auf:
Die äußere Cytoplasmaschicht ist wie bei verwandten Arten, wie zum Beispiel Beggiatoa spp., nur 0,5 bis 2 Mikrometer dick und von ungewöhnlich lockerer, schwammähnlicher Struktur; die darin eingelagerten Schwefelkügelchen färben die eigentlich farblosen Zellen leuchtend weiß ein. Neben den Schwefelablagerungen finden sich auch deutlich kleinere Kügelchen, von denen angenommen wird, dass es sich dabei um Polyphosphate beziehungsweise Glykogen handelt.
Die Verteilung der Nukleinsäuren innerhalb des Cytoplasmas ist unregelmäßig und komplex, die DNA bildet kleine, regelmäßig auftretende Haufen anstatt sich gleichmäßig zu verteilen. Ein ähnliches Phänomen wurde auch bei Epulopiscium fishelsoni beobachtet, einem anderen Riesenbakterium, das bis zur Entdeckung von Thiomargarita als das größte bekannte Bakterium galt. Es wird daher für möglich gehalten, dass solche Gruppierungen von Nukleoiden zur Steuerung besonders großer Zellen erforderlich sind.[3]
Vermehrung
Die Zellteilung findet in der Regel entlang eines Strangs statt. Häufig befinden sich sämtliche Zellen eines Strangs im gleichen Stadium der Zellteilung, was eine Synchronisation benachbarter Zellen sehr wahrscheinlich macht. Die Schleimschicht zwischen erst kürzlich geteilten Zellen ist noch sehr dünn, wird aber mit zunehmendem Alter dicker, was den Zerfall längerer Ketten begünstigt. Längere Ketten aus 40 bis 50 Zellen werden brüchig und zerfallen in mehrere Teile, wodurch separate Ketten entstehen.
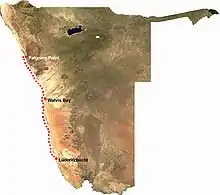
Verbreitungsgebiet
Thiomargarita namibiensis finden sich nur vor der namibischen Küste entlang eines rund 740 Kilometer langen und bis zu 76 Kilometer breiten Küstenstreifens von der Skelettküste um Palgrave Point bis zur Lüderitzbucht, mit Schwerpunkten um das Kreuzkap und die Empfängnisbucht. Der Benguelastrom, eine entlang der afrikanischen Atlantikküste vom Kap der Guten Hoffnung bis zum Äquator reichende kalte Meeresströmung, bildet hier ein Auftriebsgebiet, wodurch ein besonders artenreiches Ökosystem entsteht, welches reich an Phytoplankton ist. In dieser Zone wird der Meeresboden auf einer Fläche von rund 18.000 Quadratkilometer aus sehr flüssigem, grünen Diatomeenschlamm, einem Sediment aus abgelagerten Kieselalgenschalen, gebildet. Hier kommt Thiomargarita in Tiefen um 100 Meter in den oberen 10 bis 14 Zentimetern des Sediments vor und kann Populationsdichten mit einem Gewicht von bis zu 200 g/m² erreichen. Dabei wird die höchste Dichte unmittelbar unterhalb der Sedimentoberfläche erreicht, auf die ständig außergewöhnlich große Mengen organischen Materials (=Detritus) herabsinken. Als Resultat aus dem Abbau des organischen Materials kommen auf dem Meeresboden über lange Perioden hinweg annähernd kein Sauerstoff (0–3 Mikromol/Liter) und zugleich äußerst hohe Nitratkonzentrationen (über 10 Mikromol/Liter[4]) vor.
Lebensweise

Nur während sich Thiomargarita an der Sedimentoberfläche beziehungsweise in der darüberliegenden Wassersäule befinden, können sie Nitrat oder gegebenenfalls Sauerstoff aus dem Wasser aufnehmen. Dorthin gelangen die Ketten durch in dieser Region regelmäßig auftretende Stürme, Gaseruptionen, aber auch durch andere, kleinere Ereignisse wie starken Wellenschlag, welche die Diatomeenschlämme mitsamt der in ihnen lagernden Ketten aufwirbeln (die sogenannte „Resuspension“).
So geraten die – selbst nicht beweglichen – Zellverbände von Thiomargarita in die Wassersäule, wo sie Nitrat aufnehmen und speichern. Anschließend sinken sie wieder in tiefere Bereiche des Sediments und werden teilweise für Monate zugedeckt. Nitrat oder Sauerstoff findet sich dort nicht mehr, daher greifen sie auf das in ihrer Vakuole hochkonzentriert gespeicherte Nitrat zurück. Der im Wasser gesammelte Nitratvorrat reicht – bei vollständig gefüllter Vakuole – bei normalen Stoffwechselraten rechnerisch für rund 40 bis 50 Tage.[5] Über diese Zeit hinaus ist Thiomargarita aber auch in der Lage, notfalls mehrere Jahre ohne Nährstoffe zu überleben, aus Kultur wird von vereinzelten lebenden Zellen noch nach einer Lagerdauer von über 4 Jahren bei 5 °C und ohne Zufuhr von Nitraten oder Sulfiden berichtet.[6]
Die Sulfide, die während der Zersetzung des Detritus durch anaerobe, sulfatreduzierende Bakterien in den oberen 20 Zentimetern des Sediments[7] erzeugt werden, werden mit dem Nitrat als Elektronenakzeptor „veratmet“ (Nitratatmung). Das Sulfid wird dabei zu elementarem Schwefel oxidiert, der im Cytoplasma in Form kleiner Granula gespeichert wird und dabei Konzentrationen von 0,4 bis 1,7 Mol/Liter Gesamtvolumen erreicht. Ob der gespeicherte elementare Schwefel Thiomargarita wie bei anderen Bakterien wiederum als Energiequelle dienen kann und unter bestimmten Bedingungen weiter zu Sulfat oxidiert wird, ist nicht bekannt.
Stoffwechsel
Thiomargarita besitzt einen sehr flexiblen Stoffwechsel: er kann sowohl unter reduzierenden Bedingungen (anoxisch) wie unter oxidierenden Bedingungen (oxisch) ablaufen.
Den Großteil der Zeit befinden sich die unbeweglichen Zellen unter sauerstofffreien (anoxischen) Bedingungen im schwefelwasserstoffhaltigen Sediment. Unter diesen Bedingungen dient das Sulfid als Elektronendonator und Nitrat als Elektronenakzeptor. Das Nitrat wird dabei zu Ammonium oder elementarem Stickstoff reduziert. Genau kann die Frage nach dem Endprodukt derzeit allerdings noch nicht beantwortet werden, da eine dazu erforderliche Reinkultur noch nicht gelungen ist. Unter der Annahme, dass das Nitrat zu Ammonium reduziert wird, sieht die Summengleichung folgendermaßen aus:
Da es in dieser Umgebung kein Nitrat gibt, greifen die Zellen auf das in der Vakuole gespeicherte Nitrat zurück.
Bei Durchmischung des Sediments mit Meerwasser kommen die Zellen in Kontakt mit Sauerstoff und Nitrat. Im Gegensatz zu anderen Schwefelbakterien toleriert Thiomargarita Sauerstoff bis zur Sättigungsgrenze. Unter Anwesenheit von Sauerstoff ist die Aufnahme von Sulfid beschleunigt. Sauerstoff fungiert unter diesen Bedingungen als Elektronenakzeptor.[8] Ein Großteil des Energiegewinns könnte während dieser relativ kurzen Phasen zustande kommen.[9] Während dieser Phasen wird unter Energieverbrauch auch der Nitratspeicher aufgefüllt.
Zusätzlich zum Schwefelwasserstoff und Nitrat/Sauerstoff setzt Thiomargarita auch Phosphat und Acetat um. Unter oxischen Bedingungen nehmen sie Phosphat auf und speichern es in der energiereichen Form von Polyphosphat (siehe auch Adenosintriphosphat). Unter anoxischen Bedingungen wird das Polyphosphat unter Energiegewinn wieder abgebaut. Dafür wird unter anderem Acetat aufgenommen, das vermutlich in Form von Glykogen gespeichert wird. Das Glykogen kann unter oxischen Bedingungen dann wieder veratmet werden.[10]
Ökologie

Die Bindung des Schwefels durch Thiomargarita und die dort ebenfalls vorkommenden Beggiatoa-[7] und – seltenen – Thioploca-Schwefelbakterien hat eine wichtige Funktion im Ökosystem, denn sie verhindert die Freisetzung von Schwefelwasserstoff in das Wasser, der für die meisten Lebewesen hochgiftig ist. Dadurch machen sie die Habitate für sauerstoffgebundene Lebensformen erst bewohnbar. Welche Folgen die Aufhebung dieser Bindung haben kann, zeigten natürliche Methangaseruptionen im außergewöhnlich großen Maßstab im Frühjahr 2001, die große Mengen Schwefelwasserstoff aus dem Sediment freisetzten. Durch diese wurde auf einer Fläche von über 20.000 Quadratkilometern der gesamte freie Sauerstoff des Wassers gebunden und zugleich wurden sauerstoffabhängige Wasserlebewesen vergiftet, so dass das Leben im Wasser weitgehend abgetötet oder vertrieben wurde. Solche Eruptionen der teils nur wenige Meter bis Dezimeter unter der Oberfläche liegenden Methanblasen kommen in deutlich kleineren Maßstäben mindestens monatlich vor und sorgen für die regelmäßigen Resuspensionen des Sediments, die den Lebensrhythmus von Thiomargarita bestimmen.[11][12]
Thiomargarita sind, nicht zuletzt wegen ihrer Größe, auch Lebensraum für andere Bakterienarten. An der Hülle der Zellen verankern sich gelegentlich fadenförmige Bakterien der Gattung Thiotrix, insbesondere aber die Schleimhülle der Ketten ist Lebensraum zahlreicher Arten, darunter höchstwahrscheinlich Arten der Gattung Desulfonema, die auch die Schleimhüllen von Thioploca besiedeln.
Durch ihren regen Phosphat-Stoffwechsel ergeben sich im Porenwasser der von Thiomargarita bewohnten Zone hohe Phosphat-Konzentrationen (bis 300 Mikromol pro Liter). Dadurch bildet sich in dieser Zone Phosphorit (bis zu 5 % der Trockenmasse des Sediments Phosphor), ein Gestein, das industriell als Ausgangsmaterial zur Herstellung von Phosphor dient und dessen genaue Entstehung lange Zeit unklar war. Heute wird davon ausgegangen, dass solche Lagerstätten auf ehemalige Vorkommen von Bakterien mit ähnlichem Stoffwechsel zurückgehen.[13]
Systematik

Thiomargarita namibiensis wurde 1997 von einer Forschungsgruppe des Max-Planck-Instituts für Mikrobiologie Bremen unter Leitung von Heide Schulz gefunden, als sie an Bord des russischen Forschungsschiffs Petr Kottsov Sedimentproben aus der Walfischbucht an der Küste Namibias untersuchte.[14] Der Fund war kein Zufall, sondern die Expedition suchte aufgrund der Tatsache, dass hier sehr ähnliche Bedingungen herrschten wie in anderen Auftriebsgebieten mit Schwefelbakterienvorkommen, gezielt nach Vertretern dieser Gruppe, erwartete aber eher Thioploca- sowie Beggiatoa-Arten.
1999 dann wurde der Fund von Heide Schulz erstbeschrieben, der Gattungsname Thiomargarita bedeutet so viel wie ‚Schwefelperle‘ und spielt auf die Stränge weißglänzender, kugelförmiger Zellen an, die an Perlenketten erinnern, das Artepitheton verweist auf die namibische Küste als Fundort. Eine holotypische Reinkultur existiert aus technischen Gründen nicht,[15] allerdings kann Thiomargarita problemlos in einer Anreicherungskultur gehalten werden. Heide Schulz trug bis in die Gegenwart mit weiteren Forschungen zur Kenntnis der Art und ihrer Lebensbedingungen bei.
Thiomargarita namibiensis ist derzeit der einzige beschriebene Vertreter der Gattung, 2005 wurde vor der mexikanischen Küste allerdings ein bisher formal nicht beschriebenes Schwefelbakterium entdeckt, das molekulargenetischen Untersuchungen zufolge genetisch zu 99 % mit Thiomargarita namibiensis übereinstimmt und in späteren Arbeiten anderer Autoren als Mitglied der Gattung verstanden wird. Mit 180 bis 375 Mikrometer erreicht sie ähnliche Größen, lebt allerdings nicht in Ketten, sondern tritt als Einzelzelle oder Cluster in Erscheinung. Diese Thiomargarita namibiensis-Verwandte ist auch zur sogenannten „reduktiven Zellteilung“ fähig: Sinkt die Sulfidkonzentration ihres Habitats unter einen gewissen Schwellenwert, beginnt sich die Zelle in kleinere Einheiten zu teilen, ohne dass diese an Größe gewinnen.[16]
Molekulargenetischen Untersuchungen zufolge ist Thiomargarita eng verwandt mit der Gattung Thioploca, die vor den Küsten Chiles und Perus ähnliche ökologische Nischen ausfüllt sowie den Beggiatoa. Dabei ist Thiomargarita ebenso wie Thioploca ingrica innerhalb der Beggiatoa positioniert,[16] andere Untersuchungen sehen auch noch Thioploca araucae und Thioploca chileae als Teil einer Schwestergruppe von Thiomargarita.[1][17] Das folgende Kladogramm folgt Kalanetra et al., 2005 (vereinfachte Darstellung, fettgedruckte Namen repräsentieren Taxongruppen, dem Namen folgen die jeweiligen Accession numbers der Sequenzdatenbanken):[16]
| N.N. |
| ||||||||||||||||||||||||||||||
Nachweise
- Heide N. Schulz: The Genus Thiomargarita, in: M. Dworkin, S. Falkow, E. Rosenberg, K.-H. Schleifer, E. Stackenbrandt (Hrsg.): The Prokaryotes, Band 6., S. 1156–1163, 2006, ISBN 978-0-387-33496-7.
- Heide N. Schulz, Dirk de Beer: Uptake Rates of Oxygen and Sulfide Measured with Individual Thiomargarita namibiensis Cells by Using Microelectrodes. In: Applied And Environmental Microbiology. Band 68, Nr. 11, 2002, S. 5746–5749.
- Heide N. Schulz, Bo Barker Jørgensen: Big Bacteria. In: Annual Review of Microbiology. Band 55, 2001, S. 105–137.
- Bernice Wuethrich: Giant Sulfur-Eating Microbe Found. In: Science, New Series. band 284, Nr. 5413, 1999, S. 415.
- Heide N. Schulz, D. Riechmann: Thiomargarita namibiensis: Ein Gigant mit langem Atem. In: BioSpektrum 6, 2000, S. 116–118.
Einzelnachweise
- H. N. Schulz; T. Brinkhoff; T. G. Ferdelman; M. Hernández Mariné; A. Teske; B. B. Jørgensen: Dense Populations of a Giant Sulfur Bacterium in Namibian Shelf Sediments, Science Vol. 284, No. 5413, 1999, S. 493–495, Online (Memento vom 5. Februar 2007 im Internet Archive).
- Heide N. Schulz, Bo Barker Jørgensen: Big Bacteria, S. 117.
- Heide N. Schulz: The Genus Thiomargarita, S. 1158, 1159.
- Heide N. Schulz, Bo Barker Jørgensen: Big Bacteria, S. 130.
- Heide N. Schulz, Bo Barker Jørgensen: Big Bacteria, S. 131.
- Heide N. Schulz, D. Riechmann: Thiomargarita namibiensis: Ein Gigant mit langem Atem, S. 118.
- Volker Brüchert, Bronwen Currie, Kathleen R. Peard, Ulrich Lass, Rudolf Endler, Arne Dübecke, Elsabé Julies, Thomas Leipe, Sybille Zitzmann: Biogeochemical and physical control on shelf anoxia and water column hydrogen sulphide in the Benguel, a coastal upwelling system off Namibia. In: Past and Present Water Column Anoxia, NATO Science Series, 2006, Vol. 64, Part II, ISBN 978-1-4020-4262-1, S. 161–193.
- Heide N. Schulz, Dirk de Beer: Uptake Rates of Oxygen and Sulfide Measured with Individual Thiomargarita namibiensis Cells by Using Microelectrodes, in: Applied And Environmental Microbiology, Vol. 68, No. 11, 2002, S. 5746–5749.
- “... even though most of the time T. namibiensis cells survive in sediments containing high sulfide concentrations with internally stored nitrate as their sole electron acceptor, they may be physiologically most active during times when the sediment is suspended.” Heide N. Schulz, Dirk de Beer: Uptake Rates of Oxygen and Sulfide Measured with Individual Thiomargarita namibiensis Cells by Using Microelectrodes. S. 5748.
- Heide N. Schulz, Horst D. Schulz: Large Sulfur Bacteria and the Formation of Phosphorite. In: Science, Band 307, Nr. 5708, S. 416–418.
- Scarla J. Weeks, Bronwen Currie, Andrew Bakun: Massive emissions of toxic gas in the Atlantic. In: Nature, 415, S. 493–494, 2002
- Heide N. Schulz: The Genus Thiomargarita, S. 1160–1161.
- Heide N. Schulz, Horst D. Schulz: Large Sulfur Bacteria and the Formation of Phosphorite. S. 416–418.
- A whale of a bug. In: BBC News, 15. April 1999, Online
- Validation List Number 71: Validation of publication of new names and new combinations previously effectively published outside the IJSB. In: International Journal of Systematic Bacteriology. 1999, 49, S. 1325–1326.
- Karen M. Kalanetra, Samantha B. Joye, Nicole R. Sunseri, Douglas C. Nelson: Novel vacuolate sulfur bacteria from the Gulf of Mexico reproduce by reductive division in three dimensions. In: Environmental Microbiology 7 (9), 2005, S. 1451–1460, PMID 16104867.
- Andreas Teske: Fig. 9, in: Heide N. Schulz: The Genus Thiomargarita, S. 1160.
- Nähere Informationen zu diesem formal nicht beschriebenen Organismus siehe: Karen M. Kalanetra, Sherry L. Huston, Douglas C. Nelson: Novel, Attached, Sulfur-Oxidizing Bacteria at Shallow Hydrothermal Vents Possess Vacuoles Not Involved in Respiratory Nitrate Accumulation. In: Applied and Environmental Microbiology. Band 70, Nr. 12, 2004, S. 7487–7496.
Weblinks
- Heide N. Schulz: Thiomargarita namibiensis: Giant Microbe Holding Its Breath. In: ASM News, 68:3, 2002, S. 122–127, Online PDF
- Daniela Riechmann: Auftriebsgebiete der Ozeane – Alles Gute kommt von unten. Dossier in: Scinexx – Das Wissensmagazin. 14. Juli 2003, Online
- A Bloom By Any Other Name... Might Never Be a Bloom At All, in: Science Focus! - SeaWiFS, 29. März 2007, Online
- Eintrag zu Thiomargarita namibiensis im MicrobeWiki des Kenyon College (englisch)
- Bild eines Thiomargarita namibiensis-Stranges
- Bild von Thiomargarita im Größenvergleich mit einer Fliege