Schwefelhexafluorid
Schwefelhexafluorid ist eine anorganische chemische Verbindung aus den Elementen Schwefel und Fluor mit der Summenformel SF6. Es ist unter Normalbedingungen ein farb- und geruchloses, ungiftiges und nicht brennbares Gas, das sich, ähnlich wie Stickstoff, äußerst reaktionsträge verhält. Bei Normaldruck und einer Temperatur von −63,8 °C geht Schwefelhexafluorid durch Sublimation direkt vom festen in den gasförmigen Zustand über.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
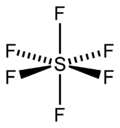 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Schwefelhexafluorid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | SF6 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloses Gas[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 146,05 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||||||||
| Dichte |
6,63 kg·m−3 (0 °C, 1013 hPa)[1] | |||||||||||||||||||||
| Sublimationspunkt | ||||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (40 mg·l−1 bei 20 °C, 1 bar)[2] | |||||||||||||||||||||
| Dipolmoment |
0[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 1000 ml·m−3 bzw. 6000 mg·m−3[4] | |||||||||||||||||||||
| Treibhauspotential |
26 087 (bezogen auf 100 Jahre)[5] | |||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Schwefelhexafluorid kann direkt aus den Elementen durch Umsetzung elementaren Schwefels (S8) im Fluorgasstrom (F2) synthetisiert werden.[7] Die Reaktion verläuft stark exotherm.[6]
Neben SF6 bilden sich bei diesem Syntheseweg auch weitere Schwefelfluoride, wie Dischwefeldecafluorid (S2F10). Daher wird bei der technischen Herstellung das Gas auf 400 °C erhitzt, wodurch eine Disproportionierung von Dischwefeldecafluorid in Schwefelhexafluorid und Schwefeltetrafluorid (SF4) erfolgt.
Durch Waschen des Gasgemisches in Lauge wird das Schwefeltetrafluorid zerstört, während SF6 durch die Lauge nicht angegriffen wird.
Durch anschließende Druckdestillation wird das reine SF6 abgetrennt.
Eigenschaften
Physikalische Eigenschaften
Schwefelhexafluorid ist unter Normalbedingungen gasförmig. Es hat eine etwa fünfmal so hohe Dichte wie Luft. Sein Sublimationspunkt liegt bei −63,8 °C.[1]
Der Tripelpunkt liegt bei einer Temperatur von −50,8 °C und bei einem Druck von 2,26 bar.[1] Erst oberhalb dieses Drucks ist auch eine flüssige Phase möglich.
Der kritische Punkt liegt bei einer Temperatur von 45,6 °C, einem kritischen Druck von 3,76 MPa und einer kritischen Dichte von 0,735 g·cm−3.[1]
Die Verdampfungsenthalpie von Schwefelhexafluorid beträgt bei einem Druck von 1013 hPa 115 kJ/kg.[8]
Kristall- und Molekülstruktur
Bei tiefen Temperaturen kristallisiert es im monoklinen Kristallsystem.[9]
Im gasförmigen Zustand ist das SF6-Molekül oktaedrisch (Oh); die S–F-Bindungslänge beträgt 156,1(2) pm.[10]
 Elementarzelle des Schwefelhexafluorids
Elementarzelle des Schwefelhexafluorids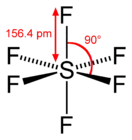 Bindungslänge und -winkel beim gasförmigen Schwefelhexafluorid
Bindungslänge und -winkel beim gasförmigen Schwefelhexafluorid
Chemische Eigenschaften
Aufgrund seiner Struktur ist es praktisch chemisch inert und verhält sich daher ähnlich wie molekularer Stickstoff oder die Edelgase. Es ist nahezu unlöslich in Wasser und nicht entflammbar.
Auf Grund seiner Inertheit sind Reaktionen in der Regel nur unter drastischeren als der Normalbedingung durchführbar. So setzen sich Alkalimetalle mit SF6 in flüssigem Ammoniak zu den korrespondierenden Sulfiden und Fluoriden um:[11]
- .
In Gegenwart von Schwefelwasserstoff ist die Komproportionierung zu elementarem Schwefel und Fluorwasserstoff (HF) bekannt:
- .
SF6 ist isoelektronisch zu den Anionen Hexafluorophosphat (PF6−), Hexafluorosilicat (SiF62−) und Hexafluoroaluminat (AlF63−).
Verwendung

Schwefelhexafluorid (SF6) wird als Isoliergas in der Mittel- und Hochspannungstechnik eingesetzt, beispielsweise in gasisolierten Schaltanlagen (GIS) mit Hochspannungsschaltern und bei gasisolierten Rohrleitern (GIL) in komplett gekapselten Anlagen mit Betriebsspannungen von 6 kV bis 800 kV.[12] Gegenüber Freiluftschaltanlagen wird deutlich Platz eingespart und die Einflüsse von Witterung und Vögeln oder Nagetieren werden vermieden. SF6 dient dabei auch als Löschgas, um den Schaltlichtbogen in Leistungsschaltern zu unterbrechen.
Die Durchschlagsfestigkeit ist bei Normaldruck fast dreimal so hoch wie in Luft oder Stickstoff. Diese Eigenschaften sowie die geringen dielektrischen Verluste prädestinieren es zur Verwendung als Isoliergas in Koaxialkabeln und gasisolierten Hochfrequenz-Leistungskondensatoren, die damit kleiner gebaut werden können. Als Isolationsgas in elektrischen Schaltanlagen wird es unter einem Druck von 5 bar bis 10 bar gehalten, um die nötige hohe Isolationsfähigkeit sicherzustellen. Je höher der Gasdruck, desto kürzer ist gemäß dem Paschen-Gesetz die mittlere Weglänge der freien Elektronen im Gas. Elektronen können nicht so stark beschleunigt werden wie bei Normaldruck, denn sie stoßen früher mit den SF6-Molekülen zusammen.[13]
In Schaltanlagen mit dem prinzipiell ungiftigen SF6-Gas entstehen im Laufe des Betriebes durch die Lichtbögen in Kombination mit Verunreinigungen wie einem geringen Wasseranteil neben dem ungiftigen Tetrafluormethan giftige Fluorid-Verbindungen wie Fluorwasserstoff und Thionylfluorid sowie das hochgiftige Dischwefeldecafluorid (S2F10). Aus diesen Gründen müssen in gasdichten SF6-Schaltanlagen vor Wartungsarbeiten Sicherheitsrichtlinien zur Entlüftung beachtet werden.[14] SF6 muss laut EU-Verordnung 517/2014 und laut der nationalen Chemikalien-Klimaschutzverordnung von zertifiziertem Personal wiedergewonnen werden, um dessen Recycling, Aufarbeitung oder Zerstörung sicherzustellen. SF6 muss gemäß den Vorschriften der DIN EN 60480 behandelt werden. Außerdem gilt die freiwillige Selbstverpflichtung der Hersteller und Betreiber von elektrischen Betriebsmitteln > 1000 Volt.[15][16][17]
Es wird als Isoliergas für Routinetests (Prüfung) mikroelektronischer Schaltkreise im Rahmen der Qualitätssicherung verwendet.
Bei der Herstellung von Halbleiter-Bauteilen dient es als Ätzgas: SF6 ist das reaktive Gas beim reaktiven Ionenätzen (RIE) und DRIE (von engl. Deep Reactive Ion Etching). Außerdem wird es auf ähnliche Weise zum Reinigungsätzen unter anderem in der Display-Fertigung eingesetzt.
SF6 verwendet man auch als Schutzgas bei der Gewinnung von Magnesium. Das SF6, spezifisch schwerer als Luft, verhindert hier den Kontakt der heißen Metallschmelze mit der Umgebungsluft. Prozessbedingt werden bei dieser Anwendung sehr große SF6-Mengen in die Atmosphäre abgegeben.
SF6 wurde früher als Isoliergas zwischen Isolierglasscheiben benutzt sowie als Füllgas in Sohlen von Sportschuhen.[18][19][20] Außerdem wurde Schwefelhexafluorid bis etwa zum Jahr 2000 auch zur Befüllung von Autoreifen eingesetzt, obwohl das pro Reifensatz bis zu 100 DM (ca. 50 Euro) kostete (siehe auch Reifengas). Alle drei vorgenannten Anwendungen sind inzwischen aus Gründen des Umweltschutzes verboten.[21][22]
Aufgrund seiner physikalischen Eigenschaften, der geringen Hintergrundkonzentration in der Atmosphäre und der sehr guten Nachweisbarkeit in Gasanalysatoren wird SF6 aktuell noch als Tracergas für Lüftungseffizienz-Messungen in sehr geringen Mengen verwendet. Für viele Anwendungen werden mittlerweile aber weniger klimaschädliche Gase eingesetzt.[23]
In der Augenheilkunde wird ein Gemisch aus Schwefelhexafluorid und Luft gegen Netzhautablösung eingesetzt, um ein Wiederanlegen der Netzhaut zu erreichen. Dazu wird während der operativen Glaskörperentfernung (Vitrektomie) das Gasgemisch in den Glaskörperraum (Camera vitrea bulbi) zu dem Zweck eingebracht, die Netzhaut auf ihre Unterlage zu drücken (Endotamponade).[24]
SF6 wird seit 2001 als Ultraschallkontrastmittel in der Medizin eingesetzt. Hier dient es insbesondere dem Nachweis von Lebermetastasen maligner Tumore. Vorteile sind eine sehr hohe zeitliche und örtliche Kontrastauflösung. Schilddrüsenerkrankungen und Niereninsuffizienz sind keine Kontraindikation zur Durchführung dieser Untersuchung. Mit Hilfe von SF6 können Leberherde zu ca. 90 % korrekt nachgewiesen werden.[25]
Klimarelevanz
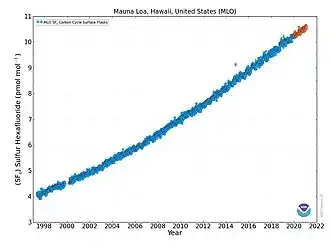
SF6-Gas ist laut Fünftem Sachstandsbericht des IPCC (Intergovernmental Panel on Climate Change, Zwischenstaatlicher Ausschuss für Klimaänderungen) das stärkste bekannte Treibhausgas. 1 kg dieses Gases ist genauso wirksam wie 26.087 kg Kohlendioxid (CO2). Die atmosphärische Lebensdauer von SF6 beträgt ca. 3.200 Jahre.[5]
Wegen der sehr geringen Konzentration von SF6 in der Erdatmosphäre (ca. 10 ppt (Parts per trillion) volumenbezogen im Jahr 2019, was 0,78 ppmV CO2-Äquivalent entspricht.; ca. 0.3 ppt Steigerung pro Jahr; CO2 ca. 400 ppm mit ca. 2 ppm pro Jahr Anstieg pro Jahr) wird sein Einfluss auf die globale Erwärmung jedoch noch als verhältnismäßig moderat betrachtet. Es trägt nicht zur Zerstörung der Ozonschicht bei.
Die Emission durch elektrotechnische Anlagen in Deutschland betrug 1997 10 % von 238 t der Gesamtemission. Der relative Anteil der Elektrischen Industrie am Ausstoß schwankt stark zwischen verschiedenen Ländern und variiert, nach von der Industrie gemeldeten Daten, im Zeitraum 1990–2012 zwischen 20–30 % (EU) und 70–80 % (US).
Der Anstieg der SF6-Konzentration in den letzten Jahren beträgt an der Station Bukit Kototabang in Indonesien von 5,3 ppt Anfang 2004 auf 6,3 ppt Ende 2008, was einem Anstieg um ca. 19 % in fünf Jahren entspricht.[26]
Im Jahr 2016 wurden in Deutschland 1142 Tonnen Schwefelhexafluorid an Verwender abgegeben, das sind ungefähr 2 % oder 23 t mehr als 2015. Die Klimawirksamkeit der Menge im Jahre 2016 beträgt 26 Mio. t CO2-Äquivalente, wobei Teile dieser Menge auch in geschlossene Systeme gefüllt wurden. Für diese Berechnung wurde der Treibhauseffekt-Faktor 22.800 gegenüber CO2 für einen verminderten Zeithorizont von 100 Jahren genutzt, obwohl die o. g. atmosphärische Lebensdauer objektiv längere Zeiträume der Hochrechnung erfordert, um Summationseffekte verantwortlich einzuschätzen. Die Hauptmenge gelangte in den Wirtschaftsbereich Elektroindustrie und Apparatebau mit 21,9 Millionen Tonnen CO2-Äquivalenten für 2016, gefolgt von der Halbleiterindustrie mit 1,2 Millionen Tonnen CO2-Äquivalenten.[27]
Emissionen
| Emissionsquelle | 1990 | 1995 | 2000 | 2002 | 2004 | 2006 | 2007 | 2007 potenzielle Emissionen* |
|---|---|---|---|---|---|---|---|---|
| Alu-Guss/Spurengas | 1 | 1 | 14,5 | 35,5 | 46 | 85,5 | 84 | - |
| Schallschutzscheiben | 69 | 108 | 52 | 46 | 54 | 61 | 67 | 1950 |
| Solartechnik/Opt. Fasern | 0 | 0 | 0 | 0,4 | 1,5 | 4,7 | 20,3 | - |
| Elektr. Schaltanlagen | 23 | 27,3 | 16,9 | 15,7 | 16,3 | 14,4 | 15,8 | 1770 |
| Magnesiumgießereien | 7,4 | 7,7 | 13,4 | 16,1 | 24,9 | 24,1 | 15,2 | - |
| T&D-Bauteile | k. A. | 16,7 | 26,6 | 23,3 | 16,0 | 12,4 | 9,9 | k. A. |
| Teilchenbeschleuniger | 5,2 | 4,5 | 5,0 | 4,9 | 4,9 | 4,9 | 4,9 | 74 |
| Autoreifen | 65 | 110 | 50 | 9 | 4 | 2,5 | 2 | 6 |
| Halbleiterproduktion | 3,7 | 2 | 2,4 | 2,4 | 3,4 | 1,3 | 1,2 | - |
| Sonstiges | 11 | 26 | 32 | 24 | 21 | 20 | 13 | k. A. |
| Insgesamt | 200 | 300 | 210 | 180 | 190 | 230 | 230 | - |
| *durchschnittlicher Jahresbestand | ||||||||
Kurioses
Wegen seiner etwa fünfmal höheren Dichte im Vergleich zu normaler Luft kann Schwefelhexafluorid wie eine unsichtbare Flüssigkeit in Behälter gegossen werden. Auf dem SF6-Spiegel können dann sehr leichte Objekte, etwa Schalen aus Aluminiumfolie, „schwimmen“. Mit großer Sorgfalt gelingt ein solcher Versuch auch mit leichter zugänglichem CO2.
Eingeatmetes SF6 verleiht beim Sprechen – im Gegensatz etwa zu Helium – eine tiefere Stimmlage als Luft. Grund dafür ist die gegenüber Luft wesentlich höhere Dichte von SF6, die zu einer geringeren Schallgeschwindigkeit im Gas führt (129 m/s, Faktor 0,39 gegenüber Luft). Experimente damit sind riskant, da SF6 in der Lunge die Abatmung des Kohlenstoffdioxids behindert. Die Gefahr einer Kohlendioxidnarkose oder eines Atemstillstandes ist daher bei SF6 größer als bei anderen Inertgasen wie beispielsweise Stickstoff oder Helium.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 566–567.
Weblinks
- International Chemical Safety Card (ICSC) für SULPHUR HEXAFLUORIDE beim National Institute for Occupational Safety and Health (NIOSH)
- Video der beiden Effekte im Abschnitt Kurioses
Einzelnachweise
- Eintrag zu Schwefelhexafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Juli 2019. (JavaScript erforderlich)
- Sicherheitsdatenblatt (praxair) (Memento vom 27. September 2007 im Internet Archive) (PDF; 36 kB).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 2551-62-4 bzw. Schwefelhexafluorid), abgerufen am 2. November 2015.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- Chase, M.W., Jr., NIST-JANAF Thermochemical Tables, Fourth Edition, J. Phys. Chem. Ref. Data, Monograph 9, 1998, 1–1951.
- Walter C. Schumb: Sulfur(VI) fluoride. In: Ludwig F. Audrieth (Hrsg.): Inorganic Syntheses. Band 3. McGraw-Hill, Inc., 1950, S. 119–124 (englisch).
- A. Lieberam: Kalorische und kritische Daten. In: Verein Deutscher Ingenieure, VDI-Gesellschaft Verfahrenstechnik und Chemieingenieurwesen (Hrsg.): VDI-Wärmeatlas. Berechnungsblätter für den Wärmeübergang. 7., erweiterte Auflage. VDI-Verlag, Düsseldorf 1994, ISBN 3-18-401362-6, S. Dc1.
- M.T. Dove, B.M. Powell, G.S. Pawley, L.S. Bartell: Monoclinic phase of SF6 and the orientational ordering transition. In: Molecular Physics, 1988, 65 (2), S. 353–358 (doi:10.1080/00268978800101081).
- L.S. Bartell, S.K. Doun: Structures of hexacoordinate compounds of main-group elements. Part III. An electron diffraction study of SF6, in: Journal of Molecular Structure, 1978, 43, S. 245–249 (doi:10.1016/0022-2860(78)80010-6).
- Holger Deubner, Florian Kraus, Holger Lars Deubner, Florian Kraus: The Decomposition Products of Sulfur Hexafluoride (SF6) with Metals Dissolved in Liquid Ammonia. In: Inorganics. Band 5, Nr. 4, 13. Oktober 2017, S. 68, doi:10.3390/inorganics5040068 (mdpi.com [abgerufen am 18. September 2018]).
- H. M. Ryan: SF6 switchgear. IET, 1989, ISBN 978-0-86341-123-6, S. 122 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Heinz Rebholz, Wolfgang Köhler, Stefan Tenbohlen: Dielektrische Festigkeit verschiedener Gase in GIS. Universität Stuttgart, 2005 (uni-stuttgart.de [PDF; 396 kB]).
- SF6-Anlagen (PDF; 356 kB), Berufsgenossenschaft der Feinmechanik und Elektrotechnik, Mai 2008.
- www.umweltbundesamt.de 20. Juli 2020.
- (IEC 60480:2004); Deutsche Fassung EN 60480:2004 Richtlinien für die Prüfung und Aufbereitung von Schwefelhexafluorid (SF6) nach Entnahme aus elektrischen Betriebsmitteln und Spezifikation für dessen Wiederverwendung.
- siehe auch umweltbundesamt.de: Emissionen von SF 6 (Vortrag vom 10. April 2017, PDF, 14 Seiten).
- Patentanmeldung WO9616564A1: Cushioning device for a footwear sole and method for making the same. Angemeldet am 1. Dezember 1995, veröffentlicht am 6. Juni 1996, Anmelder: Nike International Ltd, Nike US, Erfinder: Ross A. McLaughlin (Seite 7).
- V. Boudon, J.-P. Champion, T. Gabard, G. Pierre, M. Loëte, C. Wenger: Spectroscopic tools for remote sensing of greenhouse gases CH4, CF4 and SF6. In: Environmental Chemistry Letters, März 2003, Band 1, Ausgabe 1, S. 86–91 (Online als PDF, 300 KiB).
- Gefahr aus dem Turnschuh. In: Greenpeace Magazin, 2.98.
- ChemRRV: Chemikalien-Risikoreduktions-Verordnung, Anhang 1.5, Ziffer 6 (Verwendung).
- Verordnung (EG) Nr. 842/2006 über bestimmte fluorierte Treibhausgase, Art. 8 f. sowie Anhang II (PDF).
- Galle, B.; Samuelsson, J.; Svensson, B. H. und Borjesson G: Measurements of Methane Emissions from Landfills Using a Time Correlated Tracer Method Based on FTIR Absorption Spectroscopy. In: Environmental Science & Technology, 2001, Bd. 35, Nr. 1, S. 21–25; doi:10.1021/es0011008.
- Franz Grehn: Augenheilkunde. Springer-Verlag, Heidelberg 2006, ISBN 978-3-540-25699-1, S. 190–211 (eingeschränkte Vorschau in der Google-Buchsuche).
- D. Strobel, K. Seitz, W. Blank, A. Schuler, C. Dietrich, A. von Herbay, M. Friedrich-Rust, G. Kunze, D. Becker, U. Will, W. Kratzer, F. W. Albert, C. Pachmann, K. Dirks, H. Strunk, C. Greis, T. Bernatik: Contrast-enhanced ultrasound for the characterization of focal liver lesions – diagnostic accuracy in clinical practice (DEGUM multicenter trial). In: Ultraschall in der Medizin. Band 29, Nummer 5, Oktober 2008, S. 499–505, doi:10.1055/s-2008-1027806, PMID 19241506.
- PEMANTAUAN GAS RUMAH KACA (Memento vom 24. April 2012 im Internet Archive).
- Destatis: Abgabe von Schwefelhexafluorid 2016 gestiegen. In: UmweltMagazin. 47, Nr. 6, 2017, ISSN 0173-363X, S. 12.
- Umweltbundesamt (Hrsg.): Fluorierte Treibhausgase vermeiden - Wege zum Ausstieg. August 2010, S. 37 - Tabelle 2.5 (umweltbundesamt.de – english version).
- Bundesregierung (Hrsg.): Berichterstattung der Bundesrepublik Deutschland gemäß Artikel 5, 7 und 8 des Kyoto-Protokolls der UN-Klimarahmenkonvention zu fluorierten Treibhausgasen an das Sekretariat der Klimarahmenkonvention im Jahr 2009. April 2009 (unfccc.int).
- Winfried Schwarz: Emissionen fluorierter Treibhausgase in Deutschland 2006 und 2007 – Inventarermittlung 2006/2007 (F-Gase). Daten von HFKW, FKW und SF6 für die nationale Berichterstattung gemäß Klimarahmenkonvention für die Berichtsjahre 2006 und 2007 sowie Prüfung der Datenermittlung über externe Datenbanken. Hrsg.: Umweltbundesamt. Texte Nr. 22/2009, 2009 (umweltbundesamt.de).
