Methanthiol
Methanthiol ist ein farbloses, unangenehm nach verfaultem Gemüse riechendes Gas.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
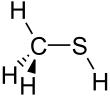 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methanthiol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH4S | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit faulig-stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 48,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
0,8665 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
6 °C [1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−22,9 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Synthese
Methanthiol erhält man durch Erhitzen von Methylhalogeniden mit Natriumhydrogensulfid und Schwefelwasserstoff in Ethanol:[5]
Die technische Herstellung erfolgt durch Umsetzung von Methanol und Schwefelwasserstoff bei ca. 400 °C am wolframaktivierten Aluminiumoxid-Kontakt. Alternativ kann Methanthiol durch Reaktion von Kohlenstoffdisulfid (CS2/H2) und von Kohlenmonoxid mit H2/H2S erfolgen.[6]
Vorkommen
Methanthiol kommt natürlich in Nüssen und Käse, aber auch im Blut, Gehirn und in anderen Organen des Menschen und von Tieren vor. Es entsteht beim bakteriellen Abbau von Proteinen. Ein Verursacher des unangenehmen Mundgeruchs beim Menschen ist – neben anderen flüchtigen schwefelhaltigen Verbindungen – Methanthiol.[7]
Methanthiol ist ein Hauptzerfallsprodukt von Dimethylsulfoniopropionat (DMSP), das in Bakterien im Meerwasser vorkommt. Deshalb ist es in oberflächennahem Wasser nachweisbar. Methanthiol kann von Bakterien zu Dimethylsulfid umgesetzt werden.
Physiologie
Größere Mengen Methanthiol, wie sie beim Abbau eines Überschusses der Aminosäure L-Methionin entstehen können, werden in den Mikrosomen der Leber teilweise zu Kohlenstoffdioxid und Sulfat oxidiert. Letzteres ist im Urin nachweisbar und senkt dessen pH-Wert.[8][9][10]
Eigenschaften
Chemisch gehört Methanthiol zur Gruppe der Alkanthiole und ist eine schwache Säure. Ihre kritische Temperatur liegt bei 196,8 °C, der kritische Druck bei 72,4 bar, die kritische Dichte bei 332 kg·m−3 und die Tripelpunkt-Temperatur bei −123,0 °C (Schmelztemperatur).[1]
Verwendung
Methanthiol wird aufgrund seines unangenehmen und anhaltenden Geruchs Erd- und Propangas als Warnstoff zugesetzt, um auf Lecks aufmerksam zu machen (Odorierung). Die Wahrnehmungsschwelle liegt für den Menschen bei etwa 2 mg/t (0,002 ppm).[11]
Außerdem werden unter Verwendung von Methanthiol die Pflanzenschutzmittel Acephat, Alanycarb, Aldicarb, Aldoxycarb, Ametryn, Butocarboxim, Desmetryn, Dimethametryn, Dithiopyr, Methomyl, Methoprotryn, Oxamyl, Prometryn, Simetryn, Terbutryn, Thiodicarb und Thiofanox dargestellt.[12] Die als Futtermittelzusatz verwendete Aminosäure DL-Methionin wird ausgehend von Methanthiol im großindustriellen Maßstab erzeugt.[13][14]
Siehe auch
Einzelnachweise
- Eintrag zu Methanthiol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu Methanethiol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 74-93-1 bzw. Methanthiol), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1978, ISBN 3-7776-0342-2, S. 135.
- Eintrag zu Methanthiol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juli 2019.
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 61–62, ISBN 978-3-8348-1245-2.
- CANELLAKIS ES, TARVER H: The metabolism of methyl mercaptan in the intact animal. In: Arch. Biochem. Biophys.. 42, Nr. 2, Februar 1953, S. 446–55. PMID 13031644.
- Tschöpe W, Ritz E: Sulfur-containing amino acids are a major determinant of urinary calcium. In: Miner Electrolyte Metab. 11, Nr. 3, 1985, S. 137–9. PMID 4010645.
- MAZEL P, HENDERSON JF, AXELROD J: S-DEMETHYLATION BY MICROSOMAL ENZYMES. In: J. Pharmacol. Exp. Ther.. 143, Januar 1964, S. 1–6. PMID 14112303.
- Torsten Schmiermund: Das Chemiewissen für die Feuerwehr, Springer Spektrum, ISBN 978-3-662-56605-3, S. 585.
- Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 1040 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 53, 1982, ISBN 3-527-25892-2.
- Bernd Hoppe, Jürgen Martens: Aminosäuren – Herstellung und Gewinnung, Chemie in unserer Zeit, 18. Jahrg. 1984, Nr. 3, S. 73–86, doi:10.1002/ciuz.19840180302.



