Chemilumineszenz
Bei dem Chemilumineszenz (Englisch: chemiluminescence) oder Chemolumineszenz[1] genannten Phänomen handelt es sich um einen Prozess, bei dem durch eine chemische Reaktion elektromagnetische Strahlung im Bereich des ultravioletten und sichtbaren Lichts emittiert wird. Wenn die Lumineszenz im infraroten Bereich stattfindet, wird der Begriff infrarote Chemilumineszenz verwendet.[2]

Die Biolumineszenz ist ein Spezialfall der Chemilumineszenz in biologischen Systemen, etwa wie bei Glühwürmchen.
Entdeckung
Bereits im Jahre 1000 v. Chr. wurden in China erste Thesen über biolumineszierende Lebewesen beschrieben. Die erste Chemilumineszenz-Reaktion wurde bereits 1669 vom Hamburger Alchemisten Heinrich Hennig Brand durch Zufall entdeckt (Phosphorus Mirabilis, Leuchten von Phosphordämpfen bei Oxidation durch Luftsauerstoff oder Wasser). Er vermutete, dass sich im menschlichen Urin Gold befindet, woraufhin er einige tausend Liter eindampfte und mit Kohle reduzierte. Dabei wurde das im Urin vorhandene Phosphat zu Phosphor reduziert und durch anschließende Oxidation zum Leuchten angeregt. Eilhard Wiedemann prägte 1888 den Begriff Chemilumineszenz.[3]
Grundlage

Die Emission von Licht bei der Chemilumineszenz ist eine Folge des Überganges eines Elektrons aus einem angeregten Zustand in einen energetisch tiefer liegenden Zustand, ggf. den Grundzustand. Anders als bei der Fluoreszenz oder Phosphoreszenz wird dieser angeregte Zustand bei der Chemilumineszenz durch eine chemische Reaktion erreicht.
Ausgangsstoffe für Chemilumineszenz-Reaktionen bezeichnet man als Luminophore. Der bekannteste ist 3-Aminophthalsäurehydrazid (Luminol). Unter Peroxyoxalat-Chemilumineszenz versteht man Reaktionen von Wasserstoffperoxid mit Derivaten der Oxalsäure in Gegenwart von Sensibilisatoren.[4][5] Viele Luminophore sind 1,2- oder 1,4-Dicarbonylverbindungen wie Oxalsäureester (z. B. Diphenyloxalat und dessen Derivate) und Luminol.
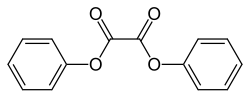 Diphenyloxalat, eine 1,2-Dicarbonylverbindung
Diphenyloxalat, eine 1,2-Dicarbonylverbindung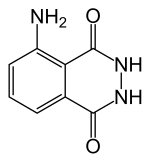 3-Aminophthalsäurehydrazid (Luminol), eine 1,4-Dicarbonylverbindung
3-Aminophthalsäurehydrazid (Luminol), eine 1,4-Dicarbonylverbindung
Bei den meisten Chemilumineszenz-Reaktionen entsteht zunächst ein instabiles Intermediat mit einer Peroxid-Brücke, dessen energiereiches Zerfallsprodukt einen Charge-Transfer-Komplex mit einem Farbstoffmolekül, dem Sensibilisator (englisch Sensitizer; einem Molekül mit mehreren Doppel- oder Dreifachbindungen) eingeht, und Energie an dieses abgibt. Das angeregte Farbstoffmolekül sendet dann ein Lichtquant aus, dessen Wellenlänge von der Struktur des verwendeten Farbstoffs abhängt.
Unter bestimmten Bedingungen lässt sich auch eine oszillierende Chemilumineszenz erzeugen, so z. B. durch Kombination des Orban-Oszillators mit Luminol.

Anwendungen
Die wohl bekannteste Chemilumineszenz-Reaktion ist die Oxidation von Luminol durch Wasserstoffperoxid in Gegenwart von Eisen- oder Manganionen, die in der Kriminalistik zur Sichtbarmachung von Blutspuren genutzt wird (der Blutfarbstoff Hämoglobin enthält Fe2+-Ionen). Das oxidierte Luminol-Molekül dient dabei gleichzeitig als Sensibilisator.
In der Gasanalytik wird die Chemolumineszenz bei der Oxidation von Stickstoffmonoxid zu Stickstoffdioxid genutzt, um Stickstoffmonoxid nachzuweisen. Wird Stickstoffdioxid vor der Oxidation im Analysator katalytisch reduziert, können beide Stickoxide nachgewiesen werden.
Kommerziell erhältlich sind Kunststoffröhrchen, die beim Knicken (Knicklichter) ein intensives, verschiedenfarbiges, lang anhaltendes Licht abgeben. Dieses Licht wird ebenfalls durch Chemilumineszenz erzeugt. In den Röhrchen befinden sich drei chemische Komponenten: ein Oxalsäureester, ein Farbstoff, dessen Emission die Farbe des Lichtes bestimmt, und ein Glasröhrchen mit Wasserstoffperoxid. Wird das Röhrchen mit Wasserstoffperoxid zerbrochen, startet die Peroxyoxalat-Chemilumineszenz.[6]
Die Chemilumineszenz von 1,2-Dioxetanen findet in der Biochemie und in der medizinischen Diagnostik Anwendung.[7] Durch sie ist man in der Lage, geringste Spuren von Enzymen bis hin zu einzelnen Molekülen sicher nachzuweisen. Neben anderen Luminophoren, wie Luminol, Acridiniumester oder Luciferine werden in der Chemilumineszenz-Immunoassay so die Konzentrationen von Antikörpern und Antigenen bestimmt. Außerdem lassen sich ATP und NADH in biologischen Medien bis zu sehr kleinen Konzentrationen bestimmen. Für viele Substrate, die mit ATP in Zusammenhang stehen, wurden empfindliche Nachweissysteme entwickelt.[8]
Literatur
- S. Albrecht, H. Brandl, Th. Zimmermann: Chemolumineszenz. Hüthig Verlag, Heidelberg 1996
- Aldo Roda: Chemiluminescence and Bioluminescence. Royal Society of Chemistry 2011; ISBN 978-1-84755-812-1
Einzelnachweise
- Duden: Rechtschreibung: Chemolumineszenz.
- Eintrag zu chemiluminescence. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01045 – Version: 2.3.1.
- Eilhard Wiedemann: Ueber Fluorescenz und Phosphorescenz I. Abhandlung. In: Annalen der Physik und Chemie. 270, 1888, S. 446–463, doi:10.1002/andp.18882700703.
- M. M. Rauhut, Chemiluminescence from Concerted Peroxide Decomposition Reactions, Acc. Chem. Research, 2, 80–87 (1969).
- A.G. Hadd, A.Seeber and J.W. Birks: Kinetics of Two Pathways in Peroxyoxalate Chemiluminescence, Journal of Organic Chemistry, 65,(2000), 2675–2683.
- Universität Jena: Die Peroxyoxlat-Chemilumineszenz.
- Universität Jena: Die Chemilumineszenz von 1,2-Dioxetanen.
- S. Albrecht, H. Brandl, W. Adam: Chemilumineszenz-Reaktionen, Chemie in unserer Zeit, 24. Jahrgang 1990, Nr. 5, S. 227–238.
Weblinks
- Showexperimente von Luminol, oszillierender Chemilumineszenz und Oxalsäureestern (Herstellung ist auch auf der Seite)
- Chemisches Licht – Experimente zur Chemilumineszenz Videoaufzeichnung eines Vortrags. Von TIMMS, Tübinger Internet Multimedia Server der Universität Tübingen.