Thiosulfate
Thiosulfate sind Derivate der im freien Zustand unbeständigen Thioschwefelsäure H2S2O3. Ihre Salze enthalten das Thiosulfat-Anion S2O32−. Thiosulfat kommt natürlich vor und wird in bestimmten biochemischen Prozessen produziert, z. B. während der bakteriellen Sulfatreduktion.
Eigenschaften
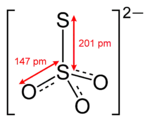
Das Präfix „thio-“ bedeutet, dass im Vergleich zum Sulfat-Anion (SO42−) im Thiosulfat-Anion ein Sauerstoffatom durch ein Schwefelatom ersetzt ist. Das Thiosulfat-Ion ist tetraedrisch und besitzt eine C3v-Symmetrie. Der Abstand zwischen den Schwefelatomen entspricht etwa einer S-S Einfachbindung, während der Abstand zwischen dem zentralen Schwefelatom und den Sauerstoffatomen vergleichbar zu den Abständen im Sulfat-Anion ist.[1] Daraus folgt, dass – obwohl Sauerstoff elektronegativer ist – das periphere Schwefelatom eine negative Ladung trägt. Die zweite negative Ladung ist über die drei verbliebenen Sauerstoffatome verteilt. Entsprechend ist in der Thioschwefelsäure ein Proton am peripheren Schwefelatom, das andere an einem der Sauerstoffatome gebunden.
Wässrige Lösungen von Thiosulfaten sind im basischen Milieu stabil. In Gegenwart von Säuren zerfallen sie aufgrund der Unbeständigkeit der freien Thioschwefelsäure in einer Disproportionierung langsam zu Schwefel, Schwefeldioxid und Wasser:
Mit Eisen(II)-ionen tritt Komplexbildung ein. Diese Reaktion ist gut geeignet, um mit Hilfe von Stoppuhr und Anblick die Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur und der (Stoffmengen-)Konzentration der Reaktionspartner zu demonstrieren.
Verwendung
Das in Chemie und Technik wichtigste Thiosulfat ist das Natriumsalz und Ammoniumsalz, auch Fixiersalz genannt. Es wird in der Analogfotografie zum Fixieren der belichteten Materialien (Filme, Fotopapier, Farb- und Schwarzweißmaterial) in der Dunkelkammer eingesetzt, da es das unbelichtete und damit unentwickelte Silberbromid als löslichen Dithiosulfatoargentatkomplex auflöst. Bei Farbmaterial wird auch das reduzierte metallische Silber durch Bleichen entfernt, so dass die Emulsion nach der Verarbeitung silberfrei ist.[1]
Thiosulfat kann dabei u. a. (wie Sulfat) als einzähniger sowie als zweizähnig-chelatbildender Ligand wirken:
Thiosulfat kann auch als Reduktionsmittel für Halogene verwendet werden.[1]
Bei der Reaktion von Thiosulfat mit dem schwachen Oxidationsmittel Iod bildet sich unter oxidativer (S-S)-Verknüpfung das Tetrathionat[1]:
Diese Reaktion findet bei der Iodometrie, ein Bestimmungsverfahren in der Analytischen Chemie, Anwendung.[2]
Medizinische Anwendung
Natrium-Thiosulfat wurde erfolgreich getestet, um Nebenwirkungen von Cisplatin zu verhindern. Eine Chemotherapie mit Cisplatin kann bei Kindern mit Hepatoblastom zu bleibender Hörverschlechterung führen. Wurde 6 Stunden nach Chemotherapie Natrium-Thiosulfat infundiert, so traten seltener Hörstörungen auf[3].
Nachweis

In Gegenwart eines Überschusses an Silberionen wird zunächst weißes Silberthiosulfat ausgefällt. Dieses disproportioniert dann zu Sulfid und Sulfat. Die Sulfidionen bilden hierbei mit den Silberionen einen schwarzen Niederschlag, sodass sich der Niederschlag von Silberthiosulfat in einem Farbwechsel von Weiß über Gelb-Orange und Braun zu Schwarz verfärbt. Dies wird zum Nachweis von Thiosulfationen ausgenutzt.[4] Diese Reaktion wird auch als anorganischer Sonnenuntergang, Abendrotreaktion oder Sonnenuntergangsreaktion bezeichnet, da der Farbwechsel der Reaktion dem des Sonnenuntergangs ähnelt.
- 1. Schritt: Thiosulfat wird durch Silberionen sofort als weißes Silberthiosulfat ausgefällt.
- 2. Schritt: Das Silberthiosulfat zerfällt (disproportioniert) in Gegenwart von Wasser langsam in Silbersulfid und Schwefelsäure.
Wird hingegen Thiosulfat im Überschuss zugegeben, so reagieren die Silberionen sofort zum oben genannten Dithiosulfatoargentatkomplex.
Weblinks
Einzelnachweise
- Wiberg, Egon., Wiberg, Nils,: Lehrbuch der anorganischen Chemie. 102., stark umgearbeitete und verb. Auflage. De Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Blasius, Ewald, Jander, Gerhart: Jander/Blasius anorganische Chemie. 2 Quantitative Analyse und Präparate. 16., völlig neu bearb. Auflage. Hirzel, Stuttgart 2012, ISBN 3-7776-2133-1.
- Sodium Thiosulfate for Protection from Cisplatin-Induced Hearing Loss | NEJM. Abgerufen am 17. Dezember 2018 (englisch).
- Jander, Gerhart, Blasius, Ewald: Jander/Blasius anorganische Chemie. 1 Einführung und qualitative Analyse : mit 21 Formeln und 79 Tabellen und Poster "Taschenfalter". 17., völlig neu bearb. Auflage. Hirzel, Stuttgart 2012, ISBN 3-7776-2134-X.
