Fermium
Fermium ist ein ausschließlich künstlich erzeugtes chemisches Element mit dem Elementsymbol Fm und der Ordnungszahl 100. Im Periodensystem steht es in der Gruppe der Actinoide (7. Periode, f-Block) und zählt auch zu den Transuranen. Fermium ist ein radioaktives Metall, welches aber aufgrund der geringen zur Verfügung stehenden Mengen bisher nicht als Metall dargestellt wurde. Es wurde 1952 nach dem Test der ersten amerikanischen Wasserstoffbombe entdeckt und Enrico Fermi zu Ehren benannt, der jedoch persönlich mit der Entdeckung von bzw. Forschung an Fermium nichts zu tun hatte.
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Fermium, Fm, 100 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Actinoide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | Ac, 7, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 257,0951 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | – (divalent: 198) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Rn] 5f12 7s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 6.50(7) eV[2] ≈ 627 kJ/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 12.4(4) eV[2] ≈ 1200 kJ/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 23.2(4) eV[2] ≈ 2240 kJ/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 39.3(4) eV[2] ≈ 3790 kJ/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 55.0(1,9) eV[2] ≈ 5310 kJ/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | (berechnet) 1125 K (ca. 852 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +2, +3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −1,96 V (Fm3+ + 3 e− → Fm) −2,37 V (Fm2+ + 2 e− → Fm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gefahren- und Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Radioaktiv | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte

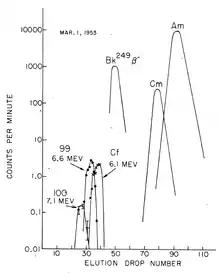
chromatographische Trennung von Fm (100), Es (99), Cf, Bk, Cm, Am.

Fermium wurde zusammen mit Einsteinium nach dem Test der ersten amerikanischen Wasserstoffbombe, Ivy Mike, am 1. November 1952 auf dem Eniwetok-Atoll gefunden. Erste Proben erhielt man auf Filterpapieren, die man beim Durchfliegen durch die Explosionswolke mitführte. Größere Mengen isolierte man später aus Korallen. Aus Gründen der militärischen Geheimhaltung wurden die Ergebnisse zunächst nicht publiziert.[7]
Eine erste Untersuchung der Explosionsüberreste hatte die Entstehung eines neuen Plutoniumisotops 244Pu aufgezeigt, dies konnte nur durch die Aufnahme von sechs Neutronen durch einen Uran-238-Kern und zwei folgende β-Zerfälle entstanden sein.
Zu der Zeit nahm man an, dass die Absorption von Neutronen durch einen schweren Kern ein seltener Vorgang wäre. Die Identifizierung von 244Pu ließ jedoch den Schluss zu, dass Urankerne viele Neutronen einfangen können, was zu neuen Elementen führt.[7]
Die Bildung gelang durch fortgesetzten Neutroneneinfang: Im Moment der Detonation war die Neutronenflussdichte so hoch, dass die meisten der zwischenzeitlich gebildeten – radioaktiven – Atomkerne bis zum jeweils nächsten Neutroneneinfang noch nicht zerfallen waren. Bei sehr hohem Neutronenfluss steigt also die Massenzahl stark an, ohne dass sich die Ordnungszahl ändert. Erst anschließend zerfallen die entstandenen instabilen Nuklide über viele β-Zerfälle zu stabilen oder instabilen Nukliden mit hoher Ordnungszahl:
Die Entdeckung von Fermium (Z = 100) erforderte mehr Material, da man davon ausging, dass die Ausbeute mindestens eine Größenordnung niedriger als die von Element 99 sein würde. Daher wurden kontaminierte Korallen aus dem Eniwetok-Atoll (wo der Test stattgefunden hatte) zum University of California Radiation Laboratory in Berkeley, Kalifornien, zur Verarbeitung und Analyse gebracht. Die Trennung der gelösten Actinoid-Ionen erfolgte in Gegenwart eines Citronensäure/Ammoniumcitrat-Puffers im schwach sauren Medium (pH ≈ 3,5) mit Ionenaustauschern bei erhöhter Temperatur. Etwa zwei Monate später wurde eine neue Komponente isoliert, ein hochenergetischer α-Strahler (7,1 MeV) mit einer Halbwertszeit von etwa einem Tag. Mit einer derart kurzen Halbwertszeit konnte es nur aus dem β-Zerfall eines Einsteiniumisotops entstehen, und so musste ein Isotop des Elements 100 das neue sein: Es wurde schnell als 255Fm identifiziert (t½ = 20,07 Stunden).[7]
Im September 1953 war noch nicht abzusehen, wann die Ergebnisse der Teams in Berkeley, Argonne und Los Alamos veröffentlicht werden könnten. Man entschied sich dazu, die neuen Elemente durch Beschussexperimente herzustellen; gleichzeitig versicherte man sich, dass diese Ergebnisse nicht unter Geheimhaltung fallen würden und somit veröffentlicht werden konnten.[7] Einsteiniumisotope wurden kurz danach am University of California Radiation Laboratory durch Beschuss von Uran (238U) mit Stickstoff (14N) hergestellt. Dabei merkte man an, dass es Forschungen zu diesem Element gebe, die bislang noch unter Geheimhaltung stehen.[8][7] Isotope der beiden neu entdeckten Elemente wurden durch Bestrahlung des Plutoniumisotops 239Pu erzeugt, die Ergebnisse wurden in fünf kurz aufeinander folgenden Publikationen veröffentlicht.[9][10][11][12][13] Die letzten Reaktionen ausgehend von Californium sind:
Das Team in Berkeley war zudem besorgt, dass eine andere Forschergruppe die leichteren Isotope des Elements 100 durch Ionenbeschuss entdecken und veröffentlichen könnte, bevor sie ihre unter Geheimhaltung stehende Forschung hätten veröffentlichen können.[7] Denn im ausgehenden Jahr 1953 sowie zu Anfang des Jahres 1954 beschoss eine Arbeitsgruppe des Nobel-Instituts für Physik in Stockholm Urankerne mit Sauerstoffkernen; es bildete sich das Isotop mit der Massenzahl 250 des Elements 100 (250Fm).[14] Die zweifelsfreie Identifizierung konnte anhand der charakteristischen Energie des beim Zerfall ausgesandten α-Teilchens erlangt werden.
Das Team in Berkeley veröffentlichte schon einige Ergebnisse der chemischen Eigenschaften beider Elemente.[15][16] Schließlich wurden die Ergebnisse der thermonuklearen Explosion im Jahr 1955 freigegeben und anschließend publiziert.[17][18]
Letztlich war die Priorität des Berkeley-Teams allgemein anerkannt, da ihre fünf Publikationen der schwedischen Publikation vorausgingen, und sie sich auf die zuvor noch geheimen Ergebnisse der thermonuklearen Explosion von 1952 stützen konnten. Damit war das Vorrecht verbunden, den neuen Elementen den Namen zu geben. Sie entschieden sich, diese fortan nach berühmten, bereits verstorbenen Wissenschaftlern zu benennen. Man war sich schnell einig, die Namen zu Ehren von Albert Einstein und Enrico Fermi zu vergeben, die beide erst vor kurzem verstorben waren:[7] „We suggest for the name for the element with the atomic number 99, einsteinium (symbol E) after Albert Einstein and for the name for the element with atomic number 100, fermium (symbol Fm), after Enrico Fermi.“[17] Die Bekanntgabe für die beiden neu entdeckten Elemente Einsteinium und Fermium erfolgte durch Albert Ghiorso auf der 1. Genfer Atomkonferenz, die vom 8. bis 20. August 1955 stattfand.[7]
Später wurde das Element zeitweilig mit dem systematischen Namen Unnilnilium bezeichnet.[19]
Isotope
Sämtliche bisher bekannten 19 Nuklide und 3 Kernisomere sind radioaktiv und instabil.[20] Die bekannten Massenzahlen reichen von 242 bis 260. Die mit Abstand längste Halbwertszeit hat das Isotop 257Fm mit 100,5 Tagen, so dass es auf der Erde keine natürlichen Vorkommen mehr geben kann. 253Fm hat eine Halbwertszeit von 3 Tagen, 251Fm von 5,3 h, 252Fm von 25,4 h, 254Fm von 3,2 h, 255Fm von 20,1 h und 256Fm von 2,6 h. Alle übrigen haben Halbwertszeiten von 30 Minuten bis unterhalb einer Millisekunde.[21]
Nimmt man den Zerfall des langlebigsten Isotops 257Fm heraus, so entsteht durch α-Zerfall zunächst das 253Cf, das seinerseits durch β-Zerfall in 253Es übergeht. Der weitere Zerfall führt dann über 249Bk, 249Cf, 245Cm, 243Am, 241Pu, 241Am zum 237Np, dem Beginn der Neptunium-Reihe (4 n + 1).
- Die angegebenen Zeiten sind Halbwertszeiten.
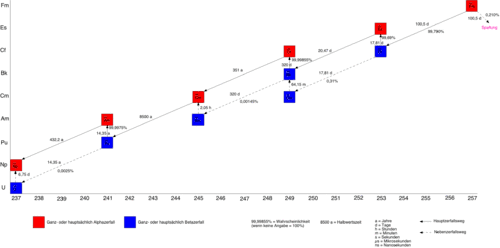 Der Zerfall von Fermium-257 bis zur Neptunium-Reihe.
Der Zerfall von Fermium-257 bis zur Neptunium-Reihe.
Fermiumbarriere
Als Fermiumbarriere bezeichnet man den Umstand, dass die Fermiumisotope 258Fm, 259Fm und 260Fm zum Teil schon nach Bruchteilen von Sekunden durch Spontanspaltung zerfallen (t½ = 370 µs, 1,5 s bzw. 4 ms). 257Fm ist ein α-Strahler und zerfällt zu 253Cf. Zudem zeigt keines der bislang bekannten Fermiumisotope β-Zerfälle, was die Bildung von Mendelevium durch Zerfall aus Fermium verhindert.[21] Diese Tatsachen vereiteln praktisch jede Bemühung, mit Hilfe von Neutronenstrahlung, zum Beispiel mit Hilfe eines Kernreaktors, Elemente mit Ordnungszahlen über 100 bzw. Massenzahlen größer als 257 zu erzeugen. Fermium ist somit das letzte Element, das durch Neutroneneinfang hergestellt werden kann.[22] Jeder Versuch, weitere Neutronen zu einem Fermium-Kern hinzuzufügen, führt zu einer Spontanspaltung.
Gewinnung
Fermium wird durch Beschuss von leichteren Actinoiden mit Neutronen in einem Kernreaktor erzeugt. Die Hauptquelle ist der 85 MW High-Flux-Isotope Reactor am Oak Ridge National Laboratory in Tennessee, USA, der auf die Herstellung von Transcuriumelementen (Z > 96) eingerichtet ist.[23]
In Oak Ridge sind größere Mengen an Curium bestrahlt worden, um Dezigramm-Mengen an Californium, Milligramm-Mengen an Berkelium und Einsteinium sowie Pikogramm-Mengen an Fermium zu erzeugen.[24] Nanogramm- und Mikrogramm-Mengen von Fermium können für bestimmte Experimente vorbereitet werden.[25] Die Mengen an Fermium, die in thermonuklearen Explosionen von 20 bis 200 Kilotonnen entstehen, bewegen sich vermutlich in der Größenordnung von einigen Milligramm, obwohl es mit einer riesigen Menge von Explosionsresten gemischt ist; 40 Pikogramm 257Fm wurden aus 10 Kilogramm der Explosionsreste aus dem Hutch-Test vom 16. Juli 1969 isoliert.[26]
Nach der Bestrahlung muss Fermium von den anderen Actinoiden und den Lanthanoid-Spaltprodukten getrennt werden. Dies wird üblicherweise durch Ionenaustauschchromatographie erreicht, das Standardverfahren läuft mit Kationenaustauschern wie Dowex 50 oder TEVA, man eluiert mit einer Lösung von Ammonium-α-hydroxyisobuttersäuremethylester.[24][27] Kleinere Kationen bilden stabilere Komplexe mit den α-Hydroxyisobuttersäuremethylester-Anionen, daher werden sie bevorzugt von der Säule eluiert.[22] Eine schnelle fraktionierte Kristallisationsmethode wurde ebenfalls beschrieben.[28]
Obwohl das stabilste Isotop des Fermiums das 257Fm mit einer Halbwertszeit von 100,5 Tagen ist, basieren die meisten Studien auf 255Fm (t½ = 20,07 Stunden). Dieses Isotop kann leicht isoliert werden, es ist ein Zerfallsprodukt des 255Es (t½ = 39,8 Tage).[22]
Geringe Mengen an Einsteinium und Fermium wurden aus Plutonium isoliert und abgetrennt, welches mit Neutronen bestrahlt wurde. Vier Einsteiniumisotope wurden gefunden (mit Angabe der damals gemessenen Halbwertszeiten): 253Es (α-Strahler mit t½ = 20,03 Tage, sowie mit einer Spontanspaltungs-Halbwertszeit von 7×105 Jahren); 254mEs (β-Strahler mit t½ = 38,5 Stunden), 254Es (α-Strahler mit t½ = ∼ 320 Tage) und 255Es (β-Strahler mit t½ = 24 Tage). Zwei Fermiumisotope wurden gefunden: 254Fm (α-Strahler mit t½ = 3,24 Stunden, sowie mit einer Spontanspaltungs-Halbwertszeit von 246 Tagen) und 255Fm (α-Strahler mit t½ = 21,5 Stunden).[29]
Durch Beschuss von Uran mit fünffach ionisierten Stickstoff- und sechsfach ionisierten Sauerstoffatomen wurden gleichfalls Einsteinium- und Fermiumisotope erzeugt.[30]
Eigenschaften
Im Periodensystem steht das Fermium mit der Ordnungszahl 100 in der Reihe der Actinoide, sein Vorgänger ist das Einsteinium, das nachfolgende Element ist das Mendelevium. Sein Analogon in der Reihe der Lanthanoide ist das Erbium.
Physikalische Eigenschaften
Das Metall wurde bislang nicht dargestellt, hingegen erfolgten Messungen an Legierungen mit Lanthanoiden, ferner liegen einige Berechnungen oder Vorhersagen vor. Die Sublimationsenthalpie ist direkt mit der Valenzelektronenstruktur des Metalls verbunden. Die Sublimationsenthalpie von Fermium wurde direkt durch Messung des Partialdrucks des Fermiums über Fm-Sm- und Fm/Es-Yb-Legierungen im Temperaturbereich von 642 bis 905 K bestimmt. Sie gelangten zu einem Wert von 142(13) kJ·mol−1. Da die Sublimationsenthalpie von Fermium ähnlich ist zu denen des zweiwertigen Einsteinium, Europium und Ytterbium, wurde der Schluss gezogen, dass Fermium einen zweiwertigen metallischen Zustand besitzt. Vergleiche mit Radien und Schmelzpunkten von Europium-, Ytterbium- und Einsteinium-Metall führten zu geschätzten Werten von 198 pm und 1125 K für Fermium.[22]
Das Normalpotential wurde als ähnlich zum Ytterbium Yb3+/Yb2+-Paar eingeschätzt, also etwa −1,15 V in Bezug auf die Standard-Wasserstoffelektrode,[31] ein Wert, der mit theoretischen Berechnungen übereinstimmt.[32] Auf der Grundlage polarographischer Messungen wurde für das Fm2+/Fm0-Paar ein Normalpotential von −2,37 V festgestellt.[33] Fm3+ kann relativ leicht zu Fm2+ reduziert werden,[34] z. B. mit Samarium(II)-chlorid, mit dem Fermium zusammen ausfällt.[35][36]
Chemische Eigenschaften
Die Chemie des Fermiums konnte bisher nur in Lösung mit Hilfe von Tracertechniken untersucht werden, feste Verbindungen wurden nicht hergestellt. Unter normalen Bedingungen liegt Fermium in Lösung als Fm3+-Ion vor, welches eine Hydratationszahl von 16,9 besitzt und eine Säurekonstante von 1,6 · 10−4 (pKs = 3,8).[37][38] Fm3+ bildet Komplexe mit einer Vielzahl von organischen Liganden mit harten Donoratomen wie Sauerstoff; und diese Komplexe sind in der Regel stabiler als die der vorhergehenden Actinoide.[22] Es bildet auch anionische Komplexe mit Liganden wie Chlorid oder Nitrat; und auch diese Komplexe scheinen stabiler zu sein als die von Einsteinium oder Californium.[15][16] Es wird angenommen, dass die Bindung in den Komplexen der höheren Actinoide meist ionischen Charakter hat: das Fm3+-Ion ist erwartungsgemäß kleiner als die vorhergehenden An3+-Ionen – aufgrund der höheren effektiven Kernladung von Fermium –; und damit würde Fermium voraussichtlich kürzere und stärkere Metall-Ligand-Bindungen bilden.[22]
Sicherheitshinweise
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Verwendung
Fermium wird – in Form seiner Verbindungen in Lösung – in erster Linie in geringen Mengen zu Studienzwecken gewonnen. Verbindungen des Fermiums wurden in fester Form bislang nicht dargestellt.
Literatur
- Robert J. Silva: Fermium, Mendelevium, Nobelium, and Lawrencium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1621–1651 (doi:10.1007/1-4020-3598-5_13).
- Glenn T. Seaborg (Hrsg.): Proceedings of the 'Symposium Commemorating the 25th Anniversary of Elements 99 and 100', 23. Januar 1978; Report LBL-7701, April 1979.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane: Teil A 1 II, S. 19–20; Teil A 2, S. 47; Teil B 1, S. 84.
Weblinks
- Eintrag zu Fermium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Albert Ghiorso: Einsteinium and Fermium, Chemical & Engineering News, 2003.
Einzelnachweise
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, entnommen aus: Robert J. Silva: Fermium, Mendelevium, Nobelium, and Lawrencium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1621–1651.
- Eintrag zu fermium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (https://physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- Eintrag zu fermium bei WebElements, https://www.webelements.com, abgerufen am 13. Juni 2020.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, entnommen aus: Robert J. Silva: Fermium, Mendelevium, Nobelium, and Lawrencium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1621–1651.
- Die Werte der atomaren und physikalischen Eigenschaften (Infobox) sind, wenn nicht anders angegeben, entnommen aus: Robert J. Silva: Fermium, Mendelevium, Nobelium, and Lawrencium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1621–1651.
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieses Element entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Albert Ghiorso: Einsteinium and Fermium, Chemical & Engineering News, 2003.
- Albert Ghiorso, G. Bernard Rossi, Bernard G. Harvey, Stanley G. Thompson: Reactions of U238 with Cyclotron-Produced Nitrogen Ions, in: Physical Review, 1954, 93 (1), S. 257–257 (doi:10.1103/PhysRev.93.257).
- S. G. Thompson, A. Ghiorso, B. G. Harvey, G. R. Choppin: Transcurium Isotopes Produced in the Neutron Irradiation of Plutonium, in: Physical Review, 1954, 93 (4), S. 908–908 (doi:10.1103/PhysRev.93.908).
- B. G. Harvey, S. G. Thompson, A. Ghiorso, G. R. Choppin: Further Production of Transcurium Nuclides by Neutron Irradiation, in: Physical Review, 1954, 93 (5), S. 1129–1129 (doi:10.1103/PhysRev.93.1129).
- M. H. Studier, P. R. Fields, H. Diamond, J. F. Mech, A. M. Friedman, P. A. Sellers, G. Pyle, C. M. Stevens, L. B. Magnusson, J. R. Huizenga: Elements 99 and 100 from Pile-Irradiated Plutonium, in: Physical Review, 1954, 93 (6), S. 1428–1428 (doi:10.1103/PhysRev.93.1428).
- P. R. Fields, M. H. Studier, J. F. Mech, H. Diamond, A. M. Friedman, L. B. Magnusson, J. R. Huizenga: Additional Properties of Isotopes of Elements 99 and 100, in: Physical Review, 1954, 94 (1), S. 209–210 (doi:10.1103/PhysRev.94.209).
- G. R. Choppin, S. G. Thompson, A. Ghiorso, B. G. Harvey: Nuclear Properties of Some Isotopes of Californium, Elements 99 and 100, in: Physical Review, 1954, 94 (4), S. 1080–1081 (doi:10.1103/PhysRev.94.1080).
- Hugo Atterling, Wilhelm Forsling, Lennart W. Holm, Lars Melander, Björn Åström: Element 100 Produced by Means of Cyclotron-Accelerated Oxygen Ions, in: Physical Review, 1954, 95 (2), S. 585–586 (doi:10.1103/PhysRev.95.585.2).
- G. T. Seaborg, S. G. Thompson, B. G. Harvey, G. R. Choppin: Chemical Properties of Elements 99 and 100; Abstract; Maschinoskript (23. Juli 1954), Radiation Laboratory, University of California, Berkeley, UCRL-2591 (Rev.) (PDF; 1,5 MB).
- S. G. Thompson, B. G. Harvey, G. R. Choppin, G. T. Seaborg: Chemical Properties of Elements 99 and 100, in: J. Am. Chem. Soc., 1954, 76 (24), S. 6229–6236 (doi:10.1021/ja01653a004).
- A. Ghiorso, S. G. Thompson, G. H. Higgins, G. T. Seaborg (Radiation Laboratory and Department of Chemistry, University of California, Berkeley, California), M. H. Studier, P. R. Fields, S. M. Fried, H. Diamond, J. F. Mech, G. L. Pyle, J. R. Huizenga, A. Hirsch, W. M. Manning (Argonne National Laboratory, Lemont, Illinois), C. I. Browne, H. L. Smith, R. W. Spence (Los Alamos Scientific Laboratory, Los Alamos, New Mexico): New Elements Einsteinium and Fermium, Atomic Numbers 99 and 100, in: Physical Review, 1955, 99 (3), S. 1048–1049 (doi:10.1103/PhysRev.99.1048; Maschinoskript (9. Juni 1955), Lawrence Berkeley National Laboratory. Paper UCRL-3036).
- P. R. Fields, M. H. Studier, H. Diamond, J. F. Mech, M. G. Inghram, G. L. Pyle, C. M. Stevens, S. Fried, W. M. Manning (Argonne National Laboratory, Lemont, Illinois); A. Ghiorso, S. G. Thompson, G. H. Higgins, G. T. Seaborg (University of California, Berkeley, California): Transplutonium Elements in Thermonuclear Test Debris, in: Physical Review, 1956, 102 (1), S. 180–182 (doi:10.1103/PhysRev.102.180).
- David R. Lide: CRC Handbook of Chemistry and Physics, 85. Auflage, CRC Press, 2004, ISBN 978-0-8493-0485-9, Section 4, S. 4–10 (eingeschränkte Vorschau in der Google-Buchsuche). In der 90. Auflage ist davon nicht mehr die Rede (S. 4–12 bis 4–13).
- G. Pfennig, H. Klewe-Nebenius, W. Seelmann-Eggebert (Hrsg.): Karlsruher Nuklidkarte, 7. Aufl., 2006.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties, in: Nuclear Physics A, 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- Robert J. Silva: Fermium, Mendelevium, Nobelium, and Lawrencium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, 3. Auflage, Springer, Dordrecht 2006, Band 3, S. 1621–1651.
- High Flux Isotope Reactor, Oak Ridge National Laboratory; abgerufen am 23. September 2010.
- C. E. Porter, F. D. Riley, Jr., R. D. Vandergrift, L. K. Felker: Fermium Purification Using Teva™ Resin Extraction Chromatography, in: Sep. Sci. Technol., 1997, 32 (1–4), S. 83–92 (doi:10.1080/01496399708003188).
- M. Sewtz, H. Backe, A. Dretzke, G. Kube, W. Lauth, P. Schwamb, K. Eberhardt, C. Grüning, P. Thörle, N. Trautmann, P. Kunz, J. Lassen, G. Passler, C. Z. Dong, S. Fritzsche, R. G. Haire: First Observation of Atomic Levels for the Element Fermium (Z = 100), in: Phys. Rev. Lett., 2003, 90 (16), S. 163002 (doi:10.1103/PhysRevLett.90.163002).
- R. W. Hoff, E. K. Hulet: Engineering with Nuclear Explosives, 1970, 2, S. 1283–1294.
- G. R. Choppin, B. G. Harvey, S. G. Thompson: A new eluant for the separation of the actinide elements, in: J. Inorg. Nucl. Chem., 1956, 2 (1), S. 66–68 (doi:10.1016/0022-1902(56)80105-X).
- N. B. Mikheev, A. N. Kamenskaya, N. A. Konovalova, I. A. Rumer, S. A. Kulyukhin: High-speed method for the separation of fermium from actinides and lanthanides, in: Radiokhimiya, 1983, 25 (2), S. 158–161.
- M. Jones, R. P. Schuman, J. P. Butler, G. Cowper, T. A. Eastwood, H. G. Jackson: Isotopes of Einsteinium and Fermium Produced by Neutron Irradiation of Plutonium, in: Physical Review, 1956, 102 (1), S. 203–207 (doi:10.1103/PhysRev.102.203).
- L. I. Guseva, K. V. Filippova, Yu. B. Gerlit, V. A. Druin, B. F. Myasoedov, N. I. Tarantin: Experiments on the Production of Einsteinium and Fermium with a Cyclotron, in: Journal of Nuclear Energy, 1954, 3 (4), S. 341–346 (übersetzt im November 1956) (doi:10.1016/0891-3919(56)90064-X).
- N. B. Mikheev, V. I. Spitsyn, A. N. Kamenskaya, N. A. Konovalova, I. A. Rumer, L. N. Auerman, A. M. Podorozhnyi: Determination of oxidation potential of the pair Fm2+/Fm3+, in: Inorg. Nucl. Chem. Lett., 1977, 13 (12), S. 651–656 (doi:10.1016/0020-1650(77)80074-3).
- L. J. Nugent, in: MTP Int. Rev. Sci.: Inorg. Chem., Ser. One, 1975, 7, S. 195–219.
- K. Samhoun, F. David, R. L. Hahn, G. D. O'Kelley, J. R. Tarrant, D. E. Hobart: Electrochemical study of mendelevium in aqueous solution: No evidence for monovalent ions, in: J. Inorg. Nucl. Chem., 1979, 41 (12), S. 1749–1754 (doi:10.1016/0022-1902(79)80117-7).
- Jaromír Malý: The amalgamation behaviour of heavy elements 1. Observation of anomalous preference in formation of amalgams of californium, einsteinium, and fermium, in: Inorg. Nucl. Chem. Lett., 1967, 3 (9), S. 373–381 (doi:10.1016/0020-1650(67)80046-1).
- N. B. Mikheev, V. I. Spitsyn, A. N. Kamenskaya, B. A. Gvozdec, V. A. Druin, I. A. Rumer, R. A. Dyachkova, N. A. Rozenkevitch, L. N. Auerman: Reduction of fermium to divalent state in chloride aqueous ethanolic solutions, in: Inorg. Nucl. Chem. Lett., 1972, 8 (11), S. 929–936 (doi:10.1016/0020-1650(72)80202-2).
- E. K. Hulet, R. W. Lougheed, P. A. Baisden, J. H. Landrum, J. F. Wild, R. F. Lundqvist: Non-observance of monovalent Md, in: J. Inorg. Nucl. Chem., 1979, 41 (12), S. 1743–1747 (doi:10.1016/0022-1902(79)80116-5).
- Robert Lundqvist, E. K. Hulet, T. A. Baisden: Electromigration Method in Tracer Studies of Complex Chemistry. II. Hydrated Radii and Hydration Numbers of Trivalent Actinides, in: Acta Chem. Scand., Ser. A, 1981, 35, S. 653–661 (doi:10.3891/acta.chem.scand.35a-0653).
- H. Hussonnois, S. Hubert, L. Aubin, R. Guillaumont, G. Boussieres: Radiochem. Radioanal. Lett., 1972, 10, S. 231–238.